乙二醇与甲醇脱水的非均相热力学平衡分析
2024-01-04贾广信郭玉珊谢亚宁贾海臣
吕 捷,贾广信,张 叶,郭玉珊,田 锴,谢亚宁,贾海臣
(中北大学 化学与化工学院,山西 太原 030051)
0 引 言
随着煤化工行业的快速发展,甲醇和乙二醇作为下游产品的产能和产量快速上涨[1-6],导致二者的产能过剩。因此,将甲醇和乙二醇转化为高附加值产品具有重要意义。利用脱水反应,可将甲醇和乙二醇转化为乙二醇甲醚混合物,这为甲醇和乙二醇的有效利用提供了新途径。
乙二醇甲醚混合物包含乙二醇单甲醚(MEEG)和乙二醇二甲醚(DEEG)。其中,乙二醇单甲醚可用作喷气式飞机燃料的防冰添加剂[7]、油漆、涂料和油墨的溶剂[3,8]、抗微生物和防腐剂[9]、有机物合成的中间体[10]等; 乙二醇二甲醚作为柴油添加剂,能显著提高柴油的十六烷值,降低污染物的排放量和柴油的使用量[8,11-12]。目前,工业上由williamson合成法制备乙二醇醚,生产过程中用到的强碱会引起分离和环境污染问题,且工艺复杂,副产品多[13-14]。相比之下,利用乙二醇和甲醇之间脱水制备乙二醇甲醚则具备显著的优势,例如反应条件温和、工艺过程简洁,是一种有前景的绿色生产方法[15]。
目前,对于乙二醇和甲醇之间的脱水反应的研究主要集中在催化剂、反应条件以及反应器[3,7],未发现热力学平衡研究方面的相关文献报道。需要注意的是,现有文献所述反应温度均在150 ℃以上[3,7],体系中甲醇的沸点为67.4 ℃,乙二醇的沸点为197.3 ℃,而沸点差异作为一种非均相性质,所以在热力学计算中绕不开非均相区间。非均相热力学研究对于理解相界面的变化、反应平衡的改变以及反应物的转化率和选择性的变化等具有重要意义。
为了更好地研究非均相体系中的热力学平衡,吉布斯自由能最小化法被广泛应用于计算非均相反应过程中的物质相稳定性和反应平衡,从而能够精确地预测反应产物的生成过程[14]。然而,原始的吉布斯自由能最小化法在解决非均相热力学计算问题时存在算法复杂度高、收敛速度慢等多种问题。本文提出一种改进的遗传算法[16],能够更加高效地优化非均相体系中的化学反应和相变过程,使得热力学计算更为准确和快速。贾广信等[17]采用改进的遗传算法对甘油和一元醇脱水制烷基甘油醚反应进行了热力学平衡分析,以考察相关参数的变化对反应体系的影响。
本文将对甲醇和乙二醇脱水反应体系进行热力学平衡计算,以探究相关参数对整个反应体系的影响。使用Benson法,Joback group contribution法和Rozicka-Domalski法估计了反应体系中各组分的热力学基础数据。在计算过程中使用吉布斯自由能最小化方法,结合改进的遗传算法来优化参数。对不同反应条件下甲醇与乙二醇反应体系的平衡转化率、产物选择性、气液相组成分布进行了研究,旨在探究温度、压力和进料物质的量比的变化对反应体系的影响趋势。研究结果将为后续乙二醇与甲醇脱水反应的实验研究提供理论支持,有助于找到最佳的反应条件。
1 方 法
1.1 合成路线
乙二醇与甲醇脱水反应的方程式为

(1)
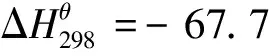
(2)
1.2 吉布斯自由能最小化法
在平衡时,系统的总吉布斯自由能(G)最小。在一定温度和压力下,反应系统的总吉布斯自由能可表示为
(3)
该式应满足以下对组分物质的量的非负限制和整个体系的质量守恒:
nij≥0,i=1,…,NC;j=1,…,NP,
(4)
i=1,…,NC;j=1,…,NP,
(5)
式中:NC为组分的数量;NP为系统中的相数;nij为相位j中组分i的物质的量;μij为组分i在相位j中的化学势;Bk为系统中k元素的总的物质的量,由系统的初始组成来确定;βik指组分i的分子中k元素的原子数。设定相关组分的物质的量和反应条件,通过式(3)~式(5)的最优化求解,最终可得到体系在吉布斯自由能最小时的平衡组成。
1.3 非均相体系中组分化学势的计算
由式(3)~式(5)可知,吉布斯自由能函数的求取转化为了组分化学势的计算。
在非均相体系中,适用于气体混合物组分的化学势为
(6)
fi=yip,
(7)
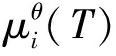
液体混合物中组分的化学势需引入活度来计算
(8)
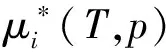
(9)
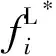
(10)
(11)
液体的摩尔体积为
(12)
ZR=0.290 56-0.087 75w,
(13)
式中:pc,Tc,Vc分别为组分的临界压力、临界温度、临界体积;ZR为压缩因子;Tr为对比温度;w为偏心因子。
(14)
(15)
(16)
(17)
式中:pr为对比压力。
(18)
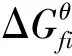
(19)

据此,引入描述化学反应焓变随温度变化关系的基希霍夫公式
(20)
标准摩尔反应熵变随温度变化的公式为
(21)

吉布斯自由能最小化方法涉及的理想气体特征参数[18]、正常沸点蒸发焓[19]、液体比热容参数[20]、相关组分的临界常数[21-22]和偏心因子数据[23]由基团贡献法估算[18,24]得到。
1.4 遗传算法
遗传算法是一种受自然选择启发的优化算法,具有全局搜索能力、适应性强、并行处理和灵活性等优势。将改进的遗传算法用于优化吉布斯自由能最小化的过程中,需通过相关组分的物质的量及质量守恒方程,以及种群不断迭代来找到最优解。迭代的3个步骤是:选择、交叉和变异[18]。此过程见图1。
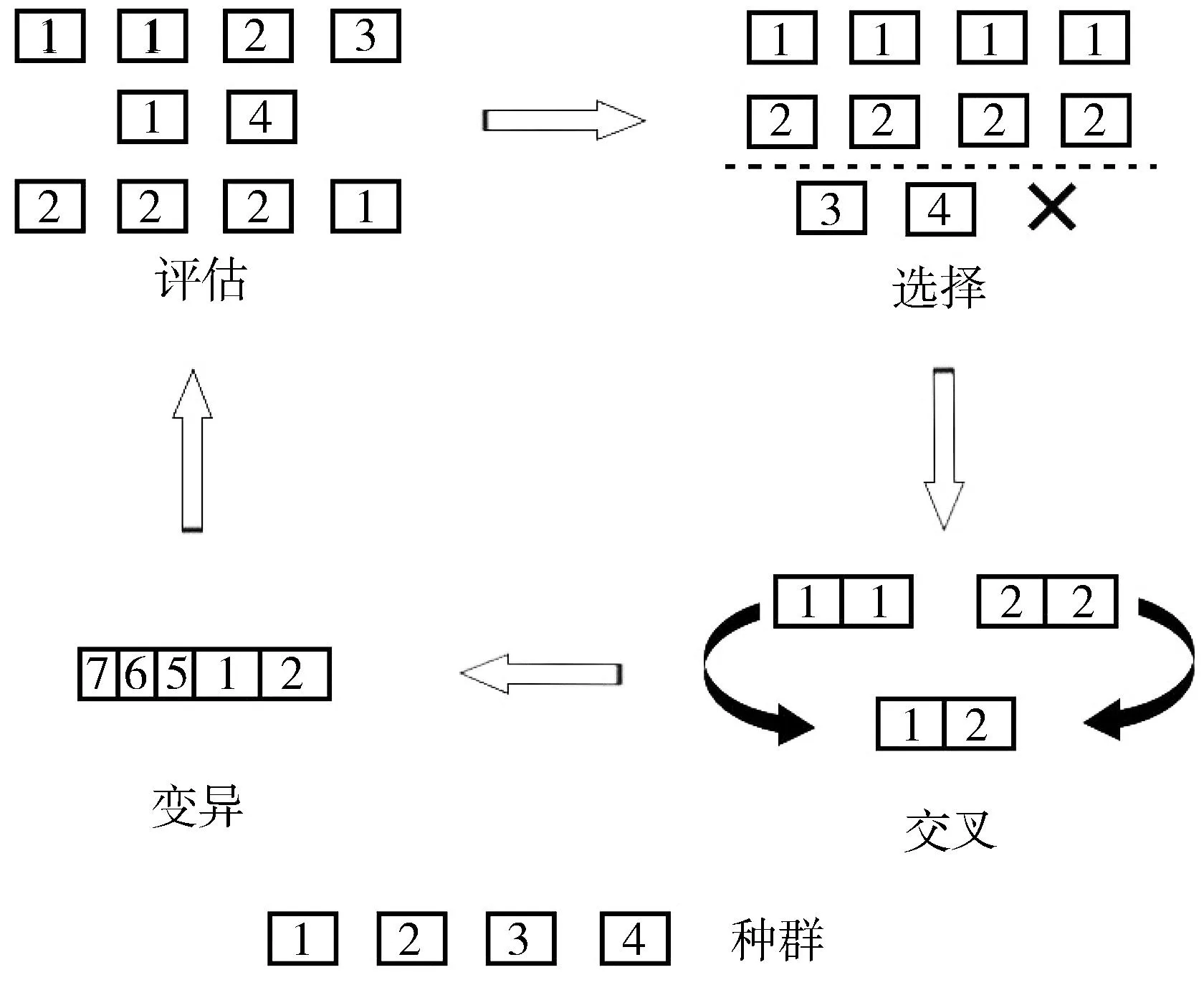
图1 遗传算法步骤
与标准遗传算法相比,本文算法进行了以下两项优化改进:
1) 扩大了突变概率的适应范围,使计算过程能够超越局部最优点,实现全局搜索;
2) 采用遗传父代和子代的最优基因组合,再从中选择最佳基因,无需进行轮盘赌,直接保留优选基因。
1.5 选择性和转化率的计算方法
甲醇和乙二醇的转化率、乙二醇甲醚的选择性、组分的平衡摩尔分数分别为

(22)

(23)
体系中i组分的平衡摩尔分数=
(24)
2 结果和讨论
在本文中确定乙二醇的进料为100 mol,温度为20~300 ℃、压力为0.1~0.7 MPa、甲醇与乙二醇的进料物质的量比为1∶2~6∶1。所有结果均通过自编程序计算得到。
2.1 温度对甲醇与乙二醇反应体系的影响
在压力0.3 MPa、甲醇与乙二醇的初始进料物质的量比为3∶1的条件下,探究温度20~300 ℃对反应物平衡转化率、产物选择性及体系气液平衡组成的影响。
2.1.1 温度对甲醇与乙二醇反应过程中平衡转化率的影响
在20~300 ℃温度范围内,甲醇和乙二醇的平衡转化率结果见图2。

图2 甲醇和乙二醇脱水反应过程中反应物的平衡转化率(0.3 MPa)
由图2 可知,在20~300 ℃,甲醇和乙二醇的转化率整体呈下降趋势。在50 ℃之前及100 ℃之后,随温度升高,二者的转化率逐渐下降; 在50~100 ℃,二者的转化率明显呈上升趋势,甲醇和乙二醇的转化率最高分别达到66.65%和99.99%。在此过程中,甲醇和乙二醇的转化率分别维持在63.7%和99.35%以上。
甲醇与乙二醇脱水过程中,二者的平衡转化率随温度变化的整体趋势与文献[14]中的结果相一致。在50 ℃之前及100 ℃之后,甲醇与乙二醇的转化率明显呈单调变化,因为式(1)和式(2)为放热反应,随着温度的升高,平衡会向吸热的方向移动,即逆向移动,所以整体上二者的转化率呈下降趋势。在60~90℃,甲醇与乙二醇的转化率逐渐上升,可能是体系发生相变所引起的,其原因将在2.1.3中进行详细探讨。
2.1.2 温度对甲醇与乙二醇反应产物选择性的影响
在20~300 ℃温度范围内,乙二醇单甲醚和乙二醇二甲醚的平衡选择性结果见图3。
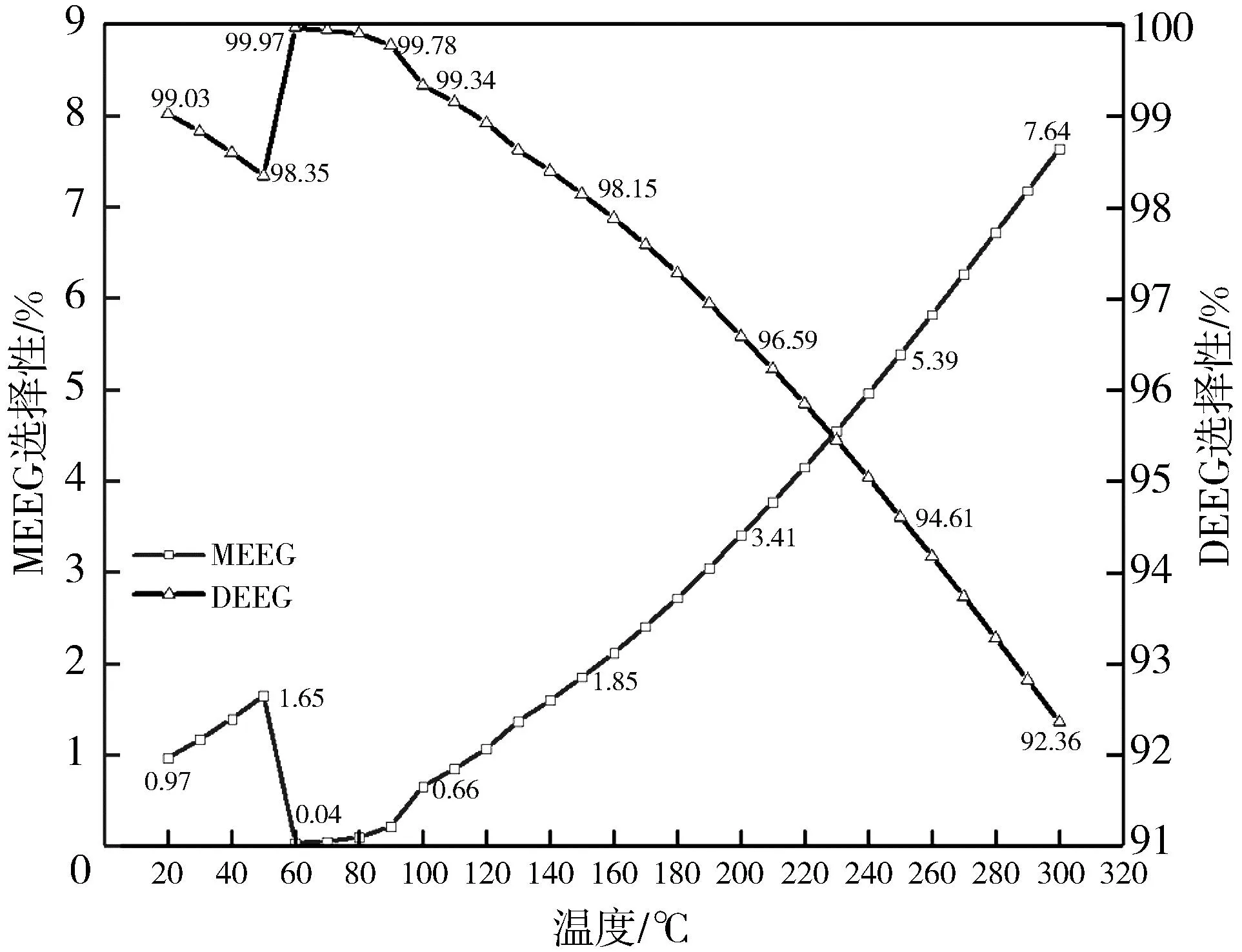
图3 甲醇和乙二醇脱水反应过程中产物的选择性 (0.3 MPa)
由图3 可知,DEEG的选择性随温度的升高先降低后又升高到一定值后开始持续下降,MEEG的选择性与之相反。在50 ℃之前和100 ℃以上的温度区间内,DEEG的选择性随温度的升高而降低; 在50~100 ℃的温度区间内,DEEG的选择性随温度的升高而升高,并且在60 ℃达到最高值(接近100%),MEEG的选择性最低。在整个温度范围内,MEEG的选择性为0.03%~7.64%,DEEG的选择性为92.35%~99.96%。在此过程中发生的变化与体系反应过程中的放热有关(见2.1.1节),还可能与体系中平衡组成的分布有关,此关系将在下文中探讨。对比图2 和图3,在反应过程中,乙二醇二甲醚和乙二醇的转化率随温度变化的趋势与温度区间一致。
2.1.3 温度对甲醇与乙二醇反应过程中气液相平衡组成分布的影响
对于组分沸点差距较大且由液相进料的反应系统,温度是影响反应体系相态分布的重要因素[8]。考察甲醇与乙二醇反应体系平衡时气液相平衡组成的分布,对于该实验的研究具有较好的指导意义。
在压力为0.3 MPa、进料物质的量比为3∶1、温度20~300 ℃时体系气液相平衡组成的分布见图4。
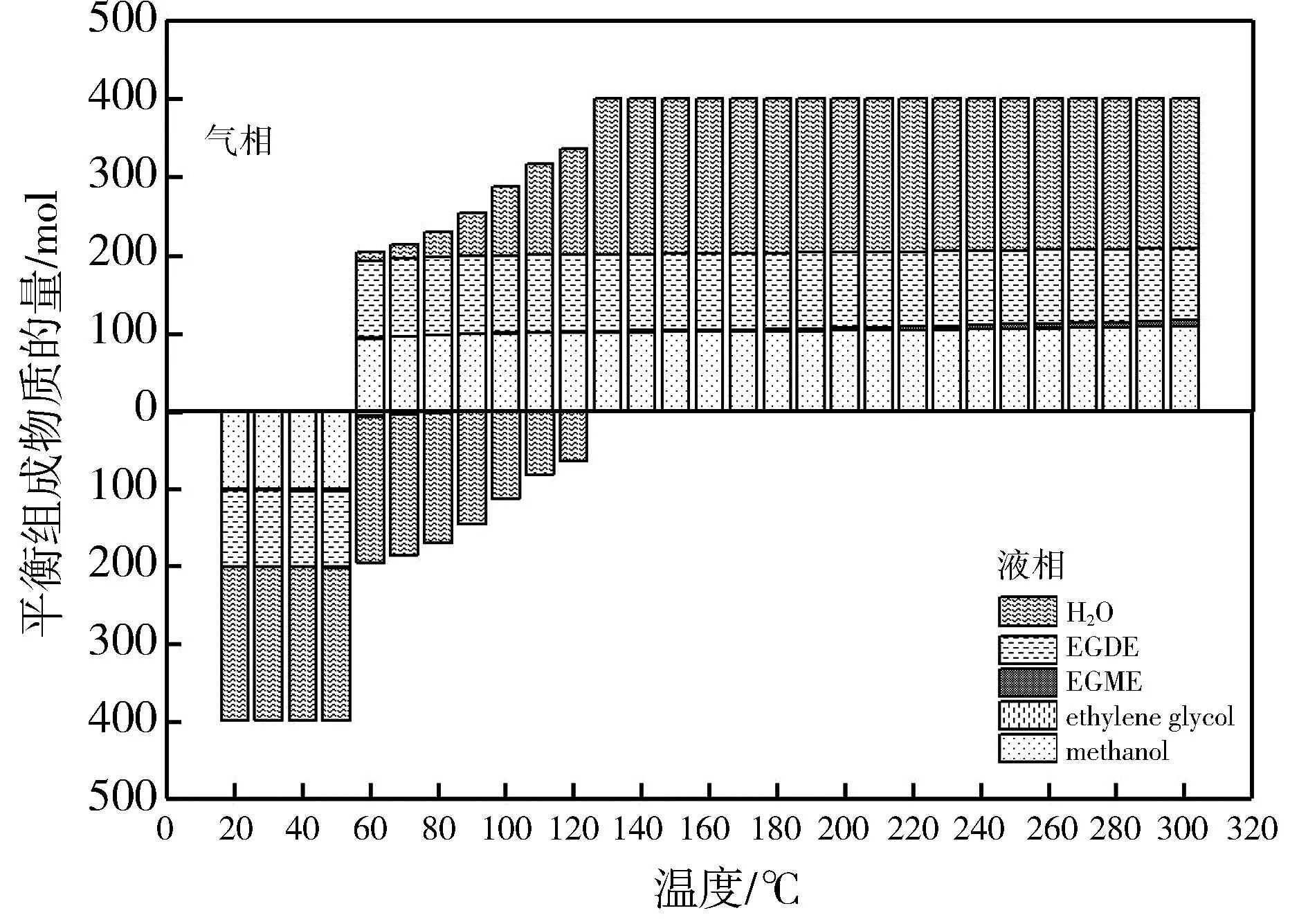
图4 甲醇与乙二醇反应时气相和液相的平衡组成
图4 的上下部分分别为平衡气相和液相组成。由图4 可知,当温度低于60 ℃时,体系所有组分均为液相,主要组成为反应过程中产生的水、少量的乙二醇二甲醚和未反应完的甲醇; 60~120 ℃,体系处于气液共存非均相状态,从60 ℃开始液相中的水逐渐转移到气相中,甲醇、乙二醇二甲醚全部转移到气相中; 当温度升高到130 ℃及以上时,体系内的组分全部为气相,水全部转移到气相中。在不同温度下,反应系统中各组分的含量大致相同。体系中乙二醇单甲醚的含量逐渐增加,其总含量相对于其他组分含量来说仍然很少,甲醇的含量随着温度的升高稍有增加,因为随着温度的升高,未反应的甲醇的含量随其转化率的降低而增加。在60~120 ℃,反应体系处于气液共存状态,其中部分组分开始吸热由液态转化为气态。这一现象验证了图2 和图3 的结果,即在该温度区间内,甲醇和乙二醇的转化率以及乙二醇二甲醚的选择性有所提高,主要原因在于反应体系中的化合物从液相转移到气相,并因此发生了剧烈的相变并吸收了大量的热量。这样,体系升温所吸收的热量又为组分相变所需的热量提供了来源,抵消了温度升高对平衡移动的影响,进一步驱动了反应体系中甲醇和乙二醇的脱水反应。
在反应过程中,反应系统生成水的大量聚集可能会造成催化剂的水热失活,降低反应效率。除此之外,式(1)和式(2)均为平衡反应,产物中积累的水会导致反应不能完全进行,影响反应平衡[2]。目前,醇脱水制备乙二醇醚的相关实验大多采用密闭高压反应釜,反应温度通常在140~300 ℃间波动[2,9,15]。然而,在这种高温条件下,大量水分的存在会影响反应的转化率和正向反应的进程。因此,在设计实验时应该尽量避免上述问题的发生了。Yu Weiqiang等[15]设计的连续流动固定床反应器,将甲醇和乙二醇连续泵入反应器,并将产物不断引出,在0.3 MPa、210 ℃下对乙二醇二甲醚的选择性高达79.4%,乙二醇的转化率约为 96.7%。
2.2 压力对甲醇与乙二醇反应体系的影响
式(1)和式(2)中甲醇和乙二醇的脱水反应属于等分子反应,然而,在整个温度区间内,压力对体系热力学平衡的影响尚不清楚。为此,在甲醇与乙二醇进料物质的量比为3∶1的条件下,考察了压力(0.1~0.7 MPa)对反应物转化率、产物选择性及体系的平衡组成的影响。
2.2.1 压力对甲醇与乙二醇反应过程中平衡转化率和产物选择性的影响
不同压力下,体系中甲醇和乙二醇的平衡转化率与乙二醇单甲醚和乙二醇二甲醚的选择性见图5。
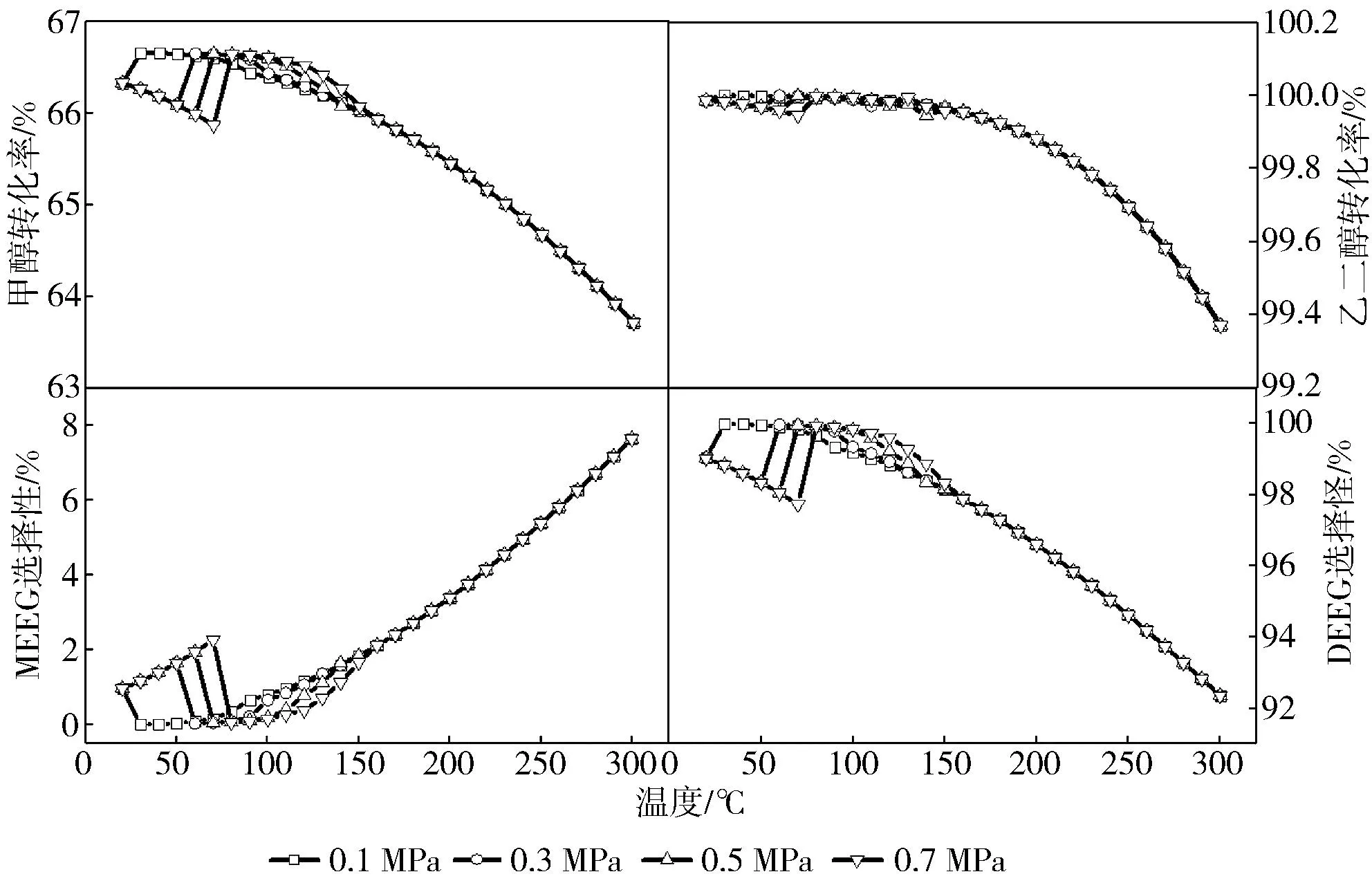
图5 不同压力下反应体系中反应物的转化率和产物的选择性
由图5 可知,当压力分别在 0.1,0.3,0.5和0.7 MPa时,系统的转化率和选择性的整体趋势没有明显变化。但随着压力的增大,甲醇和乙二醇的转化率发生变化的温度会升高,拐点的温度也随之增大。拐点数值虽有所降低,但变化不大。当反应条件为0.1 MPa、30 ℃时,甲醇和乙二醇的转化率呈现出上升的趋势。在压力升高至0.7 MPa时,类似的趋势出现在70 ℃。乙二醇单甲醚和乙二醇二甲醚的选择性的变化趋势与之相同。当温度升高到150℃以上时,压力的变化对反应体系没有影响。在整个温度范围内,不同压力下,甲醇和乙二醇的最大转化率分别在64.80%~66.33%和99.89%~99.98%之间,乙二醇单甲醚和乙二醇二甲醚的最高选择性分别在0.97%~7.64%和92.30%~99.19%范围内。
2.2.2 压力对甲醇与乙二醇反应过程中气液相平衡组成分布的影响
为了直观地看出不同压力对体系平衡组成的影响,在甲醇与乙二醇进料物质的量比为3∶1、温度为20~300 ℃的条件下,绘制了不同压力下体系的气液平衡组成分布图。
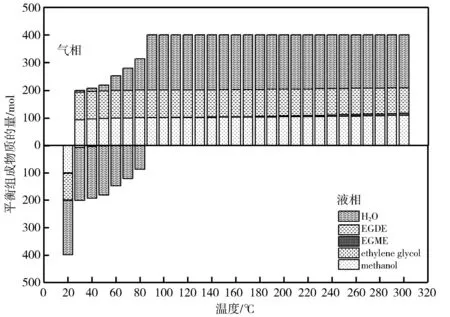
压力为0.1 MPa、0.7 MPa时体系的平衡组成分布分别见图6(a)和图6(b)。对比两组不同压力下的平衡组成分布,可知体系中各组分在气液两相中的分布是确定的,随着温度的增加,体系逐渐从液相转移到气相中。在图6(a)中,在30 ℃时体系开始向气相转移,在30~80 ℃,系统处于气液共存的非均相区间,温度达到90 ℃及以上时,体系中各组分均以气体形式存在。
(a) 0.1 MPa
相比之下,图6(b)中反应体系发生相转移的温度为80 ℃,到150 ℃时,所有组分全部转移到气相中。通过对比可知,压力的增加会对体系中的相转移温度产生影响,0.1 MPa的压力下,相变温度为30 ℃,而在0.7 MPa的压力下,相变温度则升高至70 ℃,同时,非均相区间的温度范围也从50 ℃扩大至80 ℃。
随着压力的增大,体系进入非均相区间所需的气泡点温度也会随之升高,即体系的气泡点温度会受到环境压力的影响而变化,增加的压力会使泡点温度升高。在甲醇与乙二醇反应体系中,压力的增加会使体系的泡点温度升高,即部分组分气化时所需的温度也会随之升高,这将对反应程度产生影响。同时,图5 中反应体系的转化率和选择性的变化趋势也符合气液相共存区间温度范围的变化规律,即压力越大,相变温度越高,压力的增加会提高体系组分的沸点,但是体系中各组分沸点的升高幅度存在差异,且平衡曲线的变化规律也不相同,因此体系气液共存的温度范围也会发生变化,即温度范围变宽。压力对于反应平衡的数量水平没有明显影响,因为体系的物质的量总量保持不变。除此之外,通过对比图6(a)和图6(b),也可以发现反应体系的相态不仅由组分沸点所决定,压力也对反应体系的相态产生了重要的影响。例如,甲醇与乙二醇的脱水反应中,乙二醇的沸点最高为197.3 ℃,在0.1 MPa、30 ℃ 时乙二醇二甲醚就全部气化,在0.7 MPa、80 ℃时乙二醇二甲醚全部气化,这些温度都低于其沸点。以上计算结果可以在压力方面为相关实验提供理论参考。
2.3 进料物质的量比对甲醇与乙二醇反应体系的影响
在0.3 MPa下,甲醇与乙二醇的进料物质的量比分别为2∶1,4∶1,6∶1时反应体系各组分平衡摩尔分数见图7。

图7 进料物质的量比对甲醇和乙二醇反应体系中组分平衡摩尔分数的影响(0.3 MPa)
由图7 可知,在每组温度下,随着进料物质的量比的增加,未反应完的乙二醇和MEEG的含量减少,DEEG的含量明显增加; 当进料物质的量比大于2∶1时,从图7 中很难看到乙二醇和MEEG的存在,反应体系中含有微量的MEEG,而DEEG的含量略有增加,水的含量没有发生明显变化。进料物质的量比的增加,能够促进反应的正向进行,增加DEEG的选择性。在理想状态下,甲醇与乙二醇的最优进料物质的量比是 2∶1,所以当甲醇过量时,即进料物质的量比增加促进了乙二醇的转化,乙二醇二甲醚的选择性能够接近100%。
在0.3 MPa,20~300 ℃下,进料物质的量比对反应体系各相态的影响见图8。
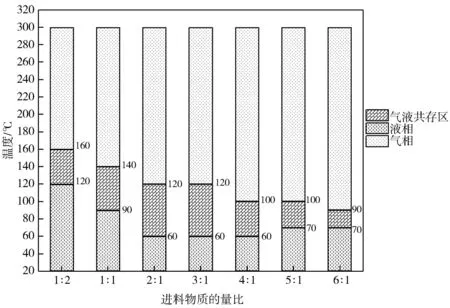
图8 进料物质的量比对甲醇和乙二醇反应体系中相态温度区间的影响(0.3 MPa)
由图8 可知,随着进料物质的量比的增加,气相温度区间也随之增大,进料物质的量比越大,体系进入气相状态时所需的温度就会越低,由最初的160 ℃降低到90 ℃。在非均相和液相区间,温度范围的变化趋势分为两部分:在2∶1之前,非均相区间的温度范围逐渐变宽,由40 ℃增加到60 ℃,而液相区间的温度范围则缩小,由120 ℃缩短到60℃。在2∶1之后,两个相态温度区间的变化趋势则与之相反。不同相态温度区间的变化趋势会对反应的转化率和选择性产生重要影响,预测和确定反应温度是实验中必不可少的步骤。
3 结 论
通过热力学平衡计算可知:随着温度的升高,反应的转化率逐渐降低。在气液共存相的温度区间内,即在发生相变的区间,二者的转化率最高。乙二醇的平衡转化率最高达到99.9%,且乙二醇二甲醚的选择性达到最高,接近100%。需要注意的是,压力对反应物的转化率和产物的选择性大小没有明显的影响。但是,压力的增大会拓宽非均相区间的温度范围,并且可通过调节压力来改变不同相态中的组成。当温度升高到150 ℃以上时,压力对反应体系没有影响。进料物质的量比的增大会影响不同相态温度区间的范围。进料物质的量比的增大会收窄非均相区间的温度范围,也会使乙二醇二甲醚的含量增加。
