不同方法制备的Cu/SiO2催化剂对己二酸二甲酯加氢制1,6-己二醇的影响
2024-01-03王英斌王康军刘蝈蝈宋雨莹秦王昕张亚芳
王英斌, 王康军, 刘蝈蝈, 宋雨莹, 秦王昕, 张亚芳
(1.沈阳化工大学 化学工程学院, 辽宁 沈阳 110142;2.沈阳化工大学 资源化工与材料教育部重点实验室, 辽宁 沈阳 110142)
二元醇作为一种高价值的精细有机化学品,广泛应用于聚酯、医药和染料等诸多领域,在所有的二元醇中,1,6-己二醇(HDO)是最有前途的二元醇之一[1].在1,6-己二醇的生产工艺中己二酸二甲酯(DMA)加氢是目前研究最为广泛的HDO合成路线[2].金属Cr修饰的CuCr催化剂因其在酯加氢反应中表现出较高的活性和稳定性,成为各类酯化合物加氢制取相应醇的首选工业催化剂[3].但由于Cr的毒性,人们试图开发出可替代CuCr的无Cr催化剂.贵金属RuSn催化剂[4]作为较早应用于DMA加氢反应的无Cr催化剂,因其选择性较低且价格昂贵,近年来DMA加氢反应催化剂的研究主要集中在CuZn催化剂[5-7].二氧化硅载体负载活性金属铜的Cu/SiO2催化剂因其优异的催化性能同样被广泛应用于酯加氢反应中[8].对于Cu/SiO2催化剂,受制备方法的影响,其Cu颗粒粒径、Cu的分散性,以及Cu与载体的相互作用很大程度上决定了其加氢性能[9].Dong等[10]采用离子交换、沉积沉淀、尿素水解均匀沉积沉淀和蒸氨法制备了Cu/SiO2催化剂用于乙酸甲酯加氢反应.He等[11]发现溶胶凝胶法制备的Cu/SiO2催化剂与沉淀法制备的催化剂相比较,由于层状硅酸铜的存在,其在草酸二乙酯加氢制乙二醇反应中具有更好的催化性能.到目前为止,在DMA加氢制HDO领域中铜基催化剂的开发和探索主要集中在CuZn催化剂,尚未有制备方法不同的Cu/SiO2催化剂对DMA加氢制HDO影响的报道.笔者采用沉积沉淀法、溶胶凝胶法和蒸氨法制备了Cu/SiO2催化剂,探索了不同方法制备的Cu/SiO2催化剂对DMA加氢制HDO反应的影响.
1 实验部分
1.1 化学试剂
己二酸二甲酯,阿拉丁试剂有限公司;Cu(NO3)3·3H2O,夏县运力化工有限公司;Na2CO3,国药化学试剂有限公司;酸性硅溶胶(质量分数30%)和碱性硅溶胶(质量分数25%),青岛海洋化学有限公司;正硅酸乙酯,天津大茂化学试剂厂;氨水溶液(质量分数25%),天津恒兴化学试剂有限公司.
1.2 催化剂的制备
采用沉积沉淀法、溶胶凝胶法和蒸氨法制备质量分数为35%的Cu/SiO2催化剂(按照CuO质量计算).
1.2.1 沉积沉淀法制备Cu/SiO2催化剂
称取10.63 g Cu(NO3)3·3H2O溶解于去离子水中配制成一定浓度的硝酸铜溶液,将26 g酸性硅溶胶加入到硝酸铜水溶液中搅拌均匀,与一定浓度的碳酸钠溶液并流滴加到100 mL去离子水中并保持在35 ℃下反应.滴加结束后老化0.5 h,之后过滤洗涤并在120 ℃下干燥12 h,将固体在400 ℃静态空气中煅烧4 h,获得沉积沉淀法Cu/SiO2催化剂.
1.2.2 溶胶凝胶法制备Cu/SiO2催化剂
称取10.63 g Cu(NO3)3·3H2O溶于去离子水中配制成一定浓度的硝酸铜溶液,将20.53 g乙醇和23.21 g正硅酸四乙酯(TEOS) 混合溶液逐滴加入到硝酸铜水溶液中.充分混合后,取一定质量的氨水逐滴加入到上述混合溶液中,升温至40 ℃密封搅拌.老化5 h后加热混合溶液至90 ℃,蒸发掉多余的氨水和乙醇.当pH降到7~8时结束,过滤洗涤并在120 ℃下干燥12 h,将固体在400 ℃静态空气中煅烧4 h,获得溶胶凝胶法Cu/SiO2催化剂.
1.2.3 蒸氨法制备Cu/SiO2催化剂
称取10.63 g Cu(NO3)3·3H2O溶解于去离子水中配制成一定浓度的硝酸铜溶液,在剧烈搅拌下将一定质量的氨水溶液滴入硝酸铜水溶液中.充分混合后,将21.67 g碱性硅溶胶滴加到铜氨溶液中,在室温条件下密封搅拌.老化4 h后加热上述混合溶液至80 ℃,开始蒸氨,当pH降到6~7时结束,过滤洗涤并在120 ℃下干燥12 h,将所得固体在400 ℃静态空气中煅烧4 h,获得蒸氨法Cu/SiO2催化剂.
1.3 催化剂的表征
采用BELSORP-mini Ⅹ全自动比表面积及孔径分布测定仪进行比表面积、孔径及孔体积测定.首先将催化剂样品在 200 ℃下进行脱气预处理,然后使用静态氮气(-195 ℃)吸附法测定氮气的吸附-脱附等温线.采用 BET 方法计算催化剂的比表面积,通过 BJH 方法获取孔径分布状况.
采用Rigaku Ultimate Ⅳ X射线粉末衍射仪测定催化剂晶相组成.使用Cu Kα射线,石墨单色器,管电压40 kV,管电流15 mA,扫描范围2θ=5°~80°,扫描速率10(°)/min.
采用Frontier FT-IR(KBr盘)红外光谱仪进行FT-IR表征.称取少量催化剂样品与KBr混合均匀后压片,扫描范围4 000~400 cm-1,扫描次数32,分辨率4 cm-1.
采用美国康塔公司生产的ChemBET Pulsar TPR/TPD型全自动化学吸附仪进行H2-TPR测定.称取20 mg催化剂装入U型石英管反应器中,通入氦气(30 mL/min),在300 ℃下吹扫30 min后再降温至50 ℃.切换成H2/Ar混合气[φ(H2)=10%,30 mL/min],以10 ℃/min的速率由室温升温至500 ℃进行程序升温还原,热导池检测器(TCD)检测信号.
采用美国康塔公司生产的ChemBET Pulsar TPR/TPD型全自动化学吸附仪进行N2O滴定.将20 mg催化剂装入U型石英管反应器中,在300 ℃ He脱气处理30 min后在He氛围中将催化剂降温至50 ℃.通入H2/Ar混合气[φ(H2)=10%],以10 ℃/min的升温速率升温至500 ℃,记录耗氢峰面积S1.He气氛下降温至50 ℃,通入纯N2O氧化30 min,然后通入H2/Ar 混合气[φ(H2)=10%]还原样品,以升温速率10 ℃/min升温至500 ℃,记录耗氢峰面积S2.根据Van Der Grift等[12]报道的方程计算催化剂的Cu的分散度、暴露的Cu的比表面积和Cu颗粒平均体积-表面直径.
催化剂的Cu分散度为
DCu=2S2/S1×100%.
(1)
催化剂的暴露的Cu比表面积为
SCu≈1 353×S2/S1.
(2)
催化剂的Cu颗粒平均体积-表面直径为
dCu≈0.5×S1/S2.
(3)
采用BELCAT Ⅱ全自动化学吸附仪进行NH3-TPD测试.称取50 mg催化剂装入样品管中,通入氦气(30 mL/min)并升温至300 ℃,脱除杂质气体和水分.降温至50 ℃,通入NH3/He混合气[φ(NH3)=10%,30 mL/min],充分吸附30 min至饱和,然后用He吹扫30 min去除残留的NH3,再以10 ℃/min速率升温至800 ℃,热导池检测器(TCD)检测信号.
1.4 催化剂活性评价
在连续流动固定床反应器中考察催化剂的催化性能.将1.5 mL催化剂装入不锈钢管式反应器(内径10 mm),将热电偶插入催化剂床层.反应前,催化剂在氢气流量为40 mL/min、氮气流量为60 mL/min、230 ℃、常压条件下还原 4 h,然后将温度降至200 ℃,氢气压力升到5 MPa,调节氢气流量为360 mL/min、己二酸二甲酯流量为0.015 mL/min.采用岛津GCMS-QP2020 NX气相色谱质谱联用仪进行产物鉴定;采用安捷伦7890A气相色谱进行产物分析,色谱柱为毛细管柱(KB-WAX,30 m×0.32 mm×0.50 μm),FID检测器;采用校正因子峰面积归一化法进行定量分析.己二酸二甲酯(DMA)的转化率和1,6-己二醇(HDO)的选择性计算公式分别为:
XDMA=(Aa×f1+AHDO×f2+
Ab×f3)/[(ADMA+Aa)×f1+
AHDO×f2+Ab×f3];
(4)
SHDO=(AHDO×f2)/(Aa×f1+
AHDO×f2+Ab×f3).
(5)
式中:ADMA为己二酸二甲酯峰面积;AHDO为1,6-己二醇峰面积;Aa为6-羟基己酸甲酯等不完全加氢副产物总峰面积;Ab为正己醇等过度加氢副产物总峰面积;f1为己二酸二甲酯相对摩尔校正因子;f2为1,6-己二醇相对摩尔校正因子;f3为正己醇相对摩尔校正因子.
2 结果与讨论
2.1 Cu/SiO2催化剂的物理织构性质
焙烧催化剂的N2吸附-脱附等温曲线和孔径分布曲线如图1所示.由图1(a)可知:3种催化剂的吸附-脱附等温曲线均为Ⅳ型,说明3种催化剂都属于介孔材料[13];但蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂滞后环类型为狭缝形孔隙材料的H3型 (IUPAC),而沉积沉淀法的滞后环类型为球形颗粒聚集体的H1型 (IUPAC).由图1(b)可知:蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂的孔径集中分布在较小的3.2 nm和2.5 nm左右,而沉积沉淀法制备的Cu/SiO2催化剂的孔径集中分布在较大的18.4 nm左右.

图1 不同方法制备的Cu/SiO2催化剂的N2吸附-脱附等温曲线和孔径分布曲线
表1列出了焙烧催化剂的BET比表面积、总孔容和平均孔径.其中:蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂的比表面积远大于沉积沉淀法制备的Cu/SiO2催化剂,分别达到了459.5 m2/g和436.7 m2/g;蒸氨法制备的Cu/SiO2催化剂的总孔容和平均孔径均大于溶胶凝胶法制备的Cu/SiO2催化剂的总孔容和平均孔径,分别达到了0.91 cm3/g和7.95 nm.据 Chen等[14]报道蒸氨法制备的Cu/SiO2催化剂因层状硅酸铜特殊的“片状”结构而具有较高的比表面积.传统的沉积沉淀法保持较大的孔径(15.51 nm),因沉淀法会导致铜物种在SiO2表面覆盖和聚集[10],导致其总孔容较小(0.60 cm3/g).不同方法制备的Cu/SiO2催化剂的N2O滴定结果如表1所示,由于蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂大比表面积的特性有利于金属铜的分散,蒸氨法和溶胶凝胶法催化剂都具有较高的铜分散度、铜比表面积和较小的铜粒径.

表1 不同方法制备的Cu/SiO2催化剂的物理结构性能
2.2 Cu/SiO2催化剂的XRD图谱
图2为不同方法制备的Cu/SiO2催化剂焙烧后的XRD图谱.
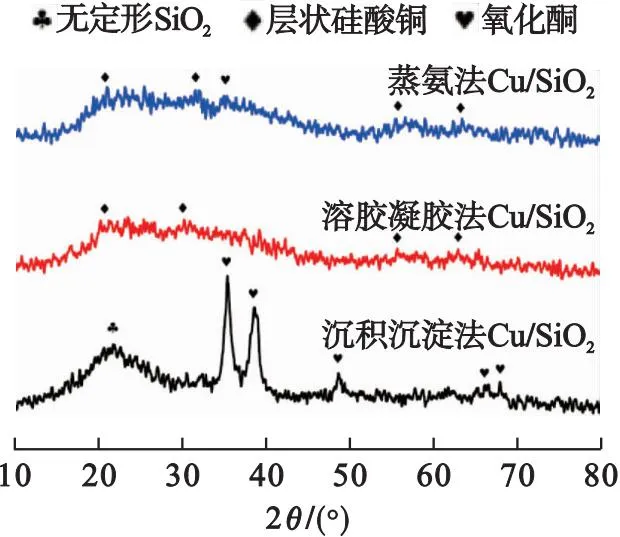
图2 不同方法制备的Cu/SiO2催化剂焙烧后的XRD图谱
由图2可知:沉积沉淀法制备的Cu/SiO2催化剂在2θ=22°处出现较宽的弥散峰,表明SiO2以无定形结构存在;蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂在2θ为30.8°、35°、57.5°和 62.4°处(PDF#27-0188)出现弱峰,表明有层状硅酸铜结构的存在[15];沉积沉淀法制备的Cu/SiO2催化剂在2θ为35.5°、38.7°、48.7°、66.2°和68.1°处(PDF#48-1548)发现CuO的特征峰[15],而蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂则未发现较强的CuO特征峰出现.结合之后的H2-TPR图谱中蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂上均只有一个尖锐的还原峰,表明活性组分铜物种在这两种催化剂上具有良好的分散性.
2.3 Cu/SiO2催化剂的FT-IR图谱
不同方法制备的Cu/SiO2催化剂的FT-IR图谱如图3所示.

图3 不同方法制备的Cu/SiO2催化剂的FT-IR图谱
由图3可以看出:在3 440 cm-1和1 632 cm-1处为吸附水的O—H振动峰,1 115 cm-1处为Si—O反对称伸缩振动峰,800 cm-1和470 cm-1处为Si—O对称伸缩振动吸收峰[14].蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂都出现了波数为670 cm-1的δOH振动吸收峰和波数为1 040 cm-1的肩峰νSiO,这说明催化剂中有层状硅酸铜形成[16].
此外,可用670 cm-1处的峰面积与 800 cm-1处的峰面积的比值I670/I800来粗略表示催化剂中层状硅酸铜的相对含量[9].如表2所示,由于制备方法的不同,溶胶凝胶法制备的Cu/SiO2催化剂层状硅酸铜的相对含量稍大于蒸氨法制备的Cu/SiO2催化剂层状硅酸铜的相对含量,而沉积沉淀法制备的Cu/SiO2催化剂的I670/I800的值为0,表明该催化剂中没有层状硅酸铜的存在.

表2 不同方法制备的Cu/SiO2催化剂的层状硅酸铜相对含量
2.4 Cu/SiO2催化剂的H2-TPR图谱
对3种催化剂进行H2-TPR测试,结果如图4所示.
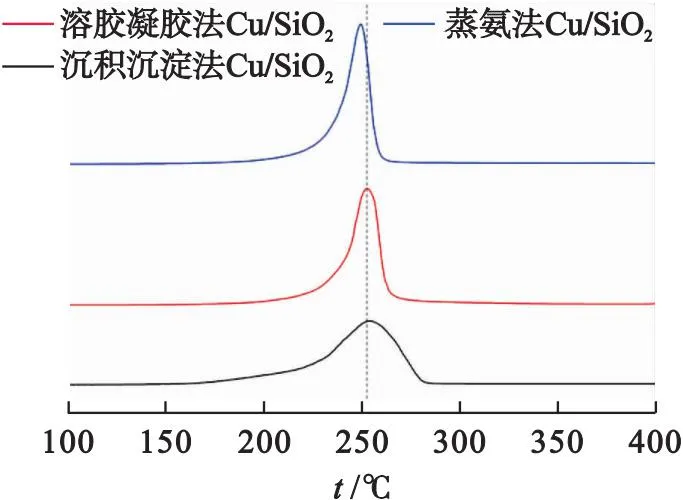
图4 不同方法制备的Cu/SiO2催化剂的H2-TPR图谱
3种制备方法催化剂的TPR曲线都只有一个低温区(200~300 ℃)还原峰[17],据报道,层状硅酸铜还原为Cu+的温度与高度分散的CuO还原为Cu0的过程重叠[18].在3种催化剂中蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂的还原性较好,还原峰较窄、还原温度较低,这说明Cu物种分布均匀[19].与其他两种方法相比沉积沉淀法制备的Cu/SiO2催化剂的H2-TPR曲线的峰型较宽,且还原峰的终点温度较高,这说明催化剂中的铜颗粒分布不均匀并且有大颗粒存在[10].
2.5 Cu/SiO2催化剂的NH3-TPD图谱
Cu+可以作为一种弱酸位在酯加氢反应过程中起重要作用[18],但是过量的酸性位点会导致脱氢、脱水、加氢异构化和裂化反应,从而将重要产物转化为更轻的化合物,而不是线性或饱和化合物[20].因此,为了探究催化剂的表面酸性,对焙烧后和还原后的Cu/SiO2催化剂进行NH3-TPD测试,结果如图5所示.
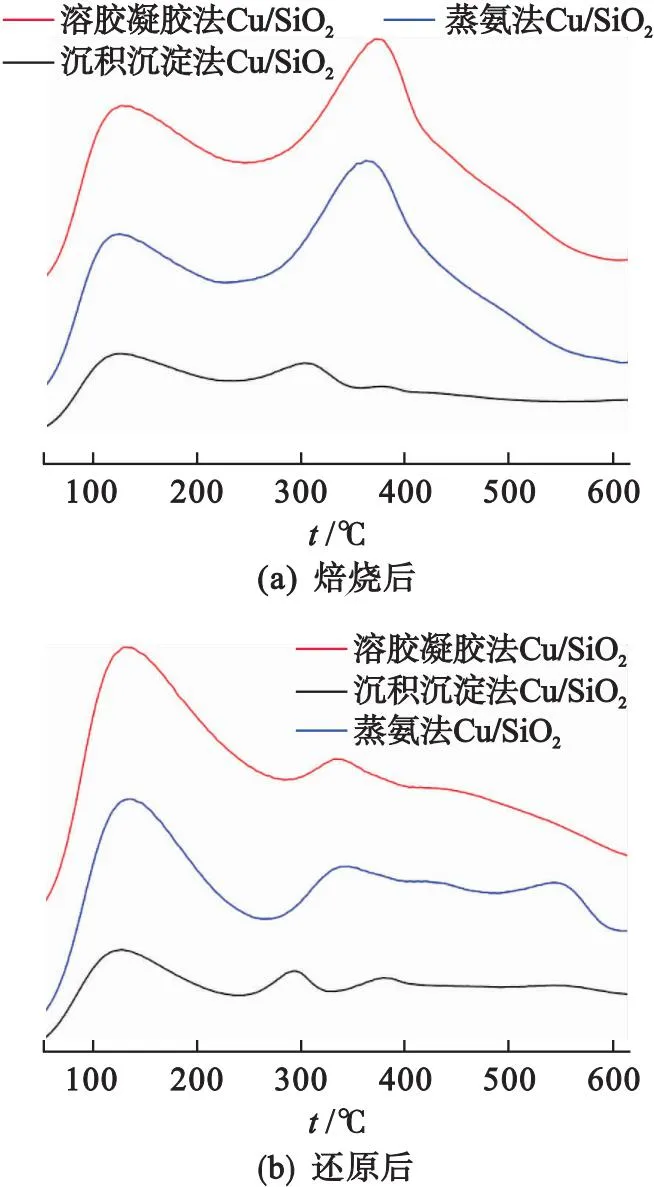
图5 不同方法制备的Cu/SiO2催化剂的NH3-TPD图谱
由图5可以看出:焙烧后和还原后沉积沉淀法制备的Cu/SiO2催化剂酸量都明显小于其他两种催化剂的酸量,Dong等[21]认为这是由于层状硅酸铜特殊的结构导致催化剂表面出现不饱和/缺陷的Si4+和Cu+物种,二者能够大幅地提高Cu/SiO2催化剂的酸量和酸强度,同时Dong等[22]的研究也验证了纯CuO和SiO2几乎没有酸性.
Nie等[23]发现在100~300 ℃、300~400 ℃和400~700 ℃区域检测到3个主要的NH3脱附峰,分别归属于NH3的弱酸、中强酸和强酸中心的脱附.从图5(a)可知:焙烧后蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂都有一个弱酸和一个较大的中强酸峰出现,沉积沉淀法制备的Cu/SiO2催化剂有一个弱酸和两个较小中强酸峰出现;溶胶凝胶法制备的Cu/SiO2催化剂中强酸脱附峰面积比蒸氨法制备的Cu/SiO2催化剂的中强酸脱附峰面积更大一些,结合FT-IR的结果表明这可能是由于溶胶凝胶法层状硅酸铜的相对含量更多导致的.还原后催化剂的NH3脱附曲线如5(b)所示,还原后沉积沉淀法制备的Cu/SiO2催化剂的NH3脱附曲线与焙烧后的NH3脱附曲线类似,而其他两种催化剂还原后的NH3脱附曲线中强酸到强酸区峰面积与还原前比明显变小,这可能是由于经H2还原催化剂中的层状硅酸铜结构大量消失导致酸性位点大量变少而导致的.
2.6 催化剂的催化性能
在液时空速为0.6 h-1、n(氢)/n(酯)=175、反应压力5.0 MPa、反应温度200 ℃的反应条件下,考察不同方法制备的Cu/SiO2催化剂的催化性能,结果如图6所示.由图6(a)可以看出:沉积沉淀法制备的Cu/SiO2催化剂的己二酸二甲酯转化率从6 h开始一直高于其他两种催化剂,其稳定后的转化率可达99.8%,而溶胶凝胶法制备的Cu/SiO2催化剂的转化率一直保持最低,其稳定后的转化率为98.8%.虽然蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂由于层状硅酸铜的存在有着较大的比表面积、铜分散度、较小的铜粒径和更高的酸量,但以上因素都没有使其反应活性进一步提升.结果显示己二酸二甲酯的转化率与催化剂的孔径大小相关,沉积沉淀法制备的Cu/SiO2催化剂因较大的孔径结构而具有更高的反应活性.Zhao等[24]的研究显示大的孔径能提高原料己二酸二甲酯的可及性从而提高催化剂的催化性能,文献[25]的研究结果也证实了孔径大小对己二酸二甲酯加氢制1,6-己二醇有显著影响,过小的孔径会限制己二酸二甲酯分子的扩散从而导致催化性能降低.
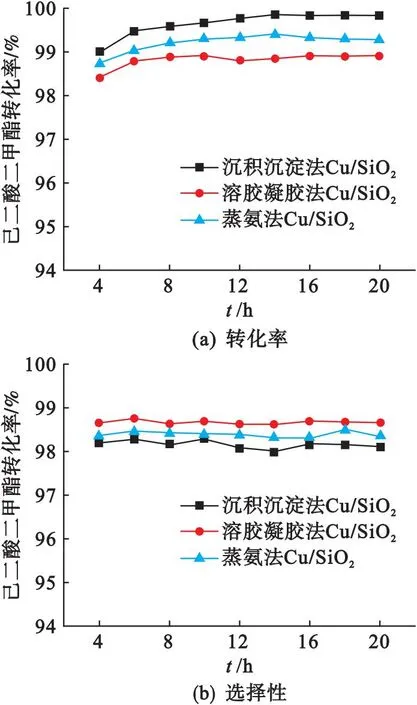
图6 不同方法制备的Cu/SiO2催化剂的己二酸二甲酯转化率和1,6-己二醇选择性随时间变化曲线
图6(b)为不同方法制备的Cu/SiO2催化剂的1,6-己二醇选择性随反应时间变化曲线.其中:溶胶凝胶法制备的Cu/SiO2催化剂选择性最高,而沉积沉淀法制备的Cu/SiO2催化剂的选择性与其他两种方法相比较低;与转化率不同的是选择性并没有随孔径的增大而增大,3种催化剂选择性的大小在不同反应条件下表现出不同的结果,如表3所示.在降低反应压力和液时空速的条件下,3种催化剂选择性的大小与未改变反应条件前的结果完全相反,因此可认为反应条件对Cu/SiO2催化剂的选择性有显著影响.
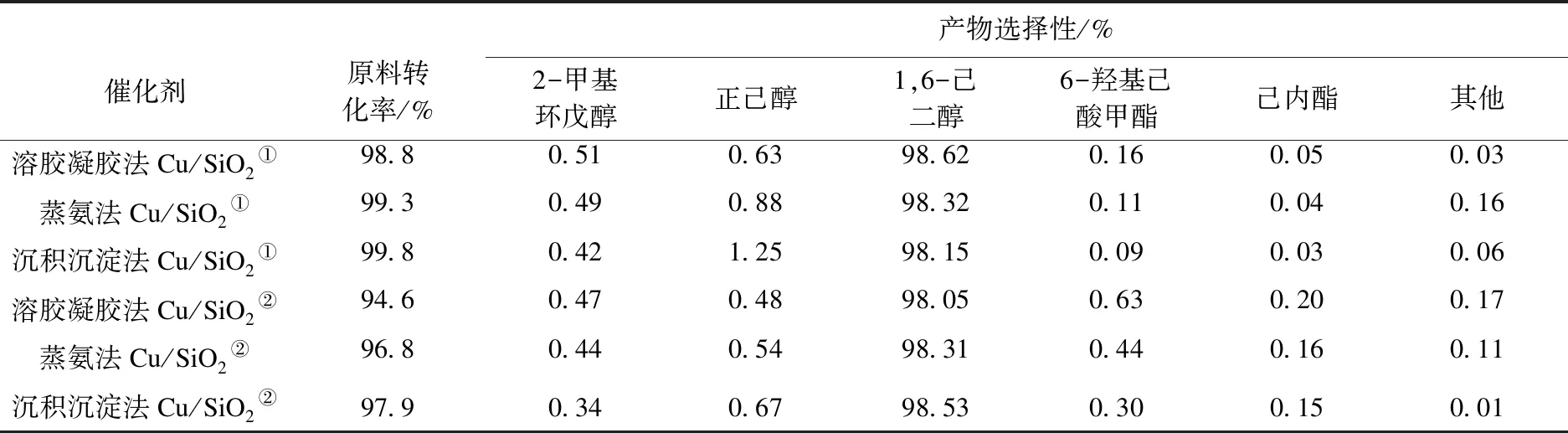
表3 不同方法制备的Cu/SiO2催化剂的催化性能
为探究反应条件对选择性的影响,在不同反应条件下考察Cu/SiO2催化剂的产物分布,结果见表3.类似于徐晓清等[26]对产物的分类方式,笔者认为产物正己醇和2-甲基环戊醇等为过度加氢副产物,产物6-羟基己酸甲酯和己内酯等为不完全加氢副产物.结合表3副产物分布情况,笔者认为在相同反应条件下3种催化剂选择性的不同是受催化剂自身活性的影响,较大的孔径结构会促进加氢反应的进行.在较为严苛的反应条件下,较大的孔径会促进过度加氢反应的进行导致选择性降低;而在较为温和的反应条件下,较大的孔径会促进不完全加氢副产物的转化导致选择性上升.
为进一步探究反应条件对选择性的影响,考察不同液时空速和反应温度对Cu/SiO2催化剂反应性能的影响,结果见表4.由表4可以看出:随着液时空速的提高催化剂的选择性不断下降,这是因为过高的液时空速会导致原料停留时间过短,加氢反应进行的不够充分,从而导致转化率降低,不完全加氢副产物增多.同时还可发现随着反应温度的提高催化剂的选择性不断下降,较高的反应温度有利于原料的转化,但是过高的反应温度会导致过度加氢副产物增多,从而使催化剂的选择性下降.综上所述,Cu/SiO2催化剂的选择性与催化剂自身的反应活性和反应的工艺条件有关.

表4 液时空速和反应温度对Cu/SiO2催化剂催化性能的影响
2.7 催化剂的稳定性能
在液时空速0.6 h-1、n(氢)/n(酯)=175、反应压力5.0 MPa、反应温度200 ℃条件下,考察沉积沉淀法制备的Cu/SiO2催化剂的稳定性,结果如图7所示.由图7可以看出:沉积沉淀法制备的Cu/SiO2催化剂可稳定运行50 h;该催化剂存在着一定的诱导时间,需约14 h转化率才能上升到稳定状态,有研究者在己二酸二甲酯加氢制1,6-己二醇贵金属催化剂的研究中同样发现了这一现象,并称该现象为“反应诱导催化剂活化”[27].虽然寿命短易失活是Cu/SiO2催化剂一直以来存在的问题,但在该实验中沉积沉淀法制备的Cu/SiO2催化剂在较高液时空速(0.6 h-1)的条件下反应50 h未失活,这将大大提高1,6-己二醇的生产能力,具有工业化的潜力.
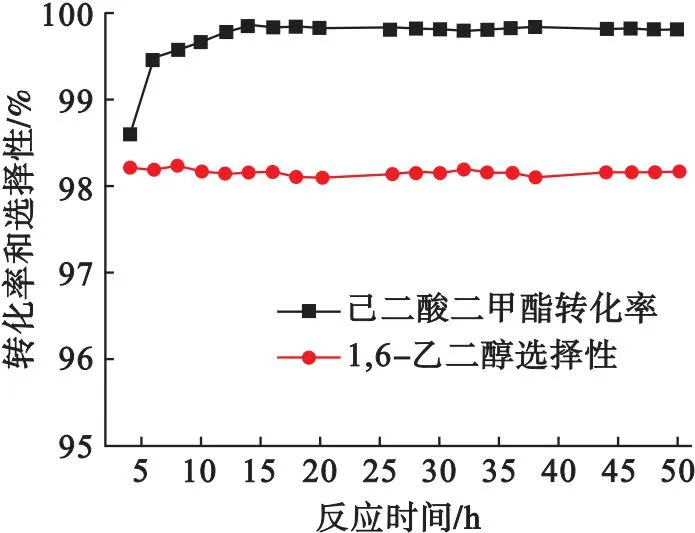
图7 沉积沉淀法制备的Cu/SiO2催化剂稳定性考察
3 结 论
实验对不同方法制备的Cu/SiO2催化剂用于己二酸二甲酯加氢制取1,6-己二醇进行了研究.不同的制备方法对Cu/SiO2催化剂的织构性能和铜的形态有显著影响.与沉积沉淀法制备的Cu/SiO2催化剂相比,蒸氨法和溶胶凝胶法制备的Cu/SiO2催化剂由于层状硅酸铜的存在虽然有着较大的比表面积、较高的铜分散度、较小的铜粒径和更高的酸量,但是较小的孔径限制了原料己二酸二甲酯的转化,导致反应的转化率较低.而反应的选择性、催化剂的加氢活性和反应的工艺条件密切相关,催化剂的表征表明沉积沉淀法制备的Cu/SiO2催化剂较高的催化活性归因于其较大的孔径结构.在所研究的催化剂中,沉积沉淀法制备的Cu/SiO2催化剂在反应温度200 ℃、反应压力5.0 MPa、液时空速 0.6 h-1和n(氢)/n(酯)=175的条件下,己二酸二甲酯的转化率可达99.8%,1,6-己二醇的选择性可达98.2%,同时该催化剂可稳定运行50 h不失活.
