含酚酰腙类衍生物的合成及生物活性研究*
2023-12-31成玉洁刘贞汝谭志同沈亚龙王守信
成玉洁,刘贞汝,谭志同,沈亚龙,王守信,盛 筱
(济宁医学院 药学院,山东 日照 276826)
酪氨酸酶(tyrosinase,Tyr,EC 1.14.18.1)又称为多酚氧化酶,是一种含有多亚基结构的含铜金属氧化酶,主要存在于动物、植物、微生物和人体中,具有重要的生理功能[1]。在哺乳动物中,Tyr是参与黑色素生物合成的关键酶,Tyr的过度表达会导致雀斑、褐斑等色素沉着性疾病的发生,严重者可能会导致恶性黑色素瘤[2]。而当Tyr的活性降低,又会造成黑色素的缺失,引起白癜风、白化病等疾病[3]。此外,Tyr还与昆虫的蜕皮、伤口愈合以及水果蔬菜的酶促褐变直接相关[4-5]。因此,开发高效、低毒的 Tyr抑制剂和激活剂在化妆品、医药、农业等领域备受关注,已成为当今研究的热点。
研究发现,细胞在正常代谢过程中会产生自由基[6],而当自由基浓度过高时会攻击生物体内的生物大分子,损害机体的组织和细胞,加快人体衰老,并会诱发心血管疾病、冠心病及癌症等[7]。抗氧化剂可以清除掉人体内多余的自由基,从而起到预防衰老和疾病发生的作用。所以,设计合成高活性的抗氧化剂一直是医药、食品、保健等领域的热门课题。
酚类化合物往往具有较好的Tyr抑制活性和抗氧化活性,其在Tyr抑制剂和抗氧化剂的研发中一直备受关注[8]。此外,酰腙类化合物因具有多样的药理活性,在药物研发中占有重要地位。研究发现,相比普通的Schiff碱,酰腙类Schiff碱具有稳定性更高、生物活性更好、化学毒性更低、更容易被生物降解等优点[9]。基于此,本研究拟将两个苯酚结构通过酰腙活性片段进行拼接,设计合成一系列含酚结构的酰腙类化合物,并初步测试它们对Tyr的抑制活性及抗氧化活性,为开发更多类型的酚类Tyr抑制剂与抗氧化剂提供参考。
1 实验部分
1.1 主要仪器与试剂
DNM-9602G酶标分析仪(北京普朗新技术有限公司);UV-2450紫外分光光度计(日本岛津公司);Bruker Avance NEO 400 MHz核磁共振波谱仪(瑞士布鲁克公司)。
1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、各种羟基取代苯甲醛(分析纯,上海萨恩化学技术有限公司);各种羟基取代苯甲酸甲酯、抗坏血酸、曲酸(分析纯,上海迈瑞尔化学技术有限公司);水合肼、L-多巴、3-甲基-2-苯并噻唑酮腙盐酸盐水合物(MBTH)、过硫酸钾(分析纯,天津希恩思生化科技有限公司);酪氨酸酶(合肥巴斯夫生物科技有限公司),其余试剂均为市售分析纯。
1.2 合成路线
本文共合成16种含酚酰腙类化合物,合成步骤如图1所示。

图1 化合物D1-D16的合成路线
1.2.1 中间体B1~B4的合成
取 100 mL 圆底烧瓶,将 3 mmoL 取代苯甲酸甲酯(A1-A4)和 0.5 mL 80%水合肼溶于 10 mL 甲醇中,在 80 ℃ 下加热回流,TLC监测反应完全后,室温下静置或放冰箱中冷冻,析出大量固体。抽滤后用冷的甲醇洗涤,室温干燥后得到纯的中间体羟基取代苯甲酰肼B1-B4。
1.2.2 目标化合物D1-D16的合成
将 0.89 mmol 羟基取代苯甲酰肼(B1-B4)、1.30 mmol 羟基取代苯甲醛(C1-C4)、10 mL 甲醇置于 100 mL 圆底烧瓶中,滴加两滴醋酸,于 80 ℃ 的油浴中加热回流,TLC监测反应完全。冷却后将反应液置于冰箱中冷冻过夜,然后抽滤,用冷的甲醇洗涤,室温干燥后得纯的目标化合物。如若反应液冷冻后无固体析出或析出固体较少,可旋干反应液后,将粗产物用甲醇/水重结晶,则得到纯的目标化合物。
4-羟基-N′-(4-羟基苯亚甲基)苯甲酰肼(D1),浅黄色固体,收率88%;1H NMR(400 MHz,DMSO-d6)δ:11.47(s,1H),10.12(s,1H),9.92(s,1H),8.33(s,1H),7.80(d,2H,J=8.0 Hz),7.54(d,2H,J=8.0 Hz),6.82~6.87(m,4H);13C NMR(100 MHz,DMSO-d6)δ:162.58,160.56,159.27,147.26,129.57,128.72,125.51,124.08,115.71,114.99。
N′-(2,4-二羟基苯亚甲基)-4-羟基苯甲酰肼(D2),黄色固体,收率63%;1H NMR(400 MHz,DMSO-d6)δ:11.73(s,1H),11.61(s,1H),10.14(s,1H),9.93(s,1H),8.47(s,1H),7.81(d,2H,J=8.4 Hz),7.27(d,1H,J=8.4 Hz),6.87(d,2H,J=8.5 Hz),6.32~6.37(m,2H);13C NMR(100 MHz,DMSO-d6)δ:162.31,160.87,160.64,159.59,148.63,131.49,129.71,123.53,115.21,110.73,107.72,102.81。
N′-(3,4-二羟基苯亚甲基)-4-羟基苯甲酰肼(D3),褐色固体,收率80%;1H NMR(400 MHz,DMSO-d6)δ:11.40(s,1H),10.08(s,1H),9.34(s,1H),9.26(s,1H),8.24(s,1H),7.79(d,2H,J=8.7 Hz),7.24(s,1H),6.91(d,1H,J=7.7 Hz),6.85(d,2H,J=8.6 Hz),6.78(d,1H,J=8.1 Hz);13C NMR(100 MHz,DMSO-d6)δ:162.62,160.62,147.89,147.54,145.82,129.65,126.10,124.26,120.51,115.68,115.09,112.74。
N′-(3,5-二羟基苯亚甲基)-4-羟基苯甲酰肼(D4),褐色固体,收率92%;1H NMR(400 MHz,DMSO-d6)δ:11.55(s,1H),10.16(s,1H),9.47(s,2H),8.23(s,1H),7.80(d,2H,J=12.0 Hz),6.86(d,2H,J=8.0 Hz),6.59(s,2H),6.26(s,1H);13C NMR(100 MHz,DMSO-d6)δ:162.72,160.70,158.71,147.27,136.22,129.68,123.91,115.06,105.12,104.34。
2,4-二羟基-N′-(4-羟基苯亚甲基)苯甲酰肼(D5),黄色固体,收率93%;1H NMR(400 MHz,DMSO-d6)δ:12.49(s,1H),11.56(s,1H),10.24(s,1H),9.98(s,1H),8.34(s,1H),7.81(d,1H,J=12.0 Hz),7.56(d,2H,J=8.0 Hz),6.84(d,2H,J=8.0 Hz),6.36(d,1H,J=8.0 Hz),6.32(d,1H,J=4.0 Hz);13C NMR(100 MHz,DMSO-d6)δ:165.36,162.61,162.37,159.55,148.47,129.52,128.99,125.19,115.77,107.37,106.17,102.89。
N′-(2,4-二羟基苯亚甲基)-2,4-二羟基苯甲酰肼(D6),浅黄色固体,收率76%;1H NMR(400 MHz,DMSO-d6)δ:12.34(s,1H),11.78(s,1H),11.42(s,1H),10.26(s,1H),10.00(s,1H),8.53(s,1H),7.80(d,1H,J=12.0 Hz),7.31(d,1H,J=8.0 Hz),6.35~6.39(m,2H),6.33(s,2H);13C NMR(100 MHz,DMSO-d6)δ:164.95,162.77,162.31,160.83,159.52,149.33,131.35,129.55,110.54,107.77,107.51,105.86,102.89,102.69。
N′-(3,4-二羟基苯亚甲基)-2,4-二羟基苯甲酰肼(D7),白色固体,收率92%;1H NMR(400 MHz,DMSO-d6)δ:12.50(s,1H),11.49(s,1H),10.22(s,1H),9.43(s,1H),9.31(s,1H),8.25(s,1H),7.79(d,1H,J=8.6 Hz),7.25(s,1H),6.96(d,1H,J=7.8 Hz),6.80(d,1H,J=8.2 Hz),6.37(dd,1H,J=1.9 Hz,J=8.7Hz),6.32(s,1H);13C NMR(100 MHz,DMSO-d6)δ:165.46,162.69,162.51,148.81,148.23,145.87,129.57,125.77,120.89,115.74,112.89,107.47,106.30,103.01。
N′-(3,5-二羟基苯亚甲基)-2,4-二羟基苯甲酰肼(D8),灰色固体,收率88%;1H NMR(400 MHz,DMSO-d6)δ:12.36(s,1H),11.57(s,1H),10.23(s,1H),9.47(s,2H),8.23(s,1H),7.78(d,1H,J=8.6 Hz),6.60(s,2H),6.36(dd,1H,J=2.3 Hz,J=8.7 Hz),6.31(d,1H,J=2.2 Hz),6.26~6.28(m,1H);13C NMR(100 MHz,DMSO-d6)δ:165.57,162.83,162.41,158.85,148.54,136.03,129.81,107.60,105.44,104.74,103.02。
3,4-二羟基-N′-(4-羟基苯亚甲基)苯甲酰肼(D9),黄色固体,收率90%;1H NMR(400 MHz,DMSO-d6)δ:11.38(s,1H),9.88(s,1H),9.58(s,1H),9.21(s,1H),8.31(s,1H),7.52(d,2H,J=8.3 Hz),7.34(s,1H),7.27(dd,1H,J=1.9 Hz,J=8.2 Hz),6.80~6.84(m,3H);13C NMR(100 MHz,DMSO-d6)δ:162.69,159.20,148.84,147.08,145.02,128.67,125.57,124.60,119.43,115.69,115.36,114.96。
N′-(2,4-二羟基苯亚甲基)-3,4-二羟基苯甲酰肼(D10),浅褐色固体,收率55%;1H NMR(400 MHz,DMSO-d6)δ:11.67(s,2H),9.58(s,3H),8.46(s,1H),7.36(s,1H),7.30(d,1H,J=8.2 Hz),7.25(d,1H,J=8.4 Hz),6.83(d,1H,J=8.2 Hz),6.31~6.37(m,2H);13C NMR(100 MHz,DMSO-d6)δ:162.48,160.61,159.60,149.25,148.60,145.23,131.55,124.00,119.66,115.43,115.19,110.75,107.72,102.82。
N′-(3,4 -二羟基苯亚甲基)-3,4-二羟基苯甲酰肼(D11),褐色固体,收率69%;1H NMR(400 MHz,DMSO-d6)δ:11.32(s,1H),9.29(s,4H),8.22(s,1H),9.23(s,2H),8.21(s,1H),7.34(d,1H,J=4.0 Hz,J=8.0 Hz),7.27(dd,1H,J=4.0 Hz,J=8.0 Hz),7.21(s,1H),6.91(dd,1H,J=4.0 Hz),6.76~6.82(m,2H);13C NMR(100 MHz,DMSO-d6)δ:162.60,148.78,147.70,147.25,145.67,144.97,126.02,124.63,120.31,119.37,115.54,115.31,114.93,112.60。
N′-(3,5-二羟基苯亚甲基)-3,4 -二羟基苯甲酰肼(D12),深褐色固体,收率90%;1H NMR(400 MHz,DMSO-d6)δ:11.45(s,1H),9.63(s,1H),9.44(s,1H),9.23(s,2H),8.21(s,1H),7.34(d,1H,J=4.0 Hz),7.28(q,1H,J=12.0 Hz),6.81(d,1H,J=8.0 Hz),6.57(s,1H),6.24~6.27(m,3H);13C NMR(100 MHz,DMSO-d6)δ:162.85,158.68,149.00,147.11,145.05,136.27,124.41,119.56,115.40,115.00,105.10,104.29。
3,5-二羟基-N′-(4 -羟基苯亚甲基)苯甲酰肼(D13),棕色固体,收率86%;1H NMR(400 MHz,DMSO-d6)δ:11.47(s,1H),9.90(s,1H),9.54(s,2H),8.31(s,1H),7.53(d,2H,J=8.0 Hz),6.83(d,2H,J=8.0 Hz),6.73(s,2H),6.41(s,1H);13C NMR(100 MHz,DMSO-d6)δ:163.07,159.32,158.35,147.80,135.72,128.77,125.41,115.68,105.69,105.44。
N′-(2,4-二羟基苯亚甲基)-3,5-二羟基苯甲酰肼(D14),红棕色固体,收率93%;1H NMR(400 MHz,DMSO-d6)δ:11.77(s,1H),11.55(s,1H),9.98(s,1H),9.62(s,2H),8.47(s,1H),7.26(d,1H,J=8.4 Hz),6.75(s,2H),6.83(d,2H,J=8.0 Hz),6.43(s,1H),6.35(d,1H,J=8.5 Hz),6.32(s,1H);13C NMR(100 MHz,DMSO-d6)δ:162.9,160.80,159.68,158.59,149.34,135.14,131.66,110.68,107.83,105.87,102.84。
N′-(3,4-二羟基苯亚甲基)-3,5-二羟基苯甲酰肼(D15),褐色固体,收率89%;1H NMR(400 MHz,DMSO-d6)δ:11.42(s,1H),9.54(s,2H),9.36(s,1H),9.26(s,1H),8.22(s,1H),7.21(d,1H,J=1.6 Hz),6.89(dd,1H,J=1.7 Hz,J=8.1 Hz),6.77(d,1H,J=8.1 Hz),6.71(d,2H,J=2.0 Hz),6.40(s,1H);13C NMR(100 MHz,DMSO-d6)δ:163.22,158.51,148.21,148.03,145.84,135.90,126.02,120.6,115.72,112.83,105.85,105.60。
N′-(3,5-二羟基苯亚甲基)-3,5-二羟基苯甲酰肼(D16),褐色固体,收率67%;1H NMR(400 MHz,DMSO-d6)δ:11.54(s,1H),9.57(s,2H),9.44(s,2H),8.21(s,1H),6.72(s,2H),6.57(s,2H),6.41(s,1H),6.26(s,1H);13C NMR(100 MHz,DMSO-d6)δ:163.24,158.68,158.39,147.87,136.10,135.54,105.75,105.60,105.16,104.42。
1.3 化合物D1-D16与Tyr作用的实验步骤
参照文献[10]的方法并稍作调整。实验中以L-多巴为底物,曲酸为阳性对照。具体测试步骤如下:DMSO溶解待测化合物得到 20 mmol/L 的储备液,然后用pH=7.4 磷酸盐缓冲液(PBS)稀释成所需浓度的溶液。反应在96 孔培养板中进行,总反应体系 300 μL。在测试体系中依次加入 111 μL PBS,6 μL Tyr,3 μL 待测样品,混匀后加入 60 μL MBTH(5 mmol/L)溶液,120 μLL-多巴(2.5 mmol/L)溶液,充分混匀后室温反应 10 min,然后往体系中加入 300 μL 乙腈终止反应;取 200 μL 混合溶液用酶标仪于 492 nm 波长下测量其吸光度,每次实验重复测试三次。最后根据下列公式计算对Tyr的抑制率。
Tyr 抑制率=[1-(A1-A2)/(A3-A4)]×100%
其中,A1为加入样品和酶时混合液的吸光度;A2为加入样品而未加酶时混合液的吸光度;A3为未加样品加酶时混合液的吸光度;A4为未加样品亦未加酶时混合液的吸光度。
1.4 清除ABTS自由基(ABTS+·)实验
参照文献[11]并稍作调整。在两个 50 mL 容量瓶里分别用蒸馏水配制成 7 mmol/L 的ABTS溶液与 4.9 mmol/L 的K2S2O8溶液,然后将二者混合均匀,于室温避光条件下储存 12 h,得到ABTS+·储备液。不断用乙醇稀释储备液使其在 734 nm 处吸光度为0.70±0.02。移取 0.1 mL 不同浓度的样品溶液和 1.9 mL 的ABTS+·溶液,使样品终浓度在0.1~20 μmol/L 之间,混匀后避光反应 30 min。测定 734 nm 处的吸光度,以抗坏血酸作为阳性对照。
ABTS+·清除率=[1-(A样品-A对照)/A空白]×100%
式中:A样品为样品反应后溶液的吸光度;A对照为样品对照溶液的吸光度;A空白为空白的ABTS+·溶液的吸光度。
1.5 清除DPPH自由基(DPPH·)实验
参照文献[11]并稍作调整。在 50 mL 容量瓶里配制 0.2 mmol/L 的DPPH·溶液,避光保存。移取 0.1 mL 不同浓度的样品溶液和 1.9 mL 的DPPH·溶液,使样品终浓度在1~200 μmol/L 之间,混匀后避光反应 30 min。测定 517 nm 处的吸光度,以抗坏血酸作为阳性对照。
DPPH·的清除率=[1-(A样品-A对照)/A空白]×100%
式中:A样品为样品反应后溶液的吸光度;A对照为样品对照溶液的吸光度;A空白为空白的ABTS+·溶液的吸光度。
2 结果与讨论
2.1 目标化合物与Tyr的作用结果
化合物D1-D16对Tyr活性的测试结果见表1。
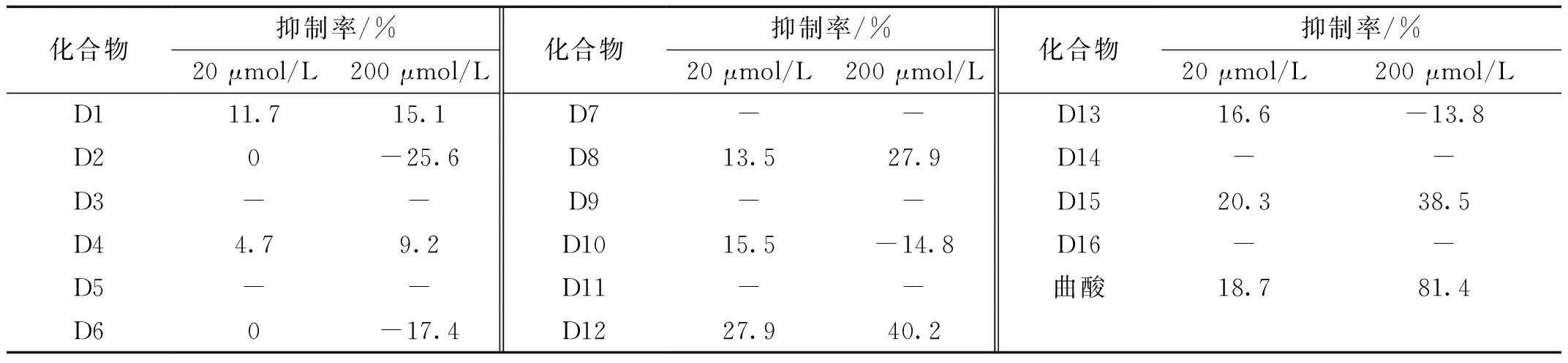
表1 目标化合物D1~D16对Tyr活性的抑制率
由表1可知,化合物D1-D16对Tyr表现出不同的作用效果。化合物D3、D5、D7、D9、D11、D13与D16在不加L-多巴时,自身就能够被Tyr氧化而与MBTH结合成粉红色的产物,说明这些化合物本身就可以作为Tyr的底物。化合物D1、D8、D12和D15在浓度 20 μmol/L 和 200 μmol/L 时对Tyr均有一定的抑制效果,但在浓度 200 μmol/L 时它们的对Tyr的抑制率均明显低于对照药物曲酸,其中的化合物D12和D15在浓度 20 μmol/L 时具有优于曲酸的Tyr抑制活性。化合物D2和D6在浓度 20 μmol/L 对Tyr无作用,而在浓度 200 μmol/L 时对Tyr的抑制率分别为-25.6%与-17.4%,说明这两个化合物在高浓度时对Tyr有一定的激活作用。化合物D10和D13在低浓度(20 μmol/L)时对Tyr显示与曲酸相当的抑制效果,而在高浓度(200 μmol/L)时却具有一定的Tyr激活活性。从构效关系上初步分析发现,当目标化合物结构中一个苯环上的间位和对位同时含有羟基时,因与L-多巴结构相似,大多可作为Tyr的底物;当目标化合物结构中一个苯环上的两个间位同时含有羟基时,大多具有一定的Tyr抑制活性;当目标化合物结构中一个苯环上的邻位和对位同时含有羟基时,大多对Tyr有一定的激活活性。
2.2 目标化合物清除ABTS+·和DPPH·的结果
化合物D1-D16清除ABTS+·和DPPH·的IC50值见表2。
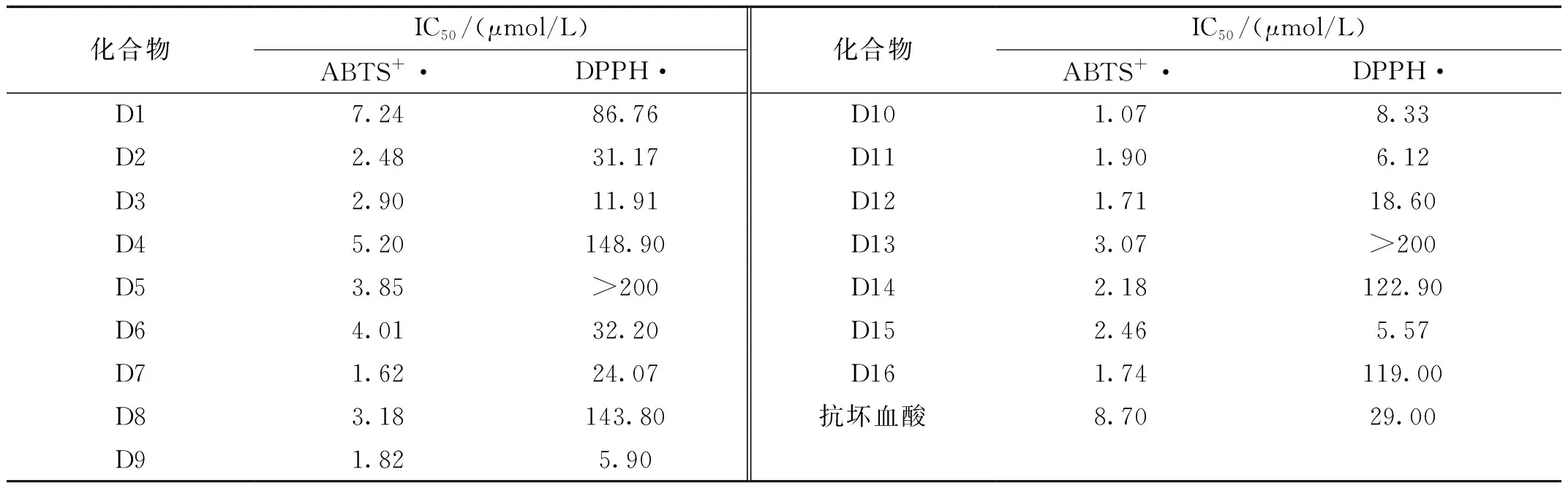
表2 化合物D1-D16对ABTS+·和DPPH·的清除效
由表2可知,所有目标化合物均有具较好的清除ABTS+·的活性,IC50值均优于对照药物抗坏血酸,其中的化合物D7、D9、D10、D11、D12、D16的活性尤为突出,大约是对照药物抗坏血酸活性的4.5~8倍。相比于ABTS+·,化合物D1-D16清除DPPH·的能力则表现出较大的差异,其中的化合物D3、D9、D10、D11、D12和D15具有优异的清除DPPH·活性,IC50值明显优于抗坏血酸;化合物D2、D6、D7的活性与抗坏血酸相当;而化合物D1、D4、D5、D8、D13、D14与D16活性则相对较差。构效关系初步分析表明,当D1-D16的结构中含有单羟基取代的苯环时,清除ABTS+·和DPPH·的活性大多较差;当D1-D16结构中一个苯环上的间位和对位同时被羟基取代时,具有优异的清除ABTS+·和DPPH·的活性;当D1-D16结构中一个苯环上的两个间位同时被羟基取代时,大多具有较差的清除DPPH·的活性,而对清除ABTS+·活性影响不大。
3 结论
以羟基取代苯甲酸甲酯、水合肼,以及羟基取代苯甲醛为原料,通过肼解、缩合两步反应,合成了16个含酚酰腙类化合物(D1-D16),并初步测试了其与Tyr的作用以及清除ABTS+·和DPPH·的能力。结果表明,目标化合物D1-D16对Tyr表现出抑制和激活不同的作用效果,部分化合物自身可作为Tyr的底物。所有目标化合物均具有优异的清除ABTS+·的活性,IC50均强于对照药物抗坏血酸;部分化合物具有优异的清除DPPH·的活性,明显强于对照药物抗坏血酸。初步构效关系分析表明,目标化合物结构中苯环上羟基的数目和取代位置对活性有较大影响。该研究设计合成的部分含酚酰腙类化合物具有优异的抗氧化活性,可作为先导结构进一步深入研究。
