高熵氧化物的设计及其在锂离子电池中的应用研究进展
2023-12-21徐昊宇康巧玲李冬云葛洪良陆轻铱
徐昊宇 王 睿*, 康巧玲*, 李冬云 徐 扬 葛洪良 陆轻铱
(1中国计量大学材料与化学学院,杭州 310018)
(2南京大学化学化工学院,南京 210023)
高熵氧化物(HEOs)是指由5 种或更多元素的固溶体组成的单相氧化物,各金属元素之间的物质的量之比为5%~35%。各组元混乱无序排列使高熵材料具有高的构型熵和优良的结构稳定性[1-4]。起初是由Rost 等[5]将高熵陶瓷材料进一步拓展到HEOs领域,且首次以金属氧化物为原料,采用传统的高温固相反应法成功制备了具有单一岩盐型结构的(MgCoNiCuZn)O HEOs。这项开创性的工作表明,熵可以促进多相混合物和五相单相氧化物固溶体之间的可逆转变[6]。有趣之处在于,八面体配位的Cu2+离子的电子占据的不对称性可能会表现出Jahn-Teller 畸变,导致4 个短的和2 个长的Cu2+—O2-分离。然而,所制备的(MgCoNiCuZn)O 即使在CuO 含量为20%的情况下也能保持稳定的单相,也就是说,熵因子由于对晶格畸变的高度耐受,在支持多组分氧化物的结构稳定性方面表现优异。更准确地说,由构型熵形成的新相应称为“熵稳定”。相比之下,传统的多组分固溶体有高熵,但通常不是熵稳定的,关键的区别是存在熵驱动临界温度下的相变。此后,一系列的HEOs,如萤石型[7-8]、尖晶石型[9-13]、钙钛矿型[14-15]、O3 和P2 层状结构被发现并合成。HEOs 一般需要满足混合熵(ΔSconfi)大于1.5R[16-17]。值得注意的是,混合熵通常用构型表示,因为它占主导地位,易于量化,HEOs 的混合熵可以用公式1 计算;公式2 适用于各组分等物质的量的情况[18];
式中R为摩尔气体常数(8.314 J·mol-1·K-1),N为组分数,Xi和Xj分别为阳离子和阴离子的物质的量分数[19]。HEOs 打破了掺杂氧化物的固有概念。一方面,高构型熵有利于形成简单的固溶体结构。另一方面,主要因素往往是混乱的排列,它们的化学成分处于无序状态,从而导致了一些有趣的性能的提升。
近年来,HEOs 在电化学储能领域受到越来越多的关注,特别是作为锂离子电池(LIBs)的阳极。图1a、1b 为近年来发表的关于HEOs 应用在LIBs 领域的文献及引用率,从图中可以看出,自2013 年首次报道后,2014—2017 年没有报道过相关的文献,而从2018 年至今,相关文章及引用率逐年递增,说明HEOs 在LIBs 领域具有非常可观的应用前景。HEOs 除了固有的多电子氧化还原机制以及高安全性以外,还有多种优势:(1)丰富灵活的组分设计减少了对任何单一元素的依赖,并为定制/微调电化学行为创造了新的机会[20];(2)热力学高熵效应和动力学迟滞扩散效应使HEOs 即使在恶劣的运行条件下也能保持稳定的结构。因此,有利于抑制体积膨胀和改善循环性能;(3)多组分协同作用和本质复杂的HEOs 表面几乎可以提供连续能量吸附,适用于多步串联反应,其次,高度无序和扭曲的晶格形成了许多内部缺陷结构,有利于促进电子和离子迁移[21];(4)HEOs 的电子结构,特别是费米能级与电极电位有关,可以通过改变化学计量比来调节[21]。然而,从目前的研究情况来看,HEOs 还面临着充放电过程中体积膨胀效应明显、导电性与锂扩散能力不足以及库仑效率较低等问题,这严重地阻碍了其进一步应用。为了加速其产业化应用的到来,国内外学者围绕着克服HEOs 本征缺陷、提高电化学性能开展了大量的研究工作。

图1 以关键词“high-entropy oxide,lithium-ion battery”在Web of Science中的检索结果分析图:(a)出版物的数量随着出版年份的变化;(b)引用次数随着出版年份的变化;(c)HEOs的电子调控和结构调控以实现高效锂电性能Fig.1 Analysis of search results in Web of Science with the keyword “high-entropy oxide,lithium-ion battery”:(a)the number of publications changed with the publication year;(b)the number of citations changed with the publication year;(c)illustration of the structural design and electronic modulation of HEOs to achieve high-efficiency lithium battery performance
概括起来说,HEOs 的化学成分调节和结构设计是提高电化学性能的关键[22-23]。如图1c 所示,本文分别从化学成分调控和结构设计2个方面结合本课题组近年来的研究及国内外重要文献,综述了HEOs 作为LIBs 电极材料的研究进展。在化学成分调控方面通过金属杂原子掺杂、非金属杂原子掺杂来提高HEOs 的本征活性。在结构设计方面,通过构建一维结构、二维结构、三维结构、空心结构以及碳材料支撑来增加HEOs 的反应活性位点数量,从而提高HEOs 的储锂性能。这项工作为开发高性能HEOs LIBs负极材料提供了有价值的见解。
1 本征活性调控
1.1 金属阳离子掺杂HEOs
金属阳离子掺杂至HEOs 中可以显著地优化其内在属性,诱导晶格中氧空位的形成,同时可以引入金属原子空位[24-26]。存在的空位可以有效地促进Li+离子在晶格中的扩散,为转化反应提供了额外的活性位点,从而提升电极的电化学动力学性能。空位还可以在不影响晶体稳定性的条件下一定程度上增加活性物质和电解液的接触面,有助于在材料内部形成原子级的导电网络,从而促进锂离子的脱嵌,有望进一步缓解负极材料的体积变化,增强循环稳定性和电子导电性[27-29]。
Duan 等[30]通过高温固相法合成了一系列七元素尖晶石结构HEOs((FeCoNiCrMnXLi)3O4,X=Cu、Mg、Zn),如图2所示,并比较了其作为LIBs负极材料的电化学性能。研究发现,采用Cu、Mg、Zn 三种金属元素掺杂形成的3种七元素样品均表现出良好的结构稳定性,这可以归因于7 种元素的协同作用使相稳定。其中,金属Zn 掺杂的HEOs 具有最高的储锂性能,在500 mA·g-1的电流密度下循环100 圈后仍然具有522.1 mAh·g-1的比容量,主要是因为Zn的掺杂形成多阳离子混合价态的HEOs 具有更为优异的电导率及反应活性。

图2 (a)(FeCoNiCrMnCuLi)3O4、(b)(FeCoNiCrMnMgLi)3O4及(c)(FeCoNiCrMnZnLi)3O4的SEM照片;(FeCoNiCrMnZnLi)3O4的(d)HRTEM图和(e)元素映射图[30]Fig.2 SEM images of(a)(FeCoNiCrMnCuLi)3O4,(b)(FeCoNiCrMnMgLi)3O4,and(c)(FeCoNiCrMnZnLi)3O4;(d)HRTEM images and(e)element mappings of(FeCoNiCrMnZnLi)3O4[30]
除了高价阳离子的掺杂以外,低价阳离子的掺杂会产生电荷补偿作用,从而形成氧空位。氧空位对于提高氧化物负极的电化学性能有双重作用,第一个作用是通过创造额外的Li+离子调节位点,加速电子和离子的电导率来增加放电比容量。第二个作用是氧空位产生的不平衡电荷分布导致外来库仑力的形成,促进了Li+离子的迁移。
Liu 等[31]采用熔盐法获得了(LiMgCoNiCuZn)O HEOs,并将其应用于LIBs 负极材料(图3a)。X 射线光电子能谱(XPS)分析表明,将Li+掺杂到HEOs 中时,氧空位的含量从40.3%增加到53.6%(图3b),这极大地影响了(LiMgCoNiCuZn)O HEOs 负极的电化学性能。HEOs 氧空位含量越大,放电容量越高。在电流密度为200 mA·g-1时,(LiMgCoNiCuZn)O循环100 次后的稳定放电容量为630 mAh·g-1,容量保持率高达97%。虽然Li+的离子半径大于Mg2+、Co2+、Ni2+、Cu2+和Zn2+等阳离子的离子半径,但由于电荷补偿机制,Li+的加入导致晶格常数降低,并且产生的氧空位会造成电荷分布不平衡,导致外来库仑力的形成,从而促进Li+离子的迁移。同时,随着Li+的加入,Co2+氧化生成的Co3+含量增加(图3c),根据CoO和Co3O4与Li 反应,每摩尔材料分别可以转移2 和8 mol 电子,Co3+的增加更加有利于电池性能的提高。基于此,(LiMgCoNiCuZn)O (Li-MO)相对于(MgCoNiCuZn)O(MO)材料展现出了更优的循环稳定性及反应动力学(图3d~3g)。除此之外,Wang等[32]通过溶液燃烧合成法制备出了K+掺杂的尖晶石型(KxCoCrFeMnNi)3/(5+x)O4(x=0、0.5、1、1.5),结果表明,等量K+掺杂的(K1/6Co1/6Cr1/6Fe1/6Mn1/6Ni1/6)3O4HEOs 负极材料具有最高的比容量和优异的倍率性能,在1 A·g-1大电流密度下循环500次仍具有1 402 mAh·g-1的可逆比容量,这主要是因为掺杂低价非活性K+时,电荷补偿效应使晶格常数降低,但高构型熵稳定的晶体结构提高了循环稳定性,同时,低价阳离子的引入所形成的丰富的表面氧空位、较小的晶粒尺寸和介孔结构,增加了赝电容贡献率和电子/离子传输能力,从而显著提升了材料的比容量和倍率性能。
综上所述,金属阳离子的引入可以有效地增加HEOs 中氧空穴的浓度,高浓度的氧空位不但能够增加费米能级附近的态密度,而且能降低锂嵌入能垒,有利于电子和离子的传输,从而有利于提升HEOs的储锂性能。
1.2 非金属掺杂HEOs
HEOs 中阴离子活性材料可以进一步提高能量密度[33]且阴离子和阳离子的晶格对构型熵有贡献,能更好地体现高熵材料的熵稳定特点,所以非金属掺杂也为提高HEOs 的电化学性能提供了一个新的研究方向[34]。
Wang等[35]以多阳离子过渡金属基HEOs为前驱体,以LiF或NaCl为反应物,采用机械力化学方法制备了多阴离子和阳离子化合物,形成了锂化Lix(Co0.2Cu0.2Mg0.2Ni0.2Zn0.2)OF 纳米颗粒(图4a~4c)。F元素掺入所形成的M—F 键具有强离子特性,所构成的金属氟化物通常比氧化物具有更高的电化学电势,且相比于Cl-掺杂,F-掺杂更易得到单相结构(图4d)。将所制备的Li(HEO)F 应用于LIBs 正极,在C/10 电流密度下循环300 圈后仍然具有125 mAh·g-1的比容量。这主要是因为与传统的氟氧化物不同,这种F掺杂的HEOs材料内部原子通过前所未有的方式排列,形成了较高的熵值,能够赋予结构优异的稳定性,从而提升了循环性能。除此之外,非金属元素掺杂在不影响电池容量的基础上,不仅能减少有毒昂贵金属元素的使用,还可以导致系统吉布斯自由能的增加,使得氧化还原反应的理论电位更高,同时,还能够抑制循环过程中的氧损失。这种方法可以为LIBs负极的应用提供新思路。

图4 (a、b)Li(HEO)F的TEM及HRTEM照片;(c)能量过滤透射电子显微镜图;(d)LiF和HEO的混合物以及Li(HEO)F的XRD图[35]Fig.4 (a,b)TEM and HRTEM images;(c)Energy filtered transmission electron microscopy mapping of the as-prepared Li(HEO)F;(d)XRD patterns obtained on both a physical mixture of LiF and HEO and the as-prepared Li(HEO)F[35]
2 结构改性
2.1 一维HEOs
一维HEOs 纳米结构具有较高的长径比,在锂离子嵌入过程中对体积膨胀的适应能力较强,可以有效缓解充放电过程中体积膨胀引起的粉化现象[36]。同时,一维纳米结构有利于加快Li+扩散动力学并缩短直流电路径,从而提升电子传输速率。除此之外,一维结构更适合于改善电荷转移并使其具有更多的活性位点[37-38]。
例如,Liu 等[39]在溶剂热条件下,探索出了一种实现多金属氧化物(POM)可控掺入纳米线中以获得HEO-POM 纳米线的通用方法(图5)。利用该方法可以灵活调节金属氧化物的种类,并且POM 也可以被其他类似尺寸的POMs 替代,进一步证明了该策略的可扩展性。所制备的一维CoZnCuNiFeZrCeOx-PMA 纳米线展现出了优异的电化学性能,在10C 的电流密度下循环5 000 圈仍然可以保留92%的比容量,这是因为所制备的一维纳米线结构与高熵多组分的协同作用所带来的优异电化学性能。除了溶剂热法以外,静电纺丝法同样适用于制备高纵横比和高比表面积的纳米状纤维材料,相比较于孤立或者弱连接的纳米粒子,静电纺丝法所制备的纳米线能够沿轴向提供连续的电流路径,同时,沿径向可以缩短离子的扩散距离,并且具有较大的比表面积,使得电解质和电极的接触面积较大,从而减少充放电的时间。在充放电过程中,纳米线可以适应体积膨胀,有利于长循环稳定。例如,Tian 等[40]通过静电纺丝- 煅烧工艺制备了一维La0.8Sr0.2(Cr0.2Mn0.2Fe0.2Co0.2Ni0.2)O高熵钙钛矿氧化物纳米纤维(图6a)。HEOs 纳米纤维独特的多孔结构使其能够与硫充分接触(图6b、6c),引入的多种金属元素可以有效地调节可溶性多硫化物的结合强度,La0.8Sr0.2(Cr0.2Mn0.2Fe0.2Co0.2Ni0.2)O纳米纤维作为双向电催化剂(S/HE-LSMO),通过高熵贡献实现可溶性多硫化物与不溶性Li2S 之间的液固转化过程。研究结果表明,硫负载为8.4 mg·cm-2的S/HE-LSMO 负极材料具有6.6 mAh·cm-2的高面积容量,同时具有良好的循环稳定性。

图5 CoZnCuNiFeZrCeOx-PMA纳米线的(a)HAADF-STEM 照片、(b)TEM照片、(c)HAADF-STEM 照片及相应的元素映射图[39]Fig.5 (a)HAADF-STEM image,(b)TEM image,(c)HAADF-STEM image,and corresponding element mappings of CoZnCuNiFeZrCeOx-PMA nanowires[39]

图6 La0.8Sr0.2(Cr0.2Mn0.2Fe0.2Co0.2Ni0.2)O纳米纤维的(a)制备流程图、(b)SEM照片、(c)TEM照片及相应的元素分布映射图[40]Fig.6 (a)Preparation process,(b)SEM image,(c)TEM image,and corresponding element mapping of La0.8Sr0.2(Cr0.2Mn0.2Fe0.2Co0.2Ni0.2)O nanofibers[40]
静电纺丝法所制备的纳米线实际上是由纳米颗粒组成,所以在考虑粒径对材料影响的同时,也需要考虑沿轴向方向的材料的粒径分布所产生的影响。Triolo 等[41]探索了不同聚合物对所制备的(Mg0.2Co0.2Ni0.2Cu0.2Zn0.2)O 高熵纳米纤维的影响,分别采用了聚乙烯吡咯烷酮(PVP)和聚丙烯腈(PAN)作为高熵材料的聚合物,其中采用PVP 获得的纳米线直径较细(100~1 400 nm),而采用PAN 会形成较粗的纤维,直径变化范围更大(180~2 500 nm),将两者应用于电极中,可以明显看出采用PVP 衍生的样品具有更加优异的电化学性能,在500 mA·g-1的电流密度下进行300 次循环后容量仍然可以保持390 mAh·g-1,这是因为采用PVP作为聚合物的纳米线直径分布更均匀,从而使得电流分布和锂化更均匀,同时,在充放电过程中所引起的体积变化会更小,使其具有更好的循环稳定性。
2.2 二维HEOs
二维层状HEOs 纳米材料具有较大的比表面积、丰富的活性位点,有利于缩短锂离子嵌入/脱出的扩散路径[42-43]。然而,将其直接应用于LIBs 时,二维材料的表面惰性容易引发较低的界面相容性。其次,虽然二维纳米材料具有高的理论比表面积,但是在材料加工或器件制造过程中这些片状的纳米材料会重新聚集从而导致活性位点的丢失[44]。因此,研究者们通过在二维片层结构中构建多孔结构,使得Li+与电极表面发生快速的化学附着和分离,这可以显著提高二维材料的储锂性能[45-46]。
例如,Wei 等[47]利用葡萄糖-尿素共晶溶剂作为溶剂和结构导向剂,并利用微波法将5 种金属盐(Ni、Cu、Mg、Co、Zn)与共晶溶剂结合。最后,通过煅烧获得了二维多孔纳米网的HEOs(图7a)。这是首次形成的二维结构的(Co,Cu,Mg,Ni,Zn)O-10 HEOs,从图7b~7d 可以看出,其具有典型的片层结构及多孔结构。利用该方法巧妙地解决了多种金属元素难以形成均一相的问题(图7e),且6种元素均匀分布在二维片层结构中(图7f)。将该样品应用于LIBs 负极材料,可以得到60%的初始库仑效率,并且在120 mA·g-1的电流密度下循环200 圈,仍有350 mA·g-1的容量,这是因为葡萄糖-尿素共晶溶剂是良好的溶剂,可以实现金属前驱体的原子级混合,碳化的葡萄糖-尿素进一步充当模板,可以限制纳米级碳模板内晶体的生长,防止了纳米结构的坍塌。而微波辅助法的运用,可以快速均匀加热均质液体,使葡萄糖-尿素共晶溶剂脱水聚合,导致所形成的碳基框架具有更好的结构特性。

图7 (Co,Cu,Mg,Ni,Zn)O-10的(a)制备流程示意图、(b,c)SEM照片、(d)TEM照片、(e)HRTEM照片、(f)HADDF-STEM 照片及元素映射图[47]Fig.7 (a)Preparation flow diagram,(b-c)SEM images,(d)TEM image,(e)HRTEM image,and(f)HADDF-STEM image and element mappings of(Co,Cu,Mg,Ni,Zn)O-10[47]
2.3 三维HEOs
三维HEOs 纳米材料往往具有较高的比表面积,能够提供丰富的储锂位点,且三维结构有利于与电解液的充分接触从而加快电子和离子的转移。同时,三维孔道结构还能缩短Li+的扩散路径[48]。此外,三维骨架结构还可以缓解充放电循环过程中的体积膨胀引起的应力[49-51]。
例如,Yang 等[52]利用低温溶胶-凝胶法制备出了三维多孔尖晶石相(Cr0.2Fe0.2Co0.2Ni0.2Zn0.2)3O4HEOs(图8a)。首先,将5 种过渡金属硝酸盐作为金属源,甘氨酸作为螯合剂和燃料剂,在液相中充分混合水解,然后通过加入氨水将溶液的pH 值调整为弱碱性。溶胶经过干燥和老化过程,缓慢聚合形成具有三维网状结构的凝胶(图8b)。将其应用于LIBs负极材料,研究结果表明,所制备的HEO-450 电极在1 A·g-1经过1 000次循环后可提供1 022 mAh·g-1的比容量,同时,在30 A·g-1的超高电流密度下,比容量依旧可达到220 mAh·g-1。这主要是因为HEO-450独特的三维网络结构能够与电解液充分接触(图8c),可以加快离子与电子的转移,同时,三维结构有利于应力的多角度释放,从而减轻循环时活性物质的体积变化。再者,熵稳定效应可以通过晶格畸变效应抑制HEO 晶体结构内阳离子短程有序地形成,从而保证锂离子的快速输运,获得优异的电化学性能。除了三维多孔结构以外,Du 等[53]利用简易的共沉淀法获得了高熵类普鲁士蓝立方块(CoNiCuMnZnFe PBA,图9a),后续通过在500 ℃氩气氛围中煅烧获得了三维立方块结构的HEOs(图9b、9c),所制备的HEOs 完美地保持了高熵类普鲁士蓝三维立方块结构,且Co、Ni、Cu、Mn、Zn、Fe、O均匀分布在立方块当中(图9d)。将所制备的三维HEOs 立方块应用于锂硫电池负极,结果表明,其在0.1C 电流密度下循环200圈后仍然具有570.9 mAh·g-1的比容量。

图8 (Cr0.2Fe0.2Co0.2Ni0.2Zn0.2)3O4的(a)制备流程示意图、(b)SEM照片和(c)接触角测试[52]Fig.8 (a)Schematic illustration for the synthesis process,(b)SEM image,and(c)contact-angle tests of(Cr0.2Fe0.2Co0.2Ni0.2Zn0.2)3O4[52]

图9 (a)高熵PBA的(a1)SEM照片、(a2)TEM照片、HADDF照片及其元素分布;高熵PBA的(b)制备流程图、(c)SEM照片、(d)HADDF-STEM 图及元素映射图[53]Fig.9 (a)SEM image(a1),TEM image(a2),and the corresponding elemental mapping analysis of binary PBA;(b)Schematic illustration for the synthesis process,(c)SEM image,and(d)HADDF-STEM image and element mappings of binary PBA[53]
2.4 中空HEOs
相比于实心结构或者块状结构的HEOs,空心结构的HEOs 因为具有内外表面,往往具有更高的比表面积、更低的密度等特点[54-55],将其应用于LIBs具有多种优势:(1)较大的比表面积,能够增加电极-电解质之间的接触面积;(2)内部空腔能够提供额外的自由体积,有利于缓解Li+嵌入/脱出过程中引起的应力应变;(3)多壳层及核壳空心纳米结构不仅可以显著减少锂离子和电子的扩散路径,还可以提供更多的储锂场所[56-58]。
我们课题组[59]利用葡萄糖水热法,制备了包含多金属的无定型碳球,然后通过煅烧的方式获得晶型的HEOs。在此过程中,通过调节不同的煅烧温度,从而调节离子扩散和氧化速率来获得不同结构的HEOs(图10a)。其中,煅烧温度为350、500、650 ℃时分别获得实心微球、核壳结构微球及中空结构的微球(图10b~10e)。所获得的不同结构的微球中Cr、Mn、Fe、Co、Ni、O 六种元素均匀分布在球体当中。将3 种结构的HEOs 应用于LIBs 负极材料,研究结果表明,核壳型中空CrMnFeCoNiO HEOs 表现出最佳的锂存储性能,其在0.5 A·g-1的电流密度下具有968.5 mAh·g-1的高比容量,这主要是因为高熵组分与中空结构的协同效应。在循环150~300 圈时,比容量呈现上升的趋势,这是因为经过一定时间的充放电,中空结构与电解液充分接触,从而导致容量增大。该研究工作为HEOs 的结构设计提供了新思路。
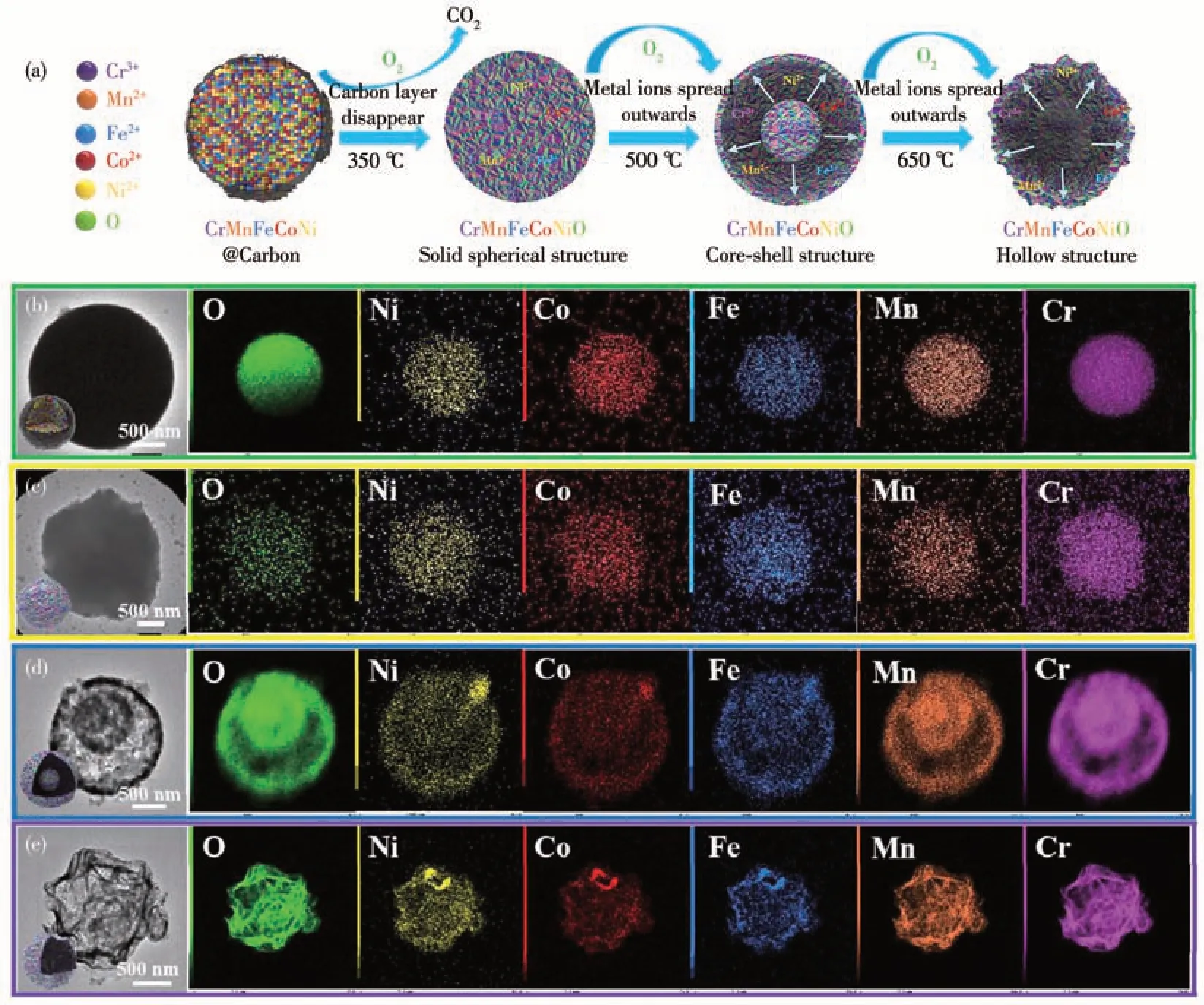
图10 (a)不同结构的HEOs的形成机制;(b)无定型前驱体、(c)实心结构、(d)核壳结构、(e)中空结构的CrMnFeCoNiO 的TEM照片及其元素映射图[59]Fig.10 (a)Mechanism of formation of HEOs with different structures;TEM images and the corresponding element mappings of(b)amorphous precursor,(c)solid spheres,(d)core-shell spheres,and(e)hollow spheres of CrMnFeCoNiO[59]
2.5 HEOs/碳复合材料
通过对HEOs 进行表面包覆来减少电解液和HEOs 的直接接触,形成稳定的SEI 膜,且包覆层可以给HEOs 材料提供更大的缓冲空间,进而缓解其循环过程中的体积膨胀[60-62]。从导电性来看,在材料表面包覆一层导电性优良且在电解液以及在充放电过程中保持稳定的物质,可以改善颗粒间的电子传导性能,从而提高材料的循环性能[63-65]。显然,碳具有成本低、导电性好、化学稳定性高、对充放电过程中副作用小等优点,是满足上述要求的优良导电剂。因此,将HEOs 与导电基体碳复合,可以有效缓冲HEOs 负极材料巨大的体积膨胀问题,从而提高材料的稳定性和循环寿命,进一步为HEOs 材料提供导电通道,增强材料电子电导率和离子扩散动力学性能[66-68]。
石墨烯具有超大的比表面积和较高的机械强度,同时具有良好的导电性和导热性,因此,具有良好的电子和离子传输通道,作为支撑活性材料的基体有利于提高电池的倍率性能[69]。因此,将石墨烯与HEOs 结合起来,组成HEOs/石墨烯复合材料,利用二者之间良好的协同效应,不仅可以抑制HEOs纳米颗粒的团聚,保持HEOs 材料的高活性表面积,还可以提供更多的离子存储位点。另外,石墨烯还可以充当HEOs 材料的导电碳网络,增加复合材料的可逆容量,赋予其优异的循环稳定性和倍率性能。Guo 等[70]通过将氧化石墨烯和HEOs 进行水热反应,获得了以单层或多层薄片相互堆叠的石墨烯均匀覆盖在(Mg0.2Co0.2Ni0.2Cu0.2Zn0.2)O 颗粒表面的负极材料HEO@G(图11a~11i)。将其运用于LIBs 时,在100 mA·g-1的电流密度下,初始库仑效率为81.7%,初始放电比容量高达1 225 mAh·g-1(图11j)。该样品还具有优异的倍率性能,在2 A·g-1的电流密度下保持393 mAh·g-1的比容量(图11k),这主要是因为表层石墨烯的包覆有利于缓冲充放电过程引起的体积膨胀。石墨烯与HEOs 的熵稳定效应相结合还可以提高HEOs的容量。表1列出了不同HEOs材料的优点及性能进行比较。

表1 不同HEOs材料的优点及性能对比Table 1 Advantages and properties comparisons of different high-entropy oxide materials

图11 (a)HEO的SEM照片;HEO@G的(b)SEM照片和(c)TEM照片;HEO@G的(d~i)元素映射图、(j)恒流充放电循环曲线和(k)倍率曲线[70]Fig.11 SEM images of(a)HEO;(b)SEM image and(c)TEM image of HEO@G;(d-i)Elemental mappings,(j)galvanostatic charge-discharge cycle curves,and(k)rate capability profiles of HEO@G[70]
3 结 论
综上所述,高熵金属氧化物具有较高的理论比容量以及组分多样化的元素调制,使得其在LIBs 中具有较大的应用前景,但是高熵金属氧化物仍存在导电性欠佳、初始库仑效率低及在锂离子脱嵌过程中体积膨胀引起的材料粉化等问题。
基于这些问题,本文在本课题组大量实验及文献报道的基础上,综述了化学成分调控包括金属原子掺杂、非金属原子掺杂来提高HEOs 的本征活性;综述了结构设计包括构建一维结构、二维结构、三维结构、空心结构及与碳材料复合来增加HEOs 的反应活性位点数量和提升材料的库仑效率,从而提高HEOs 的储锂性能。这项工作为开发高性能HEOs LIBs负极材料提供了有价值的见解。
然而,目前对HEOs 应用于LIBs 的探究才刚刚开始,不同的制备方法、制备工艺、组分、微观结构以及对其进行的优化都将对储锂性能产生影响。因此距离产业化应用还有较远距离[71-74]。作者认为HEOs 今后的发展将集中在以下几个方面:(1)目前报道的HEOs 通常含有钴元素与镁元素。通过探索其他金属元素的电化学性能,并且利用“鸡尾酒”效应代替材料中的有毒Co 或非活性Mg,探索新的更加环境友好型以及更高电化学性能的HEOs 材料;(2)开发新型制备工艺对HEOs的表界面形态与电子结构进行优化调整,可进一步提升储锂性能;(3)将理论计算和实验研究相结合,探究新的HEOs 系统的组成及计算,用实验来实现有目的的HEOs 合成,并获得其所设计的高效HEOs 储锂材料;(4) 目前HEOs 在电池方面的应用局限在岩盐型与尖晶石型,需要进一步拓展其他类型如钙钛矿型与萤石型HEOs在电池方面的应用,不断完善体系。
