响应面优化法在绣球菌液体菌种培养中的应用
2023-12-14贺立虎王文光李娟丽
贺立虎 王文光 李娟丽
摘要 为获取生物活性高的绣球菌液体培养菌种,采用响应面优化法对液体培养条件进行了优化,以菌丝生物量为指标,建立了菌丝生物量与培养pH、温度、装瓶量的数据模型,得到了适宜的培养条件,即pH为4.5,培养温度为23.9 ℃,装液量为114 mL,在此培养条件下,菌丝生物量达5.9 g/L。
关键词 绣球菌;菌丝生物量;响应面优化法
中图分类号 S 646 文献标识码 A 文章编号 0517-6611(2023)23-0044-04
doi:10.3969/j.issn.0517-6611.2023.23.010
Application of Response Surface Optimization Method in Culture Conditions of Liquid Spawn of Sparassis crispa
HE Li-hu, WANG Wen-guang, LI Juan-li
(Yangling Vocational & Technical College,Yangling,Shaanxi 712100)
Abstract Response surface methodology (RSM) was used to optimize the culture conditions for obtaining high bioactivity Sparassis crispa species, and mycelial biomass was taken as the index, the data model of mycelium biomass, culture pH, culture temperature and culture volume was established, and the suitable culture conditions were obtained. The culture conditions were pH 4.5, culture temperature 23.9 ℃ and culture volume 114 mL, the mycelium biomass reached 5.9 g/L.
Key words Sparassis crispa;Mycelial biomass;Response surface optimization method
基金项目 杨凌职业技术学院2021年科技创新项目(ZK21-69);陕西省2023年农业科技创新项目。
作者简介 贺立虎(1980—),男,陕西合阳人,副教授,从事食用菌资源开发与利用研究。
收稿日期 2022-11-20
绣球菌(Sparassis crispa),又名绣球蕈、对花菌、干巴菌、椰菜菌、蜂窝菌等,为非褶孔菌目绣球菌科绣球菌属。因其具有超高的激活免疫能力,在日本有“梦幻神奇菇”之称。因其含有多种生物活性物质,尤以β-葡聚糖含量最高[1],使其具有抗肿瘤[2]、增强免疫力[3]、保护胃黏膜、抗氧化[4]、抗衰老[5]、促进伤口愈合[6]、提高造血功能[7]等多重保健功效,在保健品市场和化妆品领域受到了追捧[8]。
绣球菌生长对环境要求严格,生长周期长,野生资源产量远不能满足市场的需求。经过大量的研究,近年来已经實现了人工栽培。笔者通过响应面优化法研究pH、培养温度、装瓶量,旨在为获取生物活性高的绣球菌液体培养菌种提供理论支持。
1 材料与方法
1.1 试验方法
将绣球菌母种(闽秀1号)接种于固体培养基(新鲜松针250 g,葡萄糖20 g,蛋白胨5 g,酵母膏5 g,琼脂粉15 g,水1 000 mL)[9]上,于25 ℃培养25 d。将培养后的绣球菌菌种定量接种于液体培养基(新鲜松针250 g,葡萄糖20 g,酵母膏10 g,琼脂粉15 g,水1 000 mL)[7],采用250 mL锥形瓶,每瓶按试验设计进行定量装样,于150 r/min恒温摇床上进行培养,每个处理设置3个平行,培养25 d,进行菌丝生物量的测定。
1.2 菌丝生物量的测定方法[10]
取恒温培养25 d的液体培养基25 mL于离心机中在5 000 r/min下离心10 min,弃去上清液,下层菌丝体用蒸馏水清洗3~4次,吸取表面水分,然后在恒温干燥箱中于60 ℃条件下烘干至恒重,称取重量计算每100 mL发酵液中的菌丝体生物量(g/L)。
1.3 中心组合设计(CCD)
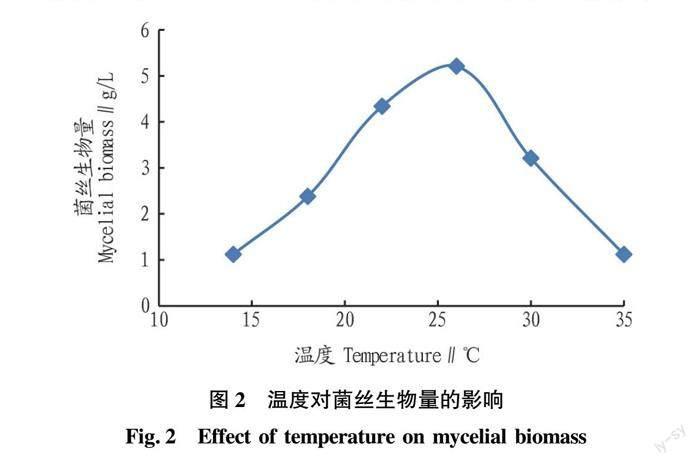
依据pH、培养温度和装液量的单因素试验结果,确定pH、培养温度和装液量的试验范围,以菌丝生物量为试验指标,进行中心组合设计(CCD),对绣球菌液体菌种培养条件进行优化。试验因素及水平见表1。
1.4 数据处理
试验数据采用Excel 2020和Design Expert 11.0.1 软件进行处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 pH对菌丝生物量的影响。
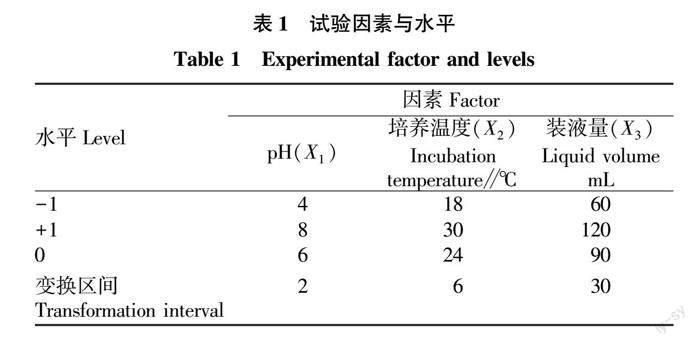
由图1可知,随着pH的升高,菌丝生物量快速增加,当pH达到6左右时,菌丝生物量达到最大4.8 g/L,然后随着pH的增加,菌丝生物量快速下降。pH过大或过小对菌丝生物量都有一定的抑制。
2.1.2 培养温度对菌丝生物量的影响。
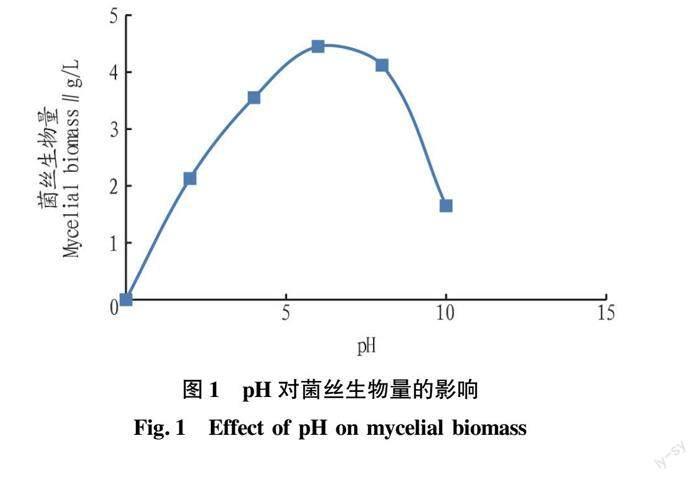
由图2可知,温度对菌丝生物量呈抛物线式的影响,在低温区,随着温度的升高,菌丝生物量快速增加,当达到27 ℃左右时,菌丝生物量达到最大值5.3 g/L,随后随着温度的继续升高,菌丝生物量快速下降。此趋势也符合温度对微生物影响的一般规律。
2.1.3 装液量对菌丝生物量的影响。
由图3可知,在40~120 mL的装液量时,随着装液量的增加,菌丝生物量也随之增加,当装液量在120 mL时,菌丝生物量达到最大为5.2 g/L,随后随着装液量的增加,菌丝生物量略微降低。
2.2 回归方程的建立及显著性分析
依据中心组合设计(CCD)进行试验,其结果见表2。
对表2的试验结果进行统计分析,得到试验指标与各因素之间的回归方程模型(1)。
Y=0.530 4-0.068 4X1+0.046 4X2+0.038 5X3-0.043 7X1X2-0.038 7X1X3-0.063 7X2X3-0.042 8X21-0.025 1X22-0.028 7X23(1)
对回归方程模型(1)以5%为置信区间进行显著性水平分析,回归方程模型、各因数显著性检验结果见表3。
依据回归方程显著性要求,当方程显著性为显著,失拟性误差为不显著时,方程模型呈显著性,即与实际试验结果具有较好的拟合性。由响应面模型方差分析可知,该试验回归方程模型的F为17.77(判定值F(0.01,9,13)=4.19),呈极显著性,失拟性误差的F为2.677(判定值F(0.05,5,8)=3.69),呈不显著,所以该回归方程模型呈极显著性。
在此回归方程模型中,各因素X1、X2、X3、X1X2、X1X3、X2X3、X21、X22、X23的P值均小于0.05,表明各因素都呈显著性。
预测拟合度R2为0.593 7,校正拟合度R2为0.872 8,预测拟合度≤校正拟合度,说明模型是合理的。信噪比值大于4 为理想值,该模型的信噪比为13.495 3,说明比值理想,可以被用来解释设计方案。
2.3 最优试验方案确定
依据二次项中心化组合设计,将因素水平带入方程模型(1)中,可得因素水平回归方程(2)。
Y=-2.245 46+0.239 838X1+0.094 825X2+0.193 91X3-0.003 646X1X2-0.000 646X1X2-0.000 354X2X1-0.010 702X21-0.000 698X22-0.000 032X23
(2)
由表3可知,各因素之间均有显著的交互作用(P<0.05),利用Design Expert 11.0.1软件进行最优方案优化,当pH为4.5、培养温度为23.9 ℃、装液量为114 mL时,可以得到较好的菌丝生物量,依据方程模型(2)可以得到理论菌丝生物量为5.9 g/L(图4~6)。
2.4 数学模型预测结果的验证
在设定菌丝生物量Y=5.9 g/L的前提下,培养pH、培养温度、装液量都在试验因素水平范围内(4<X1<8,18<X2<30,60<X3<120),使菌丝生物量达到最大,通过数学模型对绣球菌液体菌种培养条件进行预测和优化,在Design Expert 11.0.1软件中得出较优的解决方案,即理论预测菌丝生物量为5.9 g/L,此时pH为4.5,培养温度为23.9 ℃,装液量为114 mL,在此试验条件下,连续做5次平行试验,测得菌丝生物量平均值为5.8 g/L,与预测结果吻合度较好,说明利用响应面分析优化绣球菌液体菌种培养是可行的。
3 结论
该研究采用响应面优化法(CCD)对绣球菌液体菌种培养条件进行了优化,以菌丝生物量为指标,建立了绣球菌液体菌种培养与pH、培养温度、装液量3个因素的数据模型,用数据模型对菌丝生物量进行了预测,确定了最佳培养条件。在pH为4.5,培养温度为23.9 ℃,装液量为114 mL的培养条件下,菌丝生物量达5.9 g/L。
参考文献
[1] 廉添添,杨涛,孙军德,等.人工栽培绣球菌的鉴定及其子实体β-葡聚糖含量的酶法测定[J].菌物学报,2014,33(2):254-261.
[2] OHNO N,MIURA N N,NAKAJIMA M,et al.Antitumor 1,3-β-glucan from cultured fruit body of Sparassis crispa[J].Biological & pharmaceutical bulletin,2000,23(7):866-872.
[3] HARADA T,MIURA N N,ADACHI Y,et al.IFN-γ induction by SCG,1,3-β-D-glucan from Sparassis crispa,in DBA/2 mice in vitro[J].Journal of interferon & cytokine research,2002,22(12):1227-1239.
[4] 楚杰,王瑩,郝永任,等.绣球菌菌丝体多糖的抗氧化活性[J].食用菌学报,2017,24(4):50-54.
[5] 李颖,王瀚,赵志强,等.绣球菌多糖的提取及对果蝇寿命的影响[J].安徽农业科学,2014,42(13):3863-3864.
[6] KWON A H,QIU Z Y,HASHIMOTO M,et al.Effects of medicinal mushroom(Sparassis crispa)on wound healing in streptozotocin-induced diabetic rats[J].The American journal of surgery,2009,197(4):503-509.
[7] HARADA T,MIURA N,ADACHI Y,et al.Effect of SCG,1,3-β-D-glucan from Sparassis crispa on the hematopoietic response in cyclophosphamide induced leukopenic mice[J].Biological & pharmaceutical bulletin,2002,25(7):931-939.
[8] 王斌,桑亚姣,张滕霄,等.绣球菌化学成分、人工栽培和液体发酵研究进展[J].黑龙江八一农垦大学学报,2022,34(4):59-64.
[9] 杨丽莉.绣球菌液体菌种培养及栽培基质配方研究[D].杨凌:西北农林科技大学,2019.
[10] 马璐,杨驰,肖冬来,等.广叶绣球菌液体菌种培养条件优化[J].食药用菌,2020,28(6):428-433.
