过瘤胃胆碱和过瘤胃葡萄糖添加对围产期母羊能量负平衡的影响
2023-12-13涂远璐汤海江张凯贾学敬白云峰洪伟
涂远璐 汤海江 张凯 贾学敬 白云峰 洪伟






摘要: 本文通過考察血酮(血液中酮体)浓度、产羔情况及粪便微生物区系组成,评估过瘤胃胆碱(RPC)和过瘤胃葡萄糖(RPG)缓解围产期母羊能量负平衡的效果。试验期共57 d,从产前30 d到产后20 d,预饲期7 d。选取80只妊娠期(120~130 d)湖羊,随机分为4组,对照组饲喂基础饲粮,RPC组每只每天添加3 g RPC,RPG组添加15 g RPG,RPC+RPG组添加3 g RPC和15 g RPG。结果表明,1)RPG组母羊在产羔当天血酮浓度显著低于对照组(P<0.05);2)RPC+RPG组羔羊初生质量显著高于其他组(P<0.05);3)RPC和RPG的添加没有改变门水平和属水平上母羊粪便的优势菌种类,但影响了核心菌群的相对丰度,各试验组厚壁菌门和瘤胃球菌科UCG-010相对丰度均显著低于对照组(P<0.05),RPC+RPG组拟杆菌门相对丰度显著高于其他组(P<0.05),RPG组毛螺菌科AC2044群相对丰度显著高于对照组(P<0.05)。由此得出,围产期母羊饲粮中添加RPC和RPG均有助于提高羔羊初生质量,提高母羊肠道中碳水化合物利用菌拟杆菌门的相对丰度,降低纤维分解菌群厚壁菌门的相对丰度,RPG的添加还使得肠道抗炎有益菌毛螺菌科属相对丰度得到提高,同时有效降低血酮浓度。综合考虑,RPG单独添加效果最佳,RPC的适宜添加量有待进一步研究。
关键字: 过瘤胃胆碱;过瘤胃葡萄糖;能量负平衡;粪便微生物;湖羊
中图分类号: S858.26 文献标识码: A 文章编号: 1000-4440(2023)07-1567-08
Effects of rumen-protected choline and rumen-protected glucose supplementation on negative energy balance of perinatal ewes
TU Yuan-lu1,2, TANG Hai-jiang3, ZHANG Kai1,2, JIA Xue-jing1, BAI Yun-feng1,2, HONG Wei4
(1.Institute of Animal Science, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2.Ministry of Agriculture and Rural Affairs, Key Laboratory of Crop and Livestock Integrated Farming, Nanjing 210014, China;3.Pizhou Xiaohe Science and Technology Development Co., Ltd., Pizhou 221300, China;4.Shanghai Menon Animal Nutrition Technology Co.,Ltd., Shanghai 200157, China)
Abstract: In this article, the effects of rumen-protected choline (RPC) and rumen-protected glucose (RPG) on alleviating negative energy balance in periparturient ewes were evaluted by examining blood ketone concentration, lambing performance and fecal microbial composition. The experiment lasted for 57 days, from 30 days before parturition to 20 days after parturition and included a seven-day pre-feeding period. Eighty pregnant (120-130 days) Hu sheep were randomly divided into four groups, the control group fed with basic feed, the RPC group added with 3 g/head RPC per day, the RPG group added with 15 g/head RPG per day, and the RPC+RPG group added with 3 g/head RPC per day plus 15 g/head RPG per day. The results showed that, on the day of lambing, blood ketone concentration of the ewes in the RPG group was significantly lower than that in the control group (P<0.05). The birth weight of lambs in the RPC+RPG group was significantly higher than other groups (P<0.05). The dominant bacterial species at phylum and genus levels in ewe feces did not change with the addition of RPC and RPG, but the relative abundance of core bacterial groups was affected. The relative abundances of Firmicutes and Ruminococcaceae UCG-010 in all experimental groups were significantly lower than that in the control group (P<0.05), and the relative abundance of Bacteroidetes in the RPC+RPG group was significantly higher than that in other groups (P<0.05). The relative abundance of Lachnospiraceae AC2044 group in RPG group was significantly higher than that in the control group (P<0.05). In conclusion, the birth weight of lambs and the relative abundance of carbohydrate-utilizing bacterial group Bacteroidetes of the ewe intestines can be increased by adding RPC or RPG into the feed of periparturient ewes, while the relative abundance of fiber-degrading bacterial group Firmicutes can be reduced. Besides, the relative abundance of beneficial anti-inflammatory bacteria genus of Lachnosiraceae in the ewe intestine can also be increased by adding RPG into the feed of periparturient ewes, while the blood ketone concentration can be reduced effectively. In conclusion, single addition of RPG shows the best effect, and the appropriate addition amount of RPC needs further study.
Key words: rumen-protected choline;rumen-protected glucose;negative energy balance;fecal microorganism;Hu sheep
近年来,中国规模化羊场围产期母羊妊娠毒血症、产前瘫频发,治疗效果差,死亡率高,已成为制约肉羊产业发展的一大难题[1]。围产期对母羊生产十分重要,干物质采食量下降,但胎儿对营养的需求量却持续增加,尤其是对葡萄糖的需求急剧增加,极易发生能量负平衡(Negative energy balance, NEB)从而引发营养代谢疾病 [2-3]。目前有关用营养调控方法改善围产期NEB的研究多集中在奶牛上[4]。研究发现在围产后期奶牛日粮中添加过瘤胃葡萄糖(Rumen-protected glucose, RPG)可以促进后肠道葡萄糖的吸收,减少体脂动员,有效缓解能量负平衡状态[5];也有研究结果表明过瘤胃胆碱(Rumen-protected choline, RPC)可以促进极低密度脂蛋白(Very low density lipoprotein, VLDL)合成,加速甘油三酯转运出肝脏[6],从而提高奶牛的干物质采食量、改善能量代谢 [7-8]。但它们在羊上的应用很少,张凯等[9]在育肥湖羊饲粮中添加RPC,发现添加0.4% RPC对提高湖羊生长性能和营养物质消化率有较好的效果;刘春海等[10]研究发现过瘤胃添加剂组合(葡萄糖+胆碱+赖氨酸+甲硫氨酸)对妊娠母羊乳成分和产羔性能也有积极作用。
血酮(血液中酮体)是衡量母羊围产期能量代谢的重要指标[11],繁殖性能和羔羊体尺指标则与母羊围产期的营养与健康水平息息相关。基因组学的研究发现,动物粪便微生物与机体的营养、健康也密切相关[12]。因此,本研究通过考察血酮浓度、母羊繁殖性能和羔羊体尺,尝试将母羊机体健康與肠道微生物结合起来,综合评估RPC和RPG对缓解围产期母羊能量负平衡状态的效果,以期为其在养羊生产中的应用提供科学的参考依据。
1 材料与方法
1.1 试验设计
选取80只妊娠期(120~130 d)围产母羊(湖羊),随机分为4组,每组20只。对照组(CK)饲喂基础饲粮,RPC组、RPG组和RPC+RPG组每只羊分别添加RPC 3 g/d、RPG 15 g/d、RPC 3 g/d和RPG 15 g/d。RPC中氯化胆碱含量≥25%,过瘤胃率≥80%,小肠释放率≥90%,RPG中葡萄糖含量≥50%,过瘤胃率≥80%,小肠释放率≥90%。试验预饲期7 d,正饲期50 d(母羊产前30 d到产后20 d),每天早晚各饲喂1次,添加剂早晨饲喂,取适量饲粮与其混匀,待母羊采食完,再投喂当日饲粮。
1.2 饲粮组成和营养水平
在我们前期的调研中发现,中国大多数的规模化羊场怀孕母羊并未做到按不同阶段分群饲养,出于成本考虑,怀孕母羊的日粮能量水平大多统一取妊娠前期和妊娠后期的均值,因此实际上围产期能量水平大都低于NRC(美国国家科学研究委员会)标准。结合生产实际,本试验参考NRC(2007)中50 kg绵羊母羊妊娠后期(2胎)营养需要标准,设计低能水平饲粮(表1)。
1.3 样品采集及测定的指标
1.3.1 血酮 在试验开始的第15 d和每只母羊产羔当天与产后第10 d、20 d分别静脉采血,使用怡成TNN-Ⅱ型奶牛酮体测试仪测定母羊血液中酮体β-羟基丁酸(BHBA)浓度。
1.3.2 产羔情况 母羊产羔时记录活羔数和弱羔数(弱羔定义为出生体质量小于2 kg且无法自然吮吸母乳的羔羊),计算羔羊出生存活率和弱羔率。记录羔羊初生质量,测定体尺指标(体高、体斜长、胸围、管围、胸深、胸宽),羔羊出生后45 d断奶,记录断奶存活羔羊数,计算羔羊断奶成活率,计算公式如下:
羔羊出生成活率=出生活羔数/总羔数×100%
弱羔率=弱羔数/总羔数×100%
羔羊断奶成活率=断奶存活羔数/出生活羔数×100%
1.3.3 粪便微生物 在试验最后3 d,每组随机选择10只母羊,采集新鲜无污染粪便,装至塑料管中,-80 ℃保存备用。对细菌16S rRNA基因的V3~V4区进行PCR扩增,引物序列为343F(5′- TACGGRAGGCAGCAG -3′)和798R(5′- AGGGTATCTAATCCT-3′)。扩增产物由上海欧易生物医学科技有限公司利用Illumina MiSeq平台进行测序,并利用QIIME软件(1.8.0版)进行生物信息学分析。
1.4 数据统计与分析
试验数据统计分析采用SPSS 21,计数数据采用卡方检验的Fisher精确概率法,计量数据采用单因素方差分析(多重比较Duncan’s方法),P<0.05表示差异显著。
2 结果与分析
2.1 母羊各时期的血酮浓度
由表2可见,RPC和RPG的添加在试验第15 d、产后10 d和产后20 d时,对母羊血液中的BHBA浓度影响差异均不显著(P>0.05),与对照组相比,RPG的添加显著降低了母羊在产羔当天血液中的BHBA浓度(P<0.05),但与其余2个试验组差异不显著(P>0.05)。
由图1可见,从试验第15 d到产羔当天,BHBA浓度上升,RPG组增幅最小;从产羔当天到产后10 d,BHBA浓度迅速下降,RPC组降幅最大;从产后10 d到产后20 d,RPG组和PRC组出现小幅上升,但均处于健康水平(低于2.0 mmol/L)。
2.2 产羔情况
母羊产羔情况如表3所示,各试验组对羔羊出生成活率、弱羔率和羔羊断奶成活率的影响均不显著(P>0.05)。
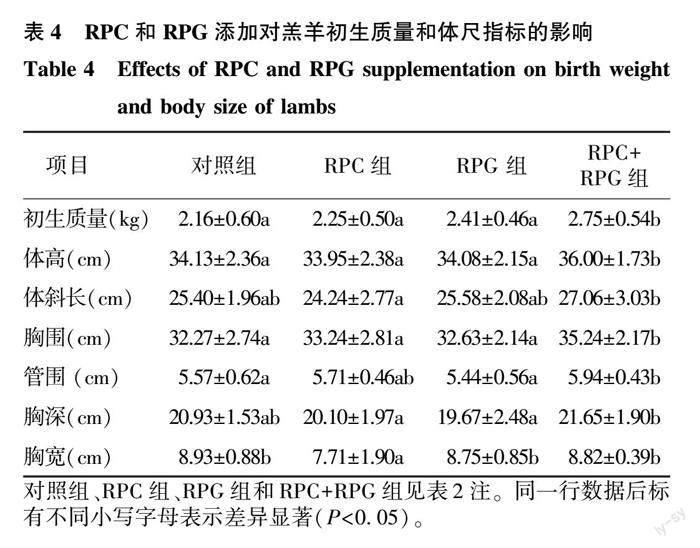
2.3 羔羊初生质量和体尺指标
由表4可见,RPC和RPG单独添加对羔羊初生质量的影响并不显著(P>0.05),组合添加RPC和RPG使羔羊初生质量显著高于其他组(P<0.05);从体尺指标来看,RPC+RPG组的体高、胸围、管围也均显著高于对照组(P<0.05),RPC组胸宽显著低于对照组(P<0.05),RPG组各指标与对照组无显著差异(P>0.05)。
2.4 母羊粪便微生物区系组成
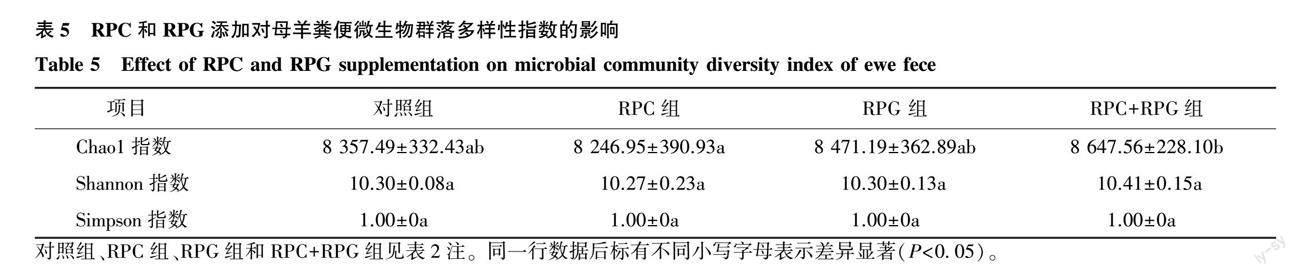
2.4.1 微生物群落多样性分析 Chao1指数反映菌群丰富度,Shannon指数和Simpson指数则反映菌群多样性。如表5所示,RPC+RPG组Chao1指数显著高于RPC组(P<0.05),但与其他组间的差异并不显著(P>0.05);各组间的微生物多样性Shannon指数和Simpson指数差异均不显著(P>0.05)。
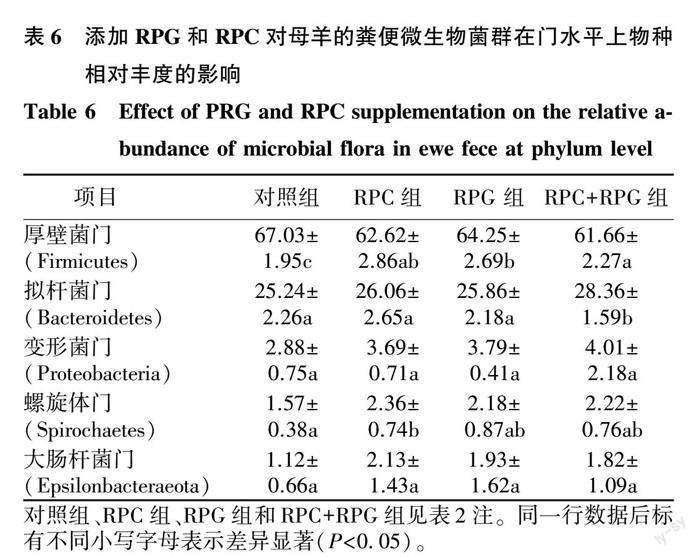
2.4.2 母羊粪便微生物菌群在门水平上的物种相对丰度 母羊粪便微生物菌群在门水平上的物种相对丰度(Top15)如图2所示,在门水平上,母羊的粪便微生物菌群组成结构并没有发生改变,仍然是厚壁菌门最多,其次为拟杆菌门。
进一步对门水平上相对丰度大于1.00%的菌群进行统计分析,由表6可见,与对照组相比,3个试验组的厚壁菌门相对丰度均显著低于对照组(P<0.05);RPC+RPG组的拟杆菌门相对丰度显著高于其他组(P<0.05),其余各组间差异不显著(P>0.05);RPC组的螺旋体门相对丰度显著高于对照组(P<0.05);各组间的变形菌门和大肠杆菌门的相对丰度均无显著差异(P>0.05)。
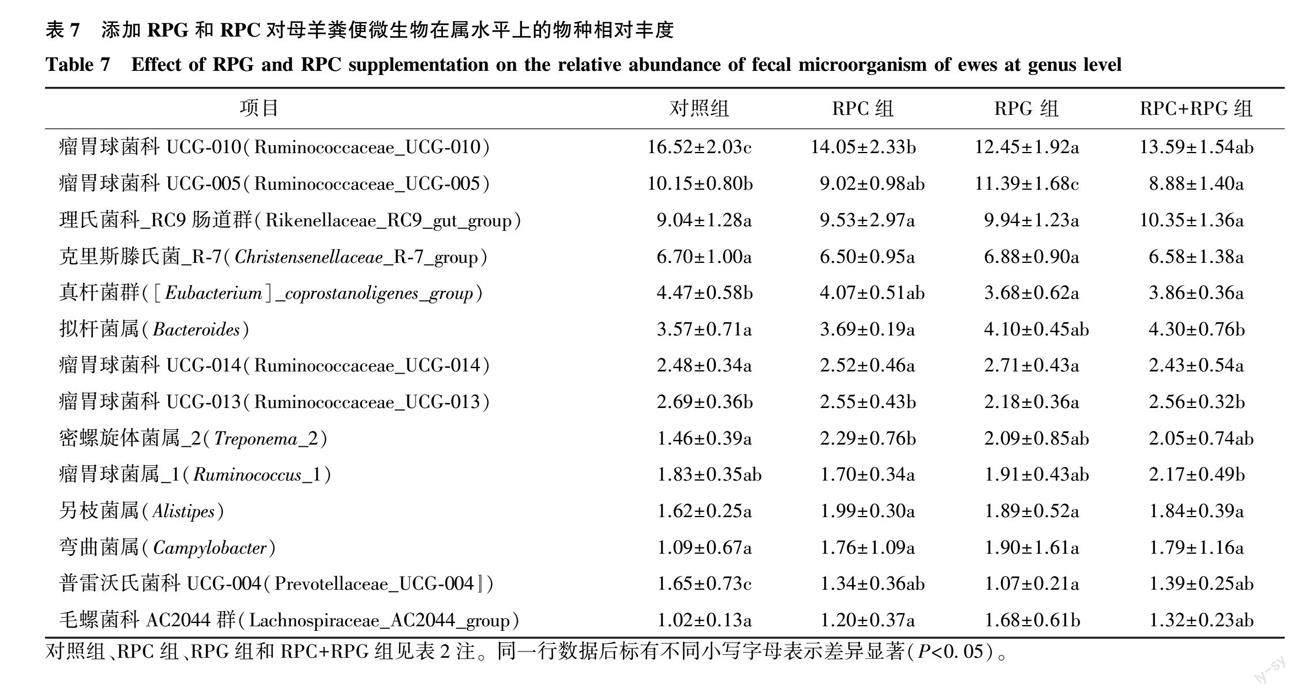
2.4.3 母羊粪便微生物菌群在属水平上的物种相对丰度 由图3可见,在属水平上,4组样本所含优势菌属也是相同的,其中瘤胃球菌科UCG-010最高,其次为瘤胃球菌科UCG-005和理研菌科_RC9肠道群,接下来是克里斯滕氏菌R-7和真桿菌群,它们合计占粪便细菌菌群组成约43%以上。
进一步分析属水平上的菌群相对丰度,除去未知菌属,相对丰度大于1.00%的已知物种共有14个(表7)。3个试验组的瘤胃球菌科UCG-010相对丰度均显著低于对照组(P<0.05);瘤胃球菌科UCG-005,RPG组的相对丰度显著高于对照组(P<0.05),RPC+RPG组的相对丰度显著低于对照组(P<0.05);真杆菌群,RPG组和RPC+RPG组的相对丰度均显著低于对照组(P<0.05);拟杆菌属,RPC+RPG组的相对丰度显著高于对照组(P<0.05);瘤胃球菌科UCG-013,RPG组的相对丰度显著低于其他组(P<0.05);密螺旋体菌属_2,RPC组的相对丰度显著高于对照组(P<0.05),与其他组间差异不显著(P>0.05);瘤胃球菌属_1,RPC+RPG组的相对丰度显著高于RPC组(P<0.05);普雷沃氏菌科UCG-004,试验组的相对丰度均显著低于对照组(P<0.05);毛螺菌科AC2044群,RPG组的相对丰度显著高于对照组和RPC组(P<0.05),与RPC+RPG组差异不显著(P>0.05)。
3 讨论
3.1 RPC和RPG添加对围产期母羊血酮浓度的影响
围产期母羊血液中酮体的浓度是反映其能量代谢平衡状态的重要指标之一,酮体浓度越高说明能量负平衡越严重。β-羟基丁酸浓度在酮体中所占比例最大,约占酮体总量的70%,其浓度高低在很大程度上可以反映机体酮体水平的高低。本研究中,从血酮浓度来看,从试验第15 d到产羔当天,除RPG组外,其余3组母羊均呈大幅增长趋势,说明围产期母羊采食量下降,能量摄入不足,能量负平衡,机体开始调动体内脂肪储备,脂肪被氧化后向三羧酸循环提供部分氧化的脂肪酸,但肝脏对脂肪酸的代谢能力有限,导致大量酮体产生[13]。RPG组BHBA浓度增幅最小,在产羔当天其BHBA浓度为1.53 mmol/L,对照组则高达2.95 mmol/L(奶牛的BHBA浓度一般以1.2 mmol/L作为临界值,超过3.0 mmol/L时则判定为临床型酮病[14]),说明通过增加外源葡萄糖供应,可以有效补充能量,减少产前体脂动用,降低血酮,从而缓解NEB,Ypw等[15]通过代谢组学分析得出RPG是通过减少脂肪动用来改善能量平衡的结论,也佐证了这一点。本研究中,RPC组和RPC+RPG组对产前血酮浓度的改善作用并不显著,但RPC有助于降低产后的血酮浓度,产后10 d时RPC组的BHBA浓度降幅为4组中最大的。孙菲菲等[6]汇总了近年来胆碱调控母牛围产期能量代谢的研究发现有关RPC对围产期奶牛血液中BHBA浓度影响的研究结论并不一致:Chung等[16]的研究结果表明25 g/d的RPC添加对BHBA浓度无影响;郑家三等[17]和Elek等[18]则发现10 g/d和50 g/d的RPC添加降低了血液BHBA浓度,这可能与不同研究的奶牛体况、饲粮组成、胆碱添加量及其有效性等因素有关。本研究中RPC添加效果不显著,推测一方面可能是RPC起作用的时间相对较晚,也可能是添加量较低或生物学效价不同,后续应加大添加量,探索最适宜添加量。
3.2 RPC和RPG添加对母羊产羔情况和羔羊体尺指标的影响
母羊围产期体况对羔羊生长发育至关重要[19],胎儿质量的80%~90%是在妊娠后期增长的[20],母乳则是羔羊生长所需营养的主要来源,母羊营养好,则奶水多,羔羊发育好,抗病力强,成活率高。从本研究结果来看,3个试验组的羔羊出生存活率、羔羊断奶成活率和弱羔率与对照组差异不显著,这可能与本试验的样本量偏小有关。从羔羊初生质量来看,与对照相比,试验组均提高了羔羊的初生质量,但仅RPC+RPG组达到显著水平,结合体尺指标来看,初生质量的增大主要体现在体斜长、胸围和管围的增加。孙亚波等[21]也发现添加过瘤胃剂组合(葡萄糖+胆碱+赖氨酸+甲硫氨酸)的母羊产羔成活率、初生质量均高于对照组。本研究结果说明,RPC和RPG的添加有助于提高羔羊初生质量和断奶成活率,从一定程度上缓解了母羊围产期的能量负平衡状态。
3.3 RPC和RPG添加对母羊粪便微生物组成的影响
RPC和RPG作为可以逃脱瘤胃发酵在后肠中发挥作用的饲料添加剂,目前少有其对后肠微生物菌群影响的研究。肠道菌群与宿主的采食、营养物质的消化吸收和能量代谢密切相关[22-23],粪便微生物作为评估反刍动物后肠道的有效指标[24],近年来受到大众关注,本研究采用16S rRNA基因测序方法,分析RPC和RPG添加对母羊肠道菌群结构的影响。
从微生物群落多样性分析结果来看,各组间Shannon指数和Simpson指数差异不显著,但RPC+RPG组的Chao1指数显著高于RPC组,说明在添加RPC基础上再添加RPG有助于提高母羊肠道微生物菌群的丰度,而RPC和RPG的单独添加对母羊肠道微生物菌群的多样性并无显著影响。
从菌群的组成结构来看,RPC和RPG并没有改变母羊粪便微生物的优势菌种类,门水平上仍然是厚壁菌门最多,其次为拟杆菌门,属水平上则是瘤胃球菌科UCG-010最多,这与前人的研究结果[25-26]一致。RPC和RPG影响了门水平上优势菌门的相对丰度,与对照组相比,厚壁菌门相对丰度显著降低,拟杆菌门RPC+RPG组相对丰度显著高于对照组,这与王亚品[27]的研究结果并不一致,其研究发现在泌乳早期奶牛饲粮中每天补充350 g的RPG,厚壁菌门增多而拟杆菌门减少,出现这种差异一方面可能是研究对象不同,另一方面则可能与饲粮组成、饲养环境和添加量有关[28-29]。厚壁菌门和拟杆菌门均有助于宿主代谢,调节脂肪代谢,提升能量效率,其中拟杆菌门主要是促进动物利用碳水化合物的优势菌群,而厚壁菌门是促进动物胃肠道微生物分解纤维素的优势菌群[30]。与对照组相比,本研究中厚壁菌门的增加与拟杆菌门的减少,推测可能是因为RPG在小肠内直接被吸收转换为能量,发酵供能减少导致,RPG添加引起重要的纤维降解菌瘤胃球菌科UCG-010的丰度显著降低[31],也佐证了这一点。RPG添加还显著提高了毛螺菌科AC2044群的相对丰度,毛螺菌科属于有益菌,与肠道抗炎相关[32],说明RPG的添加还有助于抑制炎性细菌的繁殖,减少机体炎症的发生,与张小丽等[31]的研究结果一致。RPC的添加则可能通过拟杆菌门的增加促进胆汁酸被水解为次级胆汁酸进而改善能量代谢[33]。刘婷等[34]研究了羊肠道菌群与血浆代谢产物的关系,发现血浆中与脂肪酸代谢疾病相关的3-羟基月桂酸含量与拟杆菌门丰度呈负相关,而皮质醇浓度则与拟杆菌门丰度呈正相关,与厚壁菌门丰度呈负相关,说明RPC和RPG的添加可能通过改变厚壁菌门和拟杆菌门的比例对围产母羊糖脂代谢进行调控,但具体的分子机制还有待进一步研究。
4 结论
母羊从产前30 d开始到产后20 d,饲粮中添加3 g/d的RPC或15 g/d的RPG均有助于提高羔羊初生质量,提高了母羊腸道中碳水化合物利用菌拟杆菌门的相对丰度,降低纤维分解菌群厚壁菌门的相对丰度,RPG的添加还使得肠道抗炎有益菌毛螺菌科属水平的相对丰度得到提高,同时有效降低血酮浓度。综合考虑,RPG单独添加效果最佳,RPC的适宜添加量有待进一步研究。
参考文献:
[1] 徐 楠.皖北地区羊妊娠毒血症病因调查及生化指标分析[D].合肥:安徽农业大学,2019:26-28.
[2] 贾学敬,汤海江,张 凯,等.围产期母羊妊娠毒血症营养调控研究进展[J].饲料研究,2020,43(11):121-124.
[3] 吴 怡,敖日格乐,王纯洁,等.反刍动物围产期能量负平衡的调控研究进展[J].饲料研究,2022,45(2):136-140.
[4] 张 帆,呙于明,熊本海.围产期奶牛能量负平衡营养调控研究进展[J].动物营养学报,2020,32(7):2966-2974.
[5] 李 妍,薛 倩,高艳霞,等.瘤胃保护葡萄糖对围产后期荷斯坦奶牛生产性能及血清生化指标的影响[J].畜牧兽医学报,2016,47(1):113-119.
[6] 孙菲菲,曹阳春,李生祥,等.胆碱对奶牛围产期代谢的调控[J].动物营养学报,2014,26(1):26-33.
[7] 李红宇,王德香,黄 萌,等.过瘤胃胆碱调控围产期奶牛营养平衡和机体健康研究进展[J].中国畜牧杂志,2022, 58(9):1-10.
[8] 谭子璇,吴 兵,严欣茹,等.过瘤胃胆碱在围产奶牛日粮中应用的研究进展[J].饲料博览,2020(9):34-37.
[9] 张 凯,张志鹏,白云峰,等.日粮中添加过瘤胃胆碱对湖羊生长性能和营养物质表观消化率的影响[J].江苏农业科学, 2021,49(5):137-142.
[10]刘春海,李 伟,孙亚波,等.过瘤胃组合物对辽宁绒山羊母羊生产性能的影响[J].现代畜牧科技,2022(3):1-3.
[11]翟卫爽,蒋业慧,李红燕,等.浅谈奶牛酮病与DHI数据的关系及其预防措施[J].中国奶牛,2018(7):66-69.
[12]LIU J H, ZHANG M L, ZHANG R Y, et al. Comparative studies of the composition of bacterial microbiota associated with the ruminal content, ruminal epithelium and in the faeces of lactating dairy cows [J]. Microbial Biotechnology, 2016, 9(2):257-268.
[13]王弘浩.胆碱对能量负平衡奶牛肝脏糖代谢的调控作用[D].杨凌:西北农林科技大学,2022:16.
[14]沈文祥.奶牛高酮血症检测方法评价及流行病学调查[D].南宁:广西大学, 2019:17.
[15] YPW A,MC A,DKH A,et al.Metabolomics reveals effects of rumen-protected glucose on metabolism of dairy cows in early lactation[J]. Animal Feed Science and Technology, 2020, 269:15.
[16]CHUNG Y H, CASSIDY T W, GIRARD I D, et al.Effects of rumen protected choline and dry propylene glycol on feed intake and blood metabolites of Holstein dairy cows[J].Journal of Dairy Science,2005,88:61-161.
[17]鄭家三,夏 成,张洪友,等.过瘤胃胆碱对围产期奶牛生产性能和能量代谢的影响[J].中国农业大学学报,2012,17(3):114-120.
[18]ELEK P, GAL T, HUSVTH F. Influence of rumen-protected choline on liver composition and blood variables indicating energy balance in periparturient dairy cows [J]. Acta Veterinaria Hungarica,2013,61(1):59-70.
[19]付 琳,张 丽,王 琳,等.围产期补饲过瘤胃蛋氨酸对幼龄反刍动物生长发育的影响及调控机制研究进展[J].动物营养学报,2023,35(1):31-42.
[20]刘占发,穆 巍,刘立刚,等.妊娠后期营养水平对中卫山羊母羊繁殖性能的影响[J].中国畜牧兽医,2010,37(1):198-200.
[21]孙亚波,刘春海,杨 坤,等.不同过瘤胃添加剂组合对辽宁绒山羊奶成分及产羔性能的影响[J].现代畜牧兽医,2016(12):25-29.
[22]AMABEBE E, ROBERT F O, AGBALALAH T, et al. Microbial dysbiosis-induced obesity: role of gut microbiota in homeostasis of energy metabolism [J].British Journal of Nutrition, 2020, 123(10):1-23.
[23]李 扬,吴 德,林 燕,等.肠道菌群在碳水化合物调控能量代谢中的作用及可能机理[J].今日养猪业,2019,113(5):96-99.
[24]FAULKNER M J, WENNER B A, SOLDEN L M, et al. Source of supplemental dietary copper, zinc, and manganese affects fecal microbial relative abundance in lactating dairy cows[J].Journal of Dairy Science,2017,100(2):1037-1044.
[25]王继文,王立志,闫天海,等.山羊瘤胃与粪便微生物多样性[J].动物营养学报,2015,27(8):2559-2571.
[26]王循刚,徐田伟,刘宏金,等.基于高通量测序技术的藏系绵羊瘤胃与粪便微生物群落结构差异分析[J].西北农业学报,2020,29(5):659-667.
[27]王亚品.过瘤胃葡萄糖对泌乳早期奶牛胃肠道功能及机体代谢的影响[D].北京:中国农业科学院,2021:54-66.
[28] THOETKIATTIKUL H, MHUANTONG W, LAOTHANACHAREON T, et al. Comparative analysis of microbial profiles in cow rumen fed with different dietary fiber by tagged 16S rRNA gene pyrosequencing[J]. Curr Microbiol,2013, 67(2):130-137.
[29]SOPHIE C M, NICOLAS P, PASCALE L, et al. Metatranscriptomics reveals the active bacterial and eukaryotic fibrolytic communities in the rumen of dairy cow fed a mixed diet[J]. Frontiers in Microbiology, 2017, 8:67.
[30]BRULC J M, ANTONOPOULOS D A, MILLER M, et al. Gene-centric metagenomics of the fiber-adherent bovine rumen microbiome reveals forage specific glycoside hydrolases[J].National Academy of Sciences, 2009(6):1948-1953.
[31]张小丽,吴 建,韩雪峰,等.过瘤胃葡萄糖对围产期奶牛空肠微生物群落和黏膜代谢及免疫相关基因表达的影响[J].动物营养学报,2019,31(7):3143-3155.
[32]SURANA N K, KASPER D L. Moving beyond microbiome-wide associations to causal microbe identification [J].Nature, 2017, 552(7684):244-247.
[33]PROUTY A M, BRODSKY I E, FALKOW S, et al. Bilesaltmediated induction of antimicrobial and bile resistance in Salmonella typhimurium[J].Microbiology,2004,150:775-783.
[34] 刘 婷,靳 烨,要 铎,等.植物乳杆菌对苏尼特羊肠道菌群,血浆代谢物及肉品质的影响[J].农业工程学报,2022,38(3):286-294.
(责任编辑:陈海霞)
