不同病情严重程度脓毒症患者凝血功能的变化及对预后的影响*
2023-12-13侯宇敖雪苏醒
侯宇,敖雪,苏醒
[中南大学湘雅医学院附属海口医院(海口市人民医院) 重症医学科,海南 海口 570208]
脓毒症是指机体被病原体侵入引发的全身炎症反应,疾病涉及多个器官、系统,与免疫紊乱、内毒素移位、炎症因子表达失控等多种因素有关[1]。脓毒症早期阶段,机体病理生理改变往往是功能性且可逆的,因此临床早期识别脓毒症,及时予以液体复苏、抗感染等治疗,对患者预后改善具有重要意义[2]。脓毒症患者往往伴随凝血功能障碍,相关研究表明,凝血功能异常的脓毒症患者,病死率相对更高[3]。发生脓毒症时,凝血系统被过量的炎症因子激活,造成抗凝血因子过量消耗,血液处于高凝状态,发生微循环障碍;与此同时,血栓形成产物又反过来促进炎症发展,两者相互影响,损害机体多器官功能[4-6]。本研究分析不同疾病严重程度脓毒症患者凝血功能指标的变化,探讨脓毒症合并凝血功能障碍患者预后影响因素,旨在为改善脓毒症患者预后提供新思路,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年7 月—2022 年11 月中南大学湘雅医学院附属海口医院收治的132 例脓毒症患者作为观察组。其中,男性69 例,女性63 例;年龄42~77 岁,平均(63.88±6.28)岁;呼吸系统感染39 例,中枢神经系统感染17 例,消化系统感染33 例,泌尿系统感染29 例,血液系统感染14 例;根据疾病严重程度可分为脓毒症组(71 例)、脓毒性休克组(61 例)。纳入标准:①符合2021 年欧洲危重病医学会和美国重症医学会制订的脓毒症与脓毒性休克管理指南诊断标准[7];②年龄≥ 18 岁。排除标准:①急性心肌梗死;②合并肝硬化、慢性肝肾疾病;③既往病史有慢性器官功能不全;④伴血栓性疾病或恶性肿瘤;⑤血液及免疫系统缺陷;⑥大量输注血液及血制品;⑦入组前接受抗凝、服用抗血小板药物或肾脏替代治疗等影响凝血功能;⑧妊娠或哺乳期女性。另取本院健康体检者90 例作为对照组。其中,男性46 例,女性44 例;年龄40~78 岁,平均(64.02±5.96)岁。观察组与对照组性别、年龄、体质量指数(body mass index, BMI)比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,患者及家属均签署知情同意书。
1.2 方法
1.2.1 问卷调查方法与内容 收集观察组患者基础资料,调查员经培训合格后上岗,调查员现场审核,若有漏填、错填及时予以补充。具体包括:①基本资料:性别、年龄、BMI 等。②生化指标:血小板计数、白蛋白、乳酸水平。③急性生理学和慢性健康状况评估Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)量表[8]评分。④脓毒症相关性器官功能衰竭评价(sequential organ failure assessment score, SOFA)[9]:该量表包括血液、呼吸、心血管、肝脏、肾脏、神经等系统共6 个方面,分数越高代表器官衰竭越明显。
1.2.2 凝血功能检测 采集观察组患者入住ICU时、对照组体检时外周静脉血3 mL,采用全自动血凝仪(南京瑞麦科技,AYW9000)测定凝血酶时间(thrombin time, TT)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、纤维蛋白原(Fibrinogen,FIB)水平。
1.2.3 凝血功能障碍评估 参照IBA 等[10]构建的脓毒症相关凝血病(sepsis-associated coagulopathy, SAC)分类标准中血小板计数(platelet count, PLT)及凝血酶原时间-国际标准化比值(prothrombin timeinternational normalization ratio, PT-INR)分级标准,PLT > 150×109/L 计0 分,> 100×109/L~150×109/L计1 分,> 80×109/L~100×109/L 计2 分,≤ 80×109/L计3分;PT-INR < 1.2计0分,1.2~< 1.4 计1分,1.4~<1.6 计分,≥ 1.6 计3 分。0 分为无SAC,1~3 分为轻度SAC,4~5 分为中度SAC,6 分为重度SAC。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;Kaplain-Maier 法绘制生存曲线,比较用Log rank χ2检验。影响因素的分析用多因素逐步Logistic 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 观察组与对照组凝血功能指标比较
观察组与对照组APTT、PT、TT 及FIB 水平比较,经t检验,差异均有统计学意义(P<0.05),观察组APTT、PT、TT 均长于对照组,FIB 水平低于对照组。见表1。
表1 观察组与对照组凝血功能指标比较 (±s)
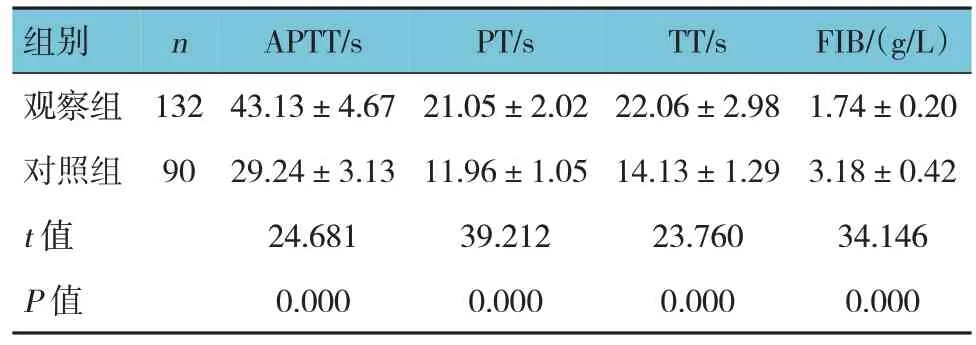
表1 观察组与对照组凝血功能指标比较 (±s)
组别观察组对照组t 值P 值n 132 90 APTT/s 43.13±4.67 29.24±3.13 24.681 0.000 PT/s 21.05±2.02 11.96±1.05 39.212 0.000 TT/s 22.06±2.98 14.13±1.29 23.760 0.000 FIB/(g/L)1.74±0.20 3.18±0.42 34.146 0.000
2.2 不同病情严重程度脓毒症患者凝血功能比较
脓毒症组与脓毒性休克组APTT、PT、TT 及FIB水平比较,经t检验,差异均有统计学意义(P<0.05),脓毒性休克组APTT、PT、TT 均长于脓毒症组,FIB 水平低于脓毒症组。见表2。
表2 不同病情严重程度脓毒症患者凝血功能比较 (±s)
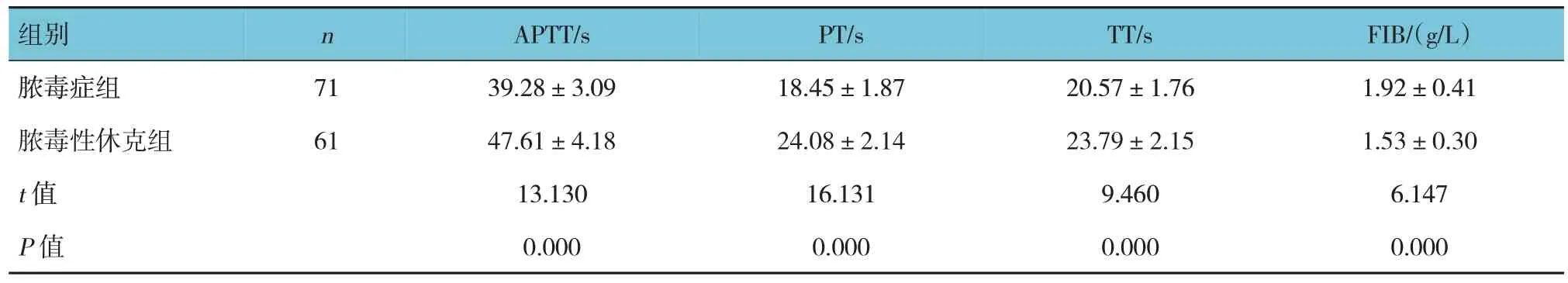
表2 不同病情严重程度脓毒症患者凝血功能比较 (±s)
组别脓毒症组脓毒性休克组t 值P 值n 71 61 APTT/s 39.28±3.09 47.61±4.18 13.130 0.000 PT/s 18.45±1.87 24.08±2.14 16.131 0.000 TT/s 20.57±1.76 23.79±2.15 9.460 0.000 FIB/(g/L)1.92±0.41 1.53±0.30 6.147 0.000
2.3 不同病情严重程度脓毒症患者凝血功能障碍发生情况比较
脓毒性休克组与脓毒症组凝血功能障碍发生率比较,经χ2检验,差异有统计学意义(χ2=9.363,P=0.002),脓毒性休克组凝血功能障碍发生率高于脓毒症组。见表3。

表3 不同病情程度脓毒症患者凝血功能障碍发生情况比较
2.4 脓毒症合并与未合并凝血功能障碍患者预后生存情况比较
依据患者入院后28 d 转归情况,绘制生存曲线(见图1)。脓毒症合并与未合并凝血功能障碍患者生存率比较,经Log-rank χ2检验,差异有统计学意义(χ2=6.738,P=0.009),脓毒症未合并凝血功能障碍患者预后优于合并凝血功能障碍患者。

图1 脓毒症合并与未合并凝血功能障碍患者的生存曲线
2.5 不同预后脓毒症合并凝血功能障碍患者的一般资料比较
存活组与死亡组性别构成、感染部位、年龄、BMI、中性粒细胞百分比比较,经χ2或t检验,差异均无统计学意义(P>0.05)。存活组与死亡组血小板计数、乳酸、白蛋白及APACHE Ⅱ、SAC、SOFA 评分比较,差异均有统计学意义(P<0.05),死亡组血小板计数、白蛋白低于存活组,乳酸、APACHE Ⅱ、SAC及SOFA 评分高于存活组。见表4。

表4 不同预后脓毒症合并凝血功能障碍患者的一般资料比较
2.6 影响脓毒症合并凝血功能障碍患者预后的多因素逐步Logistic回归分析
以生存情况为因变量,上述差异有统计学意义的指标(血小板计数、白蛋白、乳酸水平以及APACHE Ⅱ评分、SAC评分、SOFA评分)为自变量,行多因素逐步Logistic回归分析(引入水准为0.05,剔除水准为0.10),结果显示:血小板计数[=0.988(95% CI:0.980,0.996)]、白蛋白[=0.962(95% CI:0.939,0.985)]是脓毒症合并凝血功能障碍患者生存的保护因素(P<0.05);乳酸[=1.219(95% CI:1.079,1.376)]、APACHEⅡ评分[=1.347(95% CI:1.105,1.642)]、SAC 评分[=1.319(95% CI:1.108,1.571)]、SOFA 评分[=3.028(95% CI:1.689,5.431)]是脓毒症合并凝血功能障碍患者死亡的危险因素(P<0.05)。见表5。

表5 影响脓毒症合并凝血功能障碍患者预后的多因素逐步Logistic回归分析参数
3 讨论
脓毒症是一种复杂的多系统疾病,发病率、病死率均处于较高水平,是目前重症医学研究的重点和热点之一[11-12]。据统计,美国每年脓毒症患者>75 万,病死率高达50%左右,每小时约25 例患者因严重感染或脓毒性休克而死亡[13]。
临床研究显示,凝血-抗凝系统改变可反映脓毒症病情变化[14]。脓毒症患者感染状态下大量炎性介质释放,影响机体免疫调节,纤溶系统激活,毛细血管扩张,严重情况下甚至引发血管渗漏,激活机体凝血系统[15]。APTT 主要对内源性凝血水平做出反应,其延长表明凝血障碍趋向,缩短则代表机体处于高凝状态;PT 主要代表外源性凝血系统障碍情况,缺乏外源性凝血因子及抗凝物质水平升高时,机体可能出现不同程度凝血障碍;TT 主要反映纤维蛋白原向纤维蛋白转化的时间[16]。本研究中对照组APTT、PT、TT 短于观察组,而观察组FIB 含量较高,处于凝血功能紊乱状态,脓毒症患者受体内内毒素、单核细胞等多种因子影响,大量凝血因子被消耗,凝血因子合成抑制,致使FIB 含量减少,APTT、PT、TT 延长[17]。
进一步比较不同病情严重程度脓毒症患者凝血功能,结果显示脓毒症组APTT、PT、TT 短于休克组,FIB 水平高于休克组,早期脓毒症阶段机体即可表现出凝血功能紊乱,脓毒症患者病原体入侵机体,分泌内外毒素,激发炎症反应,随着疾病程度增加,炎性介质过度释放进一步加重,减少生理性抗凝血物质,溶解纤维蛋白系统损伤,凝血过程加剧[18-19]。STIEL 等[20]研究显示,25%~50%脓毒症患者伴有明显弥散性血管内凝血,且重度脓毒症患者发生弥散性血管内凝血概率为68.96%,高于早期脓毒症患者,同时死亡组并发弥散性血管内凝血的概率为63.88%,明显高于存活组,表明弥散性血管内凝血会加重脓毒症患者病情,是引起疾病高病死率的重要因素之一。本研究中脓毒性休克组患者凝血功能障碍发生率为68.85% 高于脓毒症组的42.25%,且脓毒性休克患者合并凝血功能障碍往往更为严重,与上述研究结果一致。
易茜等[21]研究显示,脓毒症合并凝血功能障碍患者表现为全身凝血和纤溶系统严重紊乱,最终引起患者出现广泛出血与多脏器功能不全,导致患者死亡。Kaplan-Meier 生存曲线显示,脓毒症患者中合并凝血功能障碍者病死率高于无凝血功能障碍者。多因素逐步Logistic 回归分析结果显示,凝血功能障碍是影响患者预后的独立危险因素,因此判断脓毒症患者凝血功能障碍情况可以在一定程度上预测患者死亡风险。脓毒症凝血功能发生紊乱,微血栓形成及出血倾向引发微循环障碍,组织缺氧,器官功能障碍加重,增加患者死亡风险[22]。本研究中存活组血小板计数较死亡组高,提示脓毒症合并凝血功能障碍患者血小板计数水平适当升高可在一定程度上改善预后,脓毒症患者发生感染后,机体往往出现骨髓抑制,血小板计数水平短时间内迅速降低,预示不良预后。血液中白蛋白是多种内、外源性物质的载体,该蛋白水平降低将导致血浆胶体渗透下降,影响药物作用效果。ULLDEMOLINS 等[23]研究显示,持续低白蛋白血症与不良预后风险增加有关。本研究结论与上述一致,因此纠正低白蛋白血症有助于提高患者存活率。乳酸是衡量组织低灌注的重要指标之一,脓毒症合并凝血功能障碍患者机体有效循环血容量不足,组织处于缺氧状态,乳酸分泌增加。本研究中多因素逐步Logistic 回归分析结果显示,乳酸高表达是脓毒症合并凝血功能障碍患者不良预后独立危险因素。相关研究表明,>3 个器官功能衰竭患者基本均会死亡。本研究也显示,随着SOFA 评分增加,患者死亡风险也相应升高,因此临床工作中,除积极控制感染外,需特别加强脏器功能保护[24]。本研究中,生存组APACHE Ⅱ评分较死亡组低。APACHE Ⅱ评分为危重病情评估系统之一,评分越高则代表患者病情越重,反映机体循环、呼吸、神经系统、凝血受损情况,脓毒症合并凝血功能障碍患者APACHE Ⅱ评分升高反映患者不良预后。本研究的不足之处在于仅分析患者入住ICU 时凝血功能水平与预后的关系,未对患者治疗后凝血指标变化进行探讨,分析患者治疗前后凝血功能变化对预后产生的影响,后续将进一步深入研究患者治疗前后凝血功能改变与预后的关系。
综上所述,脓毒症患者机体凝血系统紊乱,随着病情加重,患者出现凝血功能障碍风险也随之增加,且机体凝血功能障碍严重情况在一定程度上影响患者预后。
