胆囊癌的诊断与治疗进展
2023-12-08崔昭扬赵向宁李海珠张绍庚
乐 羿, 杨 豪, 刘 虎, 崔昭扬, 赵向宁, 安 亮, 李海珠, 张绍庚
上海孟超肿瘤医院肿瘤外科, 上海 201805
胆囊癌(gallbladder cancer,GBC)是胆道系统最常见的恶性肿瘤,占胆道恶性肿瘤的80%~95%,在消化道肿瘤中死亡率排名第6 位[1]。GBC 症状与体征无特异性,与胆囊结石和胆囊炎的症状难以区分,极易误诊误治,晚期确诊患者超过50%。GBC 具有很强侵袭性,是预后最差的恶性肿瘤之一,5 年生存率低于10%。因此,早诊断、早治疗对于GBC 的预后至关重要。
1 胆囊解剖与组织学
胆囊是梨形中空脏器,位于肝右叶下方胆囊窝,结构分为胆囊底、胆囊体、胆囊颈、胆囊管。胆囊约30%附着在肝脏上,其余部分被腹膜覆盖。胆囊管会入肝总管形成胆总管,与胰管汇合开口于十二指肠乳头。胆囊管、肝总管、肝脏脏面构成胆囊三角,胆囊动脉穿行其中,是胆囊切除术中最重要的解剖层次。胆囊储存、浓缩、释放胆汁,乳化脂肪,在消化过程中起着很重要的作用。胆囊壁由黏膜、肌层、外膜三层组成(图1)[2]。大多数GBC 发生在胆囊的底部,只有少数发生在颈部。95% GBC 起源于上皮细胞,其中腺癌约占90%,是最常见的组织学类型[3]。
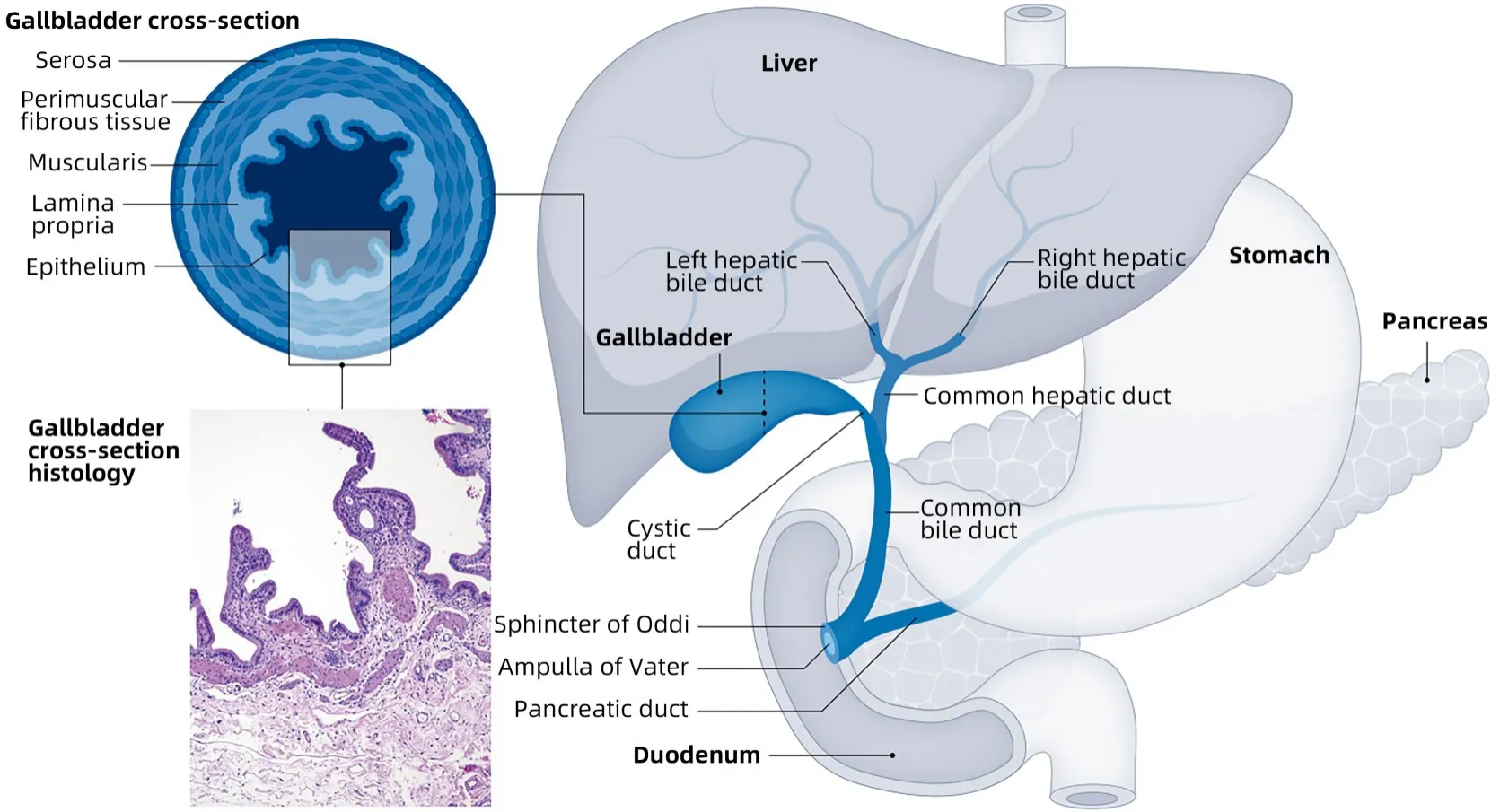
图1 胆囊解剖结构Figure 1 Anatomy of the gallbladder
2 GBC的危险因素
GBC 发生频率在地理上有很大的变异性,可能与遗传因素及炎性改变的相互作用有关。胆囊结石和慢性胆囊炎是GBC 形成的主要危险因素。85%的GBC 患者有胆囊结石,且结石越大其癌变风险越高。胆囊结石刺激局部黏膜,引起慢性胆囊炎,局部组织反复修复、增殖,DNA在复制过程中发生突变,是GBC的首要危险因素[4]。已有研究[5]表明,胆囊结石患者的GBC发病率远高于无结石者,且胆囊结石复发率极高,因此在临床中,已不再建议“保胆取石”术式,建议胆囊结石患者早期即行胆囊切除术。
胆囊息肉也是GBC常见的危险因素,发病率可达5%,约60%的胆囊息肉为胆固醇息肉,25%为子宫腺肌症伴黏膜增生。另外10%为炎性息肉,4%为良性腺瘤但有癌变潜能。对于直径<1 cm 且伴有其他危险因素的胆囊息肉,或无危险因素但直径>1 cm 的息肉,建议行胆囊切除术。
全球范围内,GBC对女性的影响是男性的2~3倍,可能是受各种女性激素、胆固醇循环和沙门菌感染的影响,雌激素导致胆汁中胆固醇过饱和,从而参与了胆囊结石介导的GBC发病机制,但雌激素在胆囊癌发病中的作用程度尚不明确。其他危险因素包括肥胖、代谢综合征、肝血吸虫病、胆囊变异、胰胆管汇流异常、先天肝外胆管囊肿、原发性硬化性胆管炎、瓷化胆囊、幽门螺杆菌感染等;而其他因素,如吸烟、食用芥末油、红辣椒、鱼腥草酮油和黄油黄、早年怀孕、使用避孕药、重金属中毒等增加了GBC患病风险(表1)。在临床诊治过程中,涉及相关危险因素时,建议进一步检查鉴别,以排除GBC,防止漏诊漏治。
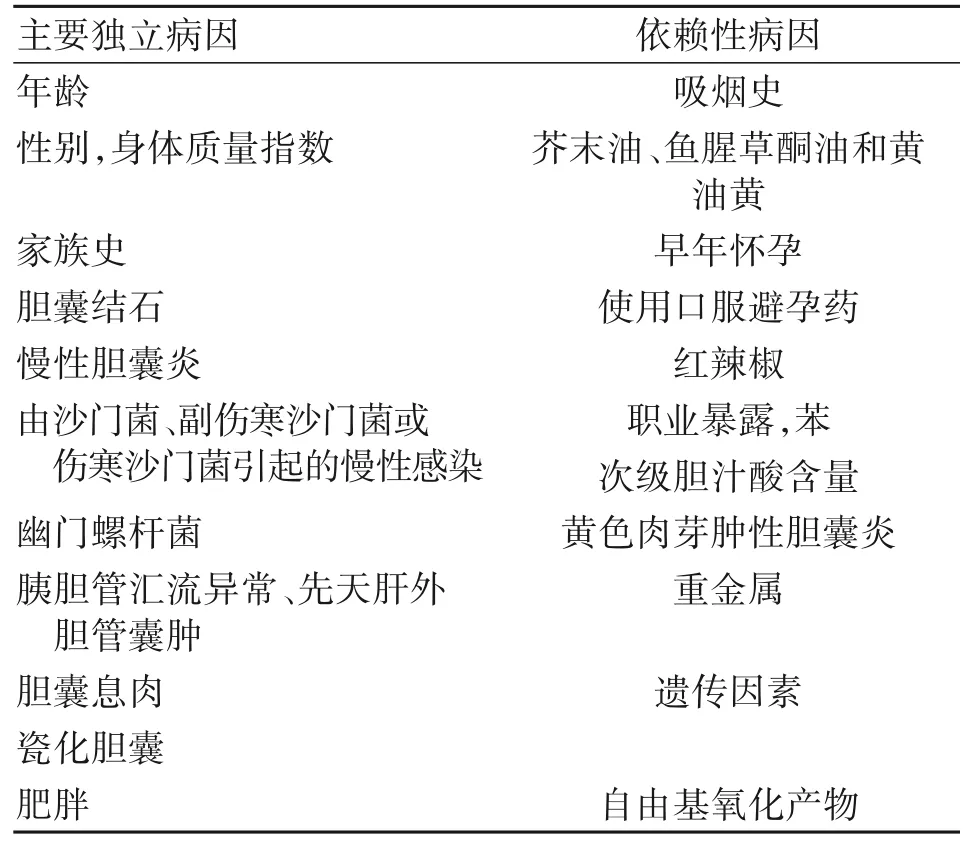
表1 GBC危险因素Table 1 Risk factors of GBC
3 GBC的发病机制
胆囊结石或其他危险因素引起的慢性胆囊炎,是GBC发生发展的主要过程,局部炎症是GBC进展的必备微环境,炎症引起的局部细胞修复是胆囊壁发生基因改变的主要原因,按照炎症-组织化生-基因改变-癌变的顺序逐步进展[7]。局部基因型改变逐渐积累,最终导致恶性肿瘤。常见的致癌基因突变包括抑癌基因的失活、致癌基因的激活、基因启动子区域的甲基化和微卫星不稳定[8]。
有研究发现,慢性炎症使局部活性氧和活性氮水平升高,产生氧化应激诱导DNA 损伤,进而激活P53介导的肿瘤抑制通路,P53通路通过控制细胞反应(如受损细胞中的凋亡、衰老和细胞周期阻滞)抑制肿瘤发生。长期慢性炎症引起的相关DNA损伤,导致基因组不稳定和早期P53功能障碍,进一步增强慢性炎症,并诱导炎症介质和致癌信号通路的过度激活,最终导致炎症组织转化为肿瘤组织[9]。在GBC 发生过程中,P53改变是最早的DNA改变,从慢性胆囊炎开始,到局部组织化生,最终进展为GBC的过程中,P53含量不断升高。不同组织类型的GBC,其基因变化存在差异,例如,乳头状癌的K-ras 值为100%阳性。33%的鳞状细胞癌和66%的腺癌病例中可检测到K-ras阳性,未分化腺癌中检测不到K-ras 突变。致癌的基因改变包括P53(50%)、EGFR(20.6%)、RB1(17.6%)和ERBB2(17.6%)突变[10-11]。而STK11、CTNNB1 和APC 的体细胞突变频率较高(分别为43%、29%和14%)[12-13]。随着病情进展,突变基因逐渐积累,最终由原位癌进展为侵袭性强的GBC。
4 GBC的诊断
4.1 临床表现 GBC 早期,患者大多没有明显症状,其症状与胆囊结石、胆囊炎症状相似,包括右上腹疼痛、黄疸、发热、腹部包块、体质量减轻,伴随有呕吐、消化不良、厌食、腹胀等症状。GBC 缺乏特异性临床表现,早期极难诊断且进展迅速,多数GBC 发现时已是晚期,预后极差。
4.2 实验室检查 GBC早期可出现肝功能异常、胆红素升高。肿瘤标志物检查也不具有特异性,其中CEA、CA19-9、CA125、CA153在诊断GBC中有一定的指导意义。直至目前,尚未发现GBC特异性的诊断指标[14-15]。研究人员[16]发现,GBC患者血液中常可发现甲基化的基因,如APC、CDH1、CDH13、PTEN、3-OST-2、SHP1、WIF-1 等,从患者血液中采集基因组DNA 来检测启动子甲基化水平,可能有助于早期诊断GBC。但尚无有利证据表明其诊断价值,未得到临床广泛认可。近年来,一些研究表明,某些microRNA的表达水平与胆囊癌的发生和预后密切相关。Xue等[17]研究表明,通过对microRNA的检测,可以为胆囊癌的早期诊断和治疗提供新的靶点。分子探针技术的发展也为GBC 的诊断提供了新思路。2023 年2 月,重庆医科大学彭奇龄团队与蒋宁团队、王建伟团队合作构建了3 层CdSe/ZnS量子点(QDs)包覆在SiO2纳米颗粒(NPs)上,形成Tri-QDs/PEI@SiO2电化学探针,用以检测循环肿瘤细胞和化疗耐药性监测[18]。
4.3 影像学检查
4.3.1 腹部超声 腹部超声是GBC 的首选检查,具有诊断敏感度高(约80%)、成本低、易于操作等特点。超声提示胆囊壁不均匀增厚、囊腔内有位置固定的包块、>1 cm腺瘤样病变时,应予以特殊关注,若同时伴有胆囊结石、胆囊炎等高危因素时,应高度怀疑癌变倾向[19]。但超声易受腹壁脂肪、肠腔气体影响,产生伪影,且GBC早期超声检查没有特异性。超声内镜则可避免肠气干扰,采用高频探头于肠腔内扫面胆囊区域,且对肿瘤浸润层次、区域淋巴结进行准确判断。超声内镜在GBC早期诊断中阳性率可达90%[20]。近年来,人工智能发展迅速,其中深度神经网络模型在各种医学成像表现出色,深度神经网络实现了让计算机自主学习并提取数据特征,最大程度上规避了伪影等影响因素。Basu 等[21]开发了RadFormer 模型,在GBC 诊断中准确率高达92%,提高了早期GBC的诊断率。
4.3.2 CT检查 在胆囊小隆起样病变,尤其是<1 cm的病变中,其敏感性远低于超声,但其特异性高于超声。其优势在于不受肋骨、腹部脂肪、胃肠腔气体影响。CT 检查可显示胆囊形态学改变、浸润层次,尤其在GBC转移的诊断中优势明显[22]。
4.3.3 MR检查 可准确评估GBC局部浸润深度、是否累及周围器官,多用于判断肿瘤良恶性及肿瘤分期。但存在操作时间长、价格高、易出现伪影等不足。结合磁共振胰胆管成像可更好的反应胰胆管解剖关系,对胆管浸润型GBC诊断优势明显[23]。
4.3.4 正电子发射断层成像检查 正电子发射断层成像技术近年来迅速发展,其敏感度、准确度较高,对于GBC 复发、远处转移有很高的诊断价值。癌组织与18F-FDG 亲合性高,可根据18F-FDG 聚集程度,结合病变形态及肿瘤标志物等进行诊断,尤其适用于判断胆囊息肉样病变良恶性。但其费用高、辐射剂量大、操作时间长,在临床中应用并不广泛,仅在其他诊断方法仍难以确定时应用[24]。Jia 等[25]发现[99mTc]Tc-HFAPi 对恶性肿瘤具有良好的靶向性,肾脏清除率快,在正常器官中摄取低,对比度更高,并首次通过了临床试验验证。[99mTc]Tc-HFAPi SPECT/CT 成本更低,是GBC的早期检测最新的候选方式。
5 GBC的治疗
5.1 手术 手术是早期GBC 治愈的唯一手段,但由于早期诊断困难,仅有20%患者可根治性切除。GBC术式:单纯胆囊切除、胆囊癌根治术、胆囊癌扩大根治术。根据GBC 的TNM 分期,选择不同术式(表2)。有研究[26]表明,黄疸是GBC 相对禁忌证,术后并发症增多,术前应仔细评估,防止术后不良反应,影响患者生存质量。

表2 胆囊癌分期与手术方式Table 2 Staging and surgical methods of GBC
5.2 放射治疗(以下简称放疗) 放疗技术包括调强放疗、三维适形放疗、立体定向体部放疗。该技术已成为重要的辅助治疗方式,为晚期GBC患者提供了肿瘤降期的可能。术前辅助放疗,增加了R0 切除的可能,术后放疗,防止GBC 复发[27]。但目前尚无有利证据表明放疗在GBC治疗中的有效性。
5.3 化学治疗(以下简称化疗) 有研究[28]表明,GBC患者化疗后5年生存率及无瘤生存率明显高于单纯手术组。术后应用卡培他滨辅助治疗可以提高患者术后的总生存期,已被视为标准治疗[29]。基于BILCAP研究和日本胆道外科学会相关研究成果,《中国恶性肿瘤整合诊治指南:胆囊癌》[30]推荐T1b期以上患者首选卡培他滨单药为一线化疗方案。Ⅱ~Ⅳ期患者则推荐丝裂霉素C联合5-氟尿嘧啶方案;晚期无法手术切除的患者推荐吉西他滨联合顺铂化疗方案(GC方案)[31]、吉西他滨联合S1化疗方案(GS方案)[32]、吉西他滨联合顺铂和白蛋白-紫杉醇化疗方案(GC+白蛋白-紫杉醇方案)[33]、伊立替康联合奥沙利铂、亚叶酸和5-氟尿嘧啶化疗方案(mFOLFIRINOX 方案)[34]。为探究双药联合是否存在治疗优势,韩国延世癌症医院开展了“吉西他滨联合卡培他滨对比卡培他滨单药辅助治疗手术切除的胆道癌的随机多中心Ⅲ期试验(KCSG HB20-14)”。许多临床和科研人员也在不断尝试多药联合化疗方案,以期达到更好的治疗效果,Ioka等[35]开展的吉西他滨+顺铂+S-1方案首次在Ⅲ期临床试验(NCT02182778)中延长了患者生存期,且高于GC 方案,具有成为晚期胆道肿瘤新的一线标准化疗方案的潜力。2023年日本国立癌症研究中心开展的“新辅助吉西他滨+顺铂+S-1对比可切除胆管癌患者直接手术治疗的随机多中心研究(JCOG1920:NABICAT)”进入Ⅲ期临床试验阶段。
5.4 靶向治疗 在临床诊疗过程中,仅有部分GBC患者表现出靶向治疗敏感度。研究人员[36]尝试针对胆管恶性肿瘤相关靶点行靶向治疗,如表皮生长因子受体、血管内皮生长因子,但治疗效果并不理想。结合高通量测序,筛选出个体特异性靶点,如HER-2/neu阳性患者,应用拉帕替尼、曲妥珠单抗联合帕妥珠单抗治疗,疗效显著[37-38]。随着分子生物学技术的发展,特异度高、敏感度强的靶向药物仍在探索中,基因和分子靶向治疗潜力巨大。
5.5 免疫治疗 程序性死亡配体1(PD-L1)在肿瘤细胞表面表达的免疫抑制蛋白,与免疫细胞表面的程序性死亡受体1(PD-1)相互作用,抑制免疫活动,使肿瘤细胞逃避免疫监视,造成免疫逃逸。已有研究[39]表明,GBC组织中PD-L1阳性率达54%。应用PD-1抑制剂阻断该通路,激活免疫微环境中T淋巴细胞,清除肿瘤细胞。目前已有针对PD-1 的派姆单克隆抗体与纳武单克隆抗体进入临床应用。2019年Ott等[40]的研究表明,派姆单克隆抗体用于晚期GBC,总体缓解率达17%,中位生存时间达6.2 个月,提示派姆单克抗对晚期GBC具有抗肿瘤作用。但其并非对所有PD-1、PD-L1 阳性患者有效,其治疗效果存在个体差异性。2022年9 月,美国食品药品监督管理局批准Durvalumab(PD-L1 抑制剂)与化疗联合用于患有局部晚期或转移性GBC患者,这是其首次批准在胆道癌中使用免疫疗法[41]。虽然GBC 免疫治疗的临床数据较少,却是GBC 新的治疗策略。
5.6 细胞治疗 嵌合抗原受体T 淋巴细胞(chimeric antigen receptor T-cell immunotherapy,CAR-T)是目前最前沿的恶性肿瘤的治疗方式之一,已有多款CAR-T 产品上市,在血液系统恶性肿瘤中表现出良好的治疗效果。研究人员开展了针对消化系统恶性肿瘤的CAR-T疗法,2018 年Feng 等[42]针对HER2 阳性晚期胆道癌的CAR-T 疗法进入Ⅰ期临床试验,结果证明CART-HER2免疫疗法的安全性和可行性,给GBC 患者带来了治疗希望。此外,嵌合EGFR、CD133 靶点的CAR-T 疗法虽然有效控制了肿瘤进展,但出现了严重的不良反应[43]。尽管目前针对GBC 的CAR-T疗法未取得突破性进展,但CAR-T 疗法仍是最具潜力的治疗策略,值得科研人员继续深入研究。
5.7 综合治疗 GBC 治疗方式多样化,但治疗效果并没有显著改善。临床工作者尝试多种治疗方式联合,以期改善患者预后。Hack等[44]开展的靶向治疗+免疫治疗+化疗联合的随机、双盲、安慰剂对照研究:贝伐珠单抗联合阿替利珠单抗和吉西他滨/顺铂治疗晚期胆道癌(IMbrave151)已进入Ⅱ期临床试验阶段。IMbrave151 或许将为GBC 的治疗提供重要的依据。2022 年8 月发表在Lancet Gastroenterol Hepatol杂志的一项免疫联合化疗的Ⅱ期临床试验:曲妥珠单抗联合FOLFOX 治疗吉西他滨和顺铂难治性HER2 阳性胆道癌(NCT04722133),该研究是韩国癌症研究小组开展的多机构Ⅱ期临床试验,对于HER2 阳性胆道癌,曲妥珠单抗联合FOLFOX 表现出良好的治疗效果,值得进一步研究[45]。2023 年3 月,周俭、樊嘉研究团队发表了关于特瑞普利单抗+仑伐替尼+GEMOX 联合治疗胆道癌的Ⅱ期临床试验的论文,其中位总生存期、无进展生存期和缓解持续时间分别为22.5、10.2 和11.0个月,疾病控制率为93.3%,治疗效果显著,是一种很有前途的治疗方案[46]。
6 小结
综上所述,GBC 是一种恶性程度极高的胆道恶性肿瘤,早期不易诊断且进展迅速,早期即可发生淋巴转移,大多确诊时已是晚期,预后极差。虽然目前针对GBC的治疗方式繁多,多种治疗方式联合也取得了一定效果,但GBC 总体预后仍不理想。因此早发现、早治疗尤为重要,如何最大可能地预防GBC发生成为重中之重。存在危险因素的群体,建议定期检查,以期早发现早治疗。生活中也应改善生活习惯,戒酒戒烟、忌高热量饮食以降低GBC发病率。同时增强影像学检查技术,提高分辨率,以及寻找GBC 特有的血清标志物,尽最大可能提高GBC早期诊断率。治疗上积极采用多种治疗方式联合,以期提高患者生存质量、延长生存期、改善患者预后。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:乐羿、杨豪负责课题设计,资料分析,撰写论文;刘虎、崔昭扬、赵向宁、安亮、李海珠参与收集及分析数据;乐羿、杨豪、张绍庚负责修改论文;张绍庚负责指导写作思路,指导撰写文章并最后定稿。
