溶血磷脂酸(LPA)对肝癌细胞的影响及相关机制的初步探讨
2023-12-08赵燕颖韩振琦邹艳平李云鹏刘丽艳程海涛
赵燕颖, 韩振琦, 邹艳平, 李云鹏, 徐 涛, 刘丽艳, 程海涛
1 长春中医药大学附属医院消化内镜科, 长春 130021; 2 吉林省一汽总医院消化内科, 长春 130011
目前肝癌的复发率仍较高,如何更好的预防肝癌和开发新的治疗方法是临床有待于攻克的难题[1]。溶血磷脂酸(lysophosphatidic acid,LPA)是一种生物活性磷脂介质,在体内信号转导过程中引起多种生物学效应,如参与心脏成纤维细胞的生长调节,促进平滑肌收缩[2]、参与肿瘤细胞生长、侵袭、转移。研究[3-4]报道LPA 在多种肿瘤发生、发展中起重要作用。本文主要是探讨LPA 与肝癌恶性进展作用的相关性以及具体机制,并就LPA 相关的信号通路在肝癌靶向治疗中的前景进行讨论。
1 资料和方法
1.1 ELISA法测定LPA
1.1.1 研究对象 选取2016 年1 月—2022 年12 月吉林省一汽总医院诊治的伴有腹腔积液的肝癌患者26例,男16例,女10例,年龄39~70岁。另选取伴有腹腔积液的肝硬化(Child-Pugh B 级18 例,Child-Pugh C 级10例)患者28例(其中酒精性肝硬化患者17例,肝炎肝硬化患者11例),男19例,女9例,年龄38~68岁。同时体检中心选28例健康人群(男16例,女12例,年龄38~66岁)作为对照组。所有腹腔积液患者中移动性浊音界于锁骨中线与腋中线的二度者占64.3%,移动性浊音超出锁骨中线的三度者占35.7%。排除标准:(1)患有除肝癌以外的其他肿瘤患者;(2)已知或可能怀孕者、哺乳期妇女;(3)严重心、肾功能异常,及有脑梗死、短暂性脑缺血发作及外周深静脉血栓形成者。
1.1.2 LPA测定方法 全部受验者均于清晨空腹采血取样2~4 mL,有腹腔积液的患者抽取腹腔积液10 mL。所有标本均于采集后30 min内3000 r/min离心10 min,仔细收集上清,采用酶联免疫法(ELISA)检测血清LPA 含量。LPA≥3.2 μmol/L 设为阳性,<3.2 μmol/L 设为阴性。
1.2 体外试验主要仪器设备和试剂 CO2孵箱、蛋白电泳、实时定量PCR 及显影系统。DMDM 培养基、小牛血清(Gbico 公司)、LPA(MSK 公司)、百日咳毒素(pertussis toxin,PTX)(Sigma 公司)、结晶紫(Sigma-Aldrich 公司)、小鼠抗人β-actin、P53 抗体(北京中杉金桥)。鼠抗人FAK、RhoA 单克隆抗体购自Abcam 公司,辣根酶标记抗生物素IgG 抗体、Western Blot Luminol Reagent 和PVDF 膜均购自美 国SantaCruz 公司。DAB 显色试剂盒购自中杉公司。RNA 提取试剂及RT-qPCR 试剂盒购自大连宝生物(TaKaRa)公司。引物由上海生工生物工程公司合成。
1.3 细胞培养 SMMC7721人肝癌细胞购自中国科学院上海细胞生物学研究所。细胞在DMDM 培养基(含10%胎牛血清,青霉素100 mg/L,链霉素100 mg/L)中,5%CO2孵箱内37 ℃培养。待细胞生长到铺满细胞瓶底面80%左右进行细胞传代。
1.4 MTT 细胞增殖实验 按照5×103个细胞/孔将对数生长期细胞接种于96 孔板,培养至细胞80%融合后分组:空白对照组(只加无血清培养基)、LPA 组(含12.5、25、50 μmol/L LPA 的无血清培养基)、PTX 组(PTX 是LPA 拮抗剂,浓度为100 μg/L)、LPA+PTX 组(100 μg/L PTX和浓度为50 μmol/L的LPA)。
分别于加药后24、48 和72h,每孔加入15 μL MTT(5 g/L)继续培养4 h,再加入DMSO(150 μL/孔),振荡10 min后采用酶标仪(570 nm)测定吸光度(A)值。根据公式计算细胞生存率:细胞生存率=(实验组A值/空白组A值)×100%。每组设3个平行孔,实验重复3次。
1.5 细胞侵袭和迁移实验 取一无菌96孔培养细胞板,每孔加入约100 μL 的Matrigel 胶,置于4 ℃冰箱。约12 h后吸出上清液。用含5%血清的封闭液室温封闭约30 min。用移液器取1×105细胞接种于之前用Matrigel 胶包被的孔中分组实验,分组与细胞增殖实验相同。将细胞培养板置于恒温培养箱中继续培养24 h后用移液器轻轻吸出上层培养液。取100 μL含结晶紫溶液加入孔中,室温静置15 min染色。洗涤2次后静置培养板至其干燥。最后用移液器取100 μL 含5%SDS的乙醇滴入培养细胞的孔中,静置约30 min后,用酶标仪测定吸光值,并定量分析实验结果。
1.6 qPCR 检测相关基因的表达 取对数期生长的SMMC7721 肝癌细胞分组处理:LPA 组(终浓度为50 μmol/L),LPA+PTX 组(50 μmol/L LPA 和100 μg/L PTX),对照组(只加无血清培养基),继续培养至48 h,用Trizol 裂解细胞提取细胞总RNA,利用微量分光光度计检测A260/A280值评价提取RNA 质量与纯度,定量后各组取2 μg 总RNA 应用cDNA 合成试剂盒逆转录获得cDNA,用实时定量PCR(real time quantitative PCR,qPCR)检测RNA 表达水平,均按照试剂盒操作说明书操作。各基因的合成引物分别为:RhoA 上游引 物5'-TTCAGCAAAGACCAAAGATGGA-3',下 游 引物5'-CACAAGACAAGGCACCCAGA-3';p53 上游引物5'-GTGGTGGTGCCCTATGAG-3';下 游 引 物 5'-GGGAGGTAGACTGACCCTTT-3';FAK 上 游 引 物5'-GCCTGGTGAAAGCTGTCATC-3';下 游 引 物 5'-GCTTCTGTGCCATCTCAATC-3';GAPDH 上游引物5'-GGTCGGAGTCAACGGATTTGGTCG-3',下 游 引 物5'-CCTCCGACGCCTGCTTCACCAC-3'。对目的基因的表达进行相对定量分析。
1.7 Western Blot 检测相关蛋白的表达 取对数期生长的SMMC7721肝癌细胞分组处理,分组同RT-PCR实验,继续培养48 h,用PBS 洗1次,加4 ℃的裂解液(按1×107个细胞加入100 μL),超声粉碎细胞,低温离心后取上清液-80 ℃冻存。为确保蛋白上样量一致,样品中蛋白经Bradford定量,然后加入2×SDS凝胶加样缓冲液100 ℃煮沸变性,样品中蛋白通过12%SDS-PAGE 分离后转至PVDF膜上,脱脂奶粉封闭4 ℃过夜;分别加入兔抗人P53,FAK,RhoA 和β-actin 抗体(1∶500),4 ℃过夜;用TBST 洗膜10 min,3次,加入1∶2 000 稀释的羊抗兔二抗,振摇1 h,TBST 洗膜,DAB 显色、拍照。分析系统测定各条带灰度值,计算蛋白表达水平。
1.8 统计学方法 采用SPSS 21.0统计软件进行统计学分析。计量资料以xˉ±s表示,多组间样本均数比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组LPA 水平比较 (1)肝癌组血浆LPA 水平(4.99±0.55)μmol/L 明显高于肝硬化组(2.63±0.43)μmol/L 及对照组(1.61±0.39)μmol/L,差异均有统计学意义(P值均<0.05)。肝硬化组与健康对照组之间比较差异无统计学意义(P>0.05)。(2)肝硬化组2例腹腔积液LPA 值较高,但仍低于肝癌组LPA 水平。肝癌组腹腔积液LPA水平(5.19±0.63)μmol/L明显高于肝硬化组(2.91±0.46)μmol/L,差异有统计学意义(P<0.05)(表1)。

表1 肝癌、肝硬化患者以及正常人群LPA的表达水平Table 1 Expression level of LPA in patients with liver cancer, liver cirrhosis and normal people
2.2 各组SMMC7721细胞增殖情况 对照组、(12.5、25、50 μmol/L)LPA 组、PTX 组 以 及LPA+PTX 组 的SMMC7721细胞24、48 和72 h 的增殖率具体如图1 所示。LPA 可明显促进SMMC7721 细胞增殖,细胞增殖率随剂量和时间增加而增加,尤其中高剂量组增殖率明显高于对照组,具有时间依赖性和剂量依赖性,随着给药剂量和时间的增加,增殖率逐渐增加,差异具有统计学意义(P<0.05)。而PTX 抑制其增殖能力,且具有时间依赖性,对照组和LPA 组细胞增殖率明显高于PTX 组,各组差异具有统计学意义(P<0.05)。72 h高剂量LPA组的增殖率是对照组的3.6倍,PTX组是对照组的0.6倍,二者联合组是对照组的1.2倍。高剂量组LPA 联合PTX 组细胞增殖率有所增加,但和对照组无明显差异(P>0.05)。说明LPA拮抗了PTX抑制细胞增殖的作用,这再次证明了LPA 有促进肿瘤细胞增殖的能力。
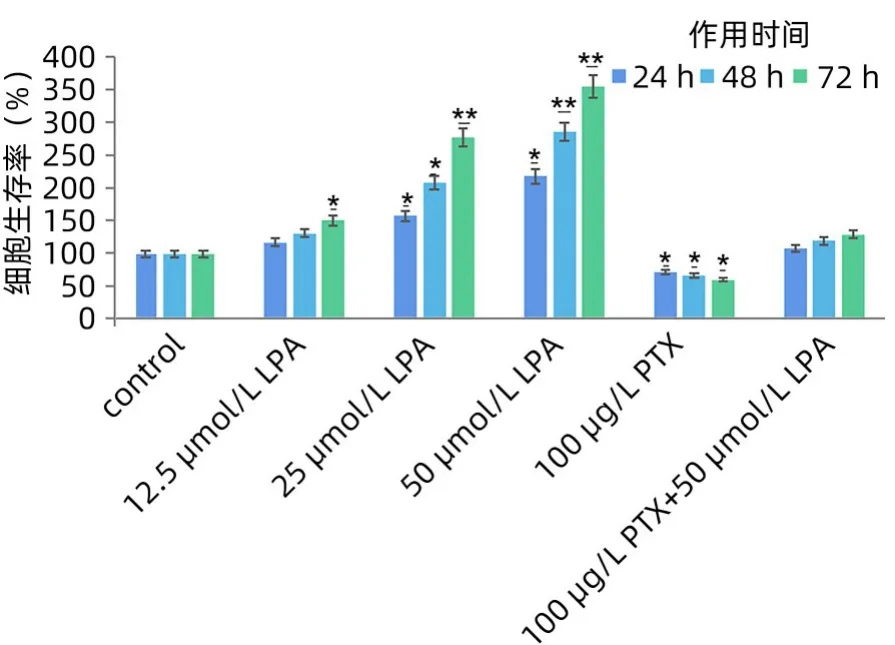
图1 各组SMMC7721细胞增殖情况Figure 1 The proliferation of SMMC7721 cells in each group
2.3 细胞侵袭和迁移实验结果 通过细胞侵袭和迁移实验检测了LPA 和PTX 对SMMC7721 肝癌细胞侵袭、迁移和黏附能力的影响(图2)。与对照组相比,加入LPA的SMMC7721细胞黏附能力明显增加,提示LPA能增加细胞黏附能力。LPA的拮抗剂PTX能明显降低SMMC7721细胞黏附能力,LPA可增加肝癌细胞的迁袭能力,与对照组相比差异有统计学意义(P<0.05)。但加用较高剂量LPA 和PTX 的联合组SMMC7721细胞的黏附能力与对照组比变化不明显。LPA能增加肝癌细胞黏附能力,PTX 作为LPA 的拮抗剂抑制肝癌细胞的黏附,抑制其迁移。结果表明随时间增加上述能力增加,各组差异具有统计学意义(P<0.05)。72 h 高剂量LPA 的迁袭率是对照组的3.09倍,PTX 组是对照组的0.4倍,二者联合组是对照组的0.99倍。
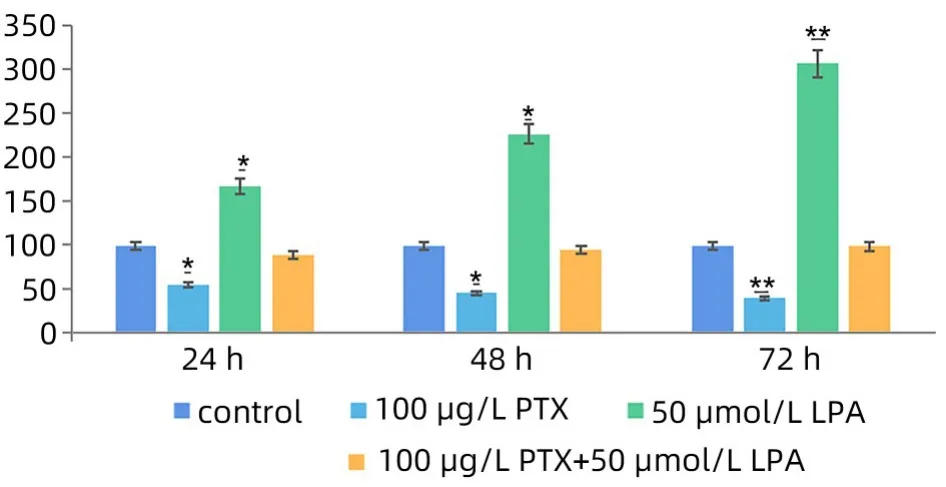
图2 各组SMMC7721细胞侵袭、迁移和黏附能力Figure 2 Adhesion ability of SMMC7721 cells in each group
2.4 qPCR 结果 与对照组相比,50 μmol/L 的LPA 作用SMMC7721细胞48 h后,细胞P53基因mRNA相对表达量下降,而RhoA 和FAK 基因mRNA 表达量增加。LPA 组和对照组差异具有统计学意义(P<0.05)。同时发现LPA+PTX 组的P53、RhoA 和FAK 基因表达与对照组比较无明显变化,差异无统计学意义(P>0.05)(图3)。
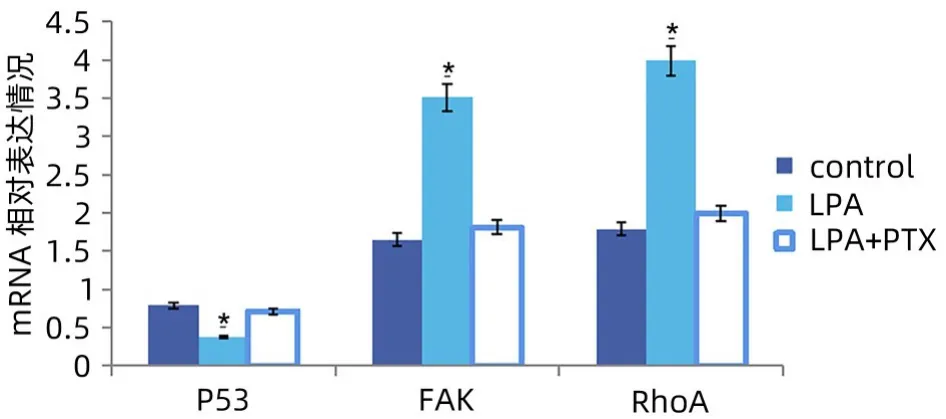
图3 各组SMMC7721细胞P53、FAK、RhoA基因表达情况Figure 3 Expression of P53, FAK and RhoA genes in SMMC7721 cells
2.5 Western Blot 结果 同等内参β-actin 水平下,LPA 组SMMC7721细胞P53蛋白表达水平是对照组的20.9%,差异具有统计学意义(P<0.01),LPA+PTX 组P53 蛋白表达水平有所升高,但仍低于对照组。LPA组SMMC7721 细胞的RhoA、FAK 蛋白表达水平是对照组的161.1%和153.9%,两组差异均具有统计学意义(P值均<0.05),LPA+PTX 组RhoA、FAK 蛋白表达水平和对照组无明显差异。LPA能明显降低P53蛋白的表达水平,同时增加SMMC7721 细胞的RhoA 和FAK蛋白表达水平(图4)。
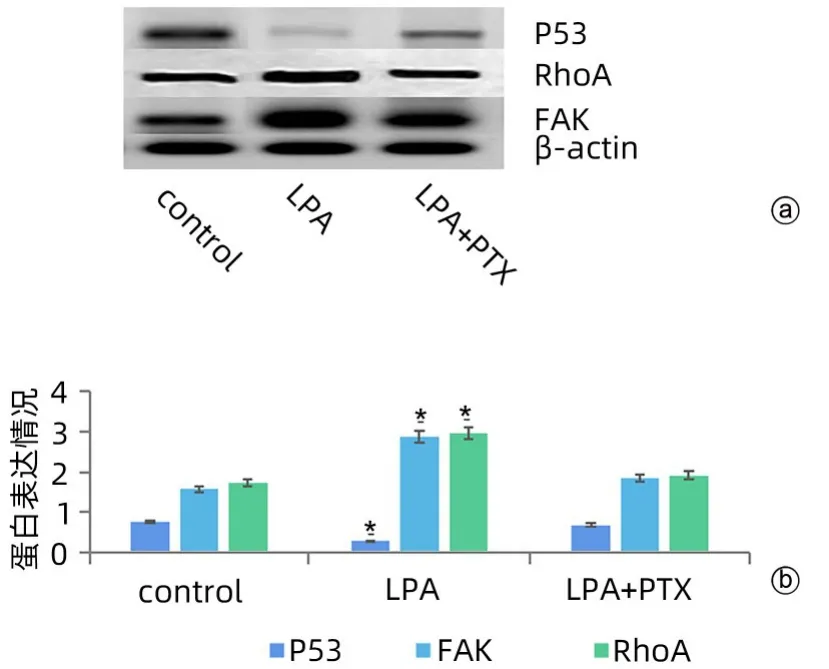
图4 各组SMMC7721细胞P53、FAK、RhoA蛋白表达情况Figure 4 Expression of P53, FAK and RhoA in SMMC7721 cells
3 讨论
LPA 最早是从卵巢癌患者的腹腔积液中分离纯化出的[5-6],LPA 是血清中的正常成分,体液当中如血清、唾液和肿瘤患者腹水中都存在LPA。LPA 及其受体在一些肿瘤中的异常高表达表明LPA 在肿瘤发生、发展中起一定作用,LPA 可诱导多种细胞增殖,可增加肿瘤细胞浸润,参与肿瘤的发生发展[7]。LPA 作为一种多功能的生物活性磷脂分子,能够参与调控细胞迁移、增殖、分化和凋亡等生物学行为[8]。
本研究通过ELISA 检测发现肝癌患者血浆中LPA 水平明显高于肝硬化患者和正常人群,而且肝癌患者腹腔积液中的LPA 水平明显高于肝硬化患者腹腔积液中的表达水平,差异均具有统计学意义。上述结果与既往研究结果一致,再次证明了LPA 在肝癌患者中有异常高表达,可作为肝癌肿瘤预测因子和治疗靶点[9]。
肿瘤细胞中有广泛的LPAR1表达,并且能够通过激活MAPK、Akt和Rho信号通路等方式调节细胞的增殖和迁移[10],同时LPAR1 能够下调肿瘤抑制因子p53的表达情况[11]。LPAR2 可通过激活Rho、Ras、Rac、MAPK、PLC 和PI3K 等信号通路来调节细胞的迁移和增殖。LPA能够通过与其紧密连接的受体激活下游多条信号通路,其中RhoA/ROCK信号通路在LPA信号传导中发挥着至关重要的作用。有研究[12]报道野生型的p53基因可以促进肿瘤细胞凋亡,但突变的p53基因可能通过激活RhoA 的这条途径,参与肿瘤细胞生长、增殖及凋亡等生物学行为的调控。FAK是一种位于胞质内的酪氨酸激酶,FAK 涉及到细胞的黏附、播散、迁移和凋亡表达,有研究[13]显示在多种肿瘤中有FAK的过度表达,包括起源于肝脏、直肠、肺部等肿瘤。FAK可能在肝癌相关通路调控着肿瘤细胞的存活、增殖,介导肝癌细胞与其他促进细胞迁移细胞因子如RhoA 的相互作用过程。FAK 会调控RhoA 的激活,RhoA 可以介导FAK的磷酸化作用,激活细胞迁移信号通路[14-17]。既往研究[18-19]显示肝癌细胞中RhoA 蛋白的表达量明显高于正常肝细胞。基于上述论点,本文研究了LPA对肝癌细胞中RhoA、FAK 和野生型P53基因和蛋白的影响,进一步明确LPA 的作用机制。本研究通过RTqPCR 和Western Blot 实验证明经LPA 处理的肝癌细胞中RhoA、FAK基因和蛋白表达明显增加,同时,LPA可以抑制野生型P53 基因和蛋白的表达,与既往研究[20]结果一致。
PTX 对LPA 有较明显的阻断效应,PTX 能拮抗LPA 对上述基因和蛋白的作用。本研究通过MTT 细胞增殖试验、细胞黏附实验检测发现,加用LPA 抑制剂PTX 后细胞增殖和黏附能力明显下降,且明显低于对照组。LPA 和PTX 互相拮抗,LPA 对细胞增殖和黏附、迁移能力有明显的促进作用,提示LPA 能促进肝癌细胞增殖和黏附、迁移作用,从而诱发肝癌的发生和发展。
伦理学声明:本研究方案于2021 年经由吉林省一汽总医院伦理委员会审批,批号:SB-2021-014。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:赵燕颖负责撰写文章;邹艳平、李云鹏、徐涛、刘丽艳参与了实验数据的整理和数据统计分析;程海涛指导文章撰写过程;韩振琦负责拟定写作思路,指导撰写文章并最后定稿。
