超声造影预测非小细胞肺癌颈部转移性淋巴结Ki-67表达水平的临床价值
2023-12-05韦力周军周畅刘蓉许涛
韦 力 周 军 周 畅 刘 蓉 许 涛
肺癌是全球最常见的严重危害人类健康的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占比高达80%[1]。增殖细胞核抗原Ki-67 是一种肿瘤增殖的生物标志物,其表达水平反映了肿瘤的增殖、浸润和转移的生物学特性,在NSCLC 个体化靶向和免疫治疗方案的制定中具有重要意义[2]。超声造影(contrast-enhanced ultrasound,CEUS)可以从形态学、血管生成、肿瘤微环境等多角度全面评估淋巴结的生物学特性,反映转移性淋巴结新生血管的位置及通透性等特点,CEUS 定量参数也可间接反映肿瘤的生物学特性[3]。本研究分析了NSCLC颈部转移性淋巴结CEUS 特征和定量参数,并分析了定量参数与Ki-67 表达水平的关系,探讨利用无创的CEUS 技术预测NSCLC 颈部转移性淋巴结Ki-67 表达水平的价值,旨在指导临床评价NSCLC 的生物学特征并制定治疗方案。
资料与方法
一、研究对象
选取2021 年6 月至2022 年7 月我院经超声引导下淋巴结穿刺活检确诊的NSCLC 颈部转移性淋巴结患者52 例,共计60 枚颈部转移性淋巴结,其中肺鳞癌转移14 枚、肺腺癌转移32 枚、肺大细胞癌转移14 枚;根据Ki-67 表达水平[4]将其分为Ki-67 高表达组(Ki-67 表达水平≥30%)38 例(42 枚颈部转移性淋巴结)和Ki-67 低表达组(Ki-67 表达水平<30%)14 例(18 枚颈部转移性淋巴结)。纳入标准:①常规超声探及颈部异常淋巴结且接受淋巴结CEUS 检查;②经超声引导下淋巴结穿刺活检及免疫组化检查获得明确的病理结果和Ki-67 表达水平。排除标准:①合并其他恶性肿瘤;②既往行淋巴结消融治疗或其他抗肿瘤治疗;③超声图像质量欠佳无法满足CEUS 定量分析。本研究经我院医学伦理委员会批准(2022-022-01),所有患者均签署知情同意书。
二、仪器与方法
1.CEUS 检查:使用法国声科Aixplorer 彩色多普勒超声诊断仪,SL10-2 线阵探头,频率2~10 MHz;检查时调节合适的深度和增益,机械指数保持基本一致。首先行常规超声检查,选取被检淋巴结血流显示最丰富的最大长轴切面,观察并记录淋巴结最大长径、最大短径、长短径比、边界、形态、淋巴门结构、是否存在无回声区和能量多普勒血流类型;其中能量多普勒血流类型分为Ⅰ型(无血流或微弱型)、Ⅱ型(门区血流信号为主)、Ⅲ型(周边型血流信号为主)和Ⅳ型(周边及门区血流型号丰富且紊乱)[5]。随后切换至CEUS模式,经肘静脉团注2.4 ml 配制好的SonoVue 混悬液(意大利Bracco 公司),随即以5.0 ml 生理盐水冲管,动态观察造影过程120 s并存储DICOM格式图像。
2.CEUS图像定性分析:分析淋巴结CEUS特征,包括增强强度、增强均匀性、是否存在灌注缺损、灌注模式和灌注类型;其中,灌注模式分为离心型(中央向周边灌注)、向心型(周边向中央灌注)或混合型(中央与周边同步);灌注类型分为Ⅰ型(均匀增强型)、Ⅱ型(规则灌注缺损或环状增强型)、Ⅲ型(不规则灌注缺损型)和Ⅳ型(微弱增强型)[6]。
3.CEUS图像定量分析:由2名具有3年工作经验的超声医师使用QontraXt 3.06 后处理软件分析淋巴结CEUS图像,首先选择淋巴结整体作为感兴趣区(ROI),然后分别在中央区和周边区选取ROI,ROI大小保持一致并避开无回声区,淋巴门存在时定义淋巴门入口为中心点,淋巴门不存在时定义淋巴结最大长、短径交点为中心点,中心点与包膜连线中点围成的区域为中央区,以外的部分为周边区[7]。见图1。分别获取淋巴结整体、中央区、周边区时间-强度曲线(TIC),分析CEUS定量参数:峰值强度(PI)、达峰时间(TTP)、曲线下面积(AUC)、平均渡越时间(MTT)、灌注速度(C)、廓清速度(K);计算淋巴结中央区与周边区CEUS 定量参数差值,包括ΔPI、ΔTTP、ΔAUC、ΔMTT、ΔC 和ΔK。所有参数均由每名医师重复测量3次,取平均值。
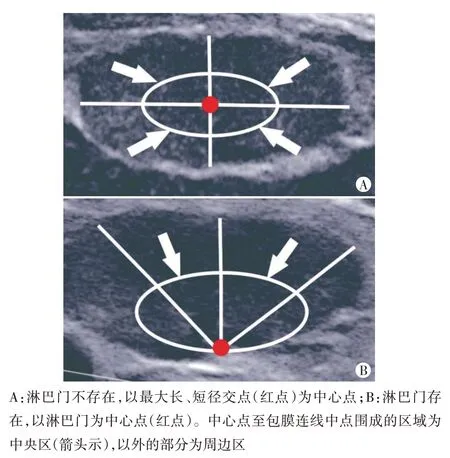
图1 淋巴结分区示意图
4.重复性检验:由同一医师间隔1 周分别重复分析TIC 获取淋巴结CEUS 定量参数进行观察者内重复性检验;由另一医师对相同图像进行分析,进行观察者间重复性检验。
三、统计学处理
应用SPSS 25.0 和GraphPad Prism 8.0 统计软件,正态分布的计量资料以表示,两组比较采用独立样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,两组比较采用Mann-WhitneyU检验。计数资料以频数或率表示,组间比较采用χ2检验或Fisher精确检验。应用多因素Logistic 回归分析筛选Ki-67 表达水平的独立预测因子。各独立预测因子与Ki-67表达水平的相关性分析采用Spearman 相关分析法。绘制受试者工作特征(ROC)曲线分析CEUS 预测Ki-67 表达水平的诊断效能。一致性检验采用组内相关系数(ICC)表示。P<0.05为差异有统计学意义。
结果
一、两组一般资料比较
两组年龄、性别、病理类型、异常淋巴结位置比较差异均无统计学意义。见表1。

表1 两组一般资料比较
二、两组淋巴结常规超声检查结果比较
两组淋巴结长短径比、边界、形态、有无淋巴门和无回声区、能量多普勒血流类型比较差异均无统计学意义。见表2。
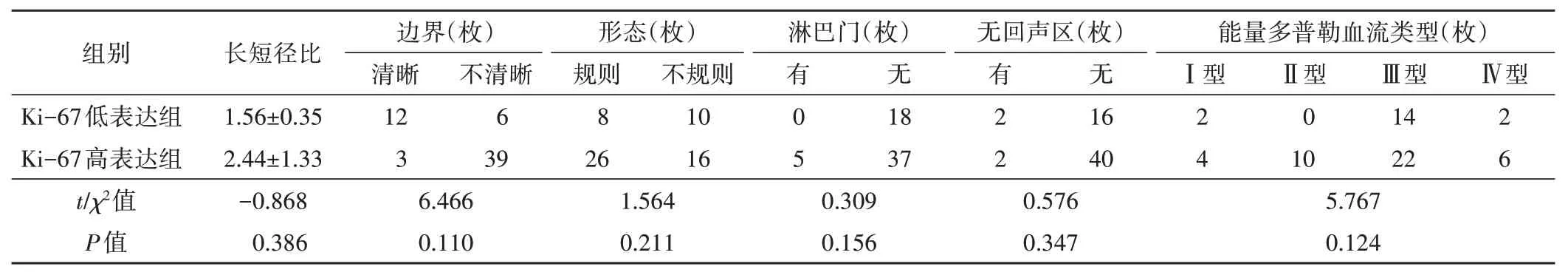
表2 两组淋巴结常规超声检查结果比较
三、两组淋巴结CEUS定性特征比较
两组淋巴结CEUS 增强强度、增强均匀性、灌注模式、灌注类型比较差异均无统计学意义。见表3。
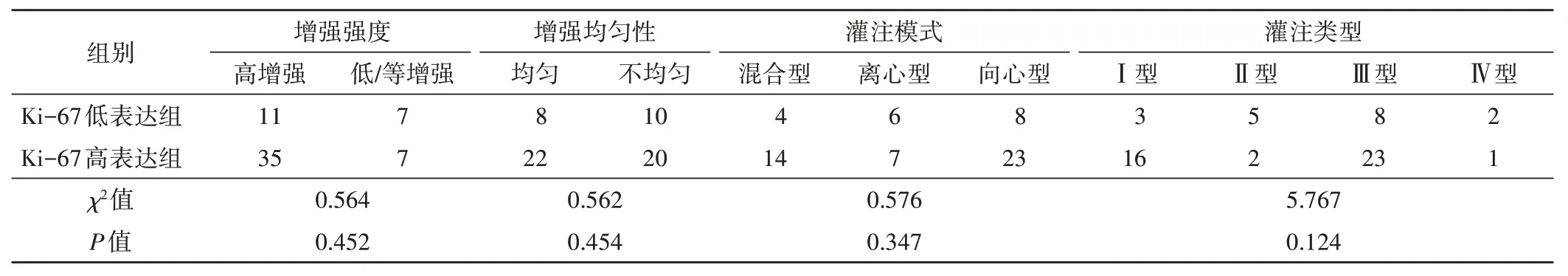
表3 两组淋巴结CEUS定性特征比较枚
四、两组淋巴结CEUS定量参数比较
Ki-67高表达组淋巴结整体及中央区PI、C和周边区PI 均大于低表达组,中央区AUC 高于低表达组,差异均有统计学意义(均P<0.05);两组整体及周边区AUC,以及整体淋巴结及各区TTP 和MTT 比较差异均无统计学意义;两组中央区与周边区CEUS 定量参数差值即ΔTTP、ΔPI、ΔAUC、ΔMTT、ΔC、ΔK 比较差异均无统计学意义。见表4和图2,3。
表4 两组淋巴结CEUS定量参数比较()
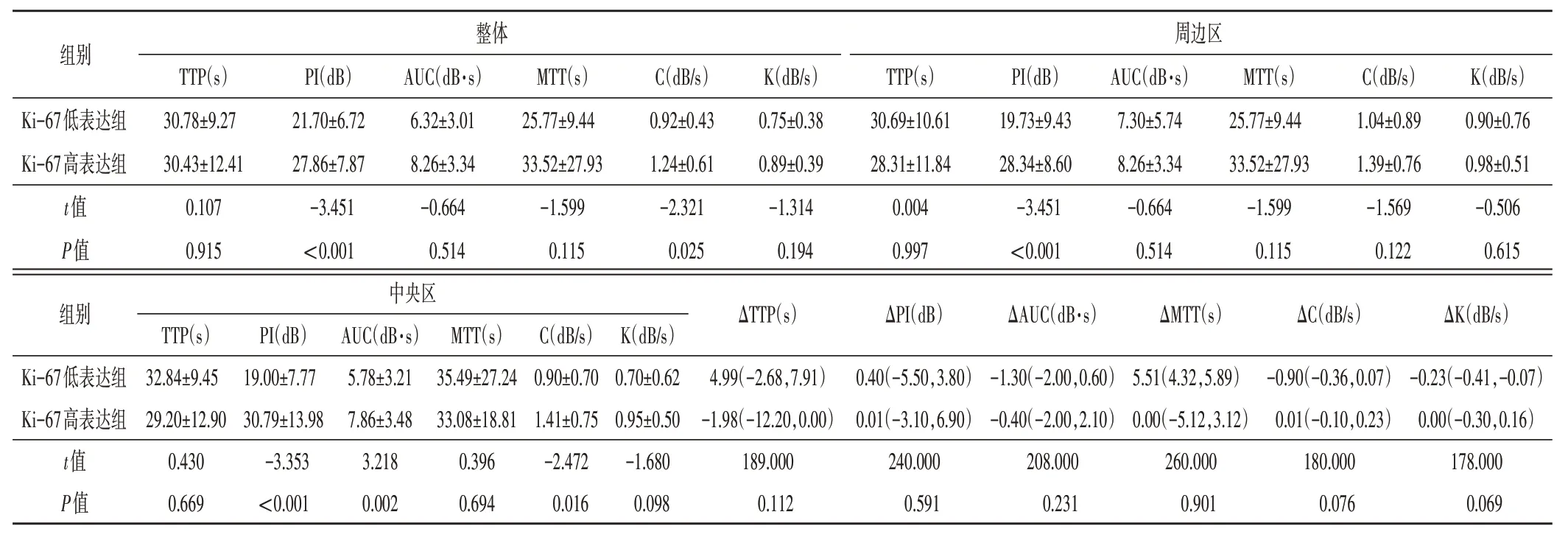
表4 两组淋巴结CEUS定量参数比较()
TTP:达峰时间;PI:峰值强度;AUC:曲线下面积;MTT:平均渡越时间;C:灌注速度;K:廓清速度;ΔTTP、ΔPI、ΔAUC、ΔMTT、ΔC、ΔK:分别为淋巴结中央区与周边区达峰时间、峰值强度、曲线下面积、平均渡越时间、灌注速度、廓清速度差值
?
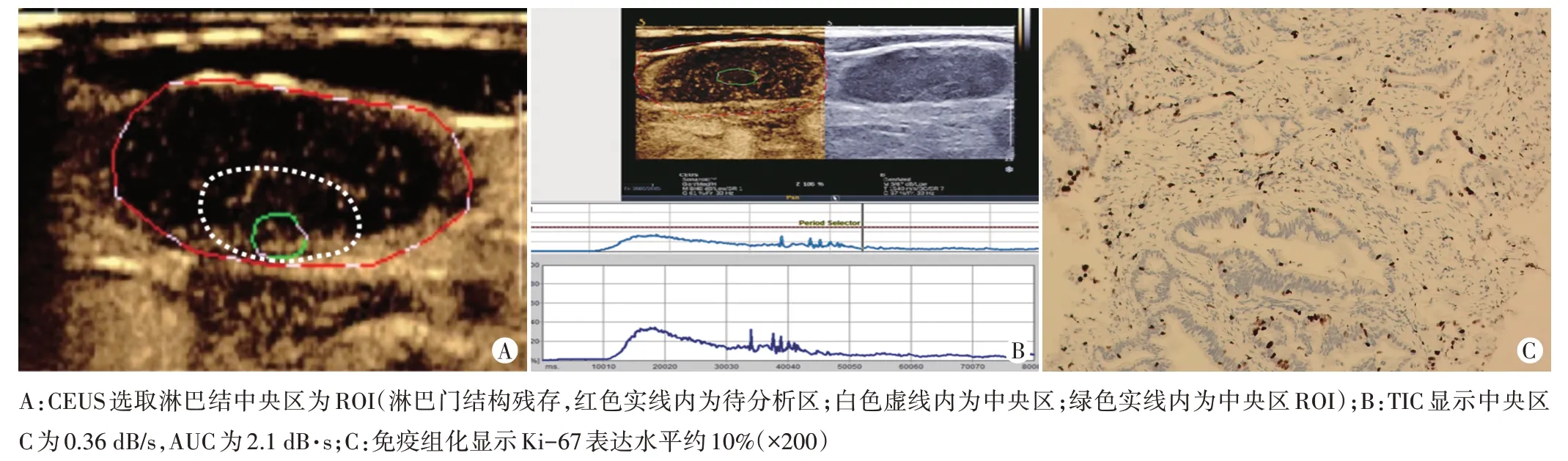
图2 Ki-67低表达组一患者(女,76岁)颈部Ⅳ区转移性淋巴结CEUS及淋巴结穿刺活检免疫组化图
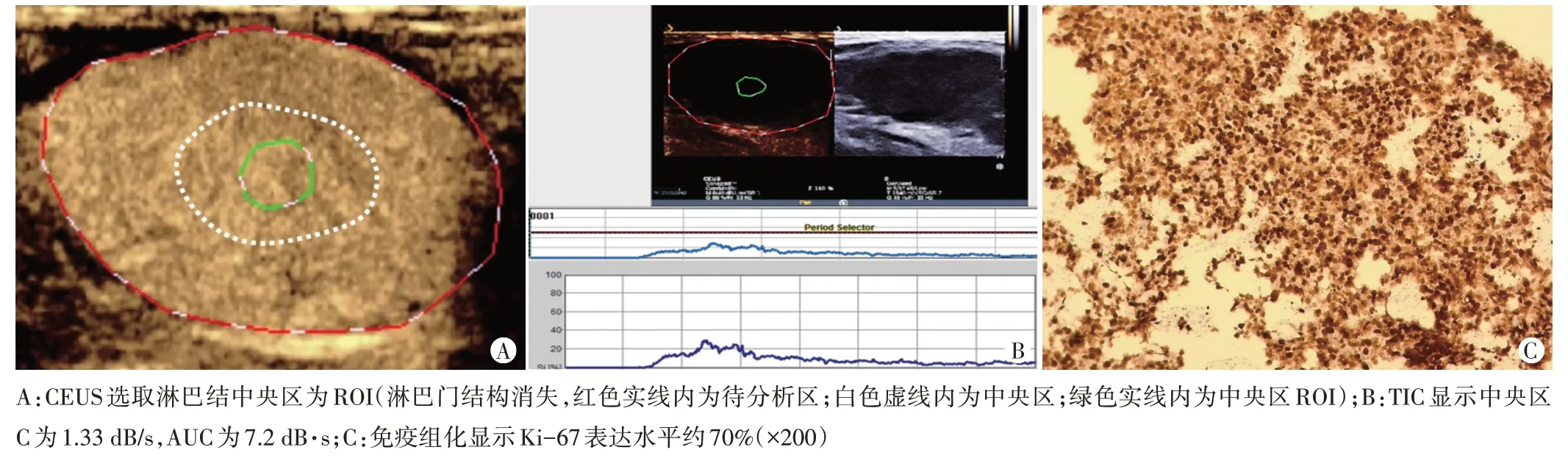
图3 Ki-67高表达组一患者(女,65岁)颈部V区转移性淋巴结CEUS及淋巴结穿刺活检免疫组化图
五、Ki-67表达水平的独立预测因子及其诊断效能
1.将上述两组比较差异有统计学意义的参数纳入多因素Logistic 回归分析,结果显示中央区AUC、C 均为Ki-67表达水平的独立预测因子(均P<0.05)。相关性分析显示,中央区AUC、C 与Ki-67 表达水平均呈正相关(r=0.543、0.552,均P<0.001)。见图4。
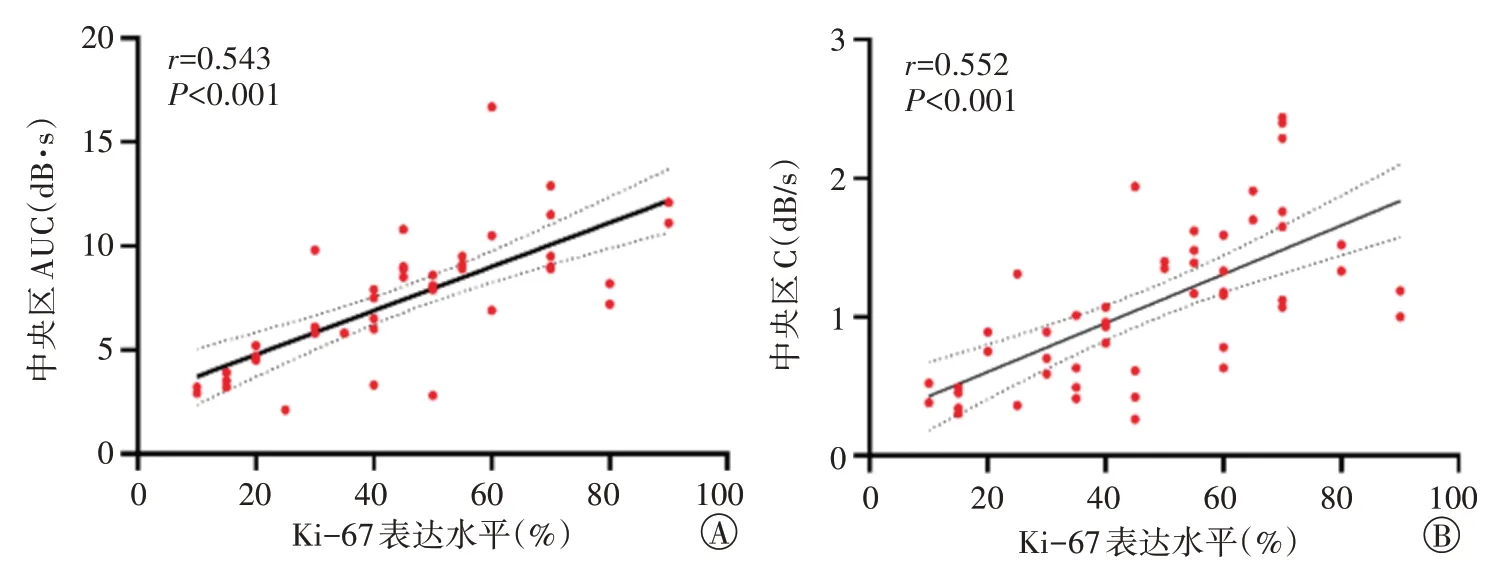
图4 中央区AUC(A)、C(B)与Ki-67表达水平的相关性分析散点图
2.ROC曲线分析显示,中央区AUC、C截断值分别为6.12、0.89 dB/s时,预测Ki-67表达水平的曲线下面积分别为0.844[95%可信区间(0.759~0.929),P<0.001]、0.901[95%可信区间(0.845~0.958),P<0.001],灵敏度和特异度分别为84.62%和76.92%、88.46%和73.08%。见图5。
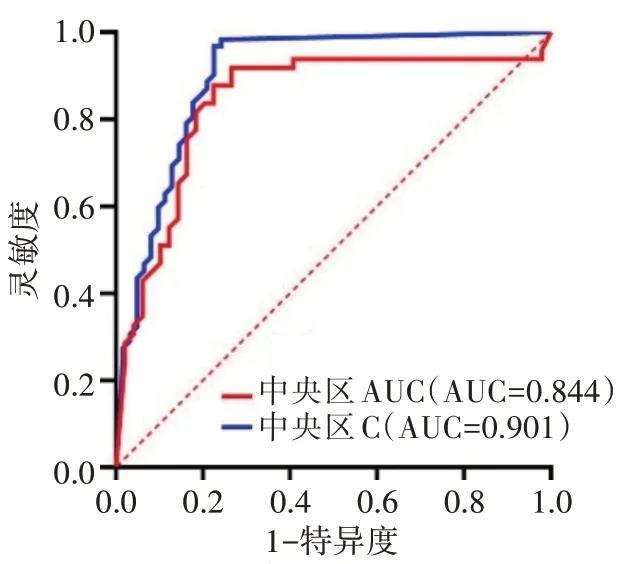
图5 CEUS 定量参数预测Ki-67 表达水平的ROC曲线图
六、重复性检验
CEUS 定量参数在观察者内及观察者间重复性均较好,见表5。
讨论
《中华医学会肿瘤学分会肺癌临床诊疗指南(2021)》[8]推荐,肺部占位疑似肺癌的患者若发现浅表淋巴结肿大,可进行活检以获得病理学诊断及肿瘤标志物的表达水平,进而帮助指导制定治疗方案、监测疗效和评估预后。其中,Ki-67 表达水平与肿瘤细胞增殖和生长密切相关,是临床上最常用的肿瘤增殖标志物。相较于血管内皮生长因子(VEGF)、缺氧诱导因子、胰岛素样生长因子3 等肿瘤标志物,Ki-67 的临床应用更广,其诊断敏感性也更高。Ki-67 不仅可以通过引起病灶形态学改变而影响超声表现,还可以反映NSCLC 患者预后,便于临床治疗。既往有研究[9]利用Ki-67 对NSCLC 进行辅助治疗分层以预判疗效,指导治疗决策,故本研究将NSCLC 颈部淋巴结转移患者依据Ki-67 表达水平进行分组,分析不同Ki-67 表达水平的淋巴结超声特征,探讨无创影像学检查评估Ki-67表达水平的可能性。
NSCLC 患者淋巴结转移具有多发性及跳跃性等特点[2],是影响肺癌治疗效果及术后生存的重要因素,本研究有8 例患者发生了多枚淋巴结转移,反映了淋巴结转移的多发性特点。Ki-67 低表达组与Ki-67 高表达组在年龄、性别、病理类型、异常淋巴结位置比较差异均无统计学意义。表明淋巴结内癌细胞的异质化并未受患者年龄、性别、原发肿瘤病理类型的影响。另外,本研究显示Ki-67 低表达组与Ki-67 高表达组淋巴结长短径比、边界、形态、有无淋巴门和无回声区、能量多普勒血流类型比较差异均无统计学意义,表明常规超声不能反映转移性淋巴结内肿瘤细胞的增殖活性,这可能是由于常规超声对淋巴结内部血流分布和灌注情况显示不足,而CEUS 可以弥补常规超声对肿瘤内部微血管显示不足的缺陷[3]。
CEUS 可以精确评估淋巴结微血管生成,其定量参数可以提供量化组织灌注和微血管通透性的病理特征[10]。既往研究[11]对于转移性淋巴结CEUS 定量参数的诊断价值评价各异,这可能是因为肿瘤异质性和患者选择偏倚导致的矛盾结果。为了尽可能减小这种偏倚,本研究选取淋巴结整体、周边区、中央区等不同区域作为ROI 进行CEUS 定量分析,结果显示Ki-67高表达组淋巴结整体及中央区PI、C 和周边区PI 均大于低表达组,中央区AUC 高于低表达组,差异均有统计学意义(均P<0.05)。原因在于转移性淋巴结内肿瘤细胞增殖速度增加,促进VEGF高表达,从而在淋巴结中新生出更丰富且通透性好的微血管网[12],造影剂灌注和廓清速度更快,峰值强度更高。另外,Ki-67 高表达组淋巴结中央区AUC 高于低表达组(均P<0.05),但两组周边区AUC 比较差异无统计学意义。分析原因可能为造影剂灌注顺序多由相对粗大的淋巴门动脉到放射状的周边分支动脉,周边区则多为沟通终末细微血管分支,中央区血流量较周边区更丰富,因此中央区造影剂的灌注量更多。而既往研究[13]表明Ki-67表达水平可以反映上皮-间充质转化表型的循环肿瘤细胞的多少,二者的协同作用会进一步刺激肿瘤的转移和增殖,中央区增大的肿瘤组织压迫淋巴结内部新生血管或形成动静脉瘘均会影响其血流量[14],这也同样证实中央区AUC 或可反映淋巴结内肿瘤细胞的增殖状态。但本研究Ki-67 低表达组与Ki-67 高表达组淋巴结CEUS 灌注模式、灌注类型比较差异均无统计学意义,这可能是因为转移性淋巴结内肿瘤细胞的浸润路径不受增殖速度的影响,原发肿瘤细胞均是从靠近皮质的淋巴管逐渐浸润,通过诱导VEGF 参与微血管生成,并逐渐向中央区侵袭,故两组淋巴结均表现为由周边向中央区的向心型增强或混合型增强[6]。与此同时,新生肿瘤血管会因为动静脉瘘、管径大小、走行迂曲、肿瘤组织栓塞等因素阻碍造影剂在淋巴组织内的灌注[15],出现非均匀增强并存在不规则灌注缺损区,这种特点是转移性淋巴结的特征性表现[16],而本研究两组淋巴结此灌注特点比较差异无统计学意义,表明转移性淋巴结内的瘤细胞增殖速度不会改变造影剂灌注的整体特点。本研究结果显示,两组中央区与周边区CEUS 定量参数差值比较差异均无统计学意义,表明肿瘤细胞的转移和增殖速度虽然影响了淋巴结在皮质和髓质的血流灌注,但是中央区和周边区的变化是趋同性的,不同Ki-67 水平的淋巴结血流灌注特点虽然在皮质区和髓质区有所差异[13],但这种差异并不会随着肿瘤增殖速度的增加而变大。
本研究多因素Logistic回归分析显示,NSCLC患者颈部转移性淋巴结中央区AUC、C 均为Ki-67 表达水平的独立预测因子,且与Ki-67 表达水平均呈正相关(r=0.543、0.552,均P<0.001)。ROC 曲线分析显示,中央区AUC、C截断值分别为6.12、0.89 dB/s时预测Ki-67表达水平的曲线下面积分别为0.844[95%可信区间(0.759~0.929),P<0.001]、0.9011[95% 可信区间(0.845~0.958),均P<0.001],灵敏度和特异度分别为84.62% 和76.92%、88.46% 和73.08%,表明中央区AUC、C具有预测Ki-67表达水平的能力。
本研究的局限性:①样本量有限,且为回顾性研究,结果可能存在偏倚;②Ki-67 表达水平作为临床治疗决策的截断值标准未统一,缺乏可靠的分组依据,虽然近年荟萃分析[17-18]证实Ki-67高表达是NSCLC 预后不良的因素,然而不同的单中心研究缺乏判断NSCLC无进展生存预后的统一截断值,本研究将Ki-67≥30%进行高、低表达分组是否合适需今后更多样本量及试验数据的证实。
综上所述,CEUS 定量参数颈部转移性淋巴结中央区AUC、C 可以预测Ki-67 表达水平,有助于临床无创评价NSCLC的肿瘤生物学特性。
