福建东山湾人工养殖池红树林浮岛养殖拟穴青蟹(Scylla paramamosain)的生长及肌肉营养成分分析*
2023-12-05李元跃陈融斌陈政强震潘煌杰李相威陈凤淋王秋荣
李元跃 柏 皓 陈融斌 陈政强 肖 震潘煌杰 李相威 陈凤淋 王秋荣
福建东山湾人工养殖池红树林浮岛养殖拟穴青蟹()的生长及肌肉营养成分分析*
李元跃1, 2柏 皓1, 2陈融斌1, 2陈政强1, 2肖 震1, 2潘煌杰1, 2李相威1, 2陈凤淋1, 2王秋荣1, 2①
(1. 集美大学水产学院 福建厦门 361021; 2. 福建省海洋渔业资源与生态环境重点实验室 福建厦门 361021)
为探究海水养殖池塘红树林浮岛养殖拟穴青蟹()的生长及其与野生拟穴青蟹营养成分的差异, 选择福建省漳浦县东山湾北部的海水养殖池塘内设置四个拟穴青蟹养殖实验组, 分别为红树林(秋茄)浮岛养殖组、海马齿浮岛养殖组、空白浮岛养殖组(水面无种植植物)和外围环沟养殖组, 并以试验点附近海区捕获的拟穴青蟹(野生组)作为对照, 对各组拟穴青蟹的肌肉营养成分进行分析。结果显示, 空白浮岛组拟穴青蟹增重率、特定生长率、出肉率及存活率均高于红树林浮岛组、海马齿浮岛组和外围环沟组; 红树林浮岛养殖拟穴青蟹肌肉粗蛋白含量(71.66%)最高, 粗脂肪含量(2.52%)相对较低, 各组拟穴青蟹肌肉中氨基酸总量在60.54%~68.68%之间, 其中红树林浮岛组拟穴青蟹肌肉中氨基酸总量、必需氨基酸总量上均显著高于野生组(<0.05); 从氨基酸评分(AAS)和化学评分(CS)结果可以得出拟穴青蟹的第一限制性氨基酸是蛋氨酸+胱氨酸, 各组拟穴青蟹肌肉中必需氨基酸指数(EAAI)均高于0.75; 肌肉中均富含不饱和脂肪酸, 尤其是多不饱和脂肪酸; 红树林浮岛组拟穴青蟹肌肉中多不饱和脂肪酸总量(ΣPUFA)、n-3系列多不饱和脂肪酸总量(Σn-3PUFA)均显著高于其他组(<0.05)。综上, 红树林浮岛养殖组拟穴青蟹肌肉的蛋白质和脂肪酸营养价值优于其他实验组。
红树林; 拟穴青蟹; 肌肉营养成分; 氨基酸; 脂肪酸
红树林是生长在热带、亚热带潮间带的木本植物群落, 以红树植物为主体, 林下常伴生常绿灌木或耐盐草本植物(王友绍, 2021)。尽管红树林具有重要的间接生态服务价值, 如维持海岸生物多样性(吴瑞, 2016)、对重金属的富集(Rahman, 2019; 李振良等, 2021)、对沉积物的滞留(Adame, 2010)和碳储存(Liu, 2014)等, 但其直接经济价值不高。随着我国逐步开展“蓝色海湾”、“海岸带修复工程”和“南红北柳”等滨海湿地修复与保护工程, 红树林面积逐年增加, 大面积的退塘还林势必会造成渔民经济收入的减少。因此, 开展红树林下养殖研究, 既能保护红树林, 还能创造直接经济价值, 解决渔民收入问题, 两全其美。
拟穴青蟹()俗称蝤蛑、蟳, 隶属于十足目(Decapoda), 梭子蟹科(Portunidae), 青蟹属(), 广泛分布于热带、亚热带沿海, 在我国主要分布在广东、广西、浙江及福建等省份。因其个体较大、味道鲜美、营养价值高, 是我国重要的海水养殖蟹类之一。目前我国拟穴青蟹的养殖模式常见的有池塘养殖、笼式养殖、工厂化循环水式立体养殖等。红树林区由于其生境特殊, 藻类种类丰富、多样性高, 对水域的次级生产有促进作用, 而且具有多种生态功能(Wong, 1995), 它可吸附或吸收利用海水中一些污染物(陈忠, 2007)。国内许多学者经过实践探索出多种红树林下新的青蟹养殖模式, 曾尚伟等(2011)在红树林间隙的滩涂设置特制的陶瓷瓦罐养殖锯缘青蟹()成活率达到80%以上, 解决了池塘养殖中锯缘青蟹因打斗而造成死亡率高及难以捕捉的问题, 同时可利用附着在红树植物上的藤壶、牡蛎等贝类作为饵料, 在保护红树林的同时又可以减少部分锯缘青蟹饵料的投入。林沛然(2018)在红树林下采用铁笼分别在光滩和红树林下养殖锯缘青蟹, 结果表明红树林下养殖的锯缘青蟹其生长、存活率及肌肉氨基酸营养价值优于光滩组。其他一些研究也表明不同盐度、饵料及养殖模式下养殖的拟穴青蟹肌肉中氨基酸及脂肪酸组成存在一定的差异(王雪锋等, 2010; 黄爱霞等, 2020; 黄伟卿等, 2020; 徐梦谦等, 2021; 方伟等, 2022)。目前有关红树林浮岛养殖拟穴青蟹养殖模式及产品营养价值的研究较少, 本研究对红树林浮岛养殖模式下拟穴青蟹的生长及营养成分进行测定分析, 采用营养生化指标对拟穴青蟹肌肉的营养价值进行评价, 为拟穴青蟹的新养殖模式可行性评估提供参考数据。
1 材料与方法
1.1 试验样地
试验样地位于福建省东山湾北面漳州市漳浦县高林村的海水土质池塘(23°54′39″N, 117°34′29″E), 池塘平均水深为1.5 m, 面积大小约为0.28 hm2。池塘与海水甬道之间设置进排水闸。
1.2 试验池红树林浮岛的构建
在人工养殖池塘底部四周挖出一条环形沟渠, 池底中央留出一高于环沟的平台作为养殖试验区。将平台分为三个养殖区: 分别记为A区(红树林)、B区(海马齿)和C区(空白对照), 分别使用围网将三个养殖区围住, 两个相邻养殖区之间留出宽约1.2 m的过道, 方便小船驶入投喂饵料。每隔1 m用竹竿固定围网, 围网高2 m, 埋入土壤0.2 m, 网体的顶面高于池塘最高水位, 如图1、图2所示。每个养殖区再使用隔网均分为三个小养殖区, 设置为三个平行试验组, 中间隔网尽量与围网固定紧凑, 不留出空隙, 避免拟穴青蟹活动至相邻小养殖区。每个小养殖区中放置一使用塑料泡沫制成的浮岛, 其中A区的三个浮岛均种植红树植物秋茄, B区的三个浮岛上种植海马齿, C区设置空白浮岛, 不种植任何植物, 作为试验对照。浮岛上使用底部留有透气孔的花盆种植, 放置于浮岛上的孔洞处, 每个浮岛上可种植216株秋茄或海马齿。浮岛面积与养殖水体面积之比约为1︰2, 使放置的浮岛既可以达到净化水体的目的, 又可提供拟穴青蟹日晒和栖息, 达到生态养殖的目标。

图1 红树林浮岛人工养殖池俯视图
注: 10代表养殖池; 20代表浮岛养殖区; 21代表浮岛; 22代表秋茄

图2 红树林浮岛人工养殖池侧视图
注: 10代表养殖池; 11代表环沟; 21代表浮岛; 22代表秋茄; 23代表隔网; 30代表拟穴青蟹
1.3 试验苗种
拟穴青蟹苗种来源于福建省漳州市漳浦县高林村当地渔民海捕的野生种苗。选择苗种为仔蟹Ⅰ~Ⅱ期。放养前用漂白粉及生石灰粉消毒试验池, 蟹苗放养前用5 mg/kg高锰酸钾溶液喷淋消毒。
1.4 养殖试验设计与管理
红树林浮岛养殖的拟穴青蟹共设置4个试验组, 分别为A区的红树林浮岛组、B区的海马齿浮岛组、C区的空白浮岛组和外围环沟组(图3、图4、图5), 每个试验组设3个重复, 共设置9个养殖小区, 每个小养殖区用渔网分隔, 面积大小约为0.13 hm2, 每个小养殖区各放养1 000只蟹苗。放苗后3 d内不投喂饵料, 放苗后第5天开始投喂对虾0号料和剁碎的小杂鱼, 放苗一个月后投喂当地渔民捕获的红肉河蓝蛤。每日投饵1次, 选择在清晨或傍晚时投喂, 投喂时将一小部分饵料放置于饵料台, 以便观察拟穴青蟹摄食及生长情况, 其余大部分饵料均匀投撒于每个网格及外围环沟中。投饵量以饱食为宜, 而遇寒冷天气时, 拟穴青蟹的摄食量会相对减少, 此时应适量减少饵料的投喂量, 特别是在蜕壳期间, 应少投料或不投料。每天需对闸门及围网进行检查看是否有破损。每10~15 d换水1次, 换水量不超过池塘水体的1/3。试验期间海水温度约为(32±3.5) °C, 盐度在9~13之间, 溶解氧4.62 mg/L以上。养殖周期为120 d。

图3 红树林浮岛

图4 海马齿浮岛

图5 空白浮岛
1.5 拟穴青蟹肌肉样品的采集与保存
养殖试验结束时, 清池捕捉拟穴青蟹, 计数各试验组存活拟穴青蟹数量以计算存活率。然后每组随机选取9只活蟹放在塑料桶中的过滤海水中暂养, 采集同批苗在周围池塘养殖(池塘组)和同期野生捕获的拟穴青蟹肌肉(野生组)作为对照组, 使用冰水将拟穴青蟹麻醉, 用抄网捞出, 采用吸水纸擦干体表水分, 称重并测量拟穴青蟹头胸甲长度。用解剖工具拆开大螯和步足, 慢慢地刮出大螯和步足肌肉, 再剪开头胸甲底部内骨骼, 刮出里面的肌肉, 最后将两部分肌肉混合进行称重, 并将取出的拟穴青蟹肌肉装在标记好的自封袋中, 于–20 °C冰箱冷冻保存, 用于肌肉营养成分分析。所有样品带回实验室进行分析测定。
1.6 生长指标计算方法
相关生长指标计算见下式:
增重率(weight gain ratio, WGR, %)=
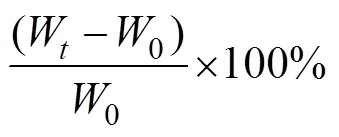
特定生长率(specific growth rate, SGR, %/d)=


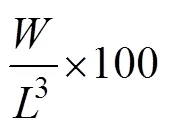

式中,0(单位: g)为拟穴青蟹的初始总重量;W(单位: g)为养殖试验结束后的拟穴青蟹终末总重量;(单位: d)为饲养天数;N为试验结束时存活的拟穴青蟹数量;N为试验开始时放养的拟穴青蟹数量;(单位: cm)为青蟹头胸甲长;1为单只拟穴青蟹肌肉重;(单位: g)为单只拟穴青蟹重量。
1.7 肌肉营养成分的测定和评价
1.7.1 肌肉常规营养成分测定 粗蛋白含量的测定采用凯氏定氮法(GB5009.5-2016); 粗脂肪含量的测定采用索氏抽提法(GB5009.6-2016); 粗灰分含量的测定采用马弗炉550 °C高温灼烧法(GB5009.4- 2016); 水分含量的测定采用105 °C烘箱恒温干燥法(GB5009.3-2016)。
1.7.2 肌肉氨基酸测定 每组拟穴青蟹肌肉经搅碎混匀干燥后先用6 mol/L盐酸在110 °C中对样品进行水解, 然后用日立L-8800氨基酸自动分析仪进行测定(GB5009.124-2016)。
1.7.3 肌肉脂肪酸测定 肌肉样品冷冻干燥后, 取适量先用氯仿甲醇混合液提取脂肪后, 经加碱皂化后用14%的三氟化硼-甲醇溶液甲酯化后用正己烷萃取上清液, 再用装有无水氯化钙的漏斗过滤, 滤过水分后用岛津GC2010气相色谱仪进行脂肪酸分析, 用峰面积归一法求出各脂肪酸相对含量(GB5009. 168-2016)。
1.7.4 肌肉营养价值评价方法 根据联合国粮食及农业组织(FAO)和世界卫生组织(WHO)在1973年建议的每克氮氨基酸评分标准模式(FAO/WHO, 1973)和中国预防医学科学院营养与食品卫生研究所提出的鸡蛋蛋白评分标准模式(王光亚, 1991)进行肌肉营养价值评定, 肌肉的氨基酸评分(Amino acid score, AAS)、化学评分(Chemistry score, CS)、必需氨基酸指数(Essential amino acid index, EAAI)计算见下式(6)、(7)、(8):


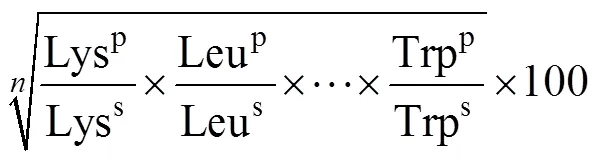
式中, mg/g N为每克氮中氨基酸的毫克数(肌肉氨基酸含量×62.5/肌肉蛋白质的百分含量);为比较的必需氨基酸数; p为待测蛋白; s为鸡蛋蛋白。
1.8 数据统计与分析
试验数据经SPSS 22.0软件进行单因素方差统计分析, 用Duncan检验法进行检验比较(显著水平=0.05,<0.05为差异显著), 结果以平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 拟穴青蟹的生长与成活率
不同养殖模式下拟穴青蟹的养殖性状见表1。经120 d养殖试验, 红树林浮岛组拟穴青蟹的增重率(1267.02%)最低且与其他三组相比存在显著性差异(<0.05), 最高为空白浮岛组(2955.37%); 各组之间拟穴青蟹肥满度无显著性差异(>0.05); 海马齿浮岛组出肉率最高(30.39%), 与外围环沟组(30.24%)和空白浮岛组(30.17%)两组之间无显著性差异(>0.05), 红树林浮岛组的出肉率(19.85%)显著低于其他组(<0.05); 各组拟穴青蟹存活率在55.89%~56.51%之间, 且无显著性差异(>0.05)。
表1 各试验组拟穴青蟹的养殖性状测定结果

Tab.1 The results of the breeding traits of S. paramamosain in different experimental groups
注: 同行数据右上角标注的不同小写字母表示差异显著(<0.05)
2.2 拟穴青蟹肌肉的常规营养成分
各试验组拟穴青蟹肌肉常规营养成分分析结果如表2所示。在粗蛋白含量上, 各组均存在显著性差异(<0.05), 红树林浮岛组(71.66%)>海马齿浮岛组(71.39%)>空白浮岛组(66.86%)> 野生组(64.90%)>外围环沟组(64.78%)。野生组青蟹肌肉的脂肪含量最高(3.01%), 显著高于其他组(<0.05), 红树林浮岛组(2.52%)与外围环沟组(2.48%)不存在显著性差异(>0.05); 外围环沟组拟穴青蟹肌肉粗灰分最高(11.18%), 空白浮岛组最低(7.79%), 红树林浮岛组(11.08%)与外围环沟组(11.18%)不存在显著性差异(>0.05), 其余四组均存在显著性差异(<0.05); 在水分含量上, 外围环沟组最高(88.13%), 红树林浮岛组最低(81.43%), 空白浮岛组(85.47%)与海马齿浮岛组(85.36%)不具有显著性差异(>0.05), 其余各组间均存在显著性差异(<0.05)。
表2 各试验组拟穴青蟹肌肉常规营养成分分析结果(干重,=3, %)

Tab.2 Proximate compositions in muscle of S. paramamosain cultured in different experimental groups (dry weight, n=3, %)
注: 同列数据右上角标注的不同小写字母表示差异显著(<0.05)
2.3 拟穴青蟹肌肉氨基酸组成
拟穴青蟹肌肉中氨基酸组成如表3所示。各组拟穴青蟹肌肉蛋白中均检测出17种氨基酸, 其中包括人体7种必需氨基酸苏氨酸(Thr)、缬氨酸(Val)、赖氨酸(Lys)、蛋氨酸(Met)、亮氨酸(Leu)、异亮氨酸(Ile)、苯丙氨酸(Phe), 非必需氨基酸10种。各组拟穴青蟹肌肉中谷氨酸(Glu)含量最高, 其次是天冬氨酸(Asp)、精氨酸(Arg)、甘氨酸(Gly)、丙氨酸(Ala)和赖氨酸(Lys), 含量最低的是胱氨酸(Cys)。氨基酸含量各组间均有显著性差异(<0.05)。从表3中可知, 红树林浮岛组拟穴青蟹肌肉7种人体必需氨基酸含量中Thr、Lys、Leu、Ile、Phe这五种氨基酸高于其他组, 十种非必需氨基酸含量中组氨酸(His)、丝氨酸(Ser)、丙氨酸(Ala)、Asp、Arg含量高于其他组; 野生组拟穴青蟹肌肉中Val和脯氨酸(Pro)高于其他组。
表3 各试验组拟穴青蟹肌肉氨基酸含量及组成(干重,=3, %)

Tab.3 Amino acid composition in muscle of S. paramamosain cultured in different experimental groups (dry weight, n=3, %)
注: *鲜味氨基酸; TEAA: 必需氨基酸总量; TNEAA: 非必需氨基酸总量; TFAA: 鲜味氨基酸总量; TAA: 氨基酸总量。同行数据右上角标注的不同小写字母表示差异显著(<0.05)
在必需氨基酸总量上, 海马齿浮岛组和红树林浮岛组显著高于其他组(<0.05), 从高到低依次为海马齿浮岛组(23.54%)>红树林浮岛组(23.53%)>空白浮岛组(21.43%)>外围环沟组(21.18%)>野生组(21.14%); 红树林浮岛组(45.15%)和海马齿浮岛组(44.70%)拟穴青蟹肌肉中非必需氨基酸总量显著高于其他组(<0.05), 空白浮岛组(40.70%)与野生组(40.32%)之间无显著性差异(>0.05), 与外围环沟组(39.36%)相比具有显著性差异(<0.05)。红树林浮岛组(68.68%)和海马齿浮岛组(68.24%)肌肉氨基酸总量最高且显著高于其他组(<0.05), 野生组(61.46%)和外围环沟组(60.54%)之间不具有显著性差异(>0.05)。红树林浮岛组鲜味氨基酸含量(28.98%)显著高于空白浮岛组(25.90%)和外围环沟组(24.39%)。
各组拟穴青蟹肌肉中TEAA/TAA值范围在34.26%~34.97%, 但各组之间无显著性差异(>0.05)。空白浮岛组(65.50%)和海马齿浮岛组(65.50%)拟穴青蟹肌肉TNEAA/TAA最高, 最低为外围环沟组(65.03%), 各组之间无显著性差异(>0.05), 各组蟹肉TNEAA/TAA均接近65%。各组拟穴青蟹肌肉TEAA/TNEAA无显著性差异, 从高到低依次为外围环沟组(53.82%)>空白浮岛组(52.67%)>海马齿浮岛组(52.66%)>野生组(52.43%)>红树林浮岛组(52.11%)。
2.4 拟穴青蟹肌肉中氨基酸营养价值评价
根据表3各试验组拟穴青蟹肌肉中氨基酸含量和FAO/WHO评分标准模式以及全鸡蛋蛋白质模式中的同种氨基酸含量, 分别计算出各组拟穴青蟹肌肉蛋白质的AAS、CS和EAAI。由表4可知, 不同养殖模式下拟穴青蟹的第一限制性氨基酸均为Met+Cys, 第二限制性氨基酸为Val, 第三限制性氨基酸为Leu, Lys的AAS和CS评分最高, 均大于1; Tyr+Phe的AAS较高; Thr的CS较高。EAAI值从高到低依次为外围环沟组(82.63)>海马齿浮岛组(80.21)>野生组(78.01)>空白浮岛组(77.30)>红树林浮岛组(76.86)。
表4 各试验组拟穴青蟹肌肉氨基酸营养价值评分结果
2.5 拟穴青蟹肌肉中脂肪酸组成
各试验组拟穴青蟹肌肉中脂肪酸组成见表5。从拟穴青蟹肌肉中共检测出19种脂肪酸, 包括5种饱和脂肪酸(SFA), 5种单不饱和脂肪酸(MUFA), 10种多不饱和脂肪酸(PUFA)。拟穴青蟹肌肉中的棕榈酸(C16:0)相对含量最高, 其次是EPA (C20:5n-3)、DHA (C22:6n-3), 含量最低的是C22:1n-9、C20:3n-3, 各种脂肪酸组间均存在显著差异(<0.05)。
从脂肪酸组成来看, 野生组和外围环沟组拟穴青蟹肌肉中的饱和脂肪酸总量(ΣSFA)基本一致并且最高, 与其他组相比具有显著性差异(<0.05), 红树林浮岛组饱和脂肪酸总量最低; 各组拟穴青蟹肌肉中单不饱和脂肪酸总量(ΣMUFA)和多不饱和脂肪酸总量(ΣPUFA)都有显著差异(<0.05), ΣMUFA从高到低顺序为: 海马齿浮岛组(16.06%)>野生组(15.33%)>空白浮岛组(14.73%)>红树林浮岛组(14.72%)>外围环沟组(14.35%), ΣPUFA从高到低顺序为: 红树林浮岛组(54.11%)>外围环沟组(53.19%)>空白浮岛组(53.11%)>海马齿浮岛组(51.07%)>野生组(44.19%)。红树林浮岛组拟穴青蟹肌肉中Σn-3PUFA最高(31.62%), 显著高于其他组(<0.05); 空白浮岛组拟穴青蟹肌肉中Σn-6PUFA最高(23.87%), 且显著高于其他组(<0.05)。红树林浮岛组的EPA+DHA含量最高, 且显著高于其他组(<0.05)。n-6/n-3PUFA从小到大排序为: 空白浮岛组(1.23%)<外围环沟组(1.39%)<红树林浮岛组(1.41%)<海马齿浮岛组(1.42%)<野生组(1.48%)。
表5 各试验组拟穴青蟹肌肉脂肪酸组成(干重,=3, %)

Tab.5 The muscle fatty acids compositions of S. paramamosain in experimental groups (dry weight, n=3, %)

续表
注: ΣSFA: 饱和脂肪酸总量; ΣMUFA: 单不饱和脂肪酸总量; ΣPUFA: 多不饱和脂肪酸总量。同行数据右上角标注的不同小写字母表示差异显著(<0.05)
3 讨论
3.1 不同养殖模式下拟穴青蟹生长及存活率比较分析
水产动物的生长受遗传、饵料营养、生活环境等诸多因素的影响(Foss, 2003)。本研究采用同一批苗种、投喂相同饵料, 比较不同养殖模式下拟穴青蟹的生长性能, 结果显示, 空白浮岛组生长性能优于其他组; 比较浮岛组和外围环沟组可知, 除红树林浮岛组外, 其余浮岛养殖组均优于外围环沟养殖组, 其原因可能如下。
一是水深对拟穴青蟹的影响, 养殖池塘整体呈现斜坡状, 离闸门越近, 水位越高, 红树林浮岛组在整个池塘底部平台最高处, 养殖水深在各组中最浅, 拟穴青蟹属于变温动物, 其生长发育与水温有密切关系, 而池水水深对温度有重要的影响, 水深越浅, 水温受气温影响变化幅度越大。根据贾秋红等(2015)的实验可以看出水深在30 cm左右的池塘养殖中华绒螯蟹()苗种成活率最低; 曾朝曙等(1991)的研究也表明水温度超过锯缘青蟹溞状幼体适宜温度时, 会对其生长发育造成明显的影响; 此外, 水位浅光照强度较大, 可能会影响拟穴青蟹的摄食及产生一定应激作用, 对拟穴青蟹生长也会产生一定负面影响(Wang, 2004; 张胜负等, 2011)。二是养殖水体对拟穴青蟹的影响, 本试验使用的浮岛为泡沫材质, 空白浮岛组养殖区浮岛上未种植植物, 浮岛漂浮于水面上, 而红树林浮岛和海马齿浮岛上种植216株秋茄和海马齿, 使红树林浮岛和海马齿浮岛较多部分沉入养殖水体中, 减少拟穴青蟹生存、活动空间, 可能会影响青蟹的生长(Yu, 2022)。本试验中, 空白浮岛组生长情况优于红树林浮岛组、海马齿浮岛组和外围环沟组, 并显著高于红树林浮岛组, 说明了池塘养殖中适宜的水深和充足的生存空间直接影响着拟穴青蟹生长。
肥满度反映了水产动物生长情况以及可食用部分所占比例。方伟等(2022)测定140日龄池塘养殖的拟穴青蟹(平均体重173.77 g)的肥满度, 结果显示肥满度在0.49~0.53 g/cm3之间, 本试验养殖120 d各组拟穴青蟹肥满度与之接近, 并且较为肥满。
3.2 不同养殖模式下拟穴青蟹肌肉常规营养成分的比较分析
本研究结果显示红树林浮岛组拟穴青蟹肌肉中粗蛋白含量略高于海马齿浮岛组且均高于70%, 与其他组相比存在显著性差异(<0.05), 这与林沛然(2018)红树林下养殖锯缘青蟹粗蛋白含量最高结果类似, 其原因可能是红树林及海马齿起到净化水体、聚集悬浮颗粒及生物聚群作用, 生物饵料种类多样, 拟穴青蟹能摄食到充足且营养较均衡的食物, 提高体蛋白质的合成效率, 提高肌肉中蛋白质的沉积。本研究中, 不同养殖模式对拟穴青蟹肌肉中粗脂肪含量影响显著, 其中野生组粗脂肪含量最高, 为3.01%, 其余组脂肪含量在2.48%~2.93%之间, 与林沛然(2018)、孙丽慧等(2019)的研究结果类似。野生青蟹在自然环境中, 摄食到生物饵料种类广泛, 不同饵料脂肪含量差异较大, 而在池塘养殖中, 拟穴青蟹的主要食物为人工投喂的红肉河蓝蛤和螺蛳, 这些贝类一般蛋白含量高, 脂肪含量较低。且拟穴青蟹栖息地相对集中, 容易造成拟穴青蟹争食斗殴, 活动量上升, 消耗更多脂肪作为能量来源, 致使体内存储的脂肪含量下降。
3.3 不同养殖模式下拟穴青蟹肌肉氨基酸组成
蛋白质是一切生命的物质基础, 其基本单位是氨基酸。氨基酸种类、含量及必需氨基酸和非必需氨基酸的比例是评价蛋白质营养价值的主要依据(颜孙安等, 2021)。本试验中各组拟穴青蟹肌肉中共检出17种氨基酸, 且在含量上均存在显著性差异(<0.05), 其中Glu、Asp、Arg、Gly、Val、Leu、Ala含量较高, 这与锯缘青蟹(林沛然, 2018)、细点圆趾蟹() (卜俊芝, 2012)、三疣梭子蟹() (杨家岳等, 2021)、中华绒螯蟹(Chen, 2007)的研究结果类似。
食物蛋白质营养价值高低取决于蛋白质含量及氨基酸组成, 特别是8种人体必需氨基酸的含量与比例。本试验各组拟穴青蟹肌肉中必需氨基酸Lys含量最高, 其次为Leu; 其中Lys含量远高于FAO/WHO模式且为全鸡蛋蛋白质模式1.08倍。Lys作为生长性氨基酸, 主要参与机体的蛋白质合成, 促进人体的生长发育; Leu可以控制血糖含量, 当人体缺少葡萄糖时, Leu可以快速分解并转化为葡萄糖。由此可见拟穴青蟹不仅滋味鲜美, 同时还具有较高的营养价值。本试验红树林浮岛组拟穴青蟹肌肉中TAA含量最高(68.68%), 表明红树林下养殖拟穴青蟹肌肉蛋白质营养优于其他养殖模式。究其原因, 可能是生活环境、饵料种类不同造成(黄爱霞等, 2020)。相对于传统池塘养殖, 本试验在改造后的池塘中采用红树林生态浮岛养殖模式, 养殖环境与饵料生物组成发生较大变化。本试验各组拟穴青蟹肌肉中总必需氨基酸占总氨基酸(TEAA/TAA)的比例均高于34%, 与FAO/ WHO提出的理想蛋白质模式中TEAA/TAA应为40%左右接近。必需氨基酸均占非必需氨基酸(TEAA/ TNEAA) 51%以上, 这与FAO/WHO提出的参考理想蛋白质标准模式中EAA/NEAA应为60%相接近, 表明拟穴青蟹的氨基酸比例适合人体对氨基酸营养的需求。
在TAA含量上, 红树林浮岛组和海马齿浮岛组接近且显著高于其他组(<0.05), 红树林浮岛组和海马齿浮岛组TAA含量接近, 均高于野生组, 表明红树林下养殖的拟穴青蟹的肌肉蛋白质营养高于野生青蟹。红树林浮岛组拟穴青蟹肌肉中的TAA含量高于红头矮蟹() (Jun, 2019)、三疣梭子蟹(郭亚男等, 2020)、南极磷虾() (方兵等, 2018)等, 由此可见, 拟穴青蟹相对于其他甲壳类水产动物氨基酸含量较高, 是一种营养价值较高的海水蟹类。
限制性氨基酸是指食物中需氨基酸含量和机体所需必需氨基酸量相比, 比值较低, 限制了机体对其他必需氨基酸和非必需氨基酸的利用。采用1973年FAO/WHO共同建议的必需氨基酸评分模式和全鸡蛋蛋白质氨基酸评分模式计算出各组的AAS和CS, 结果表示拟穴青蟹的第一限制性氨基酸为Met+Cys, 第二限制性氨基酸为Val, 这与林沛然(2018)的研究结果类似。究其原因, 是因为养殖时投喂的红肉河蓝蛤Met、Cys含量较低(金榕等, 2019)。而Met、Cys、Val三种氨基酸是拟穴青蟹最主要的限制性氨基酸, 会影响到拟穴青蟹对其他氨基酸的利用, 因此, 在拟穴青蟹养殖中应投喂一些富含Met、Cys、Val的饵料, 以提高拟穴青蟹对氨基酸的利用率, 促进其生长发育和抗病能力。在两种评分模式中Lys最高, 评分结果大于1, 说明各组拟穴青蟹肌肉中Lys含量超过了FAO/WHO推荐的标准模式谱(FAO/WHO, 1973)。根据FAO/WHO和全鸡蛋蛋白质标准模式, 拟穴青蟹肌肉蛋白中必需氨基酸组成比例平衡, 含量十分丰富, 是一种风味和营养俱佳的良好蛋白源。各养殖组拟穴青蟹肌肉必需氨基酸指数(EAAI)均高于0.75, 且高于或相近野生组, 表明养殖拟穴青蟹肌肉具有较高氨基酸营养价值。
3.4 不同养殖模式下拟穴青蟹肌肉脂肪酸组成
脂质是机体主要储存能量的物质, 尤其是多不饱和脂肪酸与生物的生长繁殖密切相关, 而脂肪酸是作为评价肌肉营养价值的主要指标之一, 是人体不可或缺的重要营养成分(刘志东等, 2014)。有研究指出, 海洋生物不饱和脂肪酸组成受到食物、环境条件、激素、遗传等因素的影响(谢帝芝等, 2013)。本试验中, 各组拟穴青蟹肌肉中共检出19种脂肪酸。野生组和外围环沟组拟穴青蟹肌肉中ΣSFA含量最高, 红树林浮岛组最低。其中饱和脂肪酸C16:0含量最高, 这与锯缘青蟹(林沛然, 2018)、椰子蟹() (Sato, 2015)、勘察加拟石蟹() (Dvoretsky, 2021)的研究结果相似。
海马齿浮岛组拟穴青蟹肌肉ΣMUFA最高, 野生组次之, 红树林浮岛组与空白浮岛组接近且略低于野生组。其中C18:1n-9含量海马齿浮岛组最高, 红树林浮岛组高于野生组, 略低于空白浮岛组。本试验各组拟穴青蟹肌肉单不饱和脂肪酸C18:1n-9含量与锯缘青蟹(林沛然, 2018)、红螯螯虾() (罗钦, 2021)接近。C18:1n-9具有降低血糖和胆固醇、调节血脂的作用, 除此之外还能保护心肌细胞的完整性。因此, 从ΣMUFA含量上可以看出红树林浮岛养殖的拟穴青蟹要优于野生拟穴青蟹。多不饱和脂肪酸(PUFA)是评价肉类脂肪营养价值高低重要的指标之一, 尤其是n-3PUFA常被认为是哺乳动物必需的营养物质(王亚娜, 2022)。本试验中, 各组拟穴青蟹肌肉中均含有较高含量的ΣPUFA, 其中二十碳五烯酸(C20:5n-3, EPA)和二十二碳六烯酸(C22:6n-3, DHA)含量在多种PUFA中占比最高。EPA和 DHA能降低血液中的胆固醇, 改善血液循环, 预防心血管疾病; 可以促进癌细胞的凋亡; DHA还是大脑和视网膜的主要构成成分(石雨等, 2014)。本研究结果显示, 红树林浮岛组拟穴青蟹肌肉中DHA含量最高, EPA含量和EPA+DHA高于野生组, 这与黄苏红等(2018)报道锯缘青蟹的肌肉中DHA、EPA的含量接近。
PUFA中n-3PUFA/n-6PUFA的比值可以反映食物脂肪酸营养价值(Burlingame, 2009)。有研究表明, 海洋甲壳类动物n-3PUFA的含量高于 n-6PUFA, n-3PUFA/n-6PUFA的比值在1~3之间(Mourente, 1996)。本试验中, 各组拟穴青蟹肌肉中n-3PUFA的含量高于n-6PUFA的含量, 并且n-3PUFA/n-6PUFA的比值在1.23~1.50之间。其中空白浮岛组n-3PUFA/ n-6PUFA的比例最低为1.23, 红树林浮岛组与海马齿浮岛组的比例均在1.4左右, 野生组的比例在1.5左右。Gill等(1997)的研究指出, n-3PUFA/n-6PUFA的理想摄入比例是1︰4~1︰10。而本试验中拟穴青蟹n-3PUFA含量高于n-6PUFA含量。表明拟穴青蟹可以作为一种优质的n-3PUFA来源以改善高比值n-6/ n-3人群膳食结构, 有利于身体健康。
4 结论
空白浮岛组拟穴青蟹的增重率、特定生长率和出肉率均高于其他实验组, 各实验组拟穴青蟹肌肉粗蛋白含量(64.78%~71.66%)较高, 粗脂肪含量(2.48%~ 3.01%)较低。其中红树林浮岛组拟穴青蟹肌肉蛋白含量显著高于野生组(<0.05)。野生组拟穴青蟹肌肉的粗脂肪含量显著高于其他组(<0.05); 外围环沟组拟穴青蟹肌肉灰分最高, 空白浮岛组最低, 红树林浮岛组与外围环沟组不存在显著性差异(>0.05), 其余四组均存在显著性差异(<0.05); 外围环沟组拟穴青蟹肌肉水分含量最高, 红树林浮岛组最低, 其余各组间均存在显著性差异(<0.05)。
各组拟穴青蟹肌肉蛋白中均检测出17种氨基酸, Glu含量最高, 其次是Asp、Arg、Gly、Ala和Lys, Cys的含量最低。红树林浮岛组拟穴青蟹肌肉7种必需氨基酸含量中Thr、Lys、Leu、Ile、Phe五种氨基酸显著高于其他组(<0.05); 红树林浮岛组拟穴青蟹肌肉氨基酸总量、必需氨基酸总量、非必需氨基酸总量、鲜味氨基酸含量均显著高于其他组(<0.05)。各组拟穴青蟹肌肉的TAEE均高于FAO/WHO标准, 但低于全鸡蛋蛋白质标准; 拟穴青蟹肌肉第一限制性氨基酸均为Met+Cys。
从拟穴青蟹肌肉中共检测出19种脂肪酸, 包括5种饱和脂肪酸(SFA), 5种单不饱和脂肪酸(MUFA), 10种多不饱和脂肪酸(PUFA)。拟穴青蟹肌肉中的棕榈酸(C16:0)相对含量最高, 其次是EPA (C20: 5n-3)、DHA (C22:6n-3), 含量最低的是C22:1n-9、C20:3n-3, 各种脂肪酸组间均存在显著差异(<0.05)。野生组和外围环沟组拟穴青蟹肌肉中的ΣSFA显著高于其他组(<0.05); 海马齿浮岛组拟穴青蟹肌肉中ΣMUFA显著高于其他组(<0.05); 红树林浮岛组拟穴青蟹肌肉中ΣPUFA、Σn-3PUFA、EPA+DHA最高; 空白浮岛组拟穴青蟹肌肉中Σn-6PUFA最高, 且均显著高于其他组(<0.05)。
卜俊芝, 2012. 三种海蟹营养和风味成分的研究[D]. 杭州: 浙江工商大学: 14.
王友绍, 2021. 全球气候变化对红树林生态系统的影响、挑战与机遇[J]. 热带海洋学报, 40(3): 1-14.
王亚娜, 2022. ω-3多不饱和脂肪酸改善高温环境诱导小鼠的热应激、炎症反应及脂质代谢紊乱的作用[D]. 呼和浩特: 内蒙古医科大学: 47.
王光亚, 1991. 食物成分表(全国代表值)[M]. 北京: 人民卫生出版社: 38.
王雪锋, 顾鸿鑫, 郭倩琳, 等, 2010. 海水和淡水养殖锯缘青蟹的营养成分分析[J]. 食品科学, 31(23): 386-390.
方伟, 刘磊, 常雯, 等, 2022. 盐碱水和海水养殖条件下的拟穴青蟹生长和营养成分比较分析[J]. 水产学报, 46(11): 2143-2157.
方兵, 施文正, 汪之和, 等, 2018. 捕捞月份对南极磷虾营养成分的影响[J]. 食品工业科技, 39(23): 17-22.
石雨, 田媛, 李磊, 等, 2014. EPA、DHA的生理功能及提取方法的研究进展[J]. 黑龙江科学, 5(10): 24-25, 23.
刘志东, 陈雪忠, 曲映红, 等, 2014. 南极冰鱼与南极磷虾营养成分分析及比较[J]. 现代食品科技, 30(2): 228-233.
孙丽慧, 林锋, 黄爱霞, 等, 2019. 拟穴青蟹雄蟹蜕壳周期肌肉与肝胰腺营养变化趋势[J]. 海洋渔业, 41(6): 694-703.
李振良, 谢群, 曾珍, 等, 2021. 湛江观海长廊红树林土壤-植物体系重金属富集与迁移规律[J]. 热带地理, 41(2): 398-409.
杨家岳, 程镇燕, 黄亚冬, 等, 2021. 饲料不同蛋白和脂肪水平对三疣梭子蟹生长性能、免疫功能和氨基酸组成的影响[J]. 饲料研究, 44(21): 57-63.
吴瑞, 2016. 红树林区大型底栖动物研究进展[J]. 热带农业科学, 36(10): 109-113.
张胜负, 蒋科技, 顾孝连, 等, 2011. 光照强度对拟穴青蟹幼体生长及能量收支的影响[J]. 海洋渔业, 33(2): 187-194.
陈忠, 2007. 广东省红树林生态系统净化功能及其价值评估[D]. 广州: 华南师范大学.
林沛然, 2018. 红树林下人工养殖拟穴青蟹养殖性状及营养成分研究[D]. 厦门: 集美大学: 24-32.
罗钦, 2021. 3种养殖模式下澳洲淡水龙虾肌肉脂肪酸品质比较[J]. 西北农林科技大学学报(自然科学版), 49(9): 22-29.
金榕, 王佳虹, 孔美兰, 2019. 红肉河蓝蛤软体部营养成分分析与评价[J]. 教育教学论坛(30): 70-72.
贾秋红, 陈晓霞, 陈媛媛, 等, 2015. 水深和盐度对河蟹苗种培育成活率的影响[J]. 河北渔业(11): 8-10.
徐梦谦, 邬伊田, 张丽, 等, 2021. 饵料种类对青蟹生长和营养品质的影响[J]. 饲料工业, 42(6): 41-45.
郭亚男, 胡园, 韩刚, 等, 2020. 两种不同产地养殖三疣梭子蟹肌肉中营养成分比较[J]. 中国食物与营养, 26(12): 45-50.
黄伟卿, 林小金, 钟传明, 等, 2020. 软颗粒饲料对拟穴青蟹成活、生长和肌肉氨基酸组分的影响[J]. 水产学杂志, 33(6): 44-49.
黄苏红, 李晔, 通旭婷, 等, 2018. 3种经济蟹类肌肉、肝胰腺及生殖腺中脂肪酸的比较研究[J]. 水产科学, 37(5): 647-652.
黄爱霞, 林锋, 孙丽慧, 等, 2020. 野生和养殖拟穴青蟹营养品质比较分析[J]. 湖北农业科学, 59(6): 139-142.
曾尚伟, 吴喜标, 裴琨, 2011. 红树林滩涂瓦缸养殖锯缘青蟹关键技术[J]. 中国水产(1): 43-44.
曾朝曙, 王桂忠, 李少菁, 1991. 锯缘青蟹胚胎发育的观察及温度影响胚胎发育的研究[J]. 福建水产(1): 45-50.
谢帝芝, 王树启, 游翠红, 等, 2013. 鱼类高度不饱和脂肪酸合成的影响因素及其机理[J]. 中国水产科学, 20(2): 456-466.
颜孙安, 林香信, 李巍, 等, 2021. 闽产食用菌的氨基酸组成特征及其营养评价[J]. 食品安全质量检测学报, 12(19): 7723-7731.
ADAME M F, NEIL D, WRIGHT S F,, 2010. Sedimentation within and among mangrove forests along a gradient of geomorphological settings [J]. Estuarine, Coastal and Shelf Science, 86(1): 21-30.
BURLINGAME B, NISHIDA C, UAUY R,, 2009. Fats and fatty acids in human nutrition: introduction [J]. Annals of Nutrition and Metabolism, 55(1/2/3): 5-7.
CHEN D W, ZHANG M, SHRESTHA S, 2007. Compositional characteristics and nutritional quality of Chinese mitten crab () [J]. Food Chemistry, 103(4): 1343-1349.
DVORETSKY A G, BICHKAEVA F A, BARANOVA N F,, 2021. Fatty acid composition of the Barents Sea red king crab () leg meat [J]. Journal of Food Composition and Analysis, 98: 103826.
FAO/WHO, 1973. Energy and protein requirements [R]. Rome: FAO: 40-73.
FOSS A, RØSNES B A, ØIESTAD V, 2003. Graded environmental hypercapnia in juvenile spotted wolffish (Olafsen): effects on growth, food conversion efficiency and nephrocalcinosis [J]. Aquaculture, 220(1/2/3/4): 607-617.
GILL I, VALIVETY R, 1997. Polyunsaturated fatty acids, part 1: occurrence, biological activities and applications [J]. Trends in Biotechnology, 15(10): 401-409.
JUN J Y, JUNG M J, JEONG I H,, 2019. Effects of a freeze-thaw-pressing muscle separation on the biochemical quality and self-stability of leg meat from red snow crab () [J]. LWT, 99: 276-282.
LIU H X, REN H, HUI D F,, 2014. Carbon stocks and potential carbon storage in the mangrove forests of China [J]. Journal of Environmental Management, 133: 86-93.
MOURENTE G, 1996.metabolism of14C-polyunsaturated fatty acids in midgut gland and ovary cells fromForskâl at the beginning of sexual maturation [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 115(2): 255-266.
RAHMAN M S, HOSSAIN M B, BABU S M O F,, 2019. Source of metal contamination in sediment, their ecological risk, and phytoremediation ability of the studied mangrove plants in ship breaking area, Bangladesh [J]. Marine Pollution Bulletin, 141: 137-146.
SATO T, OHGAMI S, KANENIWA M, 2015. Differences in compositions of free amino acids, nucleotide-related compounds, and fatty acids between sexes of the coconut crabin Okinawa, Southwest Japan [J]. Fisheries Science, 81(3): 569-579.
WANG F, DONG S L, DONG S S,, 2004. The effect of light intensity on the growth of Chinese shrimp[J]. Aquaculture, 234(1/2/3/4): 475-483.
WONG Y S, TAM N F Y, 1995. Asia-Pacific Symposium on Mangrove Ecosystems [M]. Boston: Kluwer Academic Publishers, 193-202.
YU K J, SHI C, LIU X Z,, 2022. Tank bottom area influences the growth, molting, stress response, and antioxidant capacity of juvenile mud crab[J]. Aquaculture, 548: 737705.
STUDIES ON GROWTH AND NUTRIENT COMPOSITION OFCULTURED IN FLOATING MANGROVE ISLAND, FUJIAN
LI Yuan-Yue1, 2, BAI Hao1, 2, CHEN Rong-Bin1, 2, CHEN Zheng-Qiang1, 2, XIAO Zhen1, 2, PAN Huang-Jie1, 2, LI Xiang-Wei1, 2, CHEN Feng-Lin1, 2, WANG Qiu-Rong1, 2
(1. Fisheries College, Jimei University, Xiamen 361021, China; 2. Key Laboratory of Marine Fishery Resources and Ecological Environment in Fujian Province, Xiamen 361021, China)
To explore the difference in nutrient composition ofbetween wild and cultured (in mangrove floating island in mariculture ponds), fourbreeding groups were set up for experiment in the north of Dongshan Bay, Fujian, South China. They were mangrove () floating island culture group (MG),floating island culture group (SG), no-plant floating island culture group (NG), and peripheral ring ditch culture group (PG). The experiment lasted for 120 days. The muscle nutrients of wildcaptured near the experimental site (wild group, WG) were analyzed and compared. Results show that the weight gain rate, specific growth rate, meat production rate, and survival rate ofin the BG were higher than those in the MG, SG, and PG. The crude protein content in muscle of all the four experimental groups was high (64.78%~71.66%), while the crude lipid content was low (2.48%~3.01%). The total amino acids in the muscle ofin MG ranged from 60.54% to 68.68%. The total amino acids and essential amino acids in muscle were significantly higher than those of WG (<0.05). Indicated by the amino acid score (AAS) and chemical score (CS), the first limiting amino acid was methionine + cystine, and the essential amino acid index (EAAI) of each group was above 0.75. Unsaturated fatty acids, especially polyunsaturated fatty acids, were abundant in all experimental groups; and those of MG were significantly higher than WG’s (<0.05).
mangroves; crab; muscle nutrients composition; amino acids; fatty acids
* 福建省产学合作重大项目, 2021Y4013 号; 福建省引导性项目, 2022N0015号。李元跃, 博士, 教授, E-mail: yuanyueli@ 163.com
王秋荣, 硕士生导师, 副教授, E-mail: wqiurong@126.com
2023-05-31,
2023-09-25
Q176; Q956; S968
10.11693/hyhz20230500116
