基于Ecopath模型的舟山海域褐菖(Sebastiscus marmoratus)生态容量评估*
2023-12-05郝辉擘蒋日进王跃斌单晓鸾李鹏飞刘明智李霞芳
郝辉擘 蒋日进 兰 丹 王跃斌 单晓鸾 李鹏飞 刘明智 李霞芳 杨 凡 印 瑞
郝辉擘1, 2蒋日进1, 2①兰 丹1, 2王跃斌1, 2单晓鸾3李鹏飞1, 2刘明智1, 2李霞芳1, 2杨 凡1, 2印 瑞1, 2
(1. 浙江海洋大学海洋与渔业研究所 浙江舟山 316021; 2. 浙江省海洋水产研究所 农业农村部重点渔场渔业资源科学观测实验站 浙江省海洋渔业资源可持续利用技术研究重点实验室 浙江舟山 316021; 3. 山东省乳山市海洋经济发展中心 山东乳山 264500)

舟山海域; Ecopath模型; 褐菖鲉; 生态容量
水生生物增殖放流是国内外应对渔业资源衰退现象的普遍做法, 开展增殖放流工作, 不仅能够有效恢复增殖种类渔业资源, 也能在短期内保持一定渔获产量, 是解决海洋生态保护与生物资源可持续问题的关键途径(杨林林等, 2016)。我国近海增殖放流始于20世纪70~80年代, 随着管理部门支持力度加大和人工育苗技术的发展, 放流规模和社会影响不断扩大, 我国增殖放流已进入快速发展阶段(张崇良等, 2022)。据农业农村部发布的《关于做好“十四五”水生生物增殖放流工作的指导意见》, 仅“十三五”期间, 全国累计放流各类水生生物1 900多亿尾, 并有计划继续增加放流数量和种类。在此形势下, 为保证增殖放流的生态效益, 做到合理增殖放流, 评估放流物种在放流海域生态系统中所能支撑的最大容量显得尤为重要。
舟山海域位于浙江省东北部, 长江口南部, 长江和钱塘江两大河口巨大的径流量和入海泥沙带来了大量营养物质, 而且台湾暖流、浙江沿岸流和黄海冷水团交汇也带来大量饵料, 这些地理、水文等优越条件使得舟山海域成为了多种鱼类的繁殖、生长、索饵和越冬的重要栖息地(钟志等, 2011)。然而, 20世纪70年代以来受过度捕捞、环境污染和生境破坏等因素的影响, 舟山海域生态系统遭到破坏, 渔业资源急剧减少(徐雪等, 2019)。褐菖鲉是舟山海域典型的岛礁性鱼类, 也是海洋牧场建设中的首要增殖鱼种之一(刘明智等, 2023)。近年来, 浙江省开始在中街山列岛海域开展褐菖鲉放流活动, 随着放流数量的逐渐增加, 该鱼种在舟山海域生态系统中的生态容量也逐渐受到关注, 因此褐菖鲉在舟山海域的合理生态容量有待开展研究。
Ecopath模型是生态系统能量通道模型, 最初用于研究生物量和食物消耗(Polovina, 1984), 20世纪90年代该模型被发展为计算机软件(Ecopath with Ecosim)应用到评估生态系统, 因其可同时对生态系统中营养结构和能量流动进行分析, 现已成为计算生态容量的核心工具(米玮洁等, 2012; 马文刚等, 2022)。本研究根据2021年渔业资源和生态环境调查数据, 利用Ecopath with Ecosim 6.5 (EwE)软件构建了舟山海域Ecopath模型, 分析了舟山海域的营养结构、能量流动以及食物网结构, 据此评估褐菖鲉的生态容量, 以期为渔业可持续发展提供参考依据。
1 材料与方法
1.1 研究区域
本研究的调查区域为浙江省舟山海域, 调查海域面积约为12 719 km2, 共设置调查站位38个, 具体站位分布见图1。调查时间为2021年春季(4月)和秋季(11月)。调查内容包括浮游生物调查、底栖生物调查、底拖网和流刺网调查, 调查时同步采集每个站位的环境数据。样品的获取和处理依据《海洋渔业资源调查规范》(SC/T9403-2012)。

图1 调查站位分布
1.2 模型构建
1.2.1 Ecopath模型原理 Ecopath模型以能量守恒和物质平衡为原理, 量化了生态系统中各功能组间的能量流动。模型以一组联立方程来表示生态系统的能量流动。公式如下:

式中,B和B分别表示功能组和的生物量, ()是功能组生产量与生物量的比值, ()是消耗量与生物量的比值(consumption/biomass)。EE是生态营养效率(ecotrophic efficiency), 表示生产者被利用的比例。DC表示被捕食组占捕食组的总捕食量的比值,Y为捕捞量, BA为生物累积,E为功能组的输出量。
构建Ecopath模型前需要输入5个基本参数,、、、EE中的任意3个以及食物组成DC和Y。EE是一个较难获取的参数, 所以在模型输入参数时将其设为未知数, 通过调试模型让所有功能组的EE均小于1。

鱼类和大型无脊椎动物生物量主要通过扫海面积法估算(詹秉义, 1995)。浮游植物生物量由叶绿素换算得出(孙军, 2004)。碎屑生物量采用碎屑和初级生产碳的经验公式计算(Pauly, 1993)。和参考已发表的文献或相似系统的Ecopath模型(王远超等, 2018; 徐雪等, 2019; 黄梦仪等, 2019)。功能组食物组成数据部分来源于积累的渔获物胃含物和稳定同位素数据, 其余的参考相关文献(王静, 2022; 肖祎, 2022)和渔业数据网站(https://fishbase.se/search.php)。捕捞数据参考渔业年鉴和根据渔捞日志估算。Ecopath模型平衡的基本条件是所有功能组的EE≤1, 输入参数后以10%为限度不断调整食物矩阵和生物量数据, 直至所有EE满足条件, 进而获得合理的参数值(Kavanagh, 2004)。
1.2.3 模型参数质量 模型中的Pedigree指数可以反映模型总体质量, 其范围是0~1.0。模型根据数据来源质量给每个输入的参数赋值, 数据来源质量由此数据对模型可靠性影响的大小决定。例如, 某功能组食物组成数据来源于调查海域则此数据质量较高; 反之, 如果参考了其他海域或时间较久远的数据则此数据质量较低。最终模型综合所有参数的赋值计算出模型的Pedigree指数。
1.3 混合营养效应分析和关键种分析
混合营养效应分析(Mixed Trophic Impact Analysis, MTI)可以评估舟山海域生态系统中各功能组间的直接或间接作用, 研究不同功能组生物量的变化对其他功能组的影响(Leontief, 1965)。生态关键种的辨识方法是: 功能组在生态系统中的生物量相对较低但在整个食物网能量流动中承担重要功能(Power, 1996)。通过绘制各个功能组的总体效应(Oeffect, OE)-关键指数(Keystoneness, KS)图可以辨识出生态系统中的关键种。MTI和关键种分析中的数值由Ecopath模型导出, 计算方法参考林群(2012)。
1.4 生态容量估算
生态容量是指在不破坏当前生态系统平衡的前提下所能容纳某鱼种最大的生物量(林群等, 2013)。生态容量估算方法如下: 保持其他功能组生物量不变, 最大限度提高褐菖鲉的生物量(褐菖鲉捕捞量也按照生物量增加的相同倍数提高), 当其他功能组中有任一功能组的生态效率(EE)≥1时, 褐菖鲉此时的生物量即为生态容量。褐菖鲉生态容量去掉其原生物量为褐菖鲉的增殖容量。
1.5 生态系统总体特征参数
生态系统总体特征参数反映了生态系统的基本属性和成熟度等。表示生态系统基本属性的参数有: 总消耗量(total consumption)、总输出量(Total export)、总呼吸量(total respiratory flows)、流入碎屑总量(total flow into detritus)、总系统通量(total system throughput, TST)、总生产量(total production)、总净初级生产力(calculated total net primary production)、总生物量(不计碎屑) [total biomass (excluding detritus)]; 表示生态系统成熟度的参数有: 总初级生产力/总呼吸(total primary production/ total respiration, TPP/TR)、净生产量(Net system production)、总初级生产力/总生物量(total primary production/total biomass, TPP/TB)等; 表示食物网结构的参数有: 连接指数(connectance index, CI)、系统杂食指数(system omnivory index, SOI)、系统Finn循环指数(Finn’s cycling index, FCI)、系统Finn平均路径长度(Finn’s mean path length, MPL)。
其中, TST表示生态系统的总体规模, 是总消耗量、总输出量、总呼吸量以及流入碎屑总量之和。CI表示食物网中实际连接与可能连接之间的比率。SOI表示所有消费者的摄食量的对数加权平均值(Christensen, 1992)。FCI表示系统生产力中贡献给物质和能量再循环的比例。MPL表示各循环流经食物链的平均长度(Finn, 1976)。
2 结果
2.1 营养结构和营养转化效率

碎屑食物链和牧食食物链是舟山海域生态系统主要的食物链。图3和表3显示, 在舟山海域生态系统中浮游植物提供的能量流动为909.8 t/(km2·a), 碎屑提供的能量流动为574.0 t/(km2·a), 对食物网的贡献率分别为61.32%和38.69%。始于浮游植物和碎屑的营养传递效率分别是9.34%和10.50%, 系统总平均传递效率是9.82%。舟山海域生态系统低营养级之间营养转化率较低, 营养级Ⅰ→Ⅱ为6.46%, 营养级Ⅱ→Ⅲ为8.53%。
2.2 营养相互关系和关键种分析
图4显示了舟山海域生态系统各功能组的营养相互关系。两功能组间关系为正影响(蓝色方块)表示施加影响功能组生物量的增加会使被影响功能组生物量增加; 两功能组间关系为负影响(红色方块)表示施加影响功能组生物量的增加会导致被影响功能组生物量减少, 方块颜色深浅表示影响强弱。混合营养分析结果显示, 浮游植物和有机碎屑作为初级生产者对大部分功能组均有积极影响。口足类、石首鱼科和肉食性底层鱼类均受到较多来自其他功能组的消极影响, 其中捕捞活动对他们的影响值最高。小型头足类、褐菖鲉和虾虎鱼类由于其相对较低的生物量未对其他功能组产生明显的积极或消极的影响。浮游动物、大型头足类、虾类、海蜇、龙头鱼和其他底层鱼类都表现出通过种间竞争和互相捕食对自身功能组产生较大的消极影响。对褐菖鲉有明显积极或消极影响的功能组较少, 浮游植物生物量的增加对褐菖鲉产生的积极影响最大, 而石首鱼科鱼类生物量的增加对褐菖鲉产生的消极影响最大。
表1 舟山海域生态系统Ecopath模型的功能组及主要种类组成

Tab.1 Function group and major species composition for the Zhoushan Sea area ecosystem Ecopath model
表2 舟山海域生态系统Ecopath模型输入输出参数
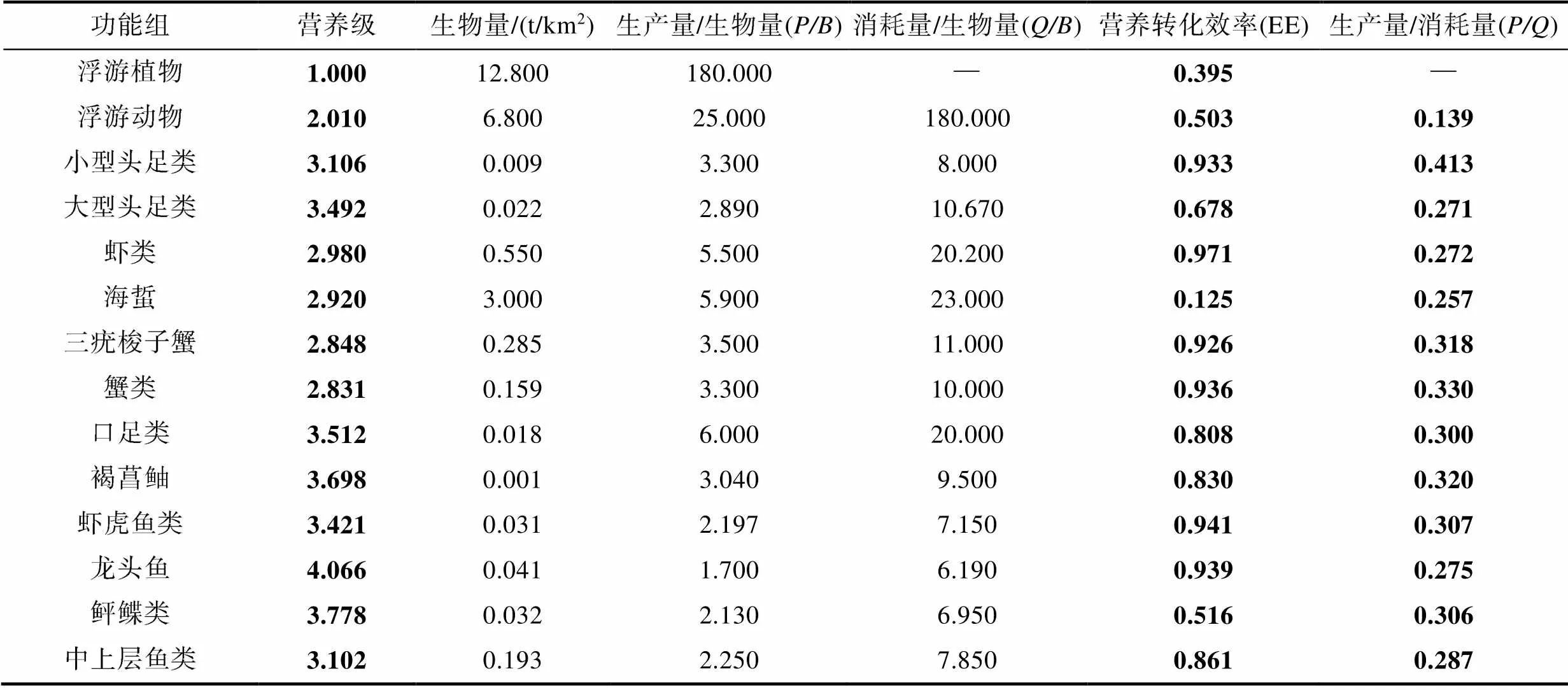
Tab.2 Basic estimates of the Ecopath with inputs of the Zhoushan sea area ecosystem

续表
注: 表中加粗字体为模型输出参数, —表示参数不存在
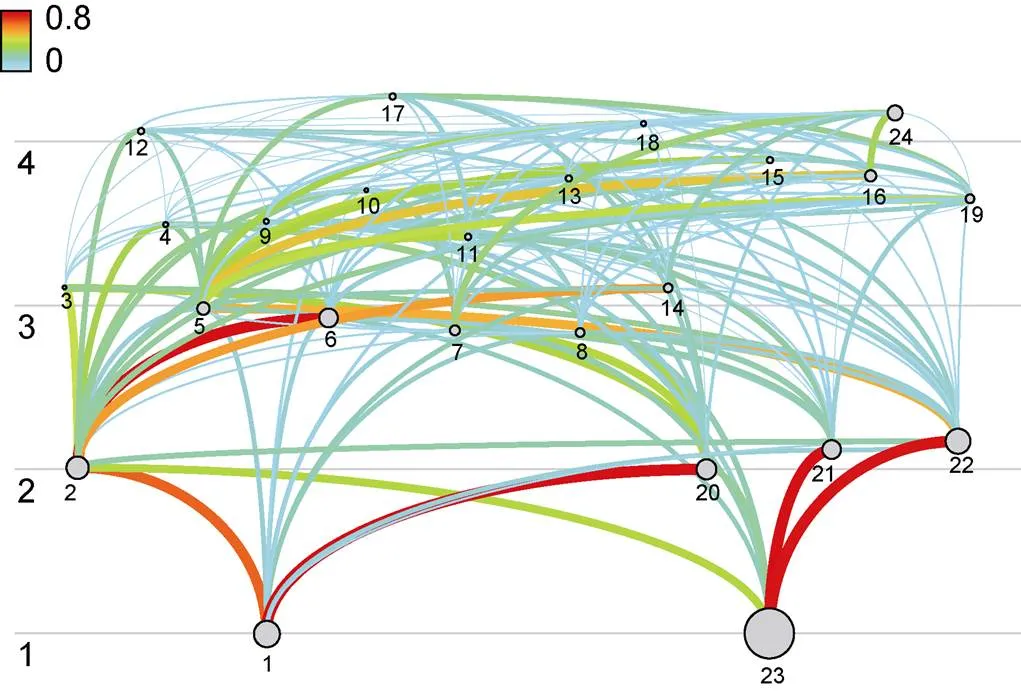
图2 舟山海域生态系统能量通道示意图
注: 图中编号1~23表示功能组, 与表1对应, 24为渔业捕捞活动, 圆圈大小表示相对生物量大小, 线条的粗细代表能量传送的多少


图3 舟山海域生态系统线性食物链
注: P. 初级生产者; D. 碎屑
表3 舟山海域生态系统营养级的转化效率

Tab.3 The transfer efficiency of discrete trophic levels in Zhoushan sea area ecosystem
注: 碎屑所占总能流比0.43; 初级生产者转化效率9.338%; 碎屑转化效率10.50%; 总转化效率9.821%

图4 舟山海域生态系统各功能组间营养关系
注: 图中编号1~23表示功能组, 与表1对应, 24为渔业捕捞活动
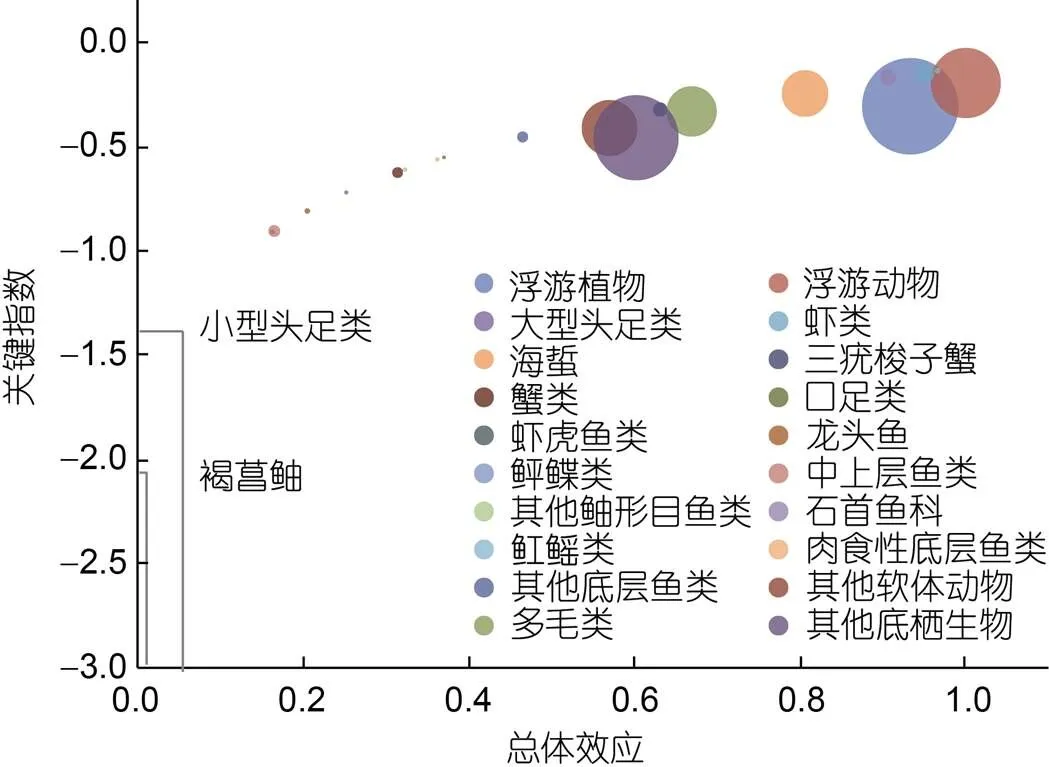
图5 舟山海域生态系统的关键种
注: 图中圆圈大小表示相对生物量大小
2.3 褐菖鲉生态容量估算
模型中, 舟山海域生态系统现有褐菖鲉生物量为0.000 92 t/km2, 当其生物量增加8.6倍到0.007 95 t/km2时(褐菖鲉捕捞量也同样增加8.6倍), 功能组虾虎鱼类生态效率达到1, 其余功能组生态效率均≤1, 即0.007 95 t/km2为褐菖鲉生态容量, 增殖容量为0.007 03 t/km2。
2.4 达到生态容量前后生态系统特征
表4反映了褐菖鲉达到生态容量前后舟山海域生态系统的系统稳定性和成熟度等生态系统参数。褐菖鲉达到生态容量后, 除杂食性指数略有降低, 其余参数均无明显变化。舟山海域生态系统的总流量为5 733.379 t/(km2·a)。总消耗量为1 600.913 t/(km2·a), 流入碎屑总量为1 842.408 t/(km2·a), 分别占系统总流量的27.92%和32.13%。系统净生产量为2 564.14 t/(km2·a),总初级生产量为1 992.633 t/(km2·a)。舟山海域生态系统的总初级生产力/总呼吸为2.26。系统的连接指数和系统杂食指数分别为0.37和0.22。系统Finn循环指数和系统Finn平均路径长度分别为4.876和2.504。
表4 舟山海域生态系统的总体特征参数

Tab.4 General characteristic parameters of the Zhoushan sea area ecosystem
3 讨论
3.1 舟山海域生态系统评价
Pedigree指数值代表了模型的总体质量和可靠性。有学者基于已发表的Ecopath模型的相关研究, 研究发现模型的Pedigree指数范围在0.164~0.675之间(Morissette, 2007)。本研究中Pedigree指数为0.58, 处于较高水平, 说明模型可信度较高。
Ecopath模型以物质守恒定律为基础将结构复杂的生态系统参数化, 有助于分析舟山海域生态系统的总体特征和系统发育状况。本研究选取了模型中多个输出参数来说明舟山海域生态系统的发展状况。首先, 总净初级生产与总呼吸的比值(TPP/TR)是系统成熟状态的指标, 此值越接近1说明生态系统越成熟(Odum, 1971)。Christensen和Pauly统计了基于41个Ecopath模型的分析, TPP/TR比值在0.8到3.2之间(Christensen, 1993), 本模型的TPP/TR为2.26, 表明舟山海域生态系统生物量累积量较低, 远未达到成熟状态。成熟生态系统的食物网相较于尚未成熟的食物网更为复杂, 所以杂食性指数和连通性指数也可以用来评估生态系统的成熟度, CI和SOI值越趋近于1, 表明生态系统食物网越复杂(洪小帆等, 2022)。当前舟山海域生态系统的CI和SOI值分别为0.372和0.222, 表明舟山海域生态系统的营养关系相对简单, 食物网的复杂程度偏低, 此结果与徐雪等(2019)对舟山渔场及邻近海域(CI=0.429, SOI=0.697)的研究结果相似。表征生态系统成熟度的指标还有系统Finn循环指数(FCI)和系统Finn平均路径长度(MPL), 成熟生态系统的物质再循环比例较高, 营养流所经过的食物链较长(Finn, 1976)。本模型中FCI为4.876, MPL为2.504, 与较为成熟的生态系统Catalan海(FCL=25.19, MPL=4.27) (Coll, 2006)和印度Bengal湾(FCL=10.59, MPL=2.991) (Dutta, 2017)相比均较低。综上五个指标可得出, 舟山海域生态系统的成熟状态较低, 生态系统处于不稳定阶段, 容易受到外界环境变化的影响。原因可能是: 舟山海域常年受到长江冲淡水和钱塘江高营养盐淡水影响以及生活污水和城市废水的污染, 使舟山海域富营养化严重(戚劲, 2021)。同时, 栖息地破坏和过度捕捞现象使舟山海域面临鱼类小型化、群落结构改变等问题(牛威震, 2022)。这些因素都限制了舟山海域生态系统向“成熟化”发展, 营养相互关系分析中捕捞活动对其他功能组的显著消极影响在一定程度上也验证了这一点。
在能流特征上, 舟山海域低营养级之间营养转化效率较低, 营养级I→II转化效率仅为 6.463%, 低于大多数海域生态系统(陈作志等, 2008; 黄梦仪等, 2019), 说明浮游植物和碎屑冗余了大量能量, 低营养级向高营养能量传递发生阻塞。同时, 舟山海域中对浮游植物和碎屑有较大依赖性的虾蟹类和中上层鱼类被大量捕捞也加剧了这一结果。因此, 可适当增加虾蟹类和中上层鱼类的数量, 一则可加速氮磷循环速率, 再者可增强低营养级向高营养级的能量输送, 增强食物网结构、增加生态系统稳定性。
3.2 褐菖鲉建议放流数量
本研究结果表明, 褐菖鲉达到生态容量后生态系统保持平衡, 即褐菖鲉在该海域仍有较大增殖空间。本研究中计算的褐菖鲉生态容量为0.007 95 t/km2。根据马鞍列岛褐菖鲉的生物学参数(李朝文等, 2018), 褐菖鲉的自然死亡系数为0.84, 总死亡系数为3.04, 捕捞死亡系数为2.20。假定褐菖鲉在0~1龄时只存在自然死亡, 且在1龄时达到生态容量, 那么可根据达到生态容量时褐菖鲉生物量回推出褐菖鲉放流量。经计算, 达到生态容量所放流鱼苗量为0.018 3 t/km2, 根据《海洋生物增殖放流技术规范》(DB33/T2102-2018)中的规定, 褐菖鲉放流鱼苗体长为3 mm, 体重为1 g, 舟山海域面积按照调查海域总面积(12 719 km2)计算, 可得褐菖鲉放流数量为23 212万尾。此数值仅为理论上可放流数量。有研究表明, 种群在达到生态容量一半时可达到最大增长率, 此时更有利于种群增长(唐启升, 1996), 故计算放流数量时可将最大生态容量减半, 此时褐菖鲉可放流量为11 582万尾。
褐菖鲉是舟山海域近岸岛礁性鱼类, 因舟山海域有众多岛屿, 且岛屿周边礁石密布, 使得褐菖鲉在舟山海域广泛分布。营养相互关系结果表明, 浮游植物对褐菖鲉产生较大积极影响, 可得出浮游植物生物量丰度越高的海域越有助于褐菖鲉的生物量增加。李朝文(2018)对褐菖鲉生境的研究中发现, 褐菖鲉幼鱼更喜欢栖息于海藻丛中。因此, 褐菖鲉放流需结合褐菖鲉分布情况及其营养关系, 将对放流地点的选择有一定参考意义。
放流种类不同对生态系统造成的影响也不同, 诸多学者在评估生态容量时分析了放流种对生态系统的影响。黄梦仪等(2019)评估大亚湾黑鲷()生态容量时发现黑鲷达到生态容量时浮游生物食性鱼类的种群增长受到抑制; 徐雪等(2019)评估舟山渔场三疣梭子蟹增殖容量时则发现三疣梭子蟹的放流对小型底栖动物影响较大。本文中, 褐菖鲉达到生态容量后虾虎鱼类的EE达到1, 分析其原因, 首先是虾虎鱼类本身受到大多数鱼类的捕食, 营养转化率达到了0.941, 其次褐菖鲉食物组成中有一部分是虾虎鱼类, 同时两者还存在一定的食物竞争关系。因此, 放流后通常是放流种的饵料生物和存在食物竞争关系的物种受到直接影响, 放流时可考虑一并放流这些受到较大影响的生物种类。
值得注意的是, 研究发现褐菖鲉的放流会在一定程度上降低系统杂食性指数, 林群等在黄河口邻近水域评估贝类生态容量时也出现了杂食性指数降低的情况(林群等, 2018)。因此, 为避免因放流单一物种造成生态系统成熟度降低, 在增殖放流活动中应兼顾放流种的饵料基础, 并综合考虑当地其他放流种类的实际情况, 真正做到“生态型”增殖放流。
4 结论
本研究在Ecopath模型基础上综合分析了舟山海域生态系统, 并估算了舟山海域褐菖鲉的生态容量。通过生态系统总体特征参数和线性食物链分析得出舟山海域生态系统食物网结构较为简单, 成熟度较低, 易受外界干扰, 初级生产力向高营养级传送能量的通道受阻, 浮游植物和碎屑冗余了大量能量。通过模型估算, 褐菖鲉在舟山海域的生态容量为0.007 95 t/km2, 建议褐菖鲉放流量为11 582万尾, 褐菖鲉在舟山海域尚有较大增殖潜力, 本研究可为褐菖鲉的增殖放流提供参考。
从Pedigree指数来看模型总体可信度较高, 但仍存在不足: (1) Ecopath为静态模型, 未考虑生态系统的季节变化和环境变化等因素; (2) 本模型中使用的摄食数据大部分来自于实际胃含物, 反映生物的摄食情况时难免存在不足(杨凡等, 2023), 在今后的研究中可应用稳定同位素技术来弥补这一不足; (3) 褐菖鲉为典型岛礁性鱼类, 评估其生态功能和容量时应尽可能将其放在较为独立的岛礁生态系统中, 但本研究中因岛礁生物生物量数据难以补充完整, 所以未能充分考虑其影响。综合分析, Ecopath模型功能强大, 但需要更为准确的数据提高模型质量, 未来仍需长期展开监测调查, 以此来减少模型可信度不足的风险。
马文刚, 尹洪洋, 孙春阳, 等, 2022. 热带典型珊瑚岛礁海洋牧场花刺参底播增殖容量及其生态效应预测[J]. 海洋与湖沼, 53(6): 1573-1584.
王远超, 梁翠, 线薇微, 等, 2018. 基于生态通道模型的长江口及邻近海域生态系统能流动态分析[J]. 海洋科学, 42(5): 54-67.
王静, 2022. 舟山群岛海域四种经济鱼类的摄食生态研究[D]. 舟山: 浙江海洋大学: 13-23.
牛威震, 2022. 舟山岛北部近岸海域鱼类群落结构特征及生物多样性研究[D]. 舟山: 浙江海洋大学: 1-2.
刘明智, 杨凡, 蒋日进, 等, 2023. 中街山列岛海域三种恋礁性鱼类的营养生态位及潜在碳源[J]. 应用生态学报, 34(4): 1130-1136.
米玮洁, 胡菊香, 赵先富, 2012. 生态通道模型及其在水生态系统中的应用探讨[J]. 环境科学与技术, 35(7): 186-190, 196.
孙军, 2004. 海洋浮游植物细胞体积和表面积模型及其转换生物量[D]. 青岛: 中国海洋大学: 3-9.
李朝文, 2018. 马鞍列岛海洋特别保护区褐菖鲉摄食生境选择[D]. 上海: 上海海洋大学: 19-20.
李朝文, 王凯, 程晓鹏, 等, 2018. 马鞍列岛海洋特别保护区褐菖鲉生物学参数估算[J]. 生物学杂志, 35(3): 106-109.
杨凡, 印瑞, 范江涛, 等, 2023. 中街山列岛海域食物网结构初步研究及主要消费者潜在碳源分析[J]. 海洋学报, 45(1): 25-37.
杨林林, 姜亚洲, 袁兴伟, 等, 2016. 象山港典型增殖种类的生态容量评估[J]. 海洋渔业, 38(3): 273-282.
肖祎, 2022. 浙江近岸海域三种洄游鱼类的摄食生态研究[D]. 舟山: 浙江海洋大学: 10-53.
张崇良, 徐宾铎, 薛莹, 等, 2022. 渔业资源增殖评估研究进展与展望[J]. 水产学报, 46(8): 1509-1524.
陈作志, 邱永松, 贾晓平, 等, 2008. 基于Ecopath模型的北部湾生态系统结构和功能[J]. 中国水产科学, 15(3): 460-468.
林群, 2012. 黄渤海典型水域生态系统能量传递与功能研究[D]. 青岛: 中国海洋大学: 26-27.
林群, 王俊, 李忠义, 等, 2018. 黄河口邻近水域贝类生态容量[J]. 应用生态学报, 29(9): 3131-3138.
林群, 李显森, 李忠义, 等, 2013. 基于Ecopath模型的莱州湾中国对虾增殖生态容量[J]. 应用生态学报, 24(4): 1131-1140.
钟志, 刘琴, 郭远明, 等, 2011. 舟山渔场海域环境质量评价[J]. 广州化工, 39(3): 138-139.
洪小帆, 陈作志, 张俊, 等, 2022. 基于Ecopath模型的七连屿礁栖性生物的生态承载力分析[J]. 热带海洋学报, 41(1): 15-27.
徐雪, 唐伟尧, 王迎宾, 2019. 舟山渔场及长江口渔场临近海域三疣梭子蟹增殖容量估算[J]. 南方水产科学, 15(3): 126-132.
唐启升, 1996. 关于容纳量及其研究[J]. 海洋水产研究, 17(2): 1-6.
黄梦仪, 徐姗楠, 刘永, 等, 2019. 基于Ecopath模型的大亚湾黑鲷生态容量评估[J]. 中国水产科学, 26(1): 1-13.
戚劲, 2021. 浙江近岸海域富营养化时空分布变化研究[D]. 杭州: 浙江大学: 16-17.
詹秉义, 1995. 渔业资源评估[M]. 北京: 中国农业出版社: 75-121.
CHRISTENSEN V, PAULY D, 1992. A Guide to the ECOPATHⅡSoftware System (Version 2.1) [M]. Manila: International Center for Living Aquatic Resources Management: 1-67.
CHRISTENSEN V, PAULY D, 1993. Trophic Models of Aquatic Ecosystems [M]. Victoria BC: WorldFish.
COLL M, PALOMERA I, TUDELA S,, 2006. Trophic flows, ecosystem structure and fishing impacts in the South Catalan Sea, Northwestern Mediterranean [J]. Journal of Marine Systems, 59(1/2): 63-96.
DUTTA S, CHAKRABORTY K, HAZRA S, 2017. Ecosystem structure and trophic dynamics of an exploited ecosystem of Bay of Bengal, Sundarban Estuary, India [J]. Fisheries Science, 83(2): 145-159.
FINN J T, 1976. Measures of ecosystem structure and function derived from analysis of flows [J]. Journal of Theoretical Biology, 56(2): 363-380.
KAVANAGH P, NEWLANDS N, CHRISTENSEN V,, 2004. Automated parameter optimization for Ecopath ecosystem models [J]. Ecological Modelling, 172(2/3/4): 141-149.
LEONTIEF W W, 1965. The structure of the U.S. economy [J]. Scientific American, 212(4): 25-35.
MORISSETTE L, 2007. Complexity, cost and quality of ecosystem models and their impact on resilience: a comparative analysis, with emphasis on marine mammals and the Gulf of St. Lawrence [D]. Vancouver: University of British Columbia.
ODUM E P, 1971. Fundamentals of Ecology [M]. 3rd ed. Philadelphia: W.B. Saunders Co.: 574.
PAULY D, SORIANO-BARTZ M L, PALOMARESA M L D, 1993. Improved construction, parametrization and interpretation of steady-state ecosystem models [C] // Proceedings of the ICLARM Conference on Trophic Models of Aquatic Ecosystems, 26: 1-13.
POLOVINA J J, 1984. Model of a coral reef ecosystem [J]. Coral Reefs, 3(1): 1-11.
POWER M E, TILMAN D, ESTES J A,, 1996. Challenges in the quest for keystones [J]. BioScience, 46(8): 609-620.
ASSESSMENT OF ECOLOGICAL CARRYING CAPACITY OFIN ZHOUSHAN SEA AREA IN THE ECOPATH MODEL
HAO Hui-Bo1, 2, JIANG Ri-Jin1, 2, LAN Dan1, 2, WANG Yue-Bin1, 2, SHAN Xiao-Luan3, LI Peng-Fei1, 2, LIU Ming-Zhi1, 2, LI Xia-Fang1, 2, YANG Fan1, 2, YIN Rui1, 2
(1. Marine and Fisheries Research Institute of Zhejiang Ocean University, Zhoushan 316021, China; 2. Zhejiang Marine Fisheries Research Institute, Scientific Observing and Experimental Station of Fishery, Resources for Key Fishing Grounds, Ministry of Agriculture and Rural Affairs, Key Laboratory of Sustainable Utilization of Technology Research for Fishery Resources of Zhejiang Province, Zhoushan 316021, China; 3. Shandong Rushan Marine Economic Development Center, Rushan 264500, China)
The Ecopath model of Zhoushan sea area ecosystem with 23 functional groups was constructed based on the data of the 2021 fishery resources survey, and the general characteristics of the current ecosystem in Zhoushan sea area were analyzed and the ecological capacity of the marbled rockfishin Zhoushan sea area was estimated. Results show that the trophic level of the Zhoushan sea area ecosystem ranged from 1.000 (phytoplankton and detritus) to 4.277 (stingrays), and Sciaenidae, shrimps, and stingrays were the key species in the Zhoushan sea area ecosystem. The detritus food chain and the grazing food chain were the main food chains in the Zhoushan sea area ecosystem. The contribution of detritus and phytoplankton to the food web was 61.32% and 38.69%, respectively. The nutrient transfer efficiency starting from phytoplankton and detritus was 9.34% and 10.50%, respectively, and the total nutrient transfer efficiency of the system was 9.82%. The total primary production/total respiration was 2.26, the system connectivity index was 0.372, and the system omnivory index was 0.222. The overall characteristics of the ecosystem reflected the low maturity state of the Zhoushan sea area ecosystem, which was in an unstable stage and easily affected by external environmental changes. According to the model estimation, when the biomass of.increased to 8.6 times,.would reach the ecological capacity of 0.007 95 t/km2, at which the ecosystem would remain in balance, and the overall characteristics of the ecosystem would be basically stable. Therefore, there is still a large potential for.to proliferate in Zhoushan sea area.
Zhoushan sea area; Ecopath model;; ecological capacity
* 国家重点研发计划项目, 2019YFD0901204号; 浙江近海重要经济种产卵场调查与评价, HYS-CZ-202217号; 长江口及其邻近海域水生生物资源动态监测项目HYS-CZ-202312号。郝辉擘, 硕士研究生, E-mail: 1092504163@qq.com
蒋日进, 高级工程师, E-mail: jiangridge@163.com
2023-05-12,
2023-07-26
S931
10.11693/hyhz20230500104
