内镜黏膜下剥离术治疗39例大肠侧向发育型肿瘤的临床疗效分析
2023-11-29黄福林林佐光
黄福林,林佐光,杨 勇
(高州市人民医院消化内科,广东 高州 525200)
大 肠 侧 向 发 育 型 肿 瘤(Laterally spreading tumor,LST)是结直肠的一种特殊平坦型病变,直径>10 mm,倾向于沿肠壁侧向生长或环肠壁生长,而不是向肠壁深部垂直生长[1]。LST 具有多种不同的病理类型,其恶性程度高达11.5%,如果未得到及时处理,会在几年之内发展成大肠癌。内镜下黏膜切除术(Endoscopic mucosal resection,EMR)可 有 效 切除病变,但对于直径大于2 cm 的LST,EMR 术中多采用分片式切除,易造成病变残留和复发,增加患者的心理和经济负担[2]。陈静等[3]研究指出,内镜黏膜下 剥 离 术(Endoscopic submucosal dissection,ESD)治疗早期结直肠癌及其癌前病变安全、有效、微创,具有广阔的临床应用前景。对于LST,由于ESD 操作难度大、风险高,故临床上特别是基层医院尚未得以推广。本研究旨在探讨ESD 治疗直径大于20 mm的LST 的有效性及安全性,现报道如下。
1 资料和方法
1.1 病例资料
选择39 例行ESD 的LST 患者纳入本研究,纳入时间2020 年1 月至2022 年12 月,病例均来自高州市人民医院。对所有患者进行分类,分类标准为内镜下形态,主要类型有混合结节型、假凹陷型、颗粒均一型、平坦隆起型等;采用0.4% 靛胭脂染色确定病灶的大小、边界等。所有患者均行择期手术,术前检查凝血功能、心肺功能等未发现异常;术前1 周内均未使用抗凝药物(如氯吡格雷、阿司匹林、替格瑞洛、华法林)。术前全面告知患者有关手术的益处与弊端,患者了解并签署同意书。本次研究经医院伦理委员会审批。
1.2 器械和材料
主要器械有日本奥林巴斯电子结肠镜CF-H290I,奥林巴斯双焦点电子胃镜GIF-HQ290,一次性黏膜切开刀(DualKnife)KD-650Q,日本奥林巴斯一次性高频止血钳FD-410LR,德国Erbe 爱尔博高频手术系统VIO300S,南微医学一次性内窥镜用注射针(22 G、5 mm、2300 mm),南微医学可旋转重复开闭软组织夹,南微医学0.2% 靛胭脂黏膜染色剂,1:10 000 肾上腺素生理盐水,玻璃酸钠,甘油果糖,复方聚乙二醇电解质散(和爽),二甲硅油散(健亨)等。
1.3 术前准备
在手术前1 d,进食少渣的食物,手术当天清晨以复合PEG 电解质散(深圳万和医药有限公司,国药准字H20030828,规格:137.15 g/ 包)清洁肠道,每次2 包,随后再服用消泡剂二甲硅油散(自贡鸿鹤医药有限公司,国药准字H51023869,规格:2.5 g/包),清除肠壁上的气泡。行肠镜检查,以南微医药0.2%靛胭脂作为黏膜着色剂,观察确定病灶的大小、边缘,通过超声内窥镜观察病灶周围淋巴结的情况(见图1)。

图1 A :普通肠镜下距肛门约5 cm 直肠见一个大小约3.5 cm×3.0 cm 的混合结节型LST;B :水中LST-ME+NBI 显示呈Pit Pattern Ⅳ型;C :超声内镜见病变主要累及黏膜层,未侵犯固有肌层,周边未见淋巴结肿大
1.4 手术方法
丙泊酚静脉注射全身麻醉后,常规行肠镜检查寻找病变,以靛胭脂染色确定病变边界,在病变切缘外2 ~5 mm 处用Dual 刀对切除区域进行标记,然后在病变切缘标记点的外侧行多点黏膜下注射,每次注入含有少量靛胭脂的1:10 000 肾上腺素生理盐水,直到病变充分隆起。用Dual 刀将病变的外侧缘黏膜切开,顺着病灶的边缘标记点外侧2 mm 环周切开,然后用Dual 刀对黏膜下层进行剥离,使病变与固有肌层分离,交替开展注射操作与剥离操作,如黏液垫消失太快,可使用玻璃酸钠或甘油果糖黏膜下注射,最后将病变整体剥离下来。术中出血通过止血钳强力电凝或软凝方法止血,术后软凝处理创面裸露的血管,如有必要,可用金属夹将创面夹闭。切除标本用盐水清洗表面黏液,展开后用大头针固定,之后将标本浸泡在4%的福尔马林中再送病理科进行检查。术中相关操作见图2。
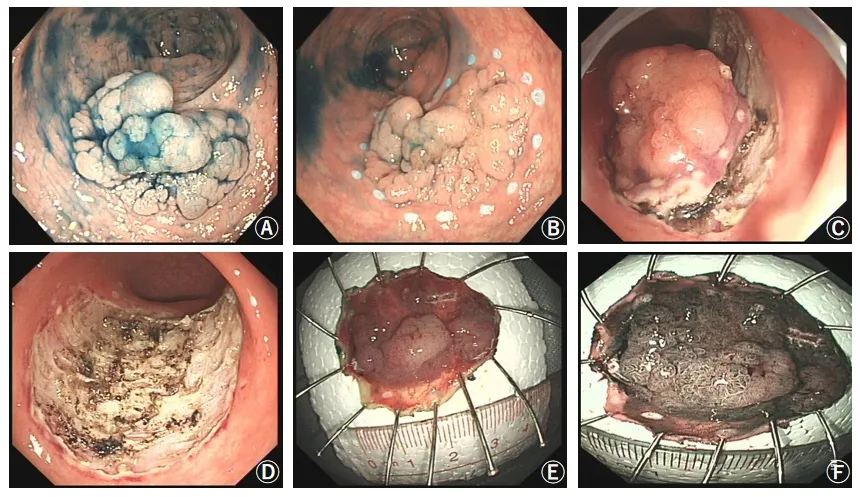
图2 A:0.4%靛胭脂染色后的LST;B:用Dual 刀行环周标记;C:用Dual 刀剥离;D:剥离后的创面;E:将剥离的标本展开固定;F:剥离的标本经窄带内镜(NBI)观察
1.5 术后处理及随访
手术结束后需要禁食24 ~72 h,预防性使用抗生素、止血药,合理补液,并视患者的情况逐渐恢复正常饮食,同时要注意患者的腹部体征、症状和粪便性状。如果患者术后出现血便或黑色便,提示发生迟发性出血;如果术后腹部平片和CT 检查显示膈下有空气,则提示发生迟发性穿孔。若患者术后出现出血、穿孔、感染等并发症,应给予禁食和胃肠减压,合理补液,使用头孢哌酮舒巴坦等药物进行抗感染治疗。若有必要,可在内镜的辅助下使用钛夹夹闭出血点或穿孔部位,或转至胃肠外科进行手术治疗。手术结束后3 ~12 个月通过电话和门诊随访的方式对患者进行随访,定期进行肠镜复查。
2 结果
2.1 临床资料
纳入研究的39 例LST 患者中,颗粒型26 例,非颗粒型13 例,内镜下结节混合型所占比例最高,达48.7%(19/39),假凹陷型所占比例最低,仅占7.7%(3/39)。肿瘤直径20 ~85 mm,平均31.8 mm。病灶分布于直肠者最多,直肠27 例(69.2%)、升结肠6例(15.4%)、乙状结肠3 例(7.7%)、横结肠2 例(5.1%)、降结肠1 例(2.6%)。
2.2 ESD 手术情况
39 例患者的手术操作时间为75 ~375 min,中位时间为142min。切除病灶直径为20 ~85 mm,平均31.8 mm。其中1 例因外院取病理组织后形成多处溃疡灶,瘢痕粘连后抬举征阴性,未能完整切除,3个月后到外科行手术切除,术后病理示:(直肠)管状腺瘤伴低级别上皮内瘤变。整块切除率为97.4%(38/39)。术后病理分型:单纯腺瘤14 例、低级别瘤变9 例、高级别瘤变12 例、癌变4 例。其中1 例乳头状腺瘤、腺癌累及蒂部组织,患者未同意外科手术补救,术后3 个月、1 年、2 年复查肠镜均未见复发;1 例管状绒毛状腺瘤,局灶癌变- 高分化腺癌,并累及基底部局灶组织,追加外科手术切除,术后病理示(直肠)肠肿物切除术后,本次送检病灶全检未见癌残留;送检(淋巴结)及检取肠周淋巴结均未见转移癌,分别为(0/8、0/6),两切缘干净。1 例(直肠)管状腺瘤,伴癌变- 高分化腺癌,蒂未见累及。1 例绒毛管状腺瘤,黏膜腺体重度异型增生、癌变,黏膜内中分化腺癌,周围切缘及基底切缘均未见癌。此2 例患者术后1 个月、半年、1 年复查肠镜均未见复发。治愈性切除率为92.3%(36/39)。
2.3 并发症
术中出血及小穿孔均予电凝止血、钛夹荷包缝合闭合创面处理。1 例为直肠全周型病变,大小约85 mm×53 mm,术后第2 d 出现腹痛、腹胀、发热,行CT 检查发现膈下游离气体、腹膜炎,经禁食、胃肠减压、头孢哌酮舒巴坦抗感染、补液保守治疗后1周康复出院,出院后不久出现大便细条难排,3 个月后复查肠镜示直肠狭窄、无法过镜(见图3),后到肛肠外科行直肠狭窄放射状切开术治疗,治疗后能通过3 指,症状缓解。39 例患者术后感染发生率为2.6%(1/39),穿孔发生率为2.6%(1/39),直肠狭窄发生率为2.6%(1/39),无迟发性出血病例。

图3 ESD 术后3 个月出现直肠狭窄病例
2.4 随访情况
术后随访3 ~36 个月,1 例患者出院后不久出现大便细条难排,3 个月后复查肠镜示直肠狭窄、无法过镜,后到肛肠外科行直肠狭窄放射状切开术治疗,治疗后能通过3 指,症状缓解。其他患者复查肠镜均显示创面愈合良好,无肿瘤局部复发和远处转移病例。
3 讨论
LST 是指直径大于10 mm、肿瘤横向生长的表面平坦型肿瘤,具有很高的癌变危险,如果未得到及时处理,会在几年之内发展成大肠癌。因此,为了防止LST 进展到结肠癌,需要对LST 进行早期处理[4]。EMR 是以往治疗LST 最常用的术式,但EMR 受限于病变范围,对于直径大于20 mm 的病灶需要采用分片手术,由于不能获得全面的病理样本,因此常导致术后残留及复发率高[5]。最近几年,在LST 的治疗中,已逐步采用了ESD,该手术是在内镜下对病灶的切缘外侧进行标记和切开,然后将病灶完整剥离下来,不会受到病灶大小的影响,可以一次完成对病灶的彻底切除,能有效克服EMR 的缺陷,并且其完整切除率很高,术后病灶残余很少,从而可大大降低患者术后病情的复发率[6]。对于LST,一般不建议进行活检送病理检查,一是因为组织活检无法反映病变的整体情况,二是在活检后容易对病变组织产生破坏,从而引起黏膜下层和肌肉层之间的粘连。在本组病例中,有1 例患者因为在外院行活检后发现了多个溃疡灶,瘢痕粘连后抬举征为阴性,因此没有能够完整切除,在3 个月后到外科进行了手术切除。
LST 的恶性度高达11.5%,其癌变后易进一步向深层侵袭,对本病侵袭深度的判断是ESD 手术中最为关键的一步,精确的判断是决定手术成功与否的关键。常见的检查方式为:(1)充吸气变形试验:先向肠腔内充气,让病变充分展开,再吸气,若病变形状发生凹陷样变化,就可以初步判定肿瘤没有浸润到黏膜下,若病变形状不变,就说明肿瘤已浸润到黏膜下全层或更深,此乃外科手术的指征。(2)抬举征阳性(lifting sign):向病变黏膜下注入生理盐水后,若病变黏膜能充分隆起,可以完全与固有肌层分离,则为抬举征阳性,此时可用EMR、ESD 等手段将病变切除;对于无法隆起或隆起不良的病灶,说明肿瘤组织已经浸润至固有肌层,不能应用EMR 或ESD 将病灶切除。(3)使用染色放大内镜技术,医师可以根据Pit Pattern 分型结果,对结直肠侧向发育型肿瘤进行良恶性判断,这对于大肠癌的早期诊断非常有用,并为大肠癌的治疗提供了一个参考依据[7]。(4)使用超声内镜对肿瘤的浸润深度进行检查和判断。
ESD 是一种新兴的、高效的内镜微创技术,但由于其操作难度大,并且有很高的手术风险,因此在临床上尤其是基层医院并未得到普及。ESD 技术的学习是一个循序渐进的过程,需要娴熟的内镜技术功底,并经系统的进修学习考核后才能开展,早期可先开展胃的ESD,在达到一定手术数量后再进行肠道的ESD。对于巨大病变,特别是全周型侧向发育型肿瘤,术中出血、肌层损伤穿孔及术后感染的发生率大大增加,且全周切除后易出现直肠狭窄。本组病例中1 例患者术后发生直肠狭窄,同时出现穿孔、急性腹膜炎及直肠狭窄3 种并发症。袁媛等[8]研究指出,采用玻璃酸钠、生理盐水和靛胭脂配制的混合液予黏膜下注射后行ESD 治疗效果佳,安全性高。早期开展ESD治疗时,可先使用玻璃酸钠、甘油果糖行黏膜下注射,这样黏液垫不易消失,可减少注射次数,利于ESD 操作,缩短手术时间,减少手术并发症的发生。黄思霖[9]报道的使用双隧道黏膜下剥离术治疗直肠环周型侧向发育型肿瘤的单中心研究中,有66.7%(4/6)的患者发生了直肠狭窄,这种改进型黏膜下剥离术的直肠狭窄并发症的发生率较低。
既往研究已证实ESD 可安全有效地治疗结直肠病变,实现整块切除及完全切除的患者可获得良好的长期预后[10]。本组所有病例均行ESD 治疗,整块切除率为97.4%(38/39),治愈性切除率为92.3%(36/39);术后感染发生率为2.6%(1/39),穿孔发生率2.6%(1/39),直肠狭窄发生率为2.6%(1/39),无迟发性出血病例,术后3 ~36 个月复查肠镜显示,创面愈合良好,无复发病例。表明ESD 治疗直径大于20 mm 的LST 是安全、有效、微创的,值得临床推广。
