新城疫载体系统表达天蚕素AD抗菌肽及其抑菌效果
2023-11-27任项霏冯贺龙徐英英杨宏春阳柳君周祖涛李自力罗青平胡思顺温国元
任项霏,冯贺龙,徐英英,李 丽,杨宏春,王 鑫,商 雨,阳柳君,周祖涛,李自力,刘 梅,罗青平,胡思顺*,温国元*
(1.华中农业大学 动物科学技术学院/动物医学院,湖北 武汉 430070;2.湖北省农业科学院 畜牧兽医研究所,湖北 武汉 430064;3.农业农村部畜禽细菌病防治制剂创制重点实验室,湖北 武汉 430064;4.畜禽病原微生物学湖北省重点实验室,湖北 武汉 430064;5.湖北洪山实验室,湖北 武汉 430070;6.湖北省预防兽医学重点实验室,湖北 武汉 430070)
天蚕素(Cecropin)是世界上首个被发现的抗菌肽,含有A、B、C、D种以及其他类似物[1]。Cecropin AD(CAD)是人工设计的由Cecropin A的氨基端1~11个氨基酸和Cecropin D的羧基端12~37个氨基酸残基组成的一种杂合肽[2],该抗菌肽有较强的抗细菌、病毒和肿瘤等多种生物活性[3],无细胞毒性作用[4-6]。其杀菌活性和抗菌谱明显优于Cecropin A和Cecropin D,且杀菌活性是Cecropin D的5~55倍,对枯草芽孢杆菌的抑制活性是Cecropin A的6倍[7-8];CAD对大肠杆菌和金黄色葡萄球菌抑菌效果尤为明显,MIC分别为1.8,0.2 g/L[9]。CAD耐高温性较强,在100℃下放置3 h仍能具有抑菌活性[10]。因此,CAD抗菌肽作为抗生素替代物,在禽病治疗方面具有较好的应用前景。
天然的提取工艺复杂,含量极低。尽管可以利用固相肽进行人工化学合成,但其合成价格昂贵,不利于其在大规模畜禽生产中应用[11]。因此,采用基因工程的方法制备抗菌肽是当前研究的热点,也是表达有活性抗菌肽的有效途径之一。在目前可用的表达系统中,因抗菌肽对宿主细胞有一定的毒性作用以及对蛋白酶非常敏感,所以很难在不添加融合蛋白的情况下,利用原核表达系统单独地表达有活性的小分子抗菌肽[12]。因其相对分子质量较小,所以在利用酵母表达系统表达抗菌肽时,会出现纯化难、表达量低等问题[10]。
新城疫病毒(NDV)载体是一种常见的疫苗载体,因其RNA基因组不能整合到宿主DNA染色体上[13-14],在癌症治疗中的溶瘤特性[15],具备稳定的表达效率[16-17],以及在载体疫苗应用中的相对安全性[17-19],使NDV载体具有十分广泛的应用前景。
本研究利用NDV载体系统表达CAD抗菌肽,通过RT-PCR和间接免疫荧光试验检测重组病毒CAD的表达,并通过体外抑菌试验检测重组NDV表达的CAD的抑菌活性,为CAD抗菌肽的临床应用提供了新思路。
1 材料与方法
1.1 材料
1.1.1细胞、菌株与质粒 叙利亚幼地鼠肾细胞(BHK-21)、鸡胚成纤维细胞(DF-1)、NDV全长克隆质粒pTS09-C、辅助质粒pVAX-NP、pVAX-P、pVAX-L,表达T7 RNA聚合酶的重组痘病毒由湖北省农业科学院畜牧兽医研究所保存;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;金黄色葡萄球菌ATCC29213、大肠杆菌ATCC25922由实验室保存。
1.1.2试剂 LipofectamineTM3000试剂盒购自Thermo Fisher公司;TPCK-胰酶购自Sigma公司;鸡源NDV阳性血清购自中国农业科学院哈尔滨兽医研究所;HA-tag多克隆抗体购自Proteintech公司;FITC标记的羊抗鸡IgG抗体和RBIT标记的羊抗兔IgG抗体均购自北京博奥森生物技术有限公司。
1.1.3CAD基因设计与合成 根据文献以及NCBI中的CAD成熟肽的基因序列,在其羧基端加上HA-tag,具体氨基酸序列为KWKLFKKIEKVGQRVRDAVISAGPAVATVAQATALAKYPYDVPDYA,斜体表示HA-tag,具体基因序列为aag tgg aag ctg ttc aag aag atc gag aag gtg ggc cag cgc gtg cgc gac gcc gtg atc agc gcc ggc ccc gcc gtg gcc acc gtg gcc cac gcc acc gcc ctg gcc aag TAC CCA TAC GAC GTC CCA GAC TAC GCT,小写字母表示CAD,大写字母表示HA-tag,该基因序列由上海生物工程公司合成并连接到质粒pUC57中,构建重组质粒pUC57-CAD。
1.2 含CAD基因的NDV全长克隆质粒的构建以合成的pUC57-CAD为模板进行PCR扩增CAD片段。为了将AD以单独编码阅读框的方式插入pTS09-C载体中,通过PCR扩增将基因起始序列(GS)、基因终止序列(GE)和Kozak序列分别添加至CAD的N端[20]。以pTS09-C为模板,反向PCR扩增载体大片段,并采用In-Fusion酶同源重组的方法,将包含有GE、GS和Kozak序列的CAD片段与载体大片段相连接。在50℃连接15 min后,将连接产物转化至DH5α感受态中,37℃培养18~24 h,挑取单菌落进行菌液PCR及酶切鉴定,并送至公司进行测序分析,构建成功的重组质粒命名为pTS-CAD。用于构建质粒的引物序列见表1。

表1 用于构建重组质粒pTS-CAD的引物序列
1.3 重组病毒的拯救与鉴定将痘病毒vTF7-3按照0.01 MOI的接种剂量预感染BHK-21细胞2 h。采用脂质体转染法[17],将插入有CAD的重组质粒和NP、P、L个辅助质粒共转染BHK-21细胞,质粒的量分别为1.250,0.313,0.313,0.625 μg。转染6 h后,加入含有0.2 g/L TPCK胰酶的维持液[21]。每天观察细胞状态,待细胞发生明显病变,反复冻融细胞3次,收获上清液,0.22 μm滤器过滤去除痘病毒。将其按照200 μL/枚的剂量接种9~11日龄SPF鸡胚37℃孵育45 d后收取尿囊液进行血凝试验[22]。血凝试验结果呈阳性的尿囊液,进行RT-PCR,并送公司测序鉴定。拯救成功的重组病毒命名为rTS-CAD。
1.4 重组病毒的生长曲线测定将重组病毒以0.1 MOI接种BHK-21细胞,感染1 h后换含有0.2 g/L TPCK胰酶的DMEM维持液,37℃、5% CO2培养,分别在12,24,36,48,60,72,84,96 h取细胞培养上清液,测定其TCID50,并绘制重组病毒的生长动力学曲线。
1.5 致病性分析将重组病毒rTS-CAD做10倍梯度稀释,取10-5~-9个稀释度的病毒液分别接种SPF鸡胚5枚,弃去24 h内死亡的鸡胚,记录鸡胚的死亡时间,计算重组病毒的鸡胚最小致死量的平均死亡时间(MDT/MLD)。
1.6 CAD在重组病毒中的表达鉴定为了检测CAD的表达,将BHK-21细胞在12孔板上培养,待细胞长至80%~90%,在培养箱孵育1 h。孵育结束后,PBS洗2~3遍,再分别感染2 MOI的rTS-CAD,继续孵育2 h,换上含有0.2 g/L TPCK-胰酶的维持液[23]。24 h后用4%多聚甲醛固定细胞,用0.5% Triton X-100透化细胞。以3% BSA进行封闭处理后,分别用NDV阳性血清和鼠源HA-tag抗体检测NDV蛋白和CAD抗菌肽的表达,然后,以FITC标记的兔抗鸡抗体和RBIT标记的羊抗鼠IgG抗体为二抗,最后以DAPI进行细胞核染色,在激光共聚焦显微镜下观察并拍照记录。
1.7 CAD的抑菌活性测定
1.7.1微孔板抑菌试验 以金黄色葡萄球菌ATCC29213、大肠杆菌ATCC25922为试验菌株,过夜摇菌,菌落计数后稀释至103CFU/mL,转移至96孔板中,50 μL/孔 (103CFU/mL),从第1孔开始,依次2倍稀释至第10孔,弃去50 μL混合物,每孔再加入100 μL感染有重组病毒的尿囊液/感染BHK-21细胞上清(图1),阴性对照孔不加菌液,加入等体积的LB培养基,阳性对照孔为菌液对照孔,只加入培养基和等量菌液。每组设3个重复,37℃温箱培养18~24 h,在阳性对照和阴性对照正常的情况下,根据加样孔培养基是否变混浊判断结果,混浊孔记为“+”,澄清孔记为“-”再计算其抑制率,即存活率%=试验组菌液稀释度/对照组菌液稀释度×100%,抑制率%=100%-存活率%。
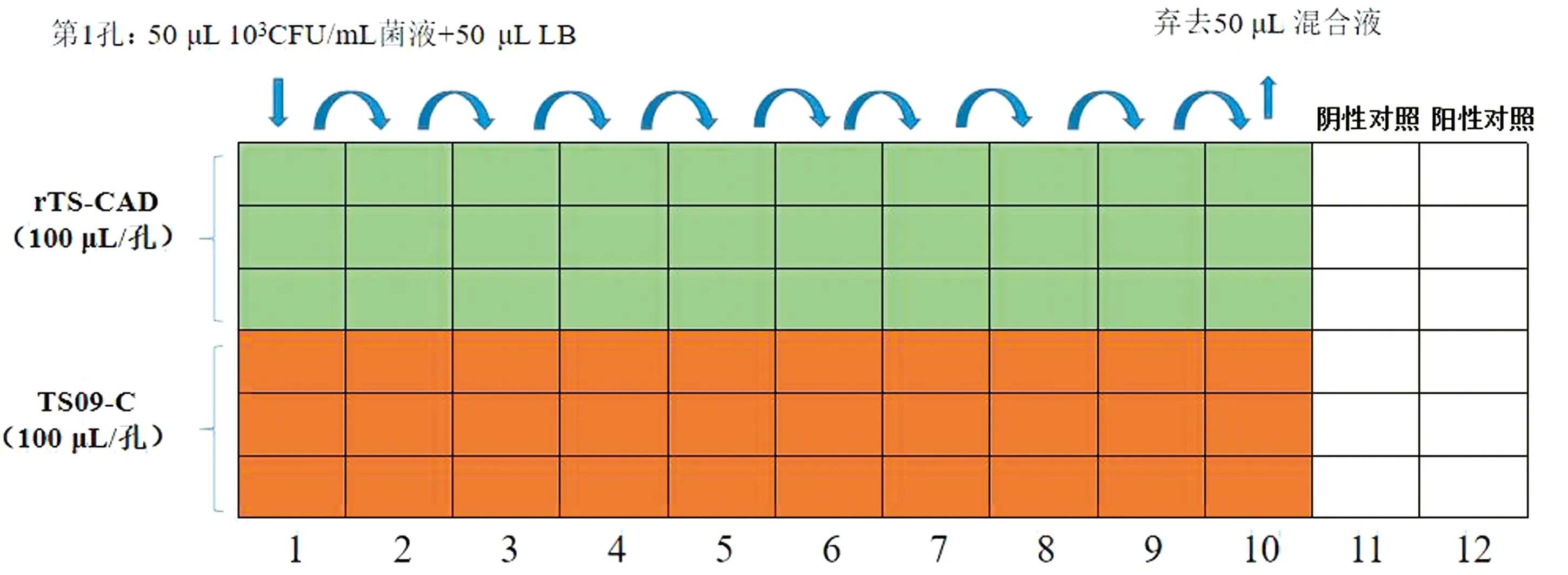
图1 微孔板抑菌验示意图
1.7.2DF-1细胞共培养法抑菌试验 参照文献方法[23-24],验证其抗菌活性。将1.0 MOI的重组病毒rTS09-C和rTS-CAD分别接种于DF-1细胞,2 h后换成含有0.2 g/L TPCK-胰酶的DMEM维持液。在感染24 h时,加入103CFU/mL新鲜菌液100 μL,继续培养。分别在12,24 h取培养液上清进行菌落计数,并以TS09-C试验组为参照计算抑菌率(即细菌存活率%=rTS-CAD组菌落数/TS09-C组菌落数×100%,抑菌率%=100%-存活率%)。
2 结果
2.1 重组质粒pTS-CAD的构建与鉴定按照构建策略将外源基因插入至NDV载体的P基因和M基因之间(图2),PCR扩增CAD片段,大小为150 bp,再利用反向PCR将pTS09-C进行载体线性化,长度为18 326 bp,电泳结果显示扩增片段的大小与预期结果一致(图3)。以同源重组的方法连接两个PCR片段,获得pTS-CAD重组质粒。在菌液PCR正确情况下,提取质粒并对两种重组质粒进行BamHⅠ酶切鉴定,结果与预期一致(图4)。将重组质粒送往公司测序,测序结果与预期一致,表明重组质粒pTS-CAD构建成功。
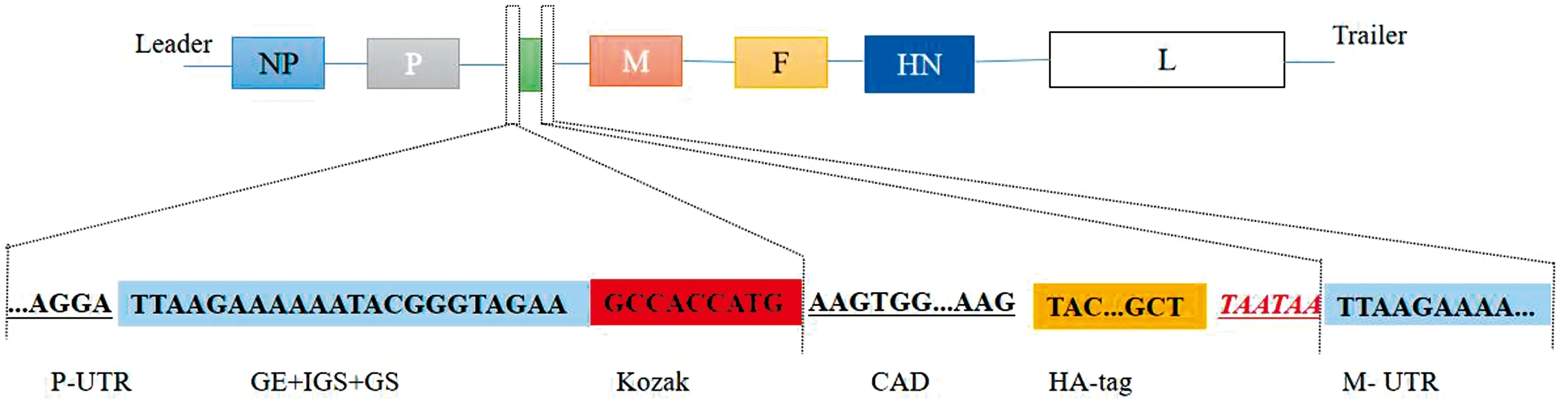
图2 重组质粒pTS-CAD的构建示意图

1.pTS09-C 载体线性化反向PCR扩增;2.CAD片段扩增
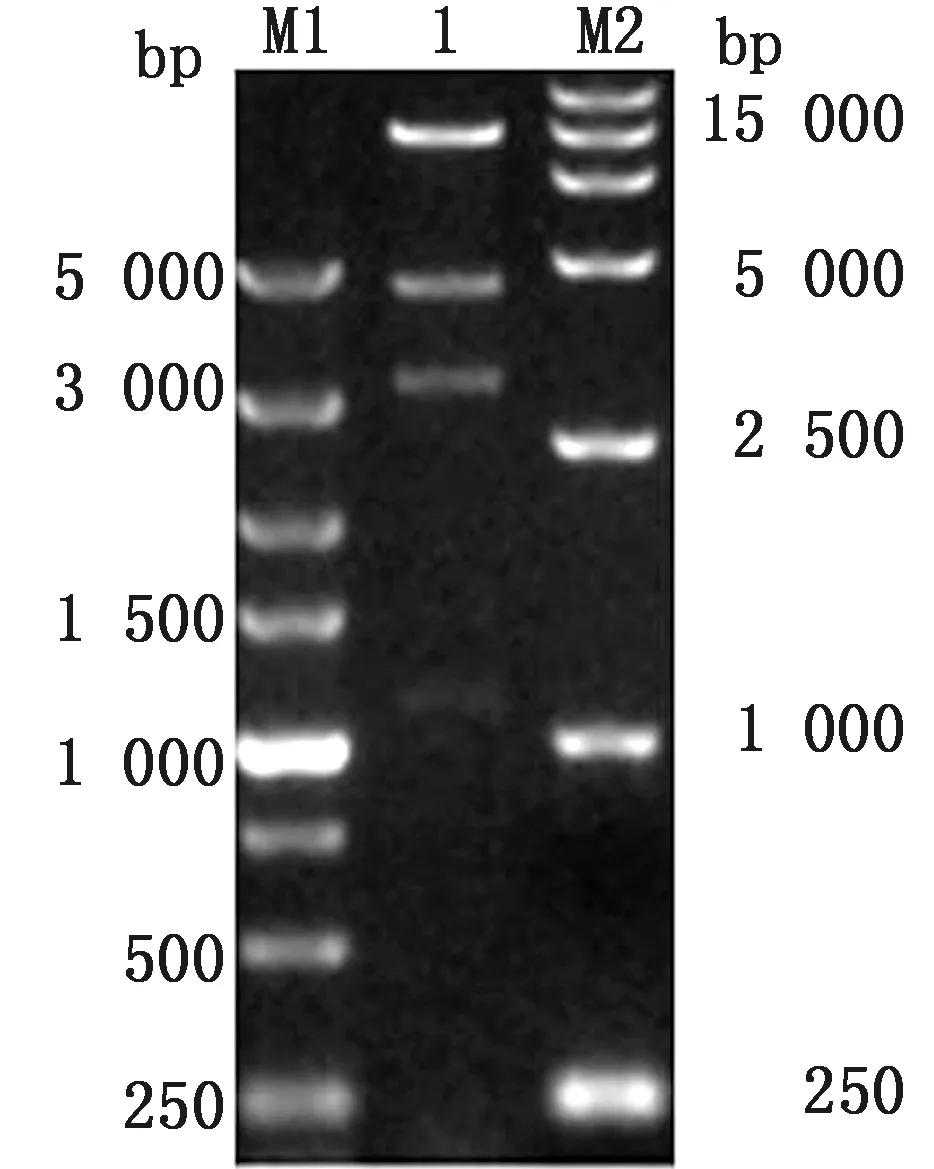
M1.DL5000 DNA Marker; M2.DL15000 DNA Marker;1.pTS-CAD BamHⅠ单酶切产物
2.2 重组病毒的拯救及其鉴定通过脂质体转染法将重组质粒pTS-CAD和3种辅助质粒共转染至BHK-21细胞,48 h后可见明显的细胞病变,部分出现皱缩变圆,脱落现象。将细胞裂解后接种9~11日龄SPF鸡胚,血凝试验检测阳性尿囊液血凝效价为26。如图5所示,利用鉴定引物将阳性的尿囊液进行NDV PCR扩增,扩增出大小为1 258 bp的DNA片段。PCR产物送公司进行测序鉴定,结果与预期一致,表明rTS-CAD重组病毒拯救成功。
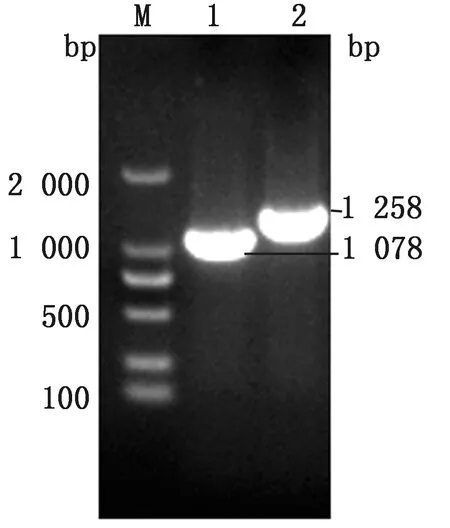
M.DL2000 DNA Marker;1.TS09-C鉴定扩增产物;2.rTS-CAD鉴定扩增产物
2.3 重组病毒的生物学特性为了研究在NDV TS09-C株的P和M基因之间插入CAD基因是否改变其生物学特性,测定了重组病毒的鸡胚增殖滴度、生长曲线和致病性。结果显示,重组病毒rTS-CAD与亲本TS09-C株具有相似的增殖特性,感染BHK-21细胞后于60~96 h达到平台期,滴度为106.99TCID50/mL(图6);其鸡胚增殖滴度为109.75EID50/mL。重组病毒rTS-CAD的MDT/MLD值大于120 h,保持了其弱毒特性。上述结果表明,CAD基因的插入未改变TS09-C株的弱毒和增殖特性。
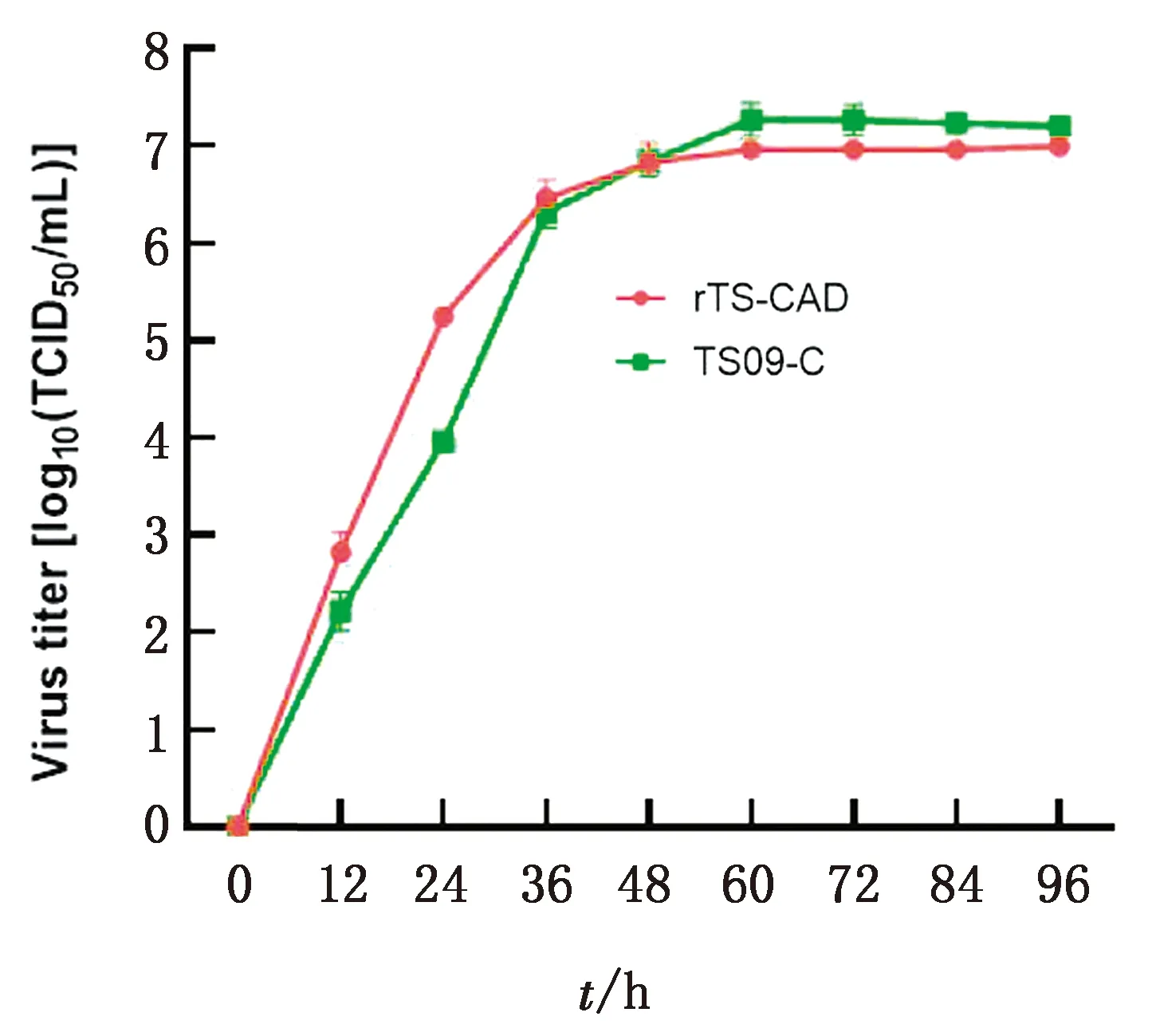
图6 重组病毒rTS-CAD在BHK-21细胞的生长曲线
2.4 CAD抗菌肽在重组病毒rTS-CAD中的表达鉴定间接免疫荧光试验结果显示,感染rTS-CAD的细胞内可同时检测到NDV蛋白(绿色荧光)和CAD(红色荧光),但在感染TS09-C株的细胞孔中仅检测到NDV(绿色荧光),未检测到红色荧光(图7),表明重组病毒rTS-CAD可以在细胞内稳定表达CAD抗菌肽。
2.5 重组病毒表达的CAD的抑菌活性检测
2.5.1微孔板法抑菌试验 在金黄色葡萄球菌抑制试验中,重组病毒尿囊液中表达的CAD抗菌肽对金黄色葡萄球菌的抑制率为79.6%,其感染细胞上清中的CAD对金黄色葡萄球菌的抑制率为91.7%(表2)。在大肠杆菌抑制试验中,重组病毒尿囊液中表达的CAD抗菌肽对大肠杆菌的抑制率为89.8%,其感染细胞上清中的CAD对大肠杆菌的抑制率为87.5%(表3)。
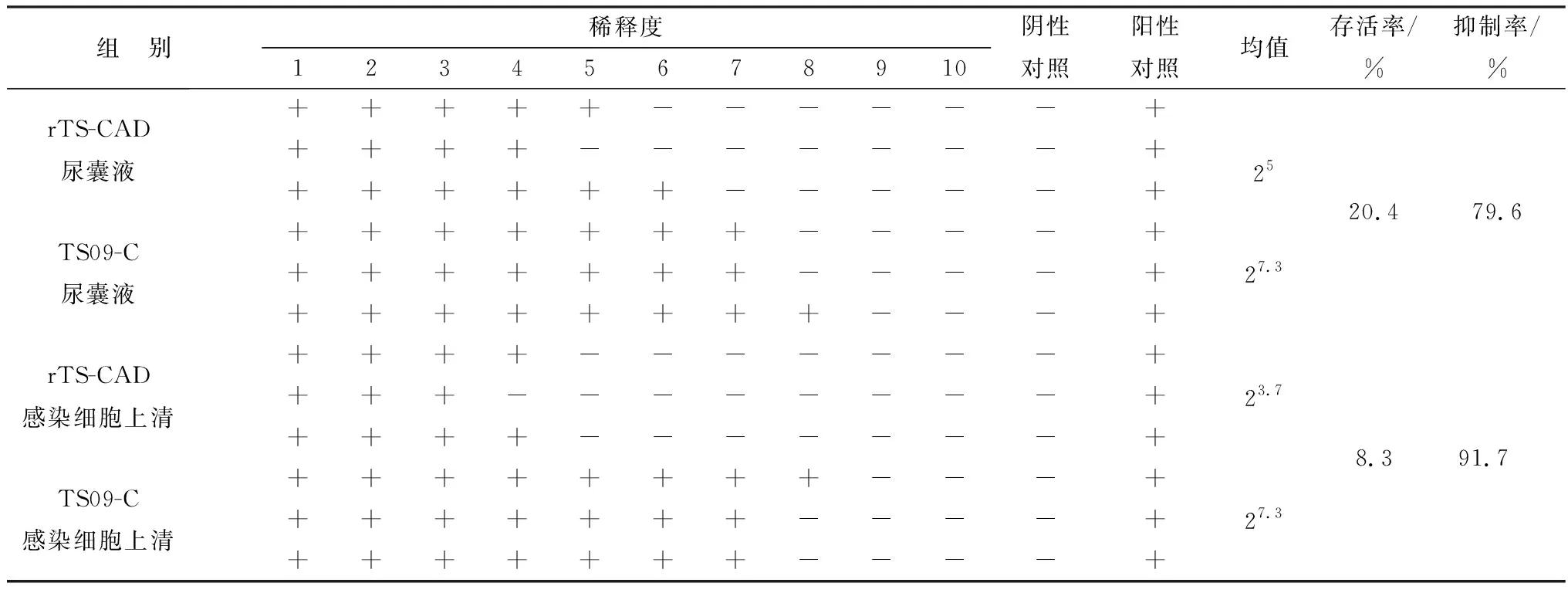
表2 重组病毒表达的CAD尿囊液和感染细胞上清对金黄色葡萄球菌(ATCC29213)的抑制作用
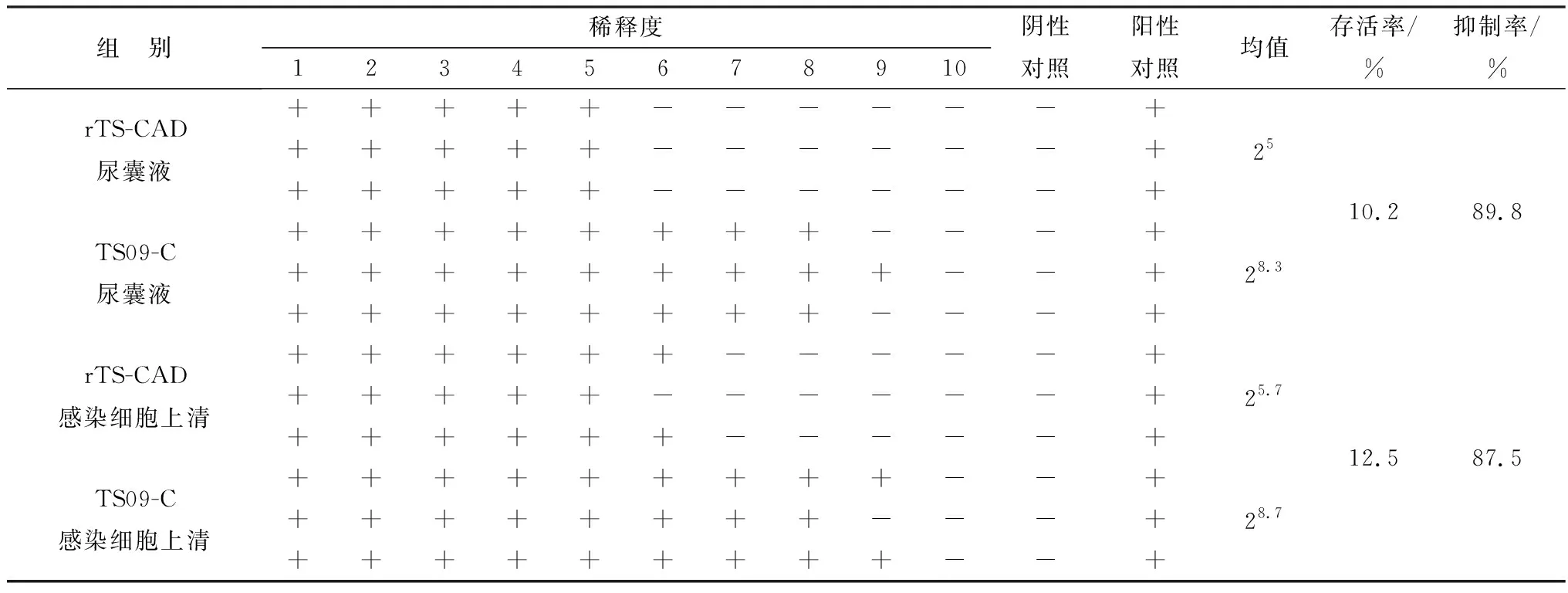
表3 重组病毒表达的CAD尿囊液和感染细胞上清对对大肠杆菌(ATCC25922)的抑制作用
2.5.2DF-1细胞共培养法抑菌试验 感染rTS-CAD重组病毒的DF-1细胞与细菌共培养,如图8所示,培养12 h后,对金黄色葡萄球菌的抑制率为74.5%,对大肠杆菌的抑制率为35.0%;共培养24 h,对金黄色葡萄球菌的抑制率达到77.7%,对大肠杆菌的抑制率提高至45.0%。结果表明,重组病毒感染DF-1后表达的CAD展示出一定的抑菌活性。
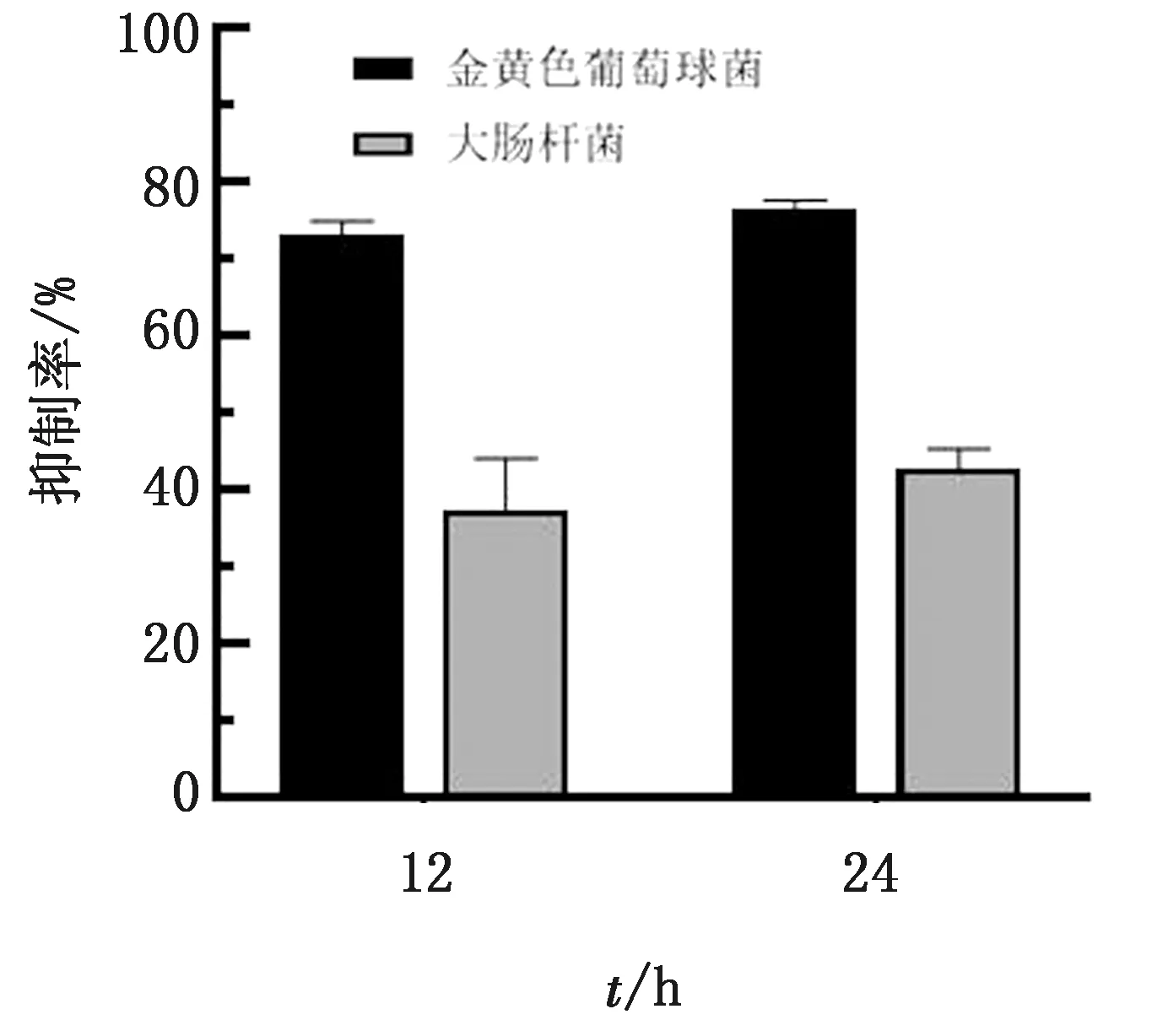
图8 DF-1细胞上验证重组病毒表达的CAD对细菌的抑制作用
3 讨论
随着抗生素滥用所导致的细菌耐药问题日益突出,寻找新型抗菌药物逐渐成为研究热点。抗菌肽因其独特的抗菌机制,使其在抑菌/杀菌的同时不易产生耐药性。但是,天然抗菌肽的产量低,其生产应用受到严重限制。因此,通过微生物发酵生产抗菌肽,可解决其生产成本高昂的问题,提升了抗菌肽在细菌病治疗领域的应用前景。
当前用于表达的表达系统主要有大肠杆菌、枯草芽孢杆菌和酵母菌以及杆状病毒。在利用大肠杆菌表达系统表达抗菌肽时,其易形成包涵体,纯化难度高、表达量低,抗菌肽对宿主菌可能存在一定的杀伤作用,因此大多采用融合方式,在抗菌肽的氨基端或羧基端融合一个可溶性蛋白,如SUMO、CLEP、Trx等[25-27]。彭建等[28]构建GST表达载体利用大肠杆菌系统进行融合表达Cec4,最终亲和纯化出0.117 g/L的蛋白。ZHANG等[29]利用枯草芽孢杆菌表达系统生产AD,从培养上清中纯化出0.026 g/L的重组AD。牛军波等[7]利用毕赤酵母表达AD串联体,确定了AD不仅对常见致病菌有抑制作用,而且可以在高温处理后仍具有抑菌活性。此外,AD在30 U/mL的胰蛋白酶下仍具有抑菌活性,并表明AD不具有溶血活性[30]。黄亚东等[31]同样利用杆状病毒表达载体,在Sf9细胞和苜蓿丫纹夜蛾幼虫中成功表达AD,其表达产物具有抑菌活性,但未纯化出抗菌肽。以上这些生产系统均需要对表达产物进行纯化,且纯化难度较大,一定程度上限制了这些表达的抗菌肽的应用效果。
NDV作为疫苗开发和基因传递的载体,已被广泛应用于多种活载体疫苗和药物的研发[32-33],具有良好的应用基础和前景。本研究将CAD插入至NDV TS09-C弱毒株,获得了重组病毒rTS-CAD株,该重组病毒可以高效表达CAD,表明利用NDV作为载体表达CAD的方法是可行的。目前养鸡场都会定期免疫新城疫疫苗来预防新城疫,若将重组病毒rTS-CAD通过鸡呼吸道免疫,重组病毒rTS-CAD可以在病毒增殖的同时表达CAD,从而对细菌产生抑制作用,进而增强局部组织抵抗细菌和NDV感染能力。因此,利用NDV载体表达CAD或其他抗菌肽在预防和控制呼吸系统疾病方面具有较好的应用前景。
本研究选择NDV TS09-C弱毒株的反向遗传操作系统[11],在P蛋白和M蛋白之间引入CAD的ORF。通过病毒拯救,成功获得了重组病毒rTS-CAD,该病毒能够在鸡胚中高效增殖,并具有一定的抑菌作用。在微孔板法抑菌试验中,重组病毒表达的CAD抗菌肽对金黄色葡萄球菌的抑制率为79.6%~91.7%;对大肠杆菌的抑制率为87.5%~89.8%。在细胞共培养试验中,重组病毒表达的CAD抗菌肽对金黄色葡萄球菌的抑制率可以达到74.5%~77.7%;对大肠杆菌的抑制率为35.0%~45.0%。这些结果为后续将开展重组病毒在鸡体内的抑菌效果试验奠定了基础,也为抗菌肽在家禽细菌病防控中的应用提供了新的思路和方法。另外,具有调节免疫、促中性粒细胞和T细胞的趋化等功能[3]。本研究构建的重组病毒rTS-CAD可能具有改善NDV弱毒疫苗的功能和提高NDV疫苗免疫效果的潜力。
