fimH基因敲除对大肠杆菌NMGCF-19菌株致病性的影响
2023-11-27杨茗崴王玮玉王裕光胡俊英张芷源王新平
杨茗崴,王玮玉,王裕光,胡俊英,张 群,张芷源,王新平
(吉林大学 动物医学学院 人与动物共患传染病国家重点实验室/教育部人兽共患病研究重点实验室,吉林 长春 130062)
大肠杆菌是一种广泛存在于人与动物体内的机会性致病菌,可引起人与动物发生多类型表现的传染病,如败血症、肠炎、尿道炎、菌血症、肺炎和脑膜脑炎等。本实验室前期从临床上呈现严重腹泻和神经症状为特征的羔羊体内分离获得1株大肠杆菌NMGCF-19菌株,发现NMGCF-19菌株可以通过血脑屏障,引起动物脑膜脑炎[1]。
大肠杆菌具有许多与感染相关的毒力因子,如P型菌毛、Ⅰ型菌毛、溶血素、细胞坏死因子等,这些毒力因子在细胞黏附、损伤宿主细胞及环境生存等方面发挥作用。其中菌毛是大肠杆菌介导菌体黏附在宿主细胞上的一种重要的黏附因子[2],借助于菌毛对宿主黏膜上皮细胞的黏附作用,细菌得以定居,以便进一步获得侵入血液,进入器官的通道,并且有研究发现菌毛在许多肠外致病性大肠杆菌的致病机制中发挥着关键作用[3],由此我们推断菌毛与大肠杆菌NMGCF-19菌株突破血脑屏障引起动物脑膜脑炎等致病能力有关。菌毛中Ⅰ型菌毛起主要黏附作用,该菌毛能与宿主黏膜上皮细胞上的甘露糖受体发生特异性结合,从而导致细菌黏附在黏膜上皮细胞上,同时95%大肠杆菌表达Ⅰ型菌毛,而P型菌毛则是对疾病的进一步发展起重要作用[4-5]。Ⅰ型菌毛与大肠杆菌的致病性密切相关,其fimH蛋白与Ⅰ型菌毛的黏附及免疫反应紧密相关,有研究显示fimH基因广泛存在于大肠杆菌,因此本试验将fimH基因作为靶向敲除基因[4-6]。
目前广泛应用于大肠杆菌基因敲除的方法有lambda Red重组系统和自杀质粒介导的同源重组基因敲除方法,但前者在同一个细菌引入多个突变的条件下,每引入一个突变就会影响下一个突变的成功率,还可能造成非所需突变的产生,甚至还会引起细菌基因组的不稳定;后者对某些保守且敲除困难的基因筛选效率极低,进而限制其应用。由于以上两种方法的限制性,本研究选择应用基因编辑效率高的CRISPR/Cas9基因编辑技术来完成基因敲除的操作。进行基因编辑操作时,CRISPR/Cas9系统需要转录两个RNA片段,一个是前体CRISPR(pre-crRNA),另一个是转录激活RNA(tracrRNA)[6-9]。这两个RNA通过碱基配对形成二聚体,与Cas9蛋白结合,形成复合物;然后,在pre-crRNA的介导下发挥Cas9蛋白的HNH与RuvC活性,切割基因组特定位置的DNA,形成DNA双链断裂[10-23]。JINEK等[24]将pre-crRNA和tracrRNA加工成一条单链RNA嵌合体,称之为gRNA。CRISPR/Cas9中的gRNA 3′端还有一段小的前间区序列邻近基序(PAM),目前证明PAM一般为NGG,是CRISPR/Cas9系统的必备区域[8]。为了进一步探索NMGCF-19菌株的致病机制,本研究将应用CRISPR/Cas9技术和小鼠模型,通过敲除菌株潜在毒力基因fimH及确定其致病性,为阐明NMGCF-19菌株的致病机理奠定基础。
A.pwtCas9-fimH-sgRNA1;B.pwtCas9-fimH-sgRNA3

A.NMGCF-19wild在Amp培养皿上的培养结果;B.pwtCas9-N19-fimH-sgRNA1质粒转化结果;C.pwtCas9-N19-fimH-sgRNA3质粒转化结果;D.空白Amp培养皿用作阴性对照
1 材料与方法
1.1 菌株、质粒、培养基和抗生素大肠杆菌NMGCF-19菌株分离于临床上呈现严重腹泻和神经症状的羔羊[1-2],由吉林大学动物检验检疫教研室保存;pwtCas9-fimH-sgRNA1、pwtCas9-fimH-sgRNA3质粒均由吉林大学动物检验检疫教研室成功构建并保存;培养基为LB培养基;抗生素为终质量浓度100 mg/L的氨苄青霉素。
1.2 主要试剂Taq DNA聚合酶、限制性内切酶Bbs Ⅰ和氨苄青霉素均购自美国 Thermo Fisher Scientific公司;HE染色试剂盒购自上海碧云天生物技术有限公司;细菌生化检测试剂盒购自杭州微生物试剂有限公司;胶回收试剂盒、细菌基因组提取试剂盒及质粒提取试剂盒购自天根生化科技(北京)有限公司。
1.3 实验动物24只SPF级昆明小鼠(6~7周龄),雌雄各半,购自辽宁长生生物科技有限公司;小鼠饲养条件良好,自由采食及饮水,饲养过程中的昼夜明暗循环为12 h,室温控制在(22±0.5)℃之间。
1.4 NMGCF-19fimH-的构建利用本实验室前期测定的NMGCF-19菌株完整基因组序列,获得fimH基因的序列信息,进行sgRNA的设计,在其5′端分别加上Bbs Ⅰ酶切位点的黏性末端(CACC/AAAC),得到Cas9-fimH-F和Cas9-fimH-R引物,送至生工生物工程(上海)股份有限公司合成,引物序列如表1所示。将Cas9-fimH-F、Cas9-fimH-R 稀释至100 μmol/L,经退火形成具有黏性末端双链DNA。反应体系Cas9-fimH-F 和Cas9-fimH-R 各10 μL,反应程序94 ℃ 5 min,然后以 0.1℃/s 降温至 4℃。取PCR扩增产物,进行1%琼脂糖凝胶电泳鉴定。将pX459质粒以Bbs Ⅰ限制性内切酶进行酶切处理,经1%琼脂糖凝胶电泳鉴定后,将胶回收产物与退火后形成的双链sgRNA(DNA)进行连接,以构建好的载体转化大肠埃希菌Top10感受态细胞,使用质粒提取试剂盒将质粒提出,经PCR及测序验证后获得pwtCas9-fimH-sgRNA基因敲除载体。
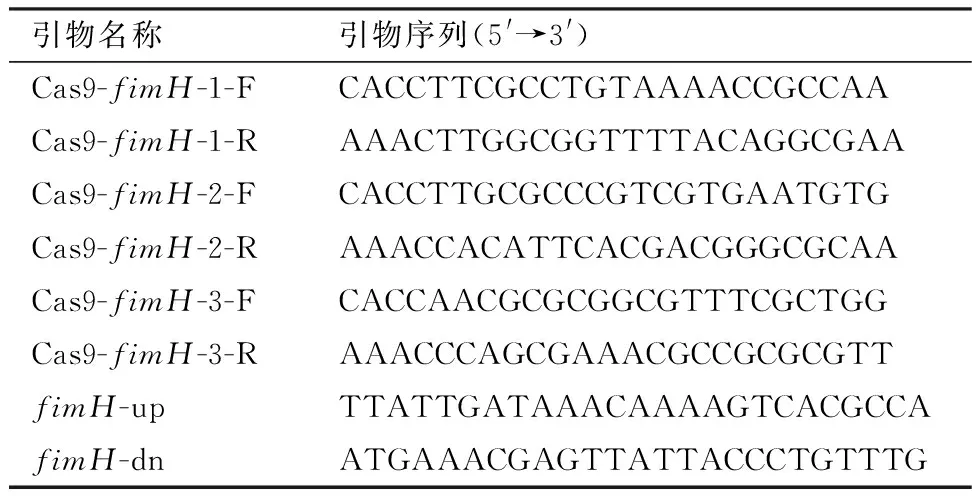
表1 敲除载体引物序列
大肠杆菌NMGCF-19菌株电转感受态细胞的制备,参见文献介绍方法进行[25]。各取1 μL纯化后的pwtCas9-fimH-sgRNA1、pwtCas9-fimH-sgRNA3基因敲除载体于1.5 mL离心管中,并将其与电转杯一同置于冰上预冷,向离心管内各加入40 μL解冻的NMGCF-19电转感受态细胞,混匀后冰上放置10 min;将该混合物转移至电转杯中,电转仪电压调节为2.1 kV进行电转操作。
取20 μL转化产物加160 μL LB,混匀后涂布于含有终质量浓度为100 mg/L氨苄青霉素的固体平板,37℃过夜培养后挑取单克隆摇菌,使用购自天根生化科技(北京)有限公司的细菌基因组提取试剂盒提取菌液中的细菌基因组,用针对fimH基因的特异性引物fimH-up和fimH-dn进行PCR检测。对PCR检测成功的细菌,回收其PCR产物进行TA克隆,并送往生工生物工程(上海)股份有限公司测序;将测序结果和原基因序列进行比对,检测fimH基因是否敲除成功,检测成功则获得NMGCF-19fimH-。
1.5 NMGCF-19fimH-与NMGCF-19wild生物学特性的鉴定以比浊法测定并绘制生长曲线。取NMGCF-19wild和NMGCF-19fimH-各接种于10管3 mL LB液体培养基中,于接种后 0,2,3,4,6,8,10,12,22,24 h 分别收取1管菌液,保存于4℃冰箱内。待收集齐所有菌液后,同时测定吸光度值(D600 nm),并以GraphPad Prism 9.0软件绘制NMGCF-19wild和NMGCF-19fimH-的生长曲线。
以接种环取适量NMGCF-19wild和NMGCF-19fimH-,接种于各生化鉴定管(半固体培养基、鸟氨酸脱羧酶、赖氨酸脱羧酶、西蒙氏枸橼酸盐、硫化氢、尿素酶、蛋白胨水、甘露醇、肌醇、山梨醇、蜜二糖、核糖醇、棉子糖、MR-VP)中,用封口膜封住,37℃培养箱中培养48 h,培养后观察并记录各鉴定管的变化。
1.6 NMGCF-19fimH-与NMGCF-19wild致病性的确定将24只小鼠随机分为4组,分别为NMGCF-19菌株接种组、NMGCF-19-F1菌株接种组、NMGCF-19-F3菌株接种组和正常对照组,每组6只,每组小鼠分别腹腔注射浓度为106CFU/0.1 mL的各菌株菌液(N-19、F1、F3)0.1 mL(即NMGCF-19wild的LD50值[3])或同体积生理盐水,接种后观察记录小鼠的活动状态与存活情况,并用GraphPad Prism 9.0软件绘制小鼠的生存曲线。对死亡或发病小鼠进行剖解,取小鼠肝脏、肾脏、肺脏等器官组织,用福尔马林固定后制作石蜡切片,进行 HE染色与病理组织学变化观察。同时,取小鼠脑组织进行涂片、革兰染色镜检并提取脑组织总RNA后反转录合成cDNA,用于脑组织中紧密连接蛋白的实时荧光定量PCR检测。紧密连接结构蛋白基因的引物根据 GenBank 上传的序列设计,各基因扩增的长度为 100 bp 左右,引物名称和序列如表2。
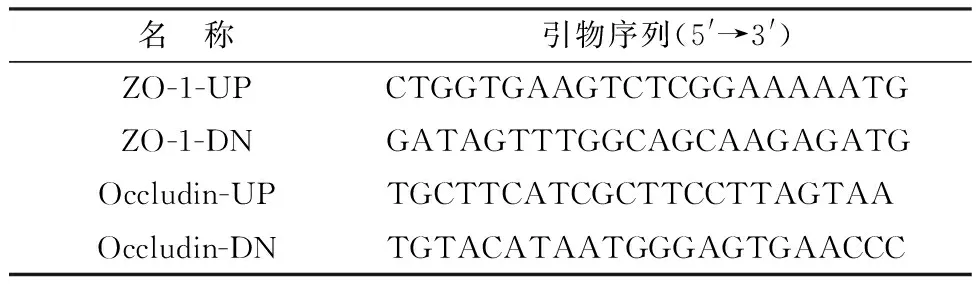
表2 荧光定量PCR引物序列
2 结果
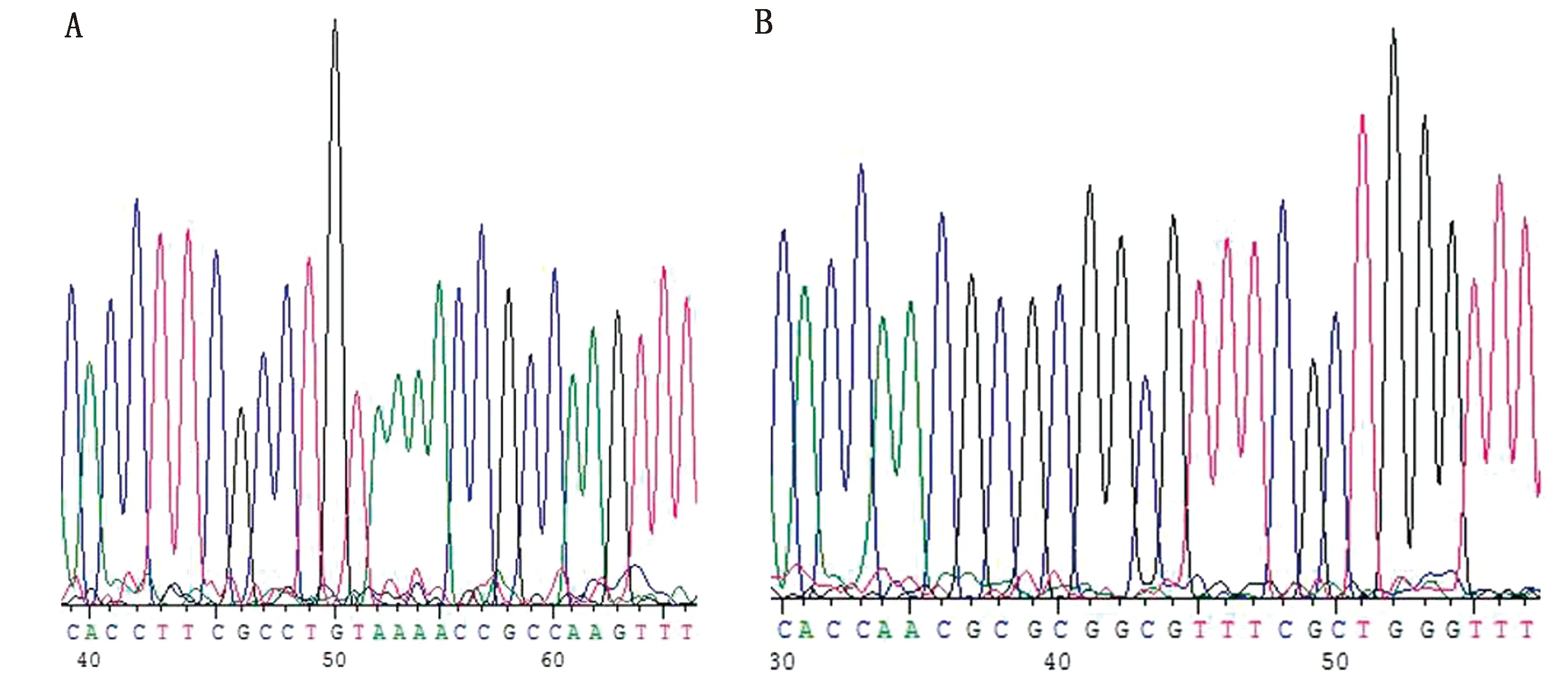
2.1 pwtCas9-fimH-sgRNA基因敲除载体的构建将设计的sgRNA引物经退火处理后与Bbs Ⅰ内切酶酶切的pX459质粒产物连接,连接产物转化大肠杆菌Top10感受态细胞,提取质粒经PCR验证阳性后进行基因测序鉴定。结果如图1所示,所构建的3种pwtCas9-fimH-sgRNA 基因敲除载体中只有pwtCas9-fimH-sgRNA1和pwtCas9-fimH-sgRNA3载体测序结果正确,构建成功率为66.7%。
2.2fimH基因转化效率验证将成功构建的pwtCas9-fimH-sgRNA基因敲除载体通过电穿孔转化到NMGCF-19菌株感受态细胞中,并涂布于含有氨苄青霉素的LB固体平板,12 h后的培养结果如图2所示。挑取单克隆摇菌后提取细菌基因组,PCR扩增片段测序确定fimH基因敲除,表明成功构建了NMGCF-19fimH-。
2.3 NMGCF-19fimH-与NMGCF-19wild的生长速率无显著性差异比浊法测定并绘制的NMGCF-19wild及NMGCF-19fimH-生长曲线如图3所示。F1基因敲除株生长速率与NMGCF-19wild基本相同,而F3基因敲除株生长速率与NMGCF-19wild相比略有降低。
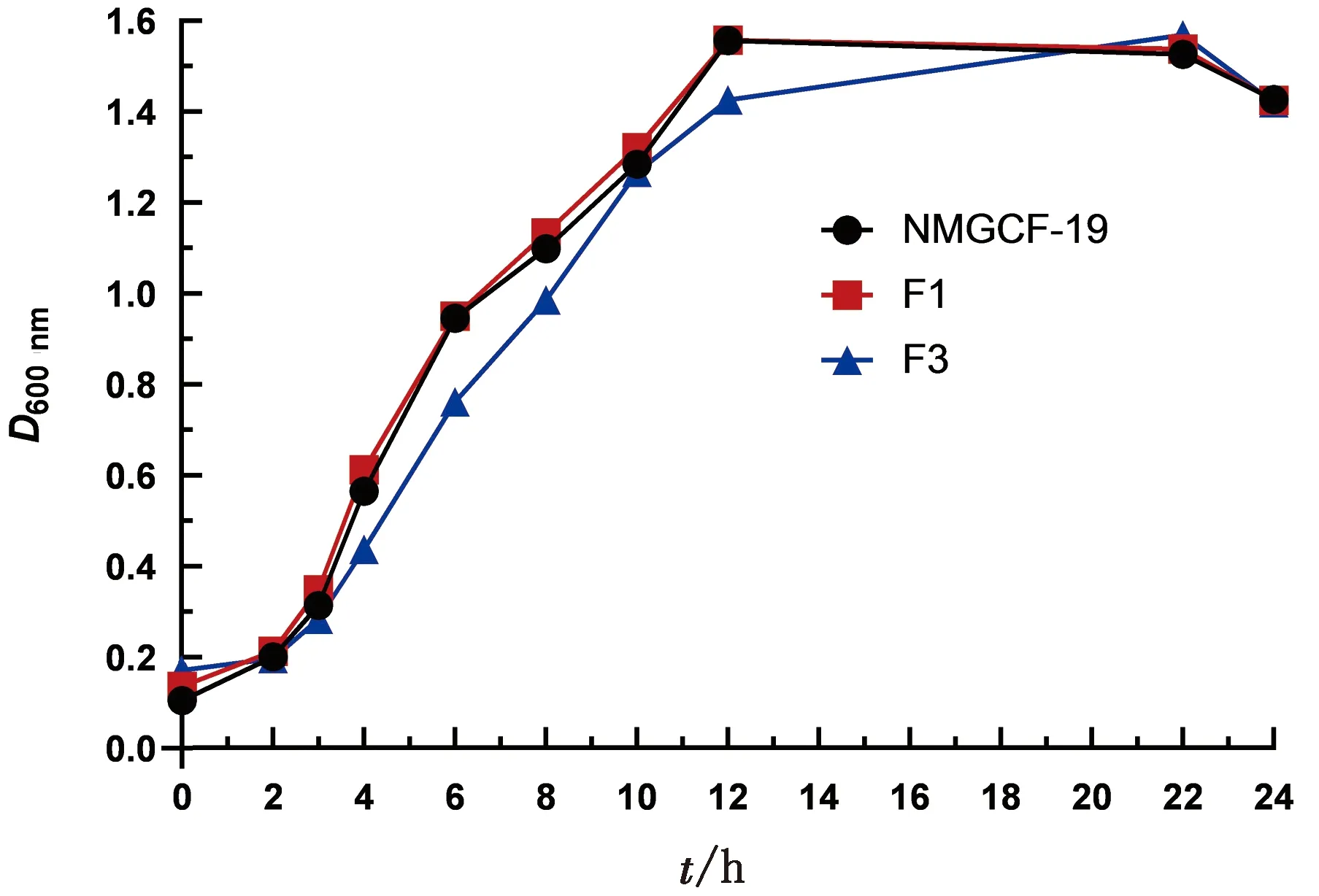
图3 NMGCF-19wild与fimH-sgRNA1(F1)和fimH-sgRNA3(F3)基因敲除菌株的细菌生长曲线
2.4 NMGCF-19fimH-与NMGCF-19wild的生化特性鉴定无显著性差异接种NMGCF-19fimH-(F1和F3)与NMGCF-19wild的生化鉴定管观察后结果记录如表3所示。NMGCF-19fimH-与NMGCF-19wild相比,只有在对鸟氨酸脱羧酶的利用上存在差异,鉴定结果NMGCF-19wild呈阴性,而NMGCF-19fimH-呈阳性。

表3 NMGCF-19fimH-与NMGCF-19wild生化特性鉴定结果
2.5 NMGCF-19fimH-的LD50值高于NMGCF-19wild将1.0×106CFU(即NMGCF-19wild的LD50值[1-2])的NMGCF-19fimH-和NMGCF-19wild腹腔注射小鼠,观察小鼠的活动状态及存活情况,记录结果如图4所示。所有腹腔注射NMGCF-19wild和fimH3基因敲除株的小鼠均在24 h内死亡,但在12 h时NMGCF-19wild感染的小鼠死亡4只,fimH3基因敲株感染小鼠死亡2只,而fimH1基因敲除株感染的小鼠有4只超过48 h仍存活。结果表明:NMGCF-19fimH-的LD50值与NMGCF-19wild相比明显增大。

图4 NMGCF-19fimH-与NMGCF-19wild的小鼠死亡曲线
2.6 NMGCF-19fimH-感染小鼠脑组织中菌体数量明显少于NMGCF-19wild将1.0×106CFU的NMGCF-19fimH-和NMGCF-19wild腹腔注射小鼠,24 h 后对脑组织进行涂片,革兰染色后镜下观察结果如图5所示。NMGCF-19fimH-感染的小鼠脑组织中未见有或仅见有少量菌体,而NMGCF-19wild感染小鼠脑组织见有大量的细菌,表明fimH基因敲除后能够通过小鼠血脑屏障的菌体数量显著减少。
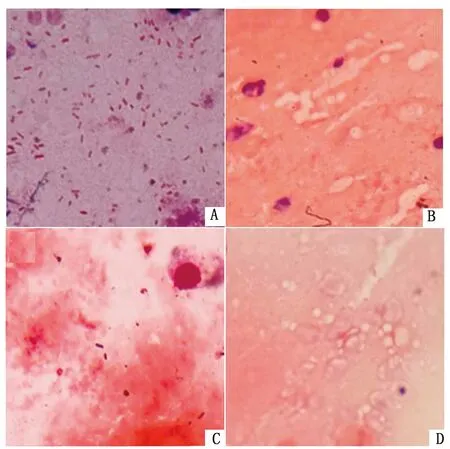
A.NMGCF-19wild感染;B.fimH1基因敲除株感染;C.fimH3基因敲除株感染;D.注射同体积生理盐水用作阴性对照
2.7 NMGCF-19fimH-感染小鼠器官组织的病理变化明显轻于NMGCF-19wild将1.0×106CFU的NMGCF-19fimH-和NMGCF-19wild腹腔注射小鼠,经24 h相同条件饲养后剖解小鼠,取其肝脏、肾脏、肺脏组织作石蜡切片,HE染色后镜下观察结果如图6所示。NMGCF-19fimH-感染引起的小鼠器官组织DIC、炎性浸润和组织细胞变性肿胀等病理变化程度与NMGCF-19wild相比明显减轻。
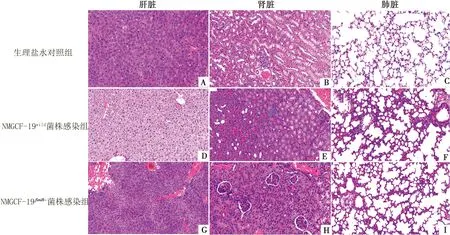
A,B,C.注射同体积生理盐水(正常健康状态)用作阴性对照的小鼠肝脏、肾脏、肺脏组织;D,E,F.分别为NMGCF-19wild感染小鼠的肝脏、肾脏、肺脏组织;G,H,I.NMGCF-19fimH-感染小鼠的肝脏、肾脏、肺脏组织
2.8 NMGCF-19fimH-感染对小鼠血脑屏障的破坏程度小于NMGCF-19wild本实验室前期研究发现大肠杆菌NMGCF-19菌株具有破坏动物血脑屏障而侵入脑组织的致病能力。为确定fimH基因敲除对脑组织血脑屏障的影响,运用qPCR方法检测小鼠脑组织中紧密连接蛋白的表达量。结果如图7所示,NMGCF-19fimH-(F1和F3)感染小鼠脑组织中紧密连接蛋白ZO-1和Occludin在核酸水平上的表达量与NMGCF-19wild相比显著上调,表明NMGCF-19fimH-对小鼠血脑屏障的破坏程度明显小于NMGCF-19wild。
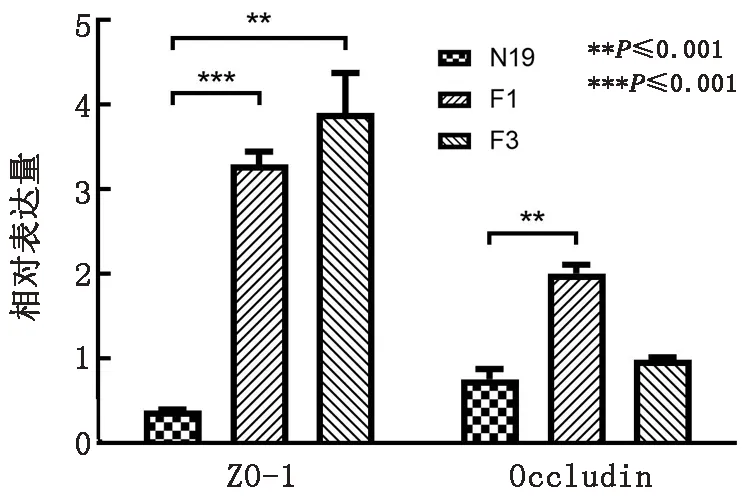
图7 qPCR检测NMGCF-19fimH-与NMGCF-19wild感染小鼠脑组织中ZO-1和Occludin核酸表达量
3 讨论
NMGCF-19菌株作为2019年本实验室从羔羊体内分离出的一种肠外致病性大肠杆菌[1-2],可引起动物诸多严重典型的组织器官病变,因此对其毒力因子和致病机制的研究具有重要意义。本实验室在前期已完成对该菌株的分离鉴定和全基因组的测序,并确定了NMGCF-19菌株具有突破动物血脑屏障进而引起脑膜脑炎的致病能力。本研究为了进一步探索NMGCF-19菌株的毒力基因及其初步致病机制,通过敲除某一潜在毒力基因和比较其与NMGCF-19wild对小鼠的致病性差异,确定基因的毒力。由于菌株的fimH基因蛋白与细菌Ⅰ型菌毛的黏附及免疫反应密切相关,并且我国目前对于大肠杆菌Ⅰ型菌毛的研究相对较少,因此我们选择fimH基因作为本试验所敲除的潜在毒力基因。由于目前常用基因敲除方法的自身局限性,我们转向选择CRISPR/Cas9基因编辑系统来进行基因敲除的操作。
通过设计sgRNA引物、退火、酶切、连接、转化、PCR及测序验证等方法,成功构建了pwtCas9-fimH-sgRNA基因敲除载体;将该载体电转NMGCF-19感受态细胞后,经验证成功构建了NMGCF-19fimH-。将NMGCF-19fimH-与NMGCF-19wild进行比较之后发现NMGCF-19fimH-具有与NMGCF-19wild不同的可以利用鸟氨酸脱羧酶的生物学特性,而细菌鸟氨酸脱羧酶在细菌生长、环境适应、抗生素抗性、生物膜形成等方面起到调节作用[26-29];在致病性方面,发现与NMGCF-19wild相比,NMGCF-19fimH-的LD50值更大,所引起动物组织器官病变的程度更弱,对动物血脑屏障的破坏性更小并且进入脑组织的菌体数量更少,这些结果表明,fimH基因的敲除可以在一定程度上降低NMGCF-19菌株的致病能力,即fimH基因为NMGCF-19菌株的毒力基因之一。
本研究确定了fimH基因为大肠杆菌NMGCF-19菌株的毒力基因之一,并为进一步阐明该菌株的致病机制和临床诊疗提供理论依据。
