酿酒酵母ARD1 对低温胁迫的响应及其互作蛋白的筛选
2023-11-26房楠楠宋瑶瑶宋育阳刘延琳
房楠楠,杜 青,宋瑶瑶,张 雪,李 莹,秦 义,宋育阳,刘延琳
(西北农林科技大学葡萄酒学院 陕西杨凌 712100)
葡萄酒酿造过程中,发酵温度对葡萄酒品质有重要的影响[1-2]。低温发酵常用于白葡萄酒和桃红葡萄酒的酿造,近几年研究者们引入低温发酵技术以增强红葡萄酒的芳香特征[3]。研究表明,较低的发酵温度(10~15 ℃)能更好地保留葡萄酒的香气,增加酯和脂肪酸的含量,提高葡萄酒的花果香;降低葡萄酒中高级醇和挥发酸的含量,减少败坏性气味物质的生成;同时也降低发酵过程中细菌污染的风险[4-6]。然而,酿酒酵母最适生长温度范围为25~32 ℃[7]。当发酵在低温下进行时,酵母的生长速率减缓,多种细胞的代谢过程发生变化[8],造成葡萄酒发酵缓慢,甚至发酵停止[9-12],因此酿酒酵母的低温耐受能力决定着低温发酵能否顺利进行[13-14]。近年来,研究者通过多种方式提高酵母的低温耐受能力,如Garcia等[15]和Ortiz等[16]通过酵母属种间杂交提高酿酒酵母的低温耐受能力。Chiva等[17]通过适应性进化、诱变筛选低温耐受的酵母菌,然而得到的菌株低温耐受能力并不理想。酿酒酵母的低温耐受性是由多基因控制的数量性状,其分子机制至今不清楚[18]。Gautschi等[19]研究发现,与对照相比,ARD1 基因缺失的菌株在20℃和38 ℃中的生长受到抑制,说明ARD1 基因可能参与酵母的温度胁迫适应性。本研究室人员前期报道了1 株低温耐受的本土酵母菌株(ZX11)[20]。基于此菌株,找到并证明ARD1 基因是与ZX11菌株低温耐受相关的基因。
ARD1 基因首次在酿酒酵母中被报道[21],它作为Nα-末端乙酰基转移酶NatA 的催化亚基,是NatA 酶行使乙酰化功能必不可少的基因[22]。Ard1p可与核糖体稳定结合,介导NatA 复合物对蛋白质进行N-末端乙酰化修饰。由于NatA 具有较多的细胞底物[23],ARD1 还具有广泛的兼职功能,比如ARD1 具有KAT 活性,介导催化ε-氨基的乙酰化,并刺激细胞增殖[24-25];介导HSP70 乙酰化来调节平衡蛋白质的复性、降解反应[26];与PIX(一种鸟嘌呤核苷酸交换因子GEF)相互作用,发挥其抗转移功能,抑制细胞的迁移能力[23]。酵母中ARD1 基因的研究较少。Whiteway等[27]提出ARD1 介导酵母孢子的形成,进而影响细胞的有丝分裂周期。
本研究通过基因敲除、基因回补等方法证明ARD1 基因与酿酒酵母ZX11 的低温耐受的相关性。利用GST-Pull down 联合质谱检测,酵母双杂交验证由CBK1 编码的Cbk1p 蛋白和ARD1 编码的Ard1p 蛋白互作,为阐明ZX11 响应低温胁迫的分子机制奠定基础,为选育优良的低温耐受酿酒酵母提供理论参考。
1 材料与方法
1.1 材料及试剂
本试验所用菌株:野生型酵母菌株ZX11 为本实验室保存。大肠杆菌DH5α、大肠杆菌BL21(DE3)、酵母菌Y2HGold 购自普因特生物技术有限公司。
本试验所用质粒:pUG6SH(带有潮霉素抗性基因)、pGEX-4T-1、PGADT7、PGBKT7、PGADT7-T、PGBKT7 -p53、PGBKT7 -Lam、pCDF -MCS1 -AtUBA1 质粒由本实验室保存;GST-ARD1、GSTCBK1、His-ARD1 为本研究构建。
试剂及试剂盒:葡萄糖、蛋白胨、酵母浸粉、琼脂、胰蛋白胨、YNB、-Ura DO Supplement、Amp、潮霉素等试剂购自宝生物生物科技有限公司;限制性内切酶(EcoR I、BamH I、Spe I)、蛋白Marker、Primestar Max Premix(2×)、1×SDS loading buffer、X-ɑ-Gal、还原型谷胱甘肽等分子生物学试剂、缺陷培养基购自宝生物生物科技有限公司;大肠质粒提取试剂盒,购自OMGA 公司;MangneGSTTMparticles 和MagneGSTTMBinding/Wash Buffer,购自Promega 公司;酵母总蛋白提取试剂盒,购自贝博生物试剂有限公司;Anti-His 多克隆抗体、Anti-FLAG 多克隆抗体、Anti-GFP 多克隆抗体、二抗Anti -IgG,购 自 Affinity Biosciences;Proleinlso GST Resin、GST 平衡缓冲液、Ni-NTA预装重力柱,购自Sangon 公司。
1.2 方法
1.2.1 基因敲除及基因回补载体构建 通过NCBI 查阅目的基因ARD1 的参考序列(Gene ID:856404),酿酒酵母的参考菌株为Saccharomyces cerevisiae S288c(strain:S288c),利用软件CE Design V1.04 设计含有45 bp 左右的同源臂的引物KO-Hph-ARD1-F(ACCTAAATACATACGATC AAGCTCCAAAATAAAACTTCGTCAACCCATATG GACATATTGTCGTTAGA)和KO-Hph-ARD1-R(AGAAGCCTGGATGAAAATATACTACGTTTATAT AGGTTGATTTAAAATACGACTCACTATAGGGAG AC),以pUG6SH 为模板PCR 扩增敲除框(潮霉素抗性基因),参考冯莉[20]的方法转化至ZX11 菌株中。取100 μL 菌液涂布在含有潮霉素的YPD 平板上,30 ℃过夜培养,挑取阳性克隆接种于50 mL的YPD 培养基中,30 ℃,150 r/min 培养12~16 h,参考冯莉[20]的方法提ZX11 基因组,以ard1-F(CAGCAACGAGTAATTGCCAAGTG)和ard1-R(CTGCAGTGTTTAGAACCGTGCTC)为验证引物,通过PCR 扩增敲除框片段,并送到擎科生物有限公司进行测序。
利用限制性内切酶Spe I 和EcoR I 对pY26载体线性化处理,插入片段获得以SpeI-ARD1-pY26T-F(TCGACGGATTCTAGAACTAGTCGAAGTATGCCTATTAATATTCGCAGAGC)和 ARD1 -EcoRI-pY26T-R(CGACGGTATCGATAAGCTTGA TATCGAATTCTTATACAATGATATCATTTACGCC)为引物,以ZX11 基因组为模板PCR 扩增。利用一步克隆试剂盒将片段和载体连接,构建pY26 -ARD1 重组质粒转化至大肠杆菌DH5α,提取阳性菌株质粒以 pY26C -F(GGACAGGTATCCGGTAAGCG)和pY26C-R(CGTACACGCGTCTGTACAGA)为验证引物,通过PCR 扩增后,送到擎科生物有限公司进行测序。
1.2.2 菌株的低温胁迫处理 取待测菌株50 μL接种于50 mL 的YPD 液体培养基中,30 ℃,150 r/min 过夜培养,取适量菌液转接于新的50 mL 的YPD 培养基中,使其初始OD600nm值为0.1,于4 ℃,150 r/min 培养,每48 h 测1 次OD600nm值,以在30 ℃生长的菌株做对照,观测其生长曲线。
将pY26-ARD1 质粒转化至ZX11△ard1 菌中,回补ARD1 基因,构建ARD1-ZX11△ard1 菌株,在SD-Ura 培养基中培养1~2 d 后,用无菌水将菌液稀释到OD600nm值为1,再进行梯度稀释10-1~10-4,从每个梯度稀释液中取2 μL 点样于YPD 固体培养基上,4 ℃下培养16 d,以30 ℃生长的菌株做对照,进一步验证ARD1 与低温胁迫的相关性。
1.2.3 GST-Pull down 联合质谱分析筛选互作蛋白 GST-Pull down 试验方法按照Promega 公司的MagneGSTTMPull Down System 进行。
1)表达载体构建及融合蛋白的表达纯化 参照1.2.1 节的方法构建重组质粒GST-ARD1,将质粒转化至大肠杆菌BL21(DE3)中,以GST 质粒为对照。取50 μL 菌液加入30 mL 的LB(+Amp)培养基中,37 ℃,200 r/min 培养活化;将培养物按1∶100 比例接入200 mL LB(+Amp)液体培养基中,200 r/min,37 ℃培养至OD600=0.4~0.6;以预试验确定的最佳IPTG 浓度、时间和温度诱导表达融合蛋白。4 ℃,5 000 r/min 离心5 min 后弃培养液,用30 mL GST 缓冲液重悬菌体;用低温超高压连续流细胞破碎仪破碎2~3 次,4 ℃,12 000 r/min 离心30 min 留上清,过0.22 μm 的滤膜。取80 μL MagneGSTTM磁珠于2 mL 的PE管中,用MagneGSTTM Binding 平衡柱子。取400 μL 上一步诱导表达的融合蛋白上清液于磁珠中,4 ℃旋转孵育,用500 μL Wash Buffer 洗脱杂蛋白。取出GST-ARD1 诱饵蛋白和GST-磁珠的混合物,GST标签蛋白与GST-磁珠的混合物。
2)酵母总蛋白的提取 参考贝博公司的酵母总蛋白提取试剂盒说明书提供的步骤,提取ZX11 酵母总蛋白。
3)ARD1 互作蛋白的筛选 将ZX11 酵母总蛋白过0.22 μm 滤膜,取400 μL 分别与上一步得到两组蛋白-磁珠混合物混合,4 ℃旋转孵育,用500 μL 的Wash Buffer 洗脱杂蛋白。洗涤完成后加 入40 μL 1×SDS loading buffer,95 ℃煮 沸5 min,将蛋白混合样品分离。所得溶液是通过GSTPull down 初步筛选到的互作蛋白混合液,取20 μL 混合液进行SDS-PAGE 检测。
1.2.4 LC-MS/MS 筛选互作蛋白 将上一步得到的蛋白胶用手术刀片切下整个泳道,并将目的条带切成1 mm2大小的胶块置于5 mL 的EP 管中,加入无菌水在室温下进行脱色处理,至胶块无色透明,送到陕西致研生物科技有限公司进行质谱检测。
1.2.5 酵母双杂交(Yeast Two-Hybrid Assays)检验互作蛋白 参照1.2.1 节的方法构建重组质粒pGBKT7-ARD1 和pGADT7-Prey 质粒,转化至酵母菌株Y2H Gold,30 ℃,150 r/min 培养1~2 d,用无菌水将菌液稀释到OD600nm值为1,取2 μL 菌液点样于相应的SD 固体培养基上,30 ℃培养3~5 d,观察酵母菌生长状况和菌落颜色变化。
1)自激活验证 按照上述步骤,将2~5 μg pGBKT7-ARD1 转化至酵母Y2HGold 中,再将pGADT7 转化至酵母pGBKT7-ARD1(Y2HGold)中,涂布在DDO(-Leu/-Trp/SD)培养基上,生长3~5 d,挑取单菌落接种于DDO 液体培养基,在30 ℃下培养2~3 d,吸取2 μL 酵母菌液点样于TDO(-Leu/-Trp/-His/SD/X-ɑ-Gal)固体培养基上,30 ℃培养3~5 d,观察酵母菌生长状况和菌落颜色变化。
2)蛋白互作验证 将pGBKT7-ARD1 和pGADT7-Prey 共同转化至酵母Y2HGold 中,同时将阳性对照(pGBKT7-53 和pGADT7-T)和阴性对照(pGBKT7-Lam 和pGADT7-T)共同转化至Y2HGold 中,分别涂布在DDO 培养基上,生长3~5 d,挑取单菌落接种于DDO 液体培养基,在30℃下培养2~3 d,吸取2 μL 酵母菌液点样于QDO(-Leu/-Trp/-His/-Ade/SD/X-ɑ-Gal)固体培养基上,30 ℃培养3~5 d,观察酵母菌生长状况和菌落颜色变化。
1.2.6 GST-Pull down 验证互作蛋白 参照1.2.1节的方法构建重组质粒His-ARD1 和GST-Prey质粒。本试验设置2 组对照组和1 组试验组。对照组1 为His 质粒与GST-Prey 质粒共同转化至BL21(DE3)中,对照组2 为His-ARD1 质粒与GST 质粒共转至BL21(DE3)中,试验组为His-ARD1 和GST-Prey 质粒共同转化至大肠杆菌BL21(DE3)中。
试验组和对照组1 用Proleinlso GST Resin对融合蛋白进行分离纯化。取1 mL 50%的谷胱甘肽-琼脂糖树脂匀浆,用5~10 倍柱体积的GST 平衡缓冲液平衡层析柱,至流出液电导和pH 值不变(与平衡液一致);取35 mL 的融合蛋白与Proleinlso GST Resin 混合,在4 ℃下孵育5~10 h;用10 倍柱体积的平衡缓冲液洗涤层析柱,收集流出液;用洗脱缓冲液(50 mmol/L Tris-HCl pH 8.0,10 mmol/L 还原型谷胱甘肽)洗脱并收集蛋白混合样品;取80 μL 蛋白混合样品加 入20 μL 5×loading buffer,95 ℃煮沸5 min,所得溶液即猎物蛋白和诱饵蛋白的混合液。
对照组2 用Ni-NTA 对融合蛋白进行分离纯化。取1 mL 50% 的Ni-NTA 匀浆,用5~10 倍柱体积的平衡缓冲液(20 mmol/L Tris-HCL pH 7.5、0.5 mol/L NaCl、10%甘油、5 mmol/L 的咪唑)平衡层析柱;取35 mL 的融合蛋白与Ni-NTA 混合,在4 ℃下孵育5~10 h;用10 倍柱体积的平衡缓冲液(20 mmol/L Tris-HCL pH 7.5、0.5 mol/L NaCl、10%甘油、20 mmol/L 的咪唑)洗涤层析柱,收集流出液;用洗脱缓冲液(20 mmol/L Tris-HCL pH 7.5、0.5 mol/L NaCl、10%甘油、150 mmol/L咪唑)洗脱并收集蛋白混合样品;取80 μL 蛋白混合样品加入20 μL 5×loading buffer,95 ℃煮沸5 min。分别取20 μL 上述样品进行SDS-PAGE 电泳检测,并进行Western Blot 检测。
2 结果
2.1 基因敲除与基因回补载体构建
用验证引物PCR 扩增同源重组在ZX11 基因组上的潮霉素抗性基因,核酸电泳检测片段长度应为1 999 bp(如图1a)与预期相符,经测序进一步确认ARD1 基因敲除成功;用验证引物PCR 扩增重组质粒GST-ARD1,核酸电泳检测插入片段长度应为1 168 bp(如图1b),经测序表明目的片段插入无误,重组表达载体构建成功。

图1 ARD1 基因敲除与基因回补载体构建Fig.1 Construction of ARD1 gene knockout and gene complementation vector
2.2 菌株的低温胁迫响应
为了验证ARD1 与野生型酿酒酵母ZX11 耐受低温的关系,本研究测试了30 ℃和4 ℃下ZX11 与ZX11△ard1 突变菌株在YPD 液体培养基中的生长状况。绘制的两组菌株生长曲线,如图2 所示,在30 ℃下,两组菌株的生长趋势差异不大。生长8 h 后两组菌几乎同时进入稳定生长期。在4 ℃下,ZX11 在整个生长周期中有明显的生长优势,其在对数生长期生长较快,仅用200 h 进入稳定生长期,OD600值稳定在5.2 左右。与在30 ℃下生长的趋势相似。ZX11△ard1 没有明显的生长拐点,生长缓慢,生长400 h 后OD600nm值趋于稳定,OD600值稳定在3 左右,与该条件下ZX11 菌株差异较大,也与在30 ℃下的生长有显著差异。该结果说明ARD1 基因敲除影响ZX11 菌株在低温条件下的生长。
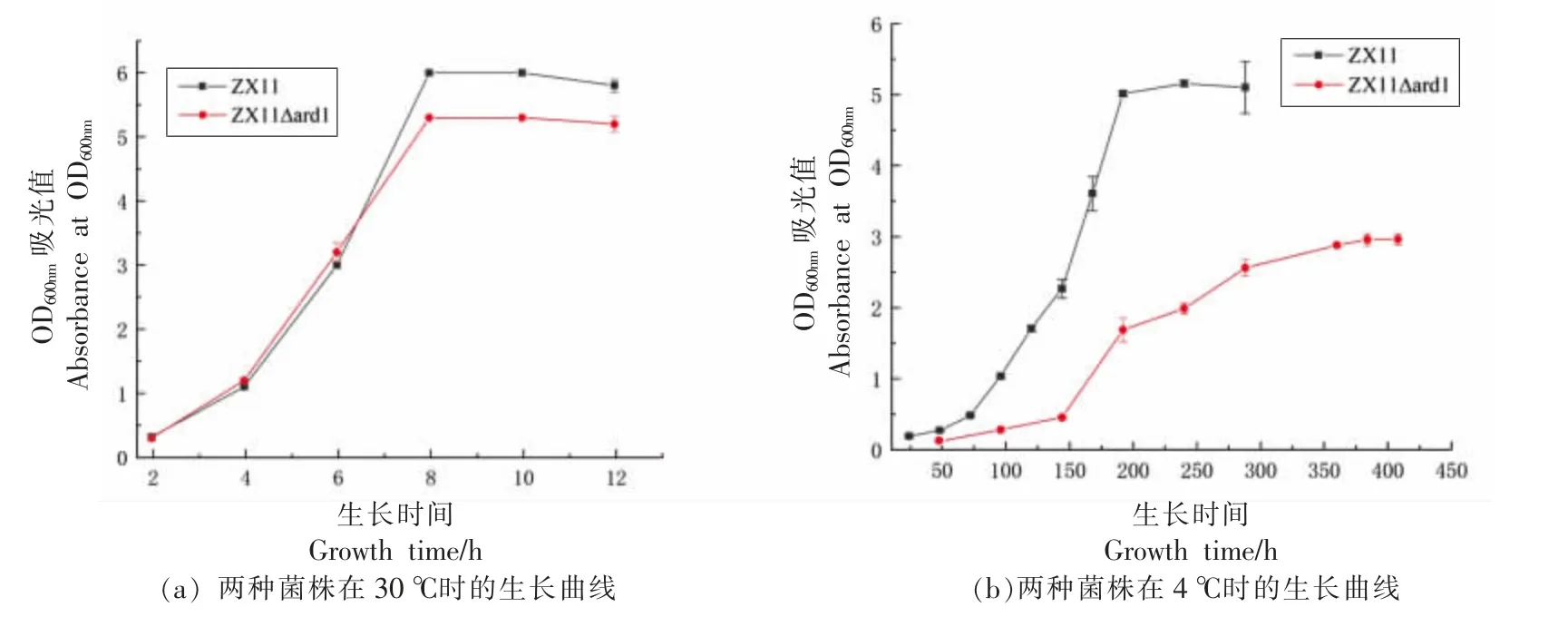
图2 不同温度条件下ZX11 和突变菌株(ZX11△ard1)的生长曲线Fig.2 Growth curves of ZX11 and mutant strain(ZX11△ard1)at different temperatures
将ARD1 基因回补到ARD1 敲除菌株ZX11△ard1 中,在30 ℃和4 ℃环境下的生长情况如图3 所示。在30 ℃中,3 组菌斑在每个浓度梯度下差异较小。4 ℃环境中,ZX11△ard1 菌斑在OD600nm为1 的时候就有差异,从10-1到10-4浓度下几乎没有生长,说明敲除ARD1 基因后,菌株在低温环境下生长受到抑制。ZX11△ard1 回补ARD1 基因后,菌斑大小又恢复到原来的状态,说明ARD1 基因对ZX11 菌株在低温环境下的生长起着关键的作用。

图3 不同温度环境下ZX11、突变菌株(ZX11△ard1)和突变菌株回补ARD1 基因的生长状况Fig.3 Growth status of ZX11,mutant strain(ZX11△ard1)and mutant strain complementing ARD1 gene at different temperatures
2.3 表达载体构建及融合蛋白的表达纯化
GST-ARD1 和GST 表达载体转化大肠杆菌DH5α 菌株,培养并提取质粒后转化BL21(DE3)表达菌株,IPTG 诱导表达 GST-ARD1 诱饵蛋白和GST 标签蛋白,预试验中最佳诱导表达条件是添加0.2 mmol/L IPTG,于16 ℃下诱导培养18 h,该条件下,上清液中的蛋白表达比较均一且表达量稳定,融合蛋白GST-ARD1 分子质量55.3 ku,标签蛋白GST 分子质量27.9 ku。通过GST-磁珠纯化,结果如图4 所示,大部分杂蛋白消失,得到纯度较高的带有GST 标签的融合蛋白。
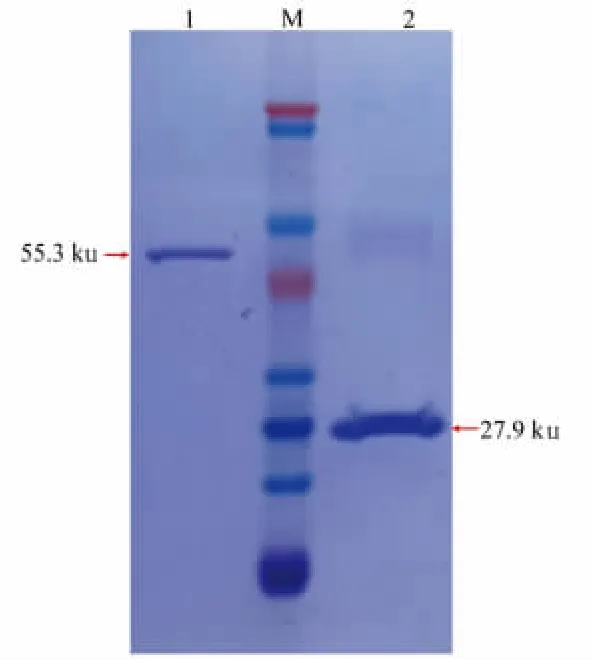
图4 融合蛋白GST-ARD1 和标签蛋白GST 的表达纯化Fig.4 Expression and purification of GST-ARD1 fusion protein and GST-tagged protein
2.4 GST-Pull down 联合质谱分析筛选互作蛋白
2.4.1 GST-Pull down 筛选互作蛋白 成功提取ZX11 的总蛋白,然后将总蛋白分别与结合在GST-磁珠上的GST-ARD1 诱饵蛋白和GST 标签蛋白进行孵育,煮脱的混合蛋白样品经SDSPAGE 进行检测,结果如图5 所示,纯化后的诱饵蛋白可以与GST 磁珠亲和,融合蛋白GST-ARD1分子质量55.3 ku,标签蛋白GST 分子质量27.9 ku。除去对照组条带,试验组仍有差异条带,说明目的蛋白在ZX11 总蛋白中钓取了部分互作蛋白。
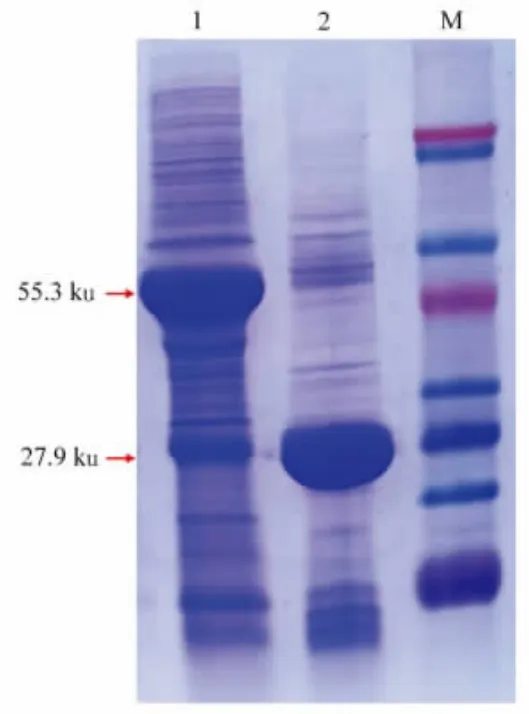
图5 混合蛋白样品的SDS-PAGE 检测Fig.5 SDS-PAGE detection of mixed protein samples
2.4.2 质谱分析互作蛋白 通过质谱鉴定,首先选择只在GST-ARD1 试验组中被鉴定到的蛋白,并剔除存在于GST 对照组中的蛋白。根据蛋白亚细胞定位信息以及已经报道的蛋白质功能,筛选到12 种可能与ARD1 相互作用的蛋白质,如表1所示。

表1 LC-MS/MS 鉴定的ARD1 相互作用蛋白Table 1 ARD1 interacting proteins identified by LC-MS/MS
2.5 酵母双杂交(Yeast Two-Hybrid Assays)检测互作蛋白
2.5.1 pGBKT7-ARD1 自激活检测 用一步克隆试剂盒构建pGBKT7-ARD1 和pGADT7-CBK1重组载体,经电泳检测和测序,鉴定重组载体构建成功。分别将pGBKT7-53 和pGADT7-T(阳性对照)、pGBKT7 -Lam 和pGADT7-T(阴性对照)以及pGBKT7-ARD1 和pGADT7(试验组)共同转化至Y2HGold 酵母中。
取3 组菌液点样在相应的平板上,菌株生长情况如图6a 所示。均在TDO 的平板生长,说明质粒转化成功,阳性对照在QDO/X-ɑ-Gal 的固体培养基上生长,阴性对照和试验组没有在QDO/Xɑ-Gal 的固体培养基上生长,说明ARD1 基因没有自激活作用。

图6 酵母双杂自激活检测及互作验证Fig.6 Yeast two-hybrid self-activation detection and interaction verification
2.5.2 蛋白互作关系验证 取3 组菌液点样在相应的平板上,均在TDO 固体培养基上生长,说明质粒转化成功,阴性对照没有在DDO/X-ɑ-Gal 的固体培养基上生长,阳性对照和pGADT7-CBK1在DDO/X-ɑ-Gal 固体培养基上生长并变色(如图6b),说明ARD1 基与CBK1 在酵母中存在互作。
2.6 GST-Pull down 验证互作蛋白
将对照组和试验组的混合蛋白样品进行SDS-PAGE 电泳结果如图7a 所示。对照组1 中有融合蛋白GST-CBK1,分子质量为114.6 ku。对照组2 中有His-ARD1 融合蛋白,分子质量为31 ku,试验组中分别检测到GST-CBK1 和His-ARD1 蛋白。结合免疫共沉淀结果,如图7b 所示,试验组中检测到Cbk1p 和Ard1p 蛋白,即CBK1与ARD1 结合,说明CBK1 与ARD1 在体外存在直接相互作用。

图7 GST-Pull down 点对点验证ARD1 与CBK1 的相互作用Fig.7 GST-Pull down peer-to-peer verification of the interaction between ARD1 and CBK1
3 讨论与结论
本研究通过基因敲除和基因回补,构建了ZX11△ard1 和ARD1-ZX11△ard1 突变体菌株,研究它们在30 ℃和4 ℃下的生长表型,确定了ARD1 基因是与酿酒酵母ZX11 低温耐受相关的基因;通过GST-Pull down 联合质谱分析获得了与Ard1p 互作的蛋白Cbk1p,用酵母双杂交技术和GST pull-down 验证了两个在体外和酵母体内均存在互作。CBK1 是AGC 激酶家族的成员之一,与NDR 蛋白激酶关系密切[28]。在酿酒酵母中,Cbk1p 通过多位点磷酸化,负责几丁质酶转录的转录因子Ace2p 的激活,调控细胞周期[29],这种调控对ACE2 细胞的定位和酵母生长过程中的细胞分离十分重要[4]。Wakade等[30]研究发现,在酵母生长阶段,CBK1 可以磷酸化调节多个基因来影响酵母的生长分裂,例如,CBK1 通过磷酸化SSD1,影响酵母细胞壁的合成,进而影响细胞的有丝分裂。
因此CBK1 基因和酵母的生长繁殖与细胞壁功能有着密切的联系,而细胞壁对于酵母响应低温胁迫有关键作用[31],ARD1 在低温条件下可能通过与CBK1 相互作用来参与酵母细胞的分裂过程,影响细胞壁完整性,从而调控酵母低温耐受能力。本研究结果对深入研究ARD1 基因调控酿酒酵母低温耐受的分子机制具有重要意义。
