异常毕赤酵母和纤维素酶对青贮甜高粱产甲烷潜力的影响*
2023-11-23任海伟李仲琦赵亚宁丁闻浩张丙云李金平刘瑞媛李连华孙永明
任海伟 ,李仲琦 ,赵亚宁 ,丁闻浩 ,张丙云 ,李金平 ,陆 栋,刘瑞媛,李连华,孙永明
(1. 兰州理工大学生命科学与工程学院 兰州 730050;2. 甘肃省生物质能与太阳能互补供能系统重点实验室 兰州 730050;3. 中国科学院近代物理研究所 兰州 730000;4. 中国科学院广州能源研究所 广州 510640)
大力发展可再生能源,从源头减少碳排放,降低化石能源依赖,是我国实现“双碳”目标、加快生态文明建设的必然选择。生物天然气(沼气)是农牧有机废弃物经厌氧消化和净化提纯产生的绿色低碳清洁能源。利用厌氧消化技术将有机物中的碳能源转化为生物甲烷,既有利于农牧废弃物的循环利用,还有助于缓解气候变化。甜高粱(Sorghum bicolor)是一种生长特性优良的C4 能源作物,具有光合作用强、抗逆性好、生长速度快、生物量高等优势,在我国甘肃、青海、新疆等西北半干旱地区广泛种植,其中甘肃省种植面积约10 万hm2。据测算,甜高粱产甲烷潜力可达223~420 mL·g-1(VS),每公顷的青贮甜高粱可产生4440 Nm3的生物甲烷,与玉米(Zea mays)相当,折合发电量约76.6~179.5 GJ·hm-2,高于小麦(Tritium aestivum)秸秆和柳枝稷(Panicum virgatum)等,可作为玉米生物能源的替代品[1]。然而,甜高粱作为一种典型的非粮生物质资源,表面覆有硅氧蜡质层,其复杂的木质纤维组分(纤维素、半纤维素和木质素等)和顽固的抗降解屏障结构很难被微生物高效降解利用,进而影响其生物能源转化效率[2]。其次,甜高粱的种植生产具有明显的收获季节性,且收获后极易被微生物污染致使可溶性糖变质或损失,与生物天然气工程要求的原料连续稳定供给存在结构性矛盾。再者,新鲜甜高粱含有毒氰苷和抗营养单宁,在厌氧消化产甲烷过程中会释放对产甲烷菌有毒的氢氰酸[3]。这些因素都会对甜高粱的厌氧消化产甲烷过程造成不利影响[4]。因此,亟需探索一种集甜高粱长时间保质贮存和强化预处理于一体的新方法,从而实现甜高粱贮存的同时进行强化预处理,以(贮存)时间换取(产能)空间,最终提高生物质转化效率。
青贮既是一种成本低廉的生物质保存方法,也蕴藏有一定的生化预处理作用,使结构性碳水化合物更易被酶或微生物水解利用,从而有效缩短厌氧发酵周期,提高产甲烷效能,降低生产成本,尤其加入乳酸菌、酵母菌、生物酶等添加剂可以促进生物质解聚,调控效果更好[2]。Wang 等[5]认为布氏乳杆菌(Lactobacillus buchneri)、植物乳杆菌(Lactobacillus plantarum)、戊糖片球菌(Pediococcus pentosaceus)等复合添加剂的应用显著提升青贮质量,并且能明显促进木质纤维组分的降解。Kaewpila 等[6]发现甜高粱青贮时添加植物乳杆菌不仅能有效改善乳酸发酵,还能提高累计产气量和甲烷产量。Antonopoulou等[7]发现甜高粱青贮时添加纤维素酶可作用于非结晶区,能有效降解木质纤维素。Zhao 等[8]发现水稻(Oryza sativa)秸秆在青贮中添加纤维素酶能使其纤维组分含量下降,可溶性碳水化合物含量上升,增加对发酵有利的微生物菌种多样性。另外,也可以通过纤维素酶在厌氧消化前对消化原料进行生物预处理,使原料结构被破坏并发生水解作用,从而提高厌氧消化的甲烷产量。Garcia 等[9]认为使用纤维素酶、纤维二糖酶对甜高粱进行酶预处理,对其产甲烷性能有一定促进作用。李秋园[10]发现利用纤维素酶对木糖渣预处理能大幅度提高原料沼气生产能力。由此可见,纤维素酶是一种高效的生物催化酶,不仅能低损耗保存生物质材料,将纤维素安全高效地降解为还原糖,促进乳酸菌发酵,还能提高原料利用率与甲烷产量。但由于生物酶制剂成本相对较高,还需要拓宽寻找新的微生物添加剂。
酵母菌也可以用作青贮添加剂,添加酿酒酵母(Sacharomy cescerevisiae)、奇异酵母(Saaccharmy cesparadoxus)等能抑制真菌繁殖,降低霉菌污染,还能调控乳酸菌代谢从而减少营养物质损耗[11]。然而,高剂量(108CFU·g-1)酿酒酵母在青贮玉米中会显著提高其pH 和氨氮(NH4+-N)含量,降低有机酸含量和有氧稳定性;并且酿酒酵母还会在青贮过程中促进酒精发酵,将糖转化为乙醇和二氧化碳,使得可溶性碳水化合物(WSC)和干物质(DM)损失[12-13]。因此,有必要寻找新的酵母菌剂进行青贮调控。异常毕赤酵母(Pichia anomala)是一种广具前景、安全无毒的嗜杀酵母,具有抗真菌、降低抗营养物质和提高蛋白等作用,还对厌氧、高渗透压、低pH 和低水分活度等极端环境有很好的耐受性。它能利用分泌的嗜杀蛋白抑制甚至杀死腐败真菌的生长,具有良好生物控制作用,常用于果蔬、谷物等粮食贮存[14]。异常毕赤酵母还能产生内切葡聚糖酶,对羧甲基纤维素具有水解作用,能破坏秸秆木质纤维组分[15]。异常毕赤酵母细胞外还存在大量植酸酶,可提高青贮料的蛋白质利用率[16]。Tayel 等[17]认为异常毕赤酵母产生的外切几丁质酶和β-1,3 葡聚糖酶能抑制黄曲霉生长,具有抗真菌活性。Olstorpe 等[18]发现在谷物饲料青贮中接种异常毕赤酵母可以减少霉菌和肠杆菌含量。任海伟等[19]认为接种异常毕赤酵母能有效减少玉米秸秆与白菜(Brassica campestris)混贮料的营养组分损失,降低纤维组分含量,改善混贮品质。因此,异常毕赤酵母可以作为一种调控青贮效果的策略选择,但其用于甜高粱青贮过程以及作为预处理对后续厌氧消化产甲烷影响的研究还鲜有报道。
本文以甜高粱的青贮保存和生物甲烷化利用为目标,选用异常毕赤酵母、纤维素酶作为青贮添加剂,系统研究不同添加剂组合对甜高粱青贮质量、生物甲烷潜力(BMP)、厌氧消化动力学、消化系统稳定性及其微生物群落的影响,进而探讨不同添加剂对甜高粱青贮质量和产甲烷潜力的调控效果,最后通过经济性分析筛选适宜的生物强化添加剂。
1 材料与方法
1.1 材料
鲜绿全株甜高粱取自中国科学院近代物理研究所白银种植基地,甜高粱植株收获后迅速运回实验室,铡刀切碎至1~2 cm 长度。青贮用纤维素酶(参照GB/T 35808-2018 测得羧甲基纤维素酶活力50 000 U·g-1)购自宁夏和氏璧生物技术有限公司,最适温度35 ℃,最适pH 4.4;3 g 纤维素酶溶于70 mL的蒸馏水。青贮用异常毕赤酵母菌(CICC 1716)购自中国农业微生物菌种保藏中心,按照说明书活化后接种至PDA 培养基,于28 ℃培养72 h 制成菌悬液。厌氧消化污泥取自甘肃荷斯坦奶牛示范中心沼气工程发酵罐[(35±1) ℃],取回实验室后驯化处理、100 目尼龙纱布过滤备用[20]。厌氧消化用的接种污泥干物质(DM)和挥发性固体(VS)含量分别为(30.8±1.02) g·kg-1(FW)和(10.9±0.58) g·kg-1(DM)。
1.2 试验方法
1.2.1 甜高粱青贮试验设计
准确称取4 kg 甜高粱碎段,依据青贮原理,添加剂加入量均以原料鲜重(fresh weight,FW)为基础,每1 kg 甜高粱使用喷壶均匀喷洒不同的生物添加剂或是等体积蒸馏水调节秸秆水分至70%~75%;再每份0.33 kg 装入聚乙烯袋(45 cm×30 cm),用真空包装机抽真空密封,于室温[(20±2) ℃]避光贮藏21 d 后完成青贮发酵,第22 天开封取样分析有机组分和发酵特性等指标[21]。试验设置1 个对照组(SS 组,每袋原料均匀喷洒70 mL 的蒸馏水)和3 个添加剂处理组: 异常毕赤酵母组(Pa 组,异常毕赤酵母接种量为1×106CFU·g-1,每袋原料均匀喷洒70 mL 浓度为1.43×107CFU·mL-1的异常毕赤酵母菌悬液)、纤维素酶组(Cx 组,纤维素酶添加量为0.3%,每袋原料均匀喷洒70 mL 浓度为0.04 g·mL-1纤维素酶溶液)和菌酶协同处理组(PC 组,同时添加异常毕赤酵母和纤维素酶,添加量同上,每袋原料均匀喷洒35 mL 浓度为2.86×107CFU·mL-1异常毕赤酵母菌悬液和35 mL浓度为0.08 g·mL-1纤维素酶溶液),每组3 个平行。
1.2.2 青贮前后的甜高粱产甲烷潜力评价
利用AMPTSII 全自动甲烷潜力系统评价新鲜或青贮甜高粱的产甲烷性能。厌氧消化条件: 发酵罐的装罐率为80%,底物添加量VS接种污泥∶VS底物=2∶1,添加蒸馏水补足发酵体积至400 mL,搅拌速率80 r·min-1,搅拌频率10 min·h-1。厌氧消化底物为1 个未青贮原料(CK)和4 个处理组(SS、Pa、Cx 和PC)完成21 d 青贮发酵的材料,每组材料3 个平行。过滤并混合均匀的接种物与消化底物按比例添加迅速摇匀后通入3 min 氮气以排除多余空气,中温[(37±0.5) ℃]进行20 d 的厌氧消化试验,分别于消化反应的第1 天、第3 天、第5 天、第7 天、第10 天、第15 天和第20 天使用10 mL 的注射器从发酵罐上方取样口抽取10 mL 均匀的发酵液测定反应体系的pH、化学需氧量(chemical oxygen demand,COD)、挥发性脂肪酸(VFAs)、氨氮(NH4+-N)等,且当日产甲烷量小于累计产甲烷量1% (BMP 1%)时认为反应停止[22-23]。仪器自动记录产气量,当日产气量需去除当日对照组产量。
1.2.3 厌氧消化动力学
利用修正Gompertz 方程对各试验组累计产甲烷量进行拟合,求解产甲烷动力学拟合参数[24],计算公式为:
式中:Y是t时刻的累计产甲烷量[mL(CH4)·g-1(VS)];Ym是最大甲烷累计产量[mL(CH4)·g-1(VS)];Rm是最大产甲烷速率[mL(CH4)·g-1(VS)];λ表示迟滞期(d)。用R2表示动力学模型拟合曲线的程度。
1.3 分析方法
1.3.1 青贮质量分析
青贮发酵完成后从每个青贮聚乙烯袋中取2~3 g样品在105 ℃下进行干物质(DM)含量测定。再取部分样品在65 ℃条件下烘干粉碎,过100 目筛子后,采用蒽酮硫酸比色法测定可溶性碳水化合物(WSC)[24];采用K9840 凯氏定氮仪测定总氮(TN),粗蛋白(CP)含量=总氮×6.25;中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和酸性洗涤木质素(ADL)采用范氏(Van Soest)洗涤法测定。纤维素(CL)、半纤维素(HC)含量[25]、生物降解潜力(BDP)以及干物质损失率(LDM)的计算公式如下:
1.3.2 发酵品质分析
根据四分法均匀准确地称取10 g 样品置于匀浆机内,按料液比1∶9 加入蒸馏水进行匀浆,以8000 r·min-1匀浆5 min 后用4 层纱布过滤匀浆液,所得滤液以3900 r·min-1离心10 min,定性滤纸二次过滤得到澄清青贮浸提液,用于测定pH、氨态氮(AN)、乳酸(LA)和乙酸(AA)等指标。青贮pH 测定采用UB-7 酸度计;氨氮(AN)测试采用苯酚-次氯酸钠比色法;乳酸(LA)、乙酸(AA)、丙酸(PPA)等有机酸产物分析采用安捷伦1200 高效液相色谱仪检测,配置KC-811 离子柱和DAD 检测器,柱温50 ℃,流动相3 mmol·L-1HClO4溶液,进样量5 μL[26]。
1.3.3 青贮质量的综合分析评价
采用隶属函数法综合评价4 个青贮组的青贮质量,以全部指标隶属函数值平均值大小进行排序,综合评价值越高代表质量越好[27]。其中DM、WSC、CP、CL、HC、LA 和AA 为正向指标,LDM、ADL、ADF、NDF 和pH 为负向指标。计算公式如下:
式中:Uxi为某指标的隶属函数值,Xi为某指标测定值,Xmin和Xmax分别为某指标最小测定值和最大测定值。
1.3.4 厌氧消化特征参数分析
取厌氧发酵液10 mL 在12 000 r·min-1状态下离心6 min,将上清液过0.45 μm 水系滤膜后加入25%的偏磷酸(浸提液与偏磷酸的体积比为5∶1),静置30 min,在1500 r·min-14 ℃状态下离心15 min,再过0.22 μm 纤维素乙酸酯滤膜去除大分子杂质。采用高效气相色谱测定原料厌氧发酵过程中的挥发性脂肪酸(volatile fatty acids,VFAs)浓度变化以及总挥发性脂肪酸(TVFA)浓度。测定条件为: FID 检测器,采用WondaCapFFAP (30 m×0.25 mm×0.25 μm)毛细管柱,分流比为5∶1,FID 温度为250 ℃[28]。
取样品离心后的上清液,使用5B-3C-V8 双参数测定仪(兰州连华科技)测定COD 和NH4+-N。采用T960 全自动电位滴定仪(山东海能仪器)测定碳酸氢盐碱度(PA)、挥发酸碱度(IA)和pH。有机元素采用Vario EL/microcube 分析仪(德国Elementar Inc.)测定后得到C、H、O、N 的含量,再将其转化为分子式CaHbOcNd表示,可通过下列方程得到单位理论甲烷产量(TMP)的甲烷理论产量和生物降解性(BI)[29]。分子式和计算公式如下:
式中: TMP 为理论甲烷 产 量[mL(CH4)·g-1(VS)],EMP为实际累计甲烷产量[mL(CH4)·g-1(VS)]。n 是C 元素所占百分比,a 是H 元素所占百分比,b 是O 元素所占百分比,c 是N 元素所占百分比。
1.3.5 厌氧消化微生物菌群分析
取厌氧发酵液 6 mL,通过冷冻高速离心留沉淀物于-80 ℃保存。采用CTAB 法提取样本基因组DNA,利用细菌特征引物341F (5’-CCTAYGGGRBGCASCAG-3’)和806 (5’-GGACTACNNGGGTATCTAAT-3’)对16S rRNA 基因V3+V4 区域进行PCR 扩增。利用古细菌特征引物Arch519F (5’-CAGCCGCCGCGGTAA-3’)和Arch 915R (5’-GTGC TCCCCCGCCAATTCCT-3’)对16S RNA 基因V4+V5 区域进行PCR 扩增。用Illumina 公司NovaSeq 6000 PE250 平台上机测序,微科盟云平台对测序结果进行微生物群落组成分析[30]。
1.4 经济性能指标分析
根据成本收益理论构建青贮预处理成本收益模型,对甜高粱青贮预处理所需纤维素酶、异常毕赤酵母增加的经济成本,以及青贮预处理所增加的甲烷产量进行经济性能分析,计算公式为:
式中:Ii表示第i种青贮预处理方式的甜高粱纯收益,Mi表示第i种青贮预处理消化组的甲烷产量,M0表示原料消化组的甲烷产量,P表示生物沼气提纯后的甲烷价格,Ei表示第i种青贮预处理甜高粱青贮成本(含添加剂)。
1.5 数据处理
数据结果采用平均值±标准差表示,使用SPSS 20.0 软件进行双因素方差分析,采用Origin 2021 软件制图并利用修正Gompertz 方程拟合累计产甲烷曲线,利用单因子ANOVO 模型处理和Duncan 方法进行多重比较。
2 结果与分析
2.1 添加剂对甜高粱青贮质量的分析
从表1 可知,青贮处理以及添加青贮添加剂均对甜高粱的青贮品质有显著影响(P<0.05),如对干物质、可溶性碳水化合物、粗蛋白等的营养物质的保存效果不同,从而甜高粱的青贮质量也有所差距。4 个青贮组的DM 含量均显著低于原料甜高粱组(P<0.05),3 个添加剂组的LDM 显著低于空白SS 组(P<0.05),尤其Cx 组和Pa 组的LDM 相对最低。与原料甜高粱相比,青贮甜高粱WSC 含量均显著下降(P<0.05),但Pa 和PC 组WSC 含量均显著高于SS 组(P<0.05)。从CP 含量变化情况来看,除了Pa 组与原料组差异不显著,其他青贮组的CP 含量均显著低于原料组,另外2 个添加剂青贮组Cx 组和PC 组的CP 含量也均显著高于SS 组(P<0.05)。
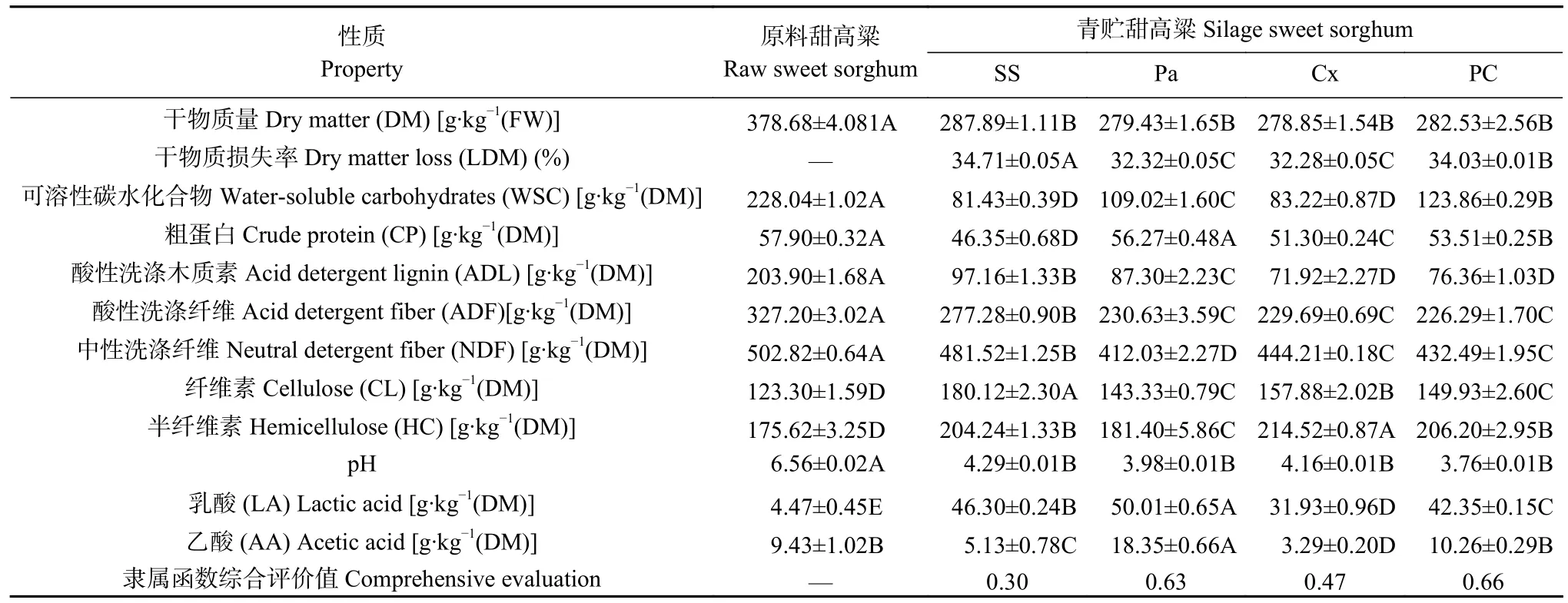
表1 不同添加剂处理下甜高粱青贮前后理化性质的变化Table 1 Physicochemical properties of sweet sorghum before and after ensiling with different additives
木质纤维组分变化结果显示,4 个青贮组ADF、NDF 和ADL 含量均显著低于原料组(P<0.05),且3个添加剂组均显著低于SS 组(P<0.05)。同时,Cx 组和PC 组的ADL 含量最低,Pa 组的NDF 含量显著低于其他试验组(P<0.05)。上述组分变化使4 个青贮组的CL 和HC 含量明显高于原料组(P<0.05),这些碳水化合物获得有效保存,为后续的厌氧消化产甲烷过程奠定了物质基础。
由表1 可知,青贮处理以及添加青贮添加剂均对甜高粱青贮发酵的pH 和有机酸含量具有显著影响(P<0.05)。其中,4 个青贮组的pH 均显著下降,远低于原料组(P<0.05);并且4 个青贮组的pH 远低于或趋近于最优青贮(pH 4.20)。从甜高粱青贮发酵的有机酸组成来看,4 个青贮组的LA 含量显著增加(P<0.05),尤其Pa 组的LA 和AA 含量均明显高于其他组(P<0.05)。添加异常毕赤酵母的两个青贮组AA 含量显著高于其他青贮处理组。
采用模糊数学隶属函数法对青贮21 d 的甜高粱进行青贮质量综合评价,选取12 个指标隶属函数值的平均值进行排名,平均值越大,代表综合质量越高。由表1 可知,4 个青贮组排名依次为PC 组>Pa 组>Cx 组>SS 组,并且PC 组(0.66)和Pa 组(0.63)的综合评价值远高于其他试验组。
2.2 添加剂对青贮甜高粱厌氧消化产甲烷过程的影响
由图1a 可知,5 个试验组的日产甲烷量均呈现双峰特征。在消化第1 天出现产气高峰,新鲜甜高粱CK 组的日产甲烷量为78.04 mL(CH4)·g-1(VS),明显低于4 个青贮高粱消化组,PC 组的日产甲烷量最高,达86.59 mL(CH4)·g-1(VS),其次是Pa 组[83.25 mL(CH4)·g-1(VS)]、Cx 组 [82.52 mL(CH4)·g-1(VS)]。消化反应进行到第5 天时出现第2 个产气峰值。此时CK 组日产甲烷量为50.00 mL(CH4)·g-1(VS),依然低于4 个青贮组,Pa 组[63.74 mL(CH4)·g-1(VS)]最高,紧随其后的是PC 组[63.07 mL(CH4)·g-1(VS)]、Cx 组[60.29 mL(CH4)·g-1(VS)]。随着消化反应持续,第6 天日产甲烷量快速降低,第11 天进入稳定期,第20 天消化反应结束(BMP 1%)。从图1b 可以看出,消化第20 天4 个青贮组的累计产甲烷量明显高于原料CK 组[351.72 mL(CH4)·g-1(VS)],其中PC 组累计产气量最高,为457.70 mL(CH4)·g-1(VS),Pa 组为455.56 mL(CH4)·g-1(VS),Cx 组为441.53 mL(CH4)·g-1(VS)。显而易见,青贮预处理对甜高粱的厌氧发酵产甲烷量有显著提升效果,尤其是添加异常毕赤酵母和或纤维素酶的青贮预处理使得甲烷产量提升25.53%~30.13%。

图1 不同添加剂对青贮甜高粱日产甲烷量(a)和累计产甲烷量(b)的影响Fig.1 Effect of different additives on daily methane production (a) and cumulative methane production (b) of sweet sorghum silage
图2 显示,青贮处理后甜高粱的实际甲烷产量均高于CK 组,且生物降解指数也显著高于CK 组(52.59%,P<0.05),其中PC 组最高,为73.39%,这与图1产甲烷量的结果一致;Pa 组、Cx 组以及SS 组的生物降解指数差异不显著,为65%~68%。
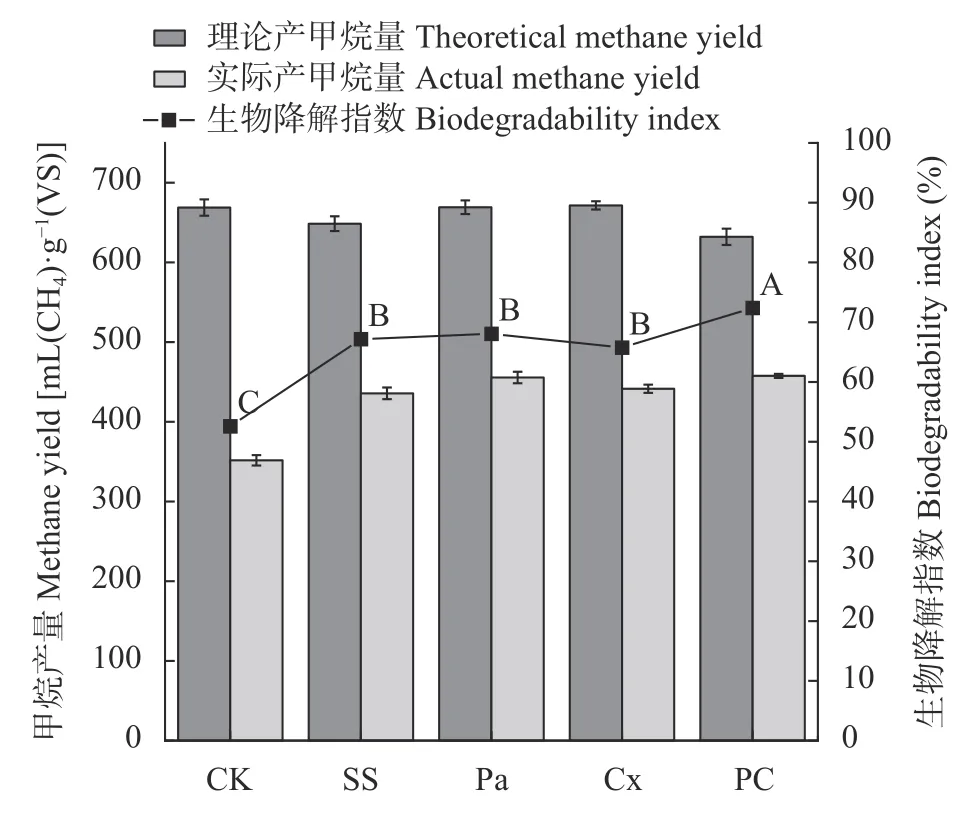
图2 不同添加剂对青贮甜高粱生物降解指数的影响Fig.2 Effect of different additives on the biodegradability index of sweet sorghum silage
2.3 添加剂对青贮甜高粱厌氧发酵动力学的影响
如表2 所示,5 个厌氧消化组的模型决定系数R2值均在0.99 以上,拟合程度能较好地说明产甲烷实际特征。4 个青贮消化组的最大累计产甲烷量(Ym)和最大产甲烷速率(Rm)均显著高于CK 组(P<0.05),其中PC 组和Cx 组的Ym增幅最显著,Pa组的Rm较CK 组提升33.57%。4 个青贮消化组的迟滞期(λ)值明显低于CK 组(P<0.05),尤其PC 组和Cx 组的迟滞期最短,这与图1 产气特征吻合。

表2 不同添加剂处理下青贮甜高粱的厌氧消化产甲烷动力学拟合参数Table 2 Kinetic parameters of methane production during anaerobic digestion of sweet sorghum silage under different additive treatments
2.4 添加剂对青贮甜高粱厌氧消化系统稳定性的影响
由图3a 可知,接种物的初始pH 为8.1,处于弱碱环境。加入物料启动消化反应后pH 迅速下降至7.60 左右,随着发酵的进行呈现持续上升的趋势并稳定在7.90~8.10。结合图3b 可知,4 个青贮消化组的初始总挥发性脂肪酸(TVFA)含量比原料组提升3.93%~15.41%。随着TVFA 被产甲烷菌群代谢利用,第10 天体系中TVFA 几乎被消耗殆尽。另外,PC 组的TVFA 含量整体低于其他3 个青贮组,这与该组累计产甲烷量结果吻合。

图3 不同添加剂对青贮甜高粱厌氧消化系统pH 和总挥发性脂肪酸含量(TVFA)的影响Fig.3 Effect of different additives on the pH and total volatile fatty acid content (TVFA) during anaerobic digestion of sweet sorghum silage
由图4 可知,5 个试验组的消化液中化学需氧量(COD)浓度均随消化反应进行而呈现整体下降趋势,尤其前10 d 的COD 浓度降幅最快。值得注意的是,Cx 组和PC 组的COD 浓度在消化第3 天略有上升。消化第10 天 COD 浓度维持在900~1100 mg·L-1,对应体系的产甲烷量进入平稳期。

图4 不同添加剂对青贮甜高粱厌氧消化系统稳定性的影响Fig.4 Effect of different additives on the systems stability of anaerobic digestion of sweet sorghum silage
5 个消化组的氨氮(NH4+-N)浓度均维持在1600~1700 mg·L-1,未产生氨抑制现象。挥发酸碱度(IA)代表挥发性脂肪酸的缓冲能力,碳酸氢盐碱度(BA)代表碳酸氢盐和氨氮的缓冲能力,挥发酸碱度/碳酸氢盐碱度IA/BA 可作为监测消化系统缓冲能力、判断系统运行稳定性的预警指标。当IA/BA>0.5 时系统趋于失稳,介于0.3~0.5 时具有较强缓冲能力,系统稳定[31]。试验中,5 个消化组的IA/BA 值随消化反应进行逐渐下降至0.5 以下,为产甲烷菌群繁殖代谢提供了稳定环境,直至消化结束时(20 d) IA/BA 值稳定在0.3 左右。
2.5 添加剂对青贮甜高粱厌氧消化系统微生物菌群结构的影响
2.5.1 细菌多样性分析
如图5a 所示,接种物中细菌门主要有厚壁菌门(Firmicutes,54.05%)、拟杆菌门(Bacteroidetes,31.52%)以及少量纤维杆菌门(Fibrobacteres,7.04%)、变形菌门(Proteobacteria,3.41%)和互养菌门(Synergistetes,2.2%)等。通过图可知,与CK 组中微生物群落组成相比,4 个青贮消化组的细菌群落结构并没有发生大的变化,但是各种功能菌门的比例有所变化。厌氧消化反应启动后,5 个消化组的消化液中厚壁菌门和拟杆菌门始终占据绝对优势,这与接种物中的优势细菌门相同;但3 个添加剂预处理的消化组的厚壁菌门和拟杆菌门的丰度之和减少,而软壁菌门(Tenericutes)的丰度增加近50%,弯曲菌门(Epsilonbacteraeota)、念珠菌门(Patescibacteria)等功能菌也表现出增加的趋势。随着反应进行,互养菌门的丰度均为“先减后增”趋势,于发酵第5 天达最低值。除PC 组外,其余4 个组的厚壁菌、拟杆菌和互养菌丰度之和均呈现“先增后减”趋势,第3 天丰度均达最高值96.60%~96.29%;而PC 组中3 类细菌丰度之和在消化第1 天达最高值97.47%,远高于其他处理组,随后丰度逐渐降低。

图5 不同添加剂对青贮甜高粱消化过程中细菌群落门水平(a)和属水平(b)相对丰度的影响Fig.5 Effect of different additives on the relative abundances of bacterial communities at phylum level (a) and genus level (b)during anaerobic digestion of sweet sorghum silage
如图5b 所示,接种物的优势细菌属包括梭状芽孢杆菌属(Clostridium_sensu_stricto_1,7.31%)、发酵单胞菌属(Fermentimonas,6.91%)、DMER64(7.32%)和瘤胃梭菌属(Ruminiclostridium_1,5.48%)等。消化反应启动后,CK 组发酵单胞菌属相对丰度增至11.11%,梭状芽孢杆菌属相对丰度增至23.33%,DMER64则降至3.97%。4 个青贮消化组的发酵单胞菌属相对丰度增至13.09%~19.97%,梭状芽孢杆菌属相对丰度增至15.34%~19.90%,且二者在PC 组中的丰度均高于SS 组、Cx 组和Pa 组。随着消化进程的推进,CK 组和SS 组的梭状芽孢杆菌属呈现先降低再升高趋势,第5 天时丰度最低,分别为6.82%和9.93%;而Cx 组和Pa 组则呈现持续下降趋势。另一方面,5 个消化组在前5 d 发酵单胞菌属相对丰度较高,10 d 后均明显下降;而鲁氏丝状杆菌属(Ruminofilibacter)和DMER64在5 d 时的相对丰度则明显高于发酵初期。此外,消化体系还有少量沉积菌属(Sedimentibacter) (2%~3%)、瘤胃梭菌属(0.5%~2%)和葡萄球菌(Turicibacter,0.3%~4.6%)。
2.5.2 古菌多样性分析
如图6a 所示,无论是接种物还是不同处理组的厌氧发酵消化液中的绝对优势菌门均为广古菌门(Euryarchaeota),平均丰度高达98%以上。反应启动初期(1~3 d),CK 组、Cx 组和Pa 组存在少量泉古菌门(Crenarchaeota,2.67%~3.10%)。结合图6b 分析,接种物中优势古菌属包括甲烷八叠球菌属(Methanosarcina,42.75 %)、甲烷短杆菌属(Methanobrevibacter,39.28 %)以及甲烷杆菌属(Methanobacterium,7.08%)、甲烷球菌属(Methanosphaera,8.06%)和少量的甲烷鬃菌属(Methanosaeta,0.11%)、甲烷粒菌属(Methanocorpusculum,0.8%)、vadinCA11(1.09%)。消化反应启动后,3 个添加剂预处理的消化组中甲烷八叠球菌属丰度持续升高,并在消化后期(10~20 d)占据优势地位,相对丰度高达89.03%~97.04%。甲烷短杆菌属、甲烷杆菌属和甲烷球菌属的丰度在消化后期均持续下降。另外,消化前期出现的甲烷鬃菌属在PC 组中相对丰度最高。

图6 不同添加剂对青贮甜高粱消化过程中古菌群落门水平(a)和属水平(b)相对丰度的影响Fig.6 Effect of different additives on the relative abundances of archaeal communities at phylum level (a) and genus level (b)during the anaerobic digestion of sweet sorghum silage
2.5.3 细菌和古菌与厌氧消化液特征参数相关性分析
由图7a 可知,发酵单胞菌属(Fermentimonas)、梭状芽孢杆菌属(Clostridium_sensu_stricto_1)、Rikenellaceae_RC9_gut_group、Fastidiosipia、罗姆布茨菌属(Romboutsia)、Ruminiclostridium-1、Paeniclostridium和葡萄球菌属(Turicibacter)等细菌与pH 呈负相关(P<0.001),与COD、TVFA 呈正相关(P<0.001)。DMER64、瘤胃梭菌属(Ruminiclostridium)、沉积菌属(Ruminofilibacter)、克里斯滕森菌属(Christensenellaceae-R-7-group)、硫代单胞菌属(Thiopseudomonas)和钙杆菌属(Caldicoprobacter)等细菌丰度与pH 呈正相关(P<0.001),与COD 和TVFA 含量呈负相关(P<0.001),氨氮与细菌的硫代单胞菌属呈正相关(P<0.05)。

图7 厌氧消化液中细菌(a)和古菌(b)属水平丰度与反应特性参数的相关性分析Fig.7 Correlation analysis of bacterial (a) and archaea (b) with anaerobic digestion characteristics parameters
由图7b 可知,甲烷八叠球菌属(Methanosarcina)与COD 和TVFA 呈负相关,与pH 呈正相关。甲烷杆菌属(Methanobacterium)、甲烷短杆菌属(Methanobrevibacter)和甲烷球菌属(Methanosphaera)等古菌与COD 和TVFA 浓度呈正相关关系,与pH 呈负相关关系。甲烷粒属(Methanocorpusculum)与氨氮呈正相关,与pH 呈负相关。
2.6 不同添加剂预处理下高粱秸秆产甲烷经济性能分析
本文中,仅以甜高粱秸秆以及青贮预处理所增加的经济成本及青贮预处理所增加的甲烷产量做经济性分析。在计算过程中,计算基准为1 t 甜高粱,以每吨VS 为一个计量单位进行计算,纤维素酶价格为60 ¥·kg-1。沼气提纯后的甲烷价格取3.5 ¥·m-3。由表3 可知,甜高粱经不同青贮预处理增产甲烷的综合理论经济收益差异较为明显,不同预处理效益由高到低依次为Pa 组、SS 组、PC 组和Cx 组。

表3 青贮预处理前后的经济性能分析Table 3 Economic performance analysis before and after ensiling pretreatment
3 讨论
3.1 添加剂对青贮甜高粱营养成分及发酵品质的影响
甜高粱中的干物质(DM)、粗蛋白(CP)和可溶性碳水化合物(WSC)等的含量高低能综合反映青贮质量优劣,这些组分的含量越高说明营养物质损失越少,青贮品质越好。本试验中,4 个青贮组的DM显著低于新鲜甜高粱,这是由于青贮过程中微生物菌群所参与的生化反应需要消耗大量可溶性糖、蛋白质等营养物质作为代谢底物,并产生CO2和有机酸等挥发物所致。与此同时,3 个添加剂组的干物质损失率(LDM)均显著低于空白SS 组,尤其Cx 组和Pa 组的LDM 相对较低。这是因为一方面,添加纤维素酶能有效分解植物细胞壁中的纤维素和半纤维素等结构性碳水化合物,为乳酸菌等有益微生物活动提供充足的发酵底物,促进发酵进程。同时,随着乳酸等有机酸积累和pH 降低,也抑制了其他不良微生物活性,进而减少干物质损耗[32]。另一方面,Pa 组中添加的异常毕赤酵母代谢产生的蛋白或糖蛋白毒素也能有效抑制或杀死不良微生物,更好地保存青贮营养物质[18]。当异常毕赤酵母和纤维素酶同时添加能进一步强化青贮发酵强度,二者协同加速了甜高粱的结构性碳水化合物消耗,产生过多的乳酸和乙酸等挥发性物质,导致PC 组的干物质损失率高于单一添加剂组[33]。
一般而言,青贮原料WSC 低于60~70 g·kg-1(DM)则不利于青贮发酵,本试验选用的甜高粱原料完全满足该条件[2]。青贮21 d,3 个添加剂组WSC 含量均显著高于SS 组,说明单独或组合添加异常毕赤酵母和纤维素酶均能有效减少碳水化合物损失,其中菌酶协同的PC 组效果更佳。这是因为一方面纤维素酶能有效破坏植物细胞壁,将纤维素水解为寡糖和葡萄糖等[7]。另一方面,异常毕赤酵母分泌的嗜杀蛋白能与靶细胞壁的β-葡聚糖结合,通过水解细胞壁的主要成分来诱发毒性作用,从而抑制腐败菌生长,减少糖分损失[14]。Zhao 等[8]认为青贮水稻(Oryza sativa)秸秆中添加纤维素酶能提高碳水化合物含量。任海伟等[19]也认为添加异常毕赤酵母能显著提高干玉米秸秆与废弃白菜混贮料碳水化合物含量。就粗蛋白含量而言,由于青贮体系本身存在分解蛋白质的微生物和蛋白酶,使得青贮组(除Pa 组外) CP 含量均明显低于原料;但Pa 组的CP 含量与原料差异不显著,说明青贮中添加异常毕赤酵母可以减少蛋白质损失。因为异常毕赤酵母独特的嗜杀作用不仅能有效抑制青贮体系的蛋白分解菌,还能降低不良微生物与有益乳酸菌的营养竞争,促进低pH 环境快速形成,致使蛋白酶失活,减少蛋白水解[15]。同时,异常毕赤酵母菌体自身富含微生物蛋白,且在产生嗜杀因子的同时还能产生植酸酶和单细胞蛋白,使得Pa 组中粗蛋白含量几乎未受损失[18]。可见,青贮发酵过程中添加异常毕赤酵母可以有效减少甜高粱营养物质损失。
木质纤维组分是影响生物质利用和厌氧消化产甲烷效能的重要因素。纤维素(CL)和半纤维素(HC)是结构性碳水化合物含能组分,酸性洗涤木质素(ADL)是影响生物降解性能的主要屏障;较高的ADL 含量会影响降解效率和产甲烷效能[34]。本试验中,3 个添加剂组酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量均呈现下降趋势且显著低于CK 组,这与赵政等[32]报道的玉米秸秆青贮中添加纤维素酶可降低NDF、ADF 和ADL 含量的研究结果一致。可见,青贮发酵对木质纤维组分降解确实具有一定的预处理作用,而且菌酶联合添加更有利于破坏木质纤维分子聚合物之间的酯键,增加生物降解可及性。与此同时,Cx 组和PC 组的ADL 含量最低,说明添加纤维素酶青贮能有效降低木质素含量,进而提高生物可及性。另外,Pa 组的NDF 含量显著低于其他试验组,这可能是源于异常毕赤酵母对细胞壁的降解作用,能产生对木质纤维素具有优先水解作用的内切葡聚糖酶,有助于降解木质纤维组分[15],这与试验中WSC、CP、NDF、ADF、CL 和 HC 等组分变化趋势相吻合。因此,添加纤维素酶和异常毕赤酵母均有助于青贮甜高粱的木质纤维组分降解,为后续的厌氧消化产甲烷过程奠定了物质基础。
青贮发酵过程产生的小分子有机酸不仅对青贮质量优劣有重要影响,同时也是厌氧产甲烷菌群的重要代谢底物。一般认为优良青贮的pH 在3.70~4.30,本试验4 个青贮组的pH 均符合优质青贮范围。这与Nkosi 等[35]在甜高粱中添加纤维素酶和乳酸菌青贮后pH 低于3.9 结果类似,同时也与Borling 等[36]发现添加异常毕赤酵母、纤维素酶以及乳酸菌与大麦(Hordeum vulgare)青贮中pH 显著降低的结果相似。青贮微生物代谢所产生的乳酸[酸度系数(pKa)=3.86]和乙酸(pKa=4.74)积累是pH 下降的主要原因。青贮发酵后的乳酸含量显著增加,均接近或高于30 g·kg-1(DM),达到优质青贮标准。优质青贮含有较多的乳酸(占有机酸含量60 %以上)和少量乙酸,几乎不含丙酸和丁酸[37]。并且乙酸具有抗真菌活性,对提高青贮有氧稳定性和保存性能具有积极作用。本试验中,Pa 组的乳酸和乙酸含量均明显高于其他组,这是因为一方面异常毕赤酵母对有害微生物生长具有抑制作用,减少有害微生物对乳酸的分解[15];另一方面异常毕赤酵母还可以释放乙酸乙酯,而后者易水解生成乙酸[38]。再者,异常毕赤酵母与青贮乳酸菌群存在互利共生机制,能协同促进有益乳酸菌群的活动[39]。Sun 等[40]认为木质纤维降解率与有机酸(尤其是乳酸)的产生呈正相关关系,这也是本试验Pa 组NDF 含量最低的原因之一。另外,高粱秸秆表面有硅氧蜡质层,不仅对纤维素酶和纤维素接触产生空间阻断作用,还能够竞争性吸附纤维素酶,影响有机酸生成量,导致Cx 组的乳酸和乙酸含量相对较低[4]。利用隶属函数法对甜高粱青贮质量综合评价,发现PC 组和Pa 组的综合评价值相近且远高于其他试验组。
3.2 添加剂对青贮甜高粱厌氧发酵过程的影响
将青贮21 d 的甜高粱和新鲜甜高粱分别作为厌氧消化的原料,进行批次厌氧发酵试验分析其产沼气效能。经青贮预处理后的甜高粱木质纤维素结构被破坏,部分半纤维素、纤维素被水解产生还原糖,进而降解为乳酸、乙酸等小分子有机酸和氨氮等物质;同时还保存有一定量能被产甲烷菌菌群直接利用的可溶性糖等组分,很容易被消化代谢转化为CH4,使得消化第1 天即出现产气高峰。消化反应第5 天时,底物中较难降解的纤维素和半纤维素等大分子物质经厚壁杆菌和拟杆菌等微生物水解、酸化,进而转化为更多能够被产甲烷菌群利用的小分子底物,从而出现第2 个产气峰值。随着消化反应持续,能被产甲烷菌群利用的营养物质开始减少,第6 天开始日产甲烷量快速降低直至反应结束。PC 组的日产甲烷潜力明显高于其他添加剂,累计产甲烷量最高且较未青贮CK 组提高30.13%。这与该组较低的木质素含量和较高的WSC、CP 以及有机酸含量等青贮质量指标密切相关,也印证了菌酶联合强化青贮甜高粱对其产甲烷能力的促进效果更为显著。此外,青贮后甜高粱的生物降解指数明显增加,尤其PC 组显著优于其他青贮组。说明青贮过程能够提升纤维素、半纤维素的降解率,降低抗降解屏障组分含量;也进一步证实菌酶联合强化青贮预处理能改善高粱的生物降解性能,促进厌氧消化产甲烷效能。
利用修正Gompertz 模型对产甲烷过程进行拟合,确定产甲烷动力学常数,模拟发酵动态过程得到最大甲烷累计产量(Ym)、最大产甲烷速率(Rm)、迟滞期(λ)和R2等参数。λ值能直接反映消化系统启动速度,间接反映产甲烷菌群增殖状况[33]。与原料组相比,4 个青贮消化组的λ 值明显缩短并且Ym和Rm均显著提高,说明青贮预处理能够提高消化反应启动速率,尤其PC 组的迟滞期最短以及Pa 组Rm提升最大,这不仅与图1 的产气特征相吻合,也进一步证明添加异常毕赤酵母进行青贮预处理能有效提高厌氧发酵系统的产气速率。
厌氧消化体系pH 直接影响细胞质膜渗透性、稳定性、营养物质溶解性,进而影响微生物代谢过程和途径;化学需氧量(COD)主要源自大分子有机物在水解、酸化阶段转化而成的溶解性有机物,是表征消化体系中能量多寡的重要指标;氨氮主要以游离氨或铵盐形式存在,氨氮浓度低于1700 mg·L-1时有利于产甲烷菌的繁殖,能有效提高缓冲能力和稳定性[3]。在厌氧消化第1 天,青贮甜高粱中大分子有机物被快速水解酸化,总挥发性脂肪酸(TVFA)累积pH 迅速下降。随后产甲烷菌群能快速消化体系中的水溶性有机质,TVFA 被逐渐消耗转化为甲烷,pH 有所升高,COD 浓度降幅加快,这与产甲烷趋势相吻合。10 d 后,pH 基本保持稳定在7.90~8.10,COD浓度维持在900~1100 mg·L-1,水解酸化反应与TVFA消耗逐渐趋于平衡,对应的产甲烷量进入平稳期。在整个厌氧发酵过程中,氨氮含量波动在1600 mg·L-1左右,这是造成厌氧发酵环境呈弱碱性的原因之一。同时,挥发性酸碱度/碳酸氢盐碱度(IA/BA)为0.3~0.5,表明消化系统运行20 d 一直处于稳定状态并且缓冲能力较高。因此,青贮预处理能为产甲烷菌群提供充足代谢底物(如挥发性脂肪酸)和适宜发酵环境(pH<8.0),确保系统的稳定性。
3.3 添加剂对青贮甜高粱厌氧消化微生物群落的影响
在甜高粱青贮中加入生物强化剂作为厌氧消化产甲烷的预处理,本质上是利用生物强化剂提高青贮发酵品质,有效保存厌氧消化所需的营养物质的同时优化重组青贮甜高粱的木质纤维组分,了解生物强化剂对厌氧消化系统内和木质纤维素降解有关的功能菌群的影响是至关重要的。通过高通量测序技术分别对接种物、青贮前后的甜高粱厌氧发酵产甲烷的发酵液进行微生物群落分析。在细菌群落变化方面,5 个消化组的厚壁菌门Firmicutes 和拟杆菌门Bacteroidetes 丰度之和在反应启动后明显增加并始终占据绝对优势,这与张蕾等[41]研究结果一致,Li等[31]研究结果也显示厚壁菌门和拟杆菌门是秸秆消化过程主要的水解酸化菌。厚壁菌对纤维类物质的底物有较强的降解能力,随着厌氧发酵的进行,木质纤维素类物质因降解而含量降低,导致该门细菌也会因生长繁殖所需的底物缺乏,从而导致丰富度降低;拟杆菌门有降解大分子碳水化合物产酸功能[42]。互养菌门丰度占比增加,这是因为互养菌门富集有利于与厌氧发酵体系中的氢营养型产甲烷菌构建良好的互营合作,可将长链脂肪酸降解生成乙酸、丙酸等有机酸;并且是极端厌氧互养产乙酸菌,同时与甲烷菌呈共养关系,将丁酸盐转化为甲烷和二氧化碳[43]。这3 个门下的微生物在甲烷发酵系统水解酸化过程中发挥极为重要的作用,尤其对木质纤维素类生物质具有较好的降解性能,在发酵系统中能成为优势菌属。随着反应进行,厚壁菌、拟杆菌和互养菌丰度之和均呈现“先增后减”趋势,不难推断消化体系中的细菌代谢能力旺盛,有效促进了乙酸代谢,这也可能是日产气量呈双峰趋势的原因之一。而PC 组在第1 天3 类细菌丰度之和即达到最高值且远高于其他处理组,这与其日产甲烷量始终高于其他处理组、生物降解指数最高以及其产甲烷动力学拟合参数中迟滞期最短的结果均吻合。此外,纤维杆菌主要水解木质纤维类物质;变形菌可将蛋白质和多糖分解成短链脂肪酸并为甲烷生成提供必要底物;软壁菌门可以降解结构碳水化合物;ε-变形菌门来源于变形菌门,可以利用NO3-N 作为电子受体进行厌氧呼吸;念珠菌门公认的水解发酵细菌,其相对丰度在厌氧发酵前期显著增长[42,44-45]。可以看出以青贮甜高粱为底物进行的厌氧发酵系统内,在以优势的厚壁菌门和拟杆菌门的水解酸化菌为主的体系中,同时富集其他微生物,这些细菌门均是以在纤维类为底物的厌氧消化体系中常见的细菌门,主要负责纤维素的水解酸化等过程。
从细菌属水平角度看,梭状芽孢杆菌属是厌氧消化系统中降解木质纤维素的水解细菌,能分泌多酶复合体,有助于植物细胞壁降解[46]。发酵单胞菌相对丰度先上升后下降;鲁氏丝状杆菌属和梭菌DMER64属在第5 天时的相对丰度明显高于发酵初期,这几种细菌的动态变化与产甲烷趋势基本吻合,也是产气迟滞期大幅缩短的原因之一。鲁氏丝状杆菌属能将小分子碳源和半纤维素分解为小分子酸和酯,以提供微生物生长所需要的营养物质[47]。DMER64不仅能直接参与菌种间电子传递,促进电子从产酸菌转移到产甲烷菌,从而提高产甲烷速率;还能在发酵系统中利用乙酸和乳酸产生氢气[48]。此外,消化体系还有少量沉积菌属(2%~3%)和葡萄球菌属(0.3%~4.6%),其中沉积菌属能以氨基酸为底物生长繁殖,葡萄球菌能分解糖和蛋白质产生挥发性脂肪酸、乙醇、二氧化碳和氢气[49]。总之,丰富的水解酸化细菌为青贮甜高粱的厌氧消化反应顺利进行提供了保障。
从古菌角度看,本试验结果与李海红等[42]报道的厌氧消化过程中产甲烷古菌种类较为单一的结论相吻合。添加剂预处理促进了乙酸营养型甲烷菌(甲烷八叠球菌属和甲烷鬃菌属)、氢营养型甲烷菌(嗜温古菌、甲烷杆菌属和甲烷粒菌属)以及甲基营养型甲烷菌(甲烷球菌属)的生长。一般而言,他们利用H2和CO2通过古菌的Wood-Ljungdahl pathway(WLP)和甲基CoM 还原的甲基分枝生成甲烷[45]。其中,甲烷八叠球菌属和甲烷鬃菌属能将甲基部分从甲醇或甲胺转移形成甲基辅酶M 作为产甲烷的重要中间体,同时也是仅以乙酸为代谢物,终产物均为甲烷的菌属[42]。嗜温古菌和甲烷粒菌属能利用甲酸盐和H2/CO2作为CH4生产底物[50]。另外,甲烷鬃菌属具有较强的产甲烷能力[51],这是PC 组甲烷产量显著提升的原因之一。虽然生物强化剂不能使甜高粱厌氧发酵系统古细菌群落组成发生变化,但可以改变其古菌群落的结构。
厌氧消化系统中的微生物群落均与pH、COD和TVFA 等发酵参数密切相关。细菌属水平中8 种细菌与pH 呈负相关,与COD、TVFA 呈正相关。其中,Rikenellaceae_RC9_gut_group属于 Rikenellaceae,已被报道是一种纤维降解相关细菌[46];Wang 等[52]研究发现罗姆布茨菌属可以利用单糖、二糖等糖类物质进行消化,其发酵产物主要为乙酸和乙醇;Paeniclostridium是一种具有高效分解木质纤维素能力的细菌[47]。由此,这8 种细菌均为水解产酸细菌,能将大分子有机物分解为挥发性有机酸,从而影响消化体系pH,并且促进乙酸营养型产甲烷菌的活性[30,53]。另一方面,6 种细菌丰度与pH 呈正相关,与COD 和TVFA 含量呈负相关。其中,钙原杆菌属和瘤胃梭菌属能产生耐高温的木聚糖酶和纤维素降解酶,将秸秆中大分子有机物水解为乙酸、H2和CO2等,从而促进氢营养型产甲烷菌活性和CO2/H2产甲烷途径[54]。氨氮与硫代单胞菌属呈正相关关系,这与Guan 等[55]报道的硫代单胞菌属可以利用硝酸盐作为厌氧污泥中的电子受体,与产甲烷菌直接进行电子传递,从而提高产甲烷效率的结果相吻合。古菌属水平上,甲烷八叠球菌与COD 和TVFA 呈负相关,与pH 呈正相关。甲烷八叠球菌主要利用乙酸产甲烷且在乙酸浓度较高时更易成为优势菌[42],本试验以乙酸营养型代谢途径为主来生产甲烷。
4 结论
纤维素酶和异常毕赤酵母均可以作为甜高粱强化青贮预处理的添加剂,无论是单独添加其中之一或是二者联合添加,均能显著提高青贮甜高粱的发酵品质,有效破坏木质纤维组分以及降低木质素含量,缩短厌氧消化产甲烷过程迟滞期,促进甜高粱产甲烷潜力释放,实现其高效甲烷化利用。究其本质,异常毕赤酵母在青贮过程中不仅可以抑制部分腐败微生物的生长繁殖,有效保存厌氧消化所需要的营养物质,同时还可以优化重组青贮甜高粱的木质纤维组分。在甜高粱青贮中添加生物强化剂的预处理不仅促进了厚壁菌门、拟杆菌门以及甲烷八叠球菌优势细菌等微生物菌群在消化过程中协同演变,同时丰富的水解酸化细菌为青贮甜高粱的厌氧消化反应顺利进行提供了保障,产甲烷菌的富集对青贮甜高粱的产甲烷潜力释放起到积极调控作用。总之,从青贮质量、产甲烷效能和经济成本等角度综合考虑,推荐实际生产中选择异常毕赤酵母作为青贮预处理的生物添加剂,该添加剂兼具成本收益和预处理高效的双重优势。
