血清Lp-PLA2、Cys-C水平与HBV感染肝硬化患者Child-Pugh分级的关联性
2023-11-23田二军姜楠王滨陈超华
田二军,姜楠,王滨,陈超华
平顶山市第一人民医院检验科,河南 平顶山 467000
乙型肝炎病毒(hepatitis B virus,HBV)可引起急性/慢性乙型肝炎、肝硬化、肝癌等严重肝脏疾病,我国HBV 感染者多达1.2亿,HBV持续感染可导致肝硬化发生,随着病情进展,可发展为原发性肝癌[1-2]。肝脏活检是判断肝硬化病情严重程度的“金标准”,但取样区域受病理医生的主观影响,导致检验结果可能存在偏差,同时活检难以长期监测患者病情,因而寻找有效诊断指标用于评估病情进展成为研究重点。脂蛋白相关磷脂酶A2(lipoprotein associated phospholipase A2,Lp-PLA2)属于特异性血管炎性因子,可提高细胞因子表达,促进内皮细胞凋亡,且与乙肝肝硬化病情进展有关[3]。胱抑素C(Cystatin C,Cys-C)属于半胱氨酸蛋白酶抑制剂超家族成员,且与肝肾组织纤维化发生有关,可参与肝肾病变过程[4-5]。目前Lp-PLA2、Cys-C 与HBV 感染肝硬化相关研究相对较少。本研究主要检测HBV 感染肝硬化患者血清Lp-PLA2、Cys-C 水平,分析其与Child-Pugh 分级、肝硬化程度相关性,为临床诊治提供参考。
1 资料与方法
1.1 一般资料 选取2020年8月至2022年10月平顶山市第一人民医院收治且符合以下纳入和排除标准的153 例HBV 感染者作为研究对象,其中肝硬化者86 例(设为肝硬化组)、乙型肝炎者67 例(设为肝炎组),另选取同期于本院体检的健康志愿者51 例作为对照组。肝硬化组患者中男性45 例,女性41 例;年龄32~54 岁,平均(42.58±3.49)岁;体质量指数(BMI) 20~28 kg/m2,平均(24.16±1.19) kg/m2;病程1~5 年,平均(3.24±0.57)年。肝炎组患者中男性35 例,女性32 例;年龄29~55 岁,平均(41.96±4.12)岁;BMI 20~29 kg/m2,平均(23.96±1.28) kg/m2;病程1~6 年,平均(3.19±0.71)年。对照组中男性28 例,女性23 例;年龄30~55岁,平均(42.19±4.03)岁;BMI 20~29 kg/m2,平均(24.03±1.33)kg/m2。三组受检者的一般资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经本院医学伦理委员会批准,所有受检者均知情且签署知情同意书。
1.2 纳排标准 (1)纳入标准:①符合肝硬化诊断标准[6],且经CT检查、肝组织活检证实为乙肝肝硬化;②符合HBV感染诊断标准[7];③原发性肝癌患者符合肝癌诊断标准[8];④未合并其他类型肝炎病毒感染;⑤未合并脂肪肝等慢性肝病者。(2)排除标准:①合并心肾功能障碍;②伴有免疫系统、凝血功能障碍;③既往抗病毒或保肝治疗史;④伴有酒精性、药物性肝炎者;⑤合并甲状腺功能亢进者;⑥既往手术史者。
1.3 方法
1.3.1 不同病情程度判定标准 依据HBV-DNA载量将HBV 感染者分为低病毒载量44 例、中病毒载量71 例、高病毒载量38 例,其中低病毒载量为103copies/mL≤HBV-DNA 载量≤105copies/mL、中病毒载量为105copies/mL<HBV-DNA≤107copies/mL、高病毒载量为HBV-DNA载量>107copies/mL[9]。肝硬化组依据Child-Pugh分级分为A级34例、B级28例、C级24例;依据肝硬化程度[10]分为代偿期肝硬化32例、失代偿期肝硬化31例、原发性肝癌23例。Child-Pugh分级[11]:包括肝性脑病、肝性脑病程度、腹水、血胆红素、血清蛋白、凝血酶原时间,每个指标分为3 个层次,分别记为1分、2分、3分,A级≤6分,6分<B级≤9分,C级>9分。
1.3.2 肝功能指标检测 肝硬化组、肝炎组均于入组时采集空腹静脉血10 mL,对照组于体检当日采集空腹静脉血10 mL,血液样本分为两份(5 mL/份),常规离心后取血清。采用cobas c701全自动生化分析仪(罗氏)检测血清碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)、白蛋白(ALB)、球蛋白(GLO)水平。
1.3.3 血清Lp-PLA2、Cys-C水平检测 入组时采用HITACHI Labospect 008As检测血清Lp-PLA2、Cys-C水平,美康生物科技股份有限公司提供检测试剂盒。
1.4 观察指标 (1)比较不同组别、不同HBV-DNA载量、不同Child-Pugh 分级、不同肝硬化程度受检者的血清Lp-PLA2、Cys-C 水平;(2)分析入组时血清Lp-PLA2、Cys-C水平与肝功能指标、Child-Pugh分级、肝硬化程度相关性;(3)评价入组时血清Lp-PLA2、Cys-C对肝硬化所致原发性肝癌的诊断价值。
1.5 统计学方法 应用SPSS26.0 统计学软件分析数据。计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较行单因素方差分析,进一步两两比较采用SNK-q检验;采用Pearson法分析血清Lp-PLA2、Cys-C 水平与肝功能指标相关性,并采用Spearman 法分析其与Child-Pugh 分级、肝硬化程度相关性;采用受试者工作特征曲线(ROC)评价血清p-PLA2、Cys-C 对肝硬化所致原发性肝癌的诊断价值。以P<0.05为差异有统计学意义。
2 结果
2.1 三组受检者的血清Lp-PLA2、Cys-C 水平与肝功能指标比较 肝硬化组患者的血清Lp-PLA2、Cys-C、ALP、GGT、GLO 水平明显高于肝炎组、对照组,且肝炎组明显高于对照组,而肝硬化组患者的血清ALB 水平明显于肝炎组、对照组,且肝炎组明显低于对照组,差异均有统计学意义(P<0.05),见表1。
表1 三组受检者的血清Lp-PLA2、Cys-C水平与肝功能指标比较(±s)Table 1 Comparison of serum Lp-PLA2,Cys-C levels and liver function indicators among the three groups(±s)
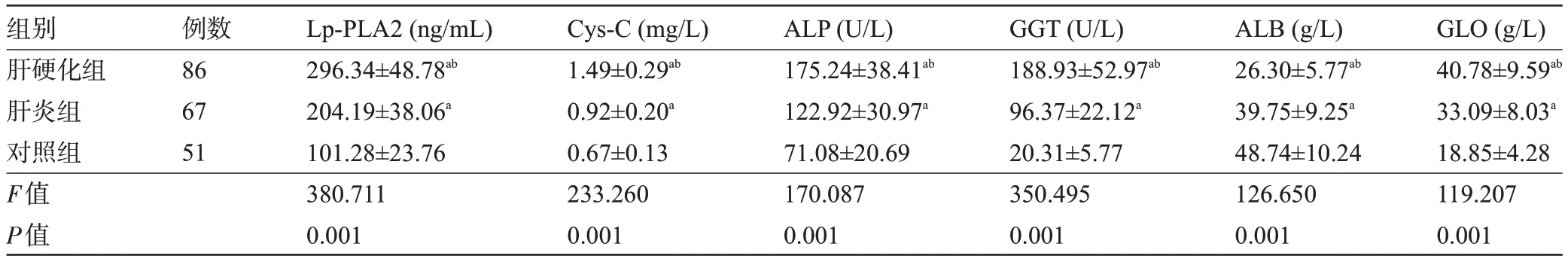
表1 三组受检者的血清Lp-PLA2、Cys-C水平与肝功能指标比较(±s)Table 1 Comparison of serum Lp-PLA2,Cys-C levels and liver function indicators among the three groups(±s)
注:与对照组比较,aP<0.05;与肝炎组比较,bP<0.05。Note:Compared with that in the control group,aP<0.05;Compared with that in the hepatitis group,bP<0.05.
组别肝硬化组肝炎组对照组F值P值例数86 67 51 Lp-PLA2(ng/mL)296.34±48.78ab 204.19±38.06a 101.28±23.76 380.711 0.001 Cys-C(mg/L)1.49±0.29ab 0.92±0.20a 0.67±0.13 233.260 0.001 ALP(U/L)175.24±38.41ab 122.92±30.97a 71.08±20.69 170.087 0.001 GGT(U/L)188.93±52.97ab 96.37±22.12a 20.31±5.77 350.495 0.001 ALB(g/L)26.30±5.77ab 39.75±9.25a 48.74±10.24 126.650 0.001 GLO(g/L)40.78±9.59ab 33.09±8.03a 18.85±4.28 119.207 0.001
2.2 不同HBV-DNA 载量患者的血清Lp-PLA2、Cys-C 水平比较 随着HBV-DNA 载量增加,患者的血清Lp-PLA2、Cys-C水平呈上升趋势,差异均有统计学意义(P<0.05),见表2。
表2 不同HBV-DNA载量患者的血清Lp-PLA2、Cys-C水平比较(±s)Table 2 Comparison of serum Lp-PLA2 and Cys-C levels in patients with different HBV DNA loads(±s)
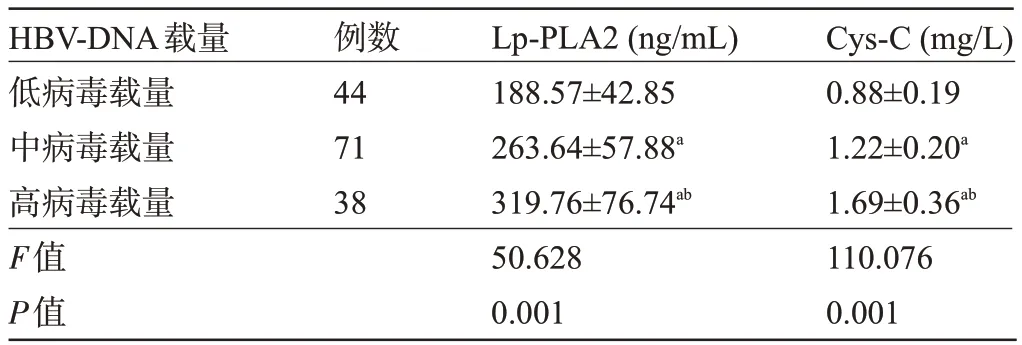
表2 不同HBV-DNA载量患者的血清Lp-PLA2、Cys-C水平比较(±s)Table 2 Comparison of serum Lp-PLA2 and Cys-C levels in patients with different HBV DNA loads(±s)
注:与低病毒载量比较,aP<0.05;与中病毒载量比较,bP<0.05。Note: Compared with low viral load,aP<0.05; Compared to the viral load,bP<0.05.
HBV-DNA载量低病毒载量中病毒载量高病毒载量F值P值Cys-C(mg/L)0.88±0.19 1.22±0.20a 1.69±0.36ab 110.076 0.001例数44 71 38 Lp-PLA2(ng/mL)188.57±42.85 263.64±57.88a 319.76±76.74ab 50.628 0.001
2.3 不同Child-Pugh 分级患者的血清Lp-PLA2、Cys-C 水平比较 随着Child-Pugh 分级增加,肝硬化患者的血清Lp-PLA2、Cys-C水平呈上升趋势,差异均有统计学意义(P<0.05),见表3。
表3 不同Child-Pugh分级患者的血清Lp-PLA2、Cys-C水平比较(±s)Table 3 Comparison of serum Lp-PLA2 and Cys-C levels among patients with different Child-Pugh grades(±s)
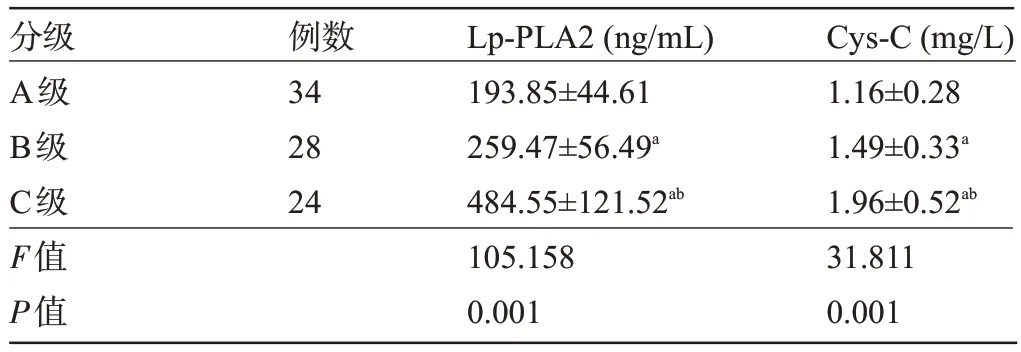
表3 不同Child-Pugh分级患者的血清Lp-PLA2、Cys-C水平比较(±s)Table 3 Comparison of serum Lp-PLA2 and Cys-C levels among patients with different Child-Pugh grades(±s)
注:与A级比较,aP<0.05;与B级比较,bP<0.05。Note:Compared with Class A,aP<0.05;Compared to Level B,bP<0.05.
分级A级B级C级F值P值Cys-C(mg/L)1.16±0.28 1.49±0.33a 1.96±0.52ab 31.811 0.001例数34 28 24 Lp-PLA2(ng/mL)193.85±44.61 259.47±56.49a 484.55±121.52ab 105.158 0.001
2.4 不同肝硬化程度患者的血清Lp-PLA2、Cys-C 水平比较 随着肝硬化程度加重,患者的血清Lp-PLA2、Cys-C 水平呈上升趋势,差异均有统计学意义(P<0.05),见表4。
表4 不同肝硬化程度患者的血清Lp-PLA2、Cys-C水平比较(±s)Table 4 Comparison of serum Lp- PLA2 and Cys- C levels in patients with different degrees of cirrhosis(±s)
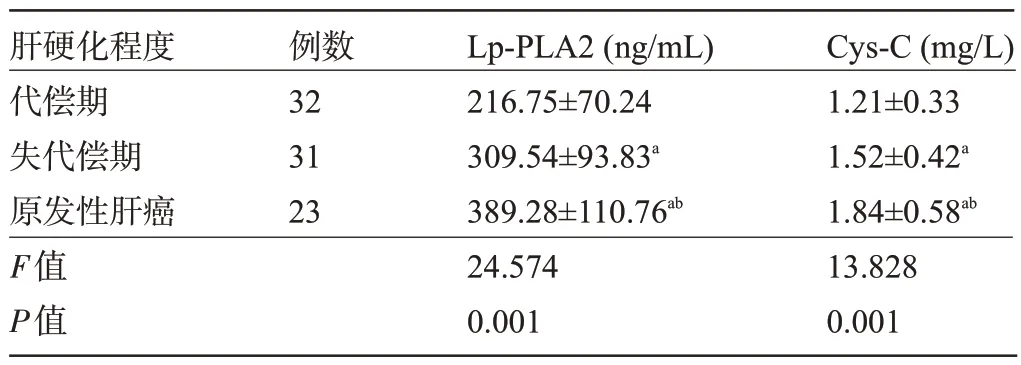
表4 不同肝硬化程度患者的血清Lp-PLA2、Cys-C水平比较(±s)Table 4 Comparison of serum Lp- PLA2 and Cys- C levels in patients with different degrees of cirrhosis(±s)
注:与代偿期比较,aP<0.05;与失代偿期比较,bP<0.05。Note:Compared with that of the compensation period,aP<0.05;Compared with that of the compensatory period,bP<0.05.
肝硬化程度代偿期失代偿期原发性肝癌F值P值例数32 31 23 Lp-PLA2(ng/mL)216.75±70.24 309.54±93.83a 389.28±110.76ab 24.574 0.001 Cys-C(mg/L)1.21±0.33 1.52±0.42a 1.84±0.58ab 13.828 0.001
2.5 肝硬化患者血清Lp-PLA2、Cys-C 水平与肝功能、Child-Pugh 分级及肝硬化程度的相关性 经Pearson法相关性分析结果显示,血清Lp-PLA2、Cys-C水平与ALP、GGT、GLO 呈正相关(P<0.05),而与ALB呈负相关(P<0.05);经Spearman 法相关性分析结果显示,血清Lp-PLA2、Cys-C水平与Child-Pugh分级(A级=1、B级=2、C级=3)、肝硬化程度(代偿期=1、失代偿期=2、原发性肝癌=3)呈正相关(P<0.05),见表5。
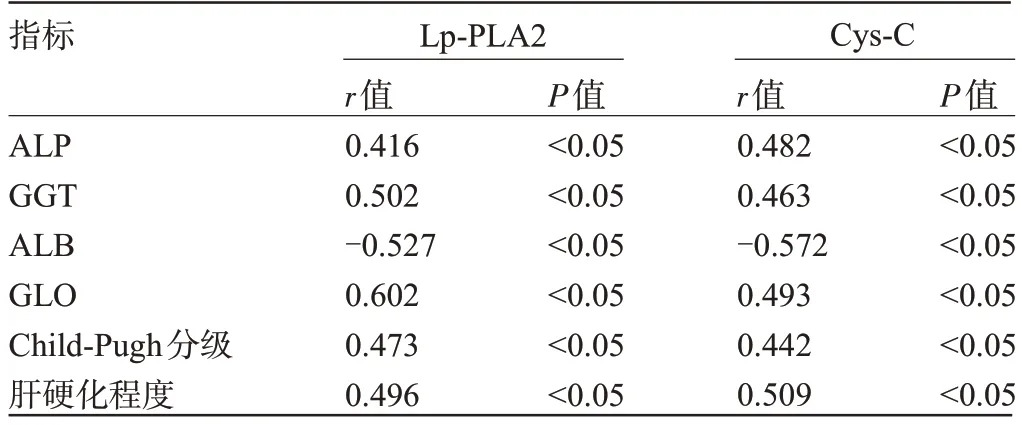
表5 肝硬化患者血清Lp-PLA2、Cys-C 水平与肝功能、Child-Pugh分级及肝硬化程度的相关性Table 5 Correlation between serum Lp-PLA2, Cys-C levels and liver function,Child Pugh grade,and degree of cirrhosis in patients with liver cirrhosis
2.6 血清Lp-PLA2、Cys-C 对肝硬化所致原发性肝癌的诊断价值 以失代偿期31例为阳性样本,以代偿期32 例为阴性样本,绘制ROC 曲线,结果显示,血清Lp-PLA2、Cys-C 联合鉴别诊断失代偿期的AUC 明显大于单独指标鉴别诊断,差异具有统计学意义(P<0.05);以原发性肝癌23 例为阳性样本,以失代偿期31例为阴性样本,绘制ROC曲线,结果显示,血清Lp-PLA2、Cys-C联合鉴别诊断原发性肝癌的AUC明显大于单独指标鉴别诊断,差异有统计学意义(P<0.05),见表6、图1和图2。
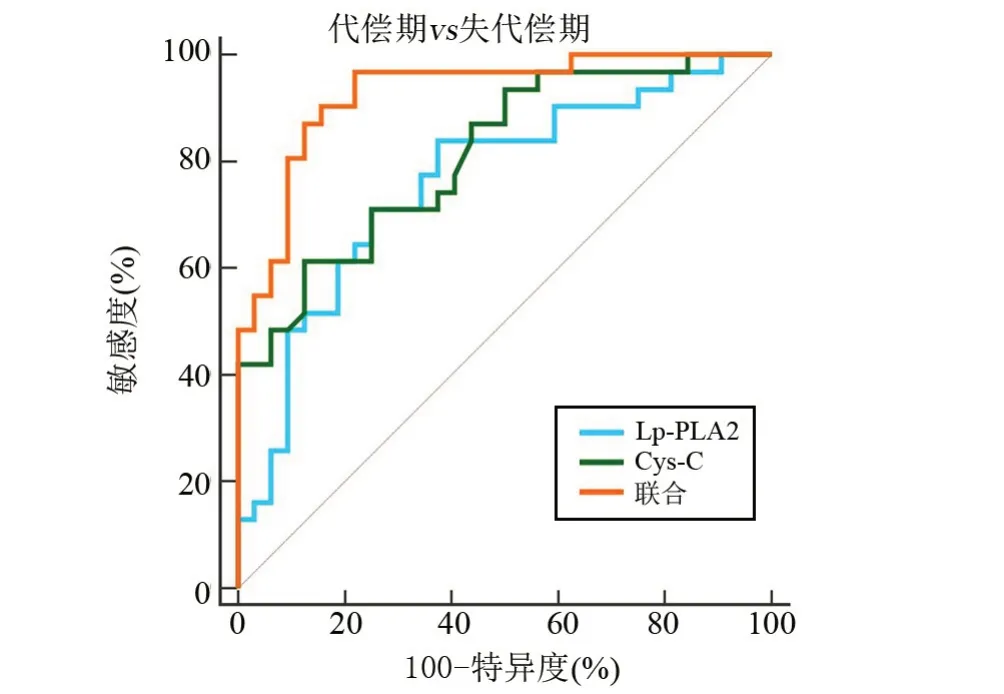
图1 血清Lp-PLA2、Cys-C联合鉴别诊断失代偿期患者的ROCFigure 1 ROC of Lp- PLA2 and Cys- C alone and in combiration for differential diagnosis of decompensated patients
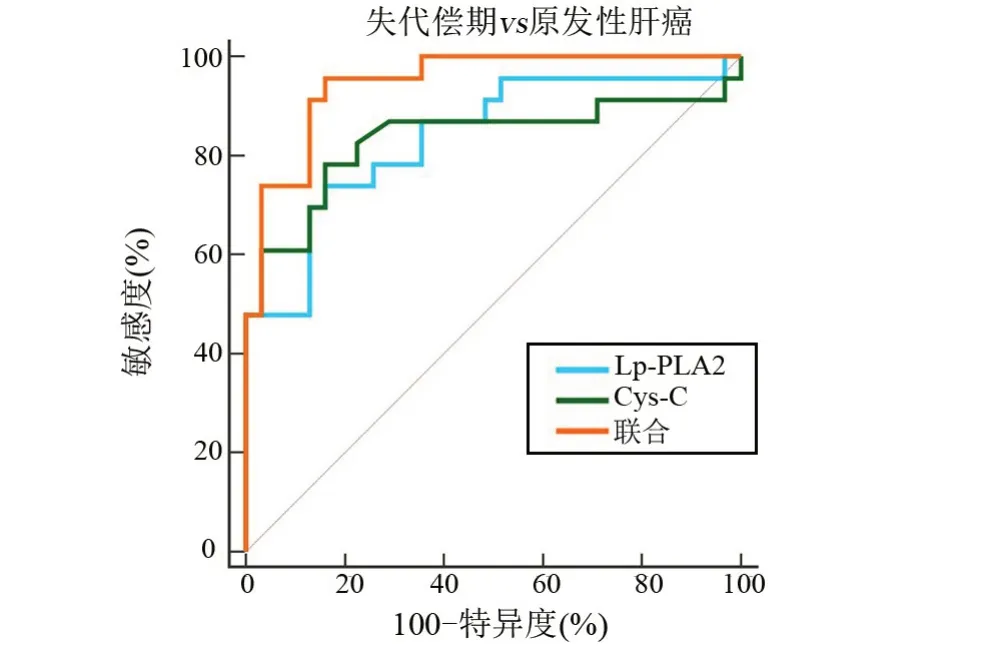
图2 血清Lp-PLA2、Cys-C联合鉴别诊断原发性肝癌患者的ROCFigure 2 ROC of Lp-PLA2 and Cys-C alone and in combiration for differential diagnosis of primary liver cancer
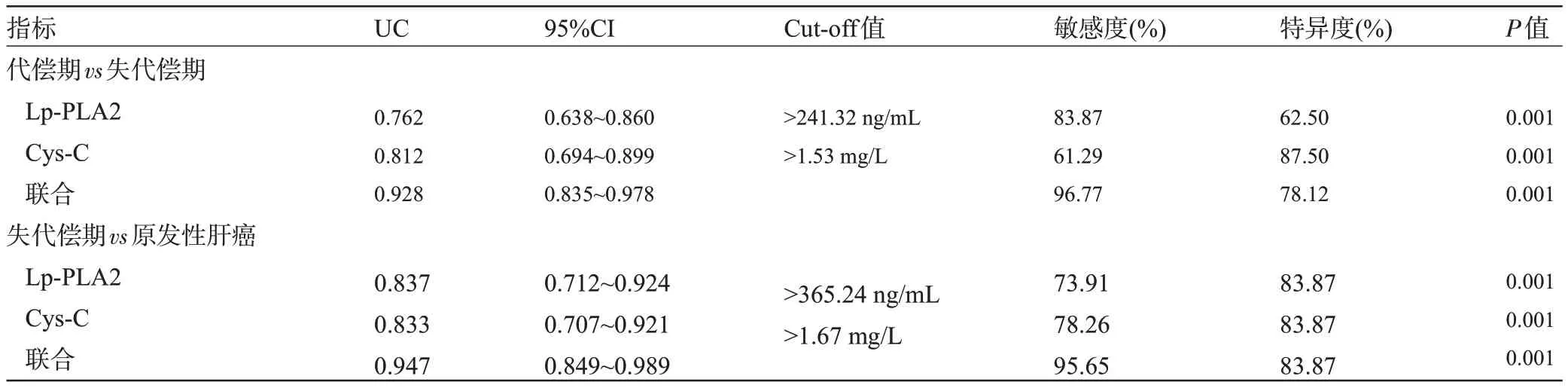
表6 血清Lp-PLA2、Cys-C对肝硬化所致原发性肝癌的诊断价值Table 6 Diagnostic value of serum Lp-PLA2 and Cys-C in primary liver cancer caused by cirrhosis
3 讨论
HBV感染后可刺激机体免疫系统,破坏肝细胞合成胶原功能,致使肝纤维化发展,甚至诱发肝癌与急性肾损伤[12]。生化、影像学检查是重要辅助检查手段,Child-Pugh 分级可评估肝脏储备功能,但未能明确肝硬化严重程度,因而寻找细胞因子评估患者病情严重程度具有重要意义。
Lp-PLA2 水平升高与机体氧化应激反应密切相关,可提高细胞对细胞血脂成分的吸收代谢能力,中和氧化型磷脂,以此降低其对肝脏或其他脏器组织损伤[13-14]。本研究结果显示,肝硬化组血清Lp-PLA2 水平高于肝炎组、对照组,且肝炎组高于对照组,提示Lp-PLA2 差异性表达可能影响HBV 感染肝硬化病情进展。本研究发现随着HBV-DNA载量增加,血清Lp-PLA2 水平呈上升趋势,其与ALP、GGT、GLO、Child-Pugh分级、肝硬化程度呈正相关,而与ALB呈负相关,证实Lp-PLA2水平变化可能反映肝功能情况,肝脏感染程度。其作用机制可能为Lp-PLA2 表达异常可影响肝脏上皮细胞生理功能,而HBV感染肝硬化进展过程中,可刺激肝细胞产生细胞因子,导致Lp-PLA2 水平升高。
Cys-C 可反映机体内氧化应激代谢状态,并可调节炎性反应、细胞外基质降解及吞噬功能,同时Cys-C 水平升高可提高游离氧自由基水平、局部微循环环境中游离电子浓度,促进肝脏间质细胞损伤及纤维化,加剧氧化还原反应平衡紊乱,促进肝硬化病情进展[15-17]。本研究结果显示,肝硬化组血清Cys-C 水平高于肝炎组、对照组,且肝炎组高于对照组,其水平与ALP、GGT、GLO 呈正相关,而与ALB 呈负相关,提示HBV 感染肝硬化患者伴有肝肾功能降低。其原因可能为HBV感染肝硬化患者体内醛固酮水平升高,可增强肾小管重吸收能力,引起肾小管、肾小球功能失衡,导致Cys-C 水平升高。本研究结果显示,随着HBVDNA 载量、Child-Pugh 分级增加及肝硬化程度加重,血清Cys-C 水平呈上升趋势,提示Cys-C 表达与HBV感染肝硬化病情密切相关,这主要是由于Cys-C 水平升高可影响肝脏上皮细胞,破坏线粒体膜完整性,促进转氨酶释放,降低肝脏合成、解毒功能,影响肝细胞再生,并可影响胱抑素富集程度,促进活性氧形成,引起细胞脂质过氧化反应,加重肝组织损伤程度,致使肝功能恶化。目前Lp-PLA2、Cys-C 在肝硬化应用中的研究相对较少,本研究探讨Lp-PLA2、Cys-C在诊断肝硬化程度方面的临床价值,结果显示,血清Lp-PLA2、Cys-C联合鉴别诊断失代偿期的AUC大于单独指标鉴别诊断,其联合鉴别诊断原发性肝癌的AUC大于单独指标鉴别诊断,提示血清Lp-PLA2、Cys-C在诊断肝硬化程度中具有一定临床应用价值。
综上所述,HBV 感染肝硬化患者血清Lp-PLA2、Cys-C水平升高,且与肝功能指标、Child-Pugh分级、肝硬化程度密切相关,联合检测其水平在诊断肝硬化程度方面具有一定临床价值,因而监测Lp-PLA2、Cys-C水平变化有助于判断HBV 感染肝硬化患者肝硬化程度,可为临床制定治疗方案提供参考。
