浮游植物优势属演替和丝状蓝藻增殖的驱动因子研究
——以千岛湖为例
2023-11-22陈玉茹刘佳睿郑文婷岳智颖程新良吴志旭
陈玉茹 刘佳睿 郑文婷 岳智颖, 沈 宏 程新良 吴志旭 谢 平
(1.大连海洋大学,大连 116023;2.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,东湖湖泊生态系统试验站,武汉 430072;3.浙江省杭州生态环境监测中心,杭州 310000;4.中国科学院大学,北京 100049;5.杭州市生态环境局淳安分局,杭州 311700)
浮游植物作为水生生态系统的初级生产者,在生态系统的能量流动和物质循环中发挥重要作用,其群落结构直接影响水生态系统功能[1]。浮游植物群落演替与营养盐浓度及气候变化之间存在着密切联系[2],是众多环境因子在时间和空间上综合作用的结果。相比湖泊,大多数水库具有营养盐浓度低的特点,水库藻类群落演替及其驱动因子已有大量研究报道[3—8],主要与水温[3—5]、水动力[6,7]、氮磷比、总磷[8]等环境因子相关。由于水库类型不同,浮游植物演替的驱动因子也不相同,通常是多种环境因子共同驱动的结果。
近年来,随着气候变化和人类活动干扰,许多水库面临蓝藻水华的风险,其中丝状蓝藻水华暴发的频率和强度越来越高[9,10],我国一些湖库如南京方便水库、抚仙湖[11]和东平湖[12]等,尽管营养盐较低,仍发现偶发性丝状蓝藻水华。丝状蓝藻,其形态和生理生化多样性复杂,不同种类丝状蓝藻的水华形成机制也各不相同[13—15],多数种类对低营养盐有较强的耐受性,易在贫营养水体中成为优势类群[16]。目前对微囊藻在富营养水体中发生水华的过程和机制已有较为详尽的研究[17],但对贫-中营养水体浮游植物优势属演替及丝状蓝藻优势的发生机制有待深入探究[18]。
千岛湖目前处于贫-中营养状态[19],作为长三角地区重要的水源地,保障其水质安全具有重要战略意义。千岛湖自1980年以来,随着气温增加[20],水体透明度下降[21],总磷浓度升高[22],藻类密度显著增加,局部库湾发生蓝藻水华[20]。在2008年前,千岛湖浮游植物优势属以小环藻属(Cyclotella)、隐藻属(Cryptomonas)和蓝隐藻属(Chroomonas)为主,2009—2012年蓝藻成为主要类群,浮游植物优势属转变为颤藻属(Oscillatoria)、小球藻属(Chlorella)、小环藻属(Cyclotella)和蓝隐藻属(Chroomonas)。自2013年以来,丝状蓝藻逐渐成为浮游植物优势类群,与其他藻类共同占优势[23]。千岛湖浮游植物群落结构变化和众多因素有关,尤其与总氮、氮磷比及透明度关系密切[23]。然而,何种因子驱动丝状蓝藻优势度逐渐增大,目前尚不十分清楚。
为揭示水库浮游植物优势属演替和丝状蓝藻占主导地位的驱动因子,本研究以千岛湖为例,通过对千岛湖2017—2021年浮游植物和理化因子监测,结合浮游植物功能群(Functional groups,FGs)[24]分析,阐明千岛湖浮游植物优势属、优势功能群和丝状蓝藻变化的驱动因子,以期为湖库优势属演替和丝状蓝藻水华预警和防控提供科学依据。
1 材料与方法
1.1 采样点设置和采样频率
千岛湖(29°11'—30°02'N,118°34'—119°15'E)位于杭州市淳安县,水库面积580 km2。本研究于2017—2021年,在千岛湖18个点位(图1)开展每月1次的调查采样。18个采样点涵盖了千岛湖全湖,包括街口、小金山、三潭岛、大坝前、航头岛和茅头尖6个国控点位及富文、威坪林场、毛竹源、姥山出口、百亩畈、排岭水厂、密山、西园、城中湖、县自来水厂、斋上和许源林场12个点位。由于条件有限,威坪林场、毛竹源、姥山出口、百亩畈、密山、西园、县自来水厂、斋上和许源林场9个点位监测频率为两月1次(1、3、5、7、9和11月),2019年未进行监测。
图1 千岛湖采样点分布Fig.1 Distribution of sampling sites in Qiandaohu Reservior
1.2 浮游植物样品采集与计数
采样严格按照2010版《淡水浮游生物调查技术规范》[25]进行,依据《中国淡水藻类: 系统、生态及分类》[26],所采集浮游植物进行鉴定(鉴定到属水平)。浮游植物定量样品采用卡盖式深水采水器分层采集水样,采集1 L混合水样于样本瓶中,加入1.5 mL浓缩Lugol’s试剂固定48h后,去除上层清液,浓缩到30 mL样本瓶中,利用光学显微镜于10×40倍下鉴定和计数,根据近似几何图形及经验体积公式估算出单位体积的生物量。
1.3 理化指标分析测定
透明度(Secchi depth,SD)、水温(Water temperature,WT)、酸碱度(Pondus hydrogenii,pH)和溶解氧(Dissolved oxygen,DO)等理化指标在现场使用塞氏盘测定和YSI多参数水质仪测定。降雨量(Precipitation,Pre)和气温(Temperature,Temp)从国家气象科学数据共享服务平台(http://data.cma.cn)和淳安县水雨情服务系统网站(http://caslj.hzyuansi.com)下载。把水样冷藏带回实验室,参照《水和废水监测(第四版)》[27]中总氮(Total Nitrogen,TN)和总磷(Total Phosphorus,TP)的测定方法,分别采用碱性过硫酸钾消解分光光度法和过硫酸钾消解分光光度法,对原水中的TN和TP进行测定。
1.4 数据分析
理化因子和浮游植物数据分析依据每月各采样点数据年均值计算。数据处理及分析在R 4.1.0中完成,利用Origin 2022和R软件中的ggplot2包作图对数据进行展示。采用R软件中vegan包对浮游植物优势种与理化因子进行冗余分析(RDA),利用Monte Carlo检验进行理化因子与浮游植物年际间显著性分析,P<0.05表示具有显著差异。浮游植物密度和生物量及丝状蓝藻与理化因子的相关性分析通过vegan包的Mantel Test完成。通过lavaan包建立结构方程模型(SEM),描述环境因子对藻类密度、生物量和蓝藻密度、生物量的影响路径及作用强度。其中显著性用P表示,P<0.01为极显著相关,P<0.05为显著相关,P≥0.05无显著性。
浮游植物分类学优势度和功能群优势度[28]计算公式如下:
式中,Y为优势度;ni为第i种藻类的生物量或功能群的生物量;N为所有藻类或功能群的总生物量,fi为第i种藻类或功能群出现的频率。当Y≥0.02即为优势种(属)或优势功能群。
2 结果
2.1 水体理化因子及气象因子年际变化
在监测期间,千岛湖各理化因子年际变化趋势如图2所示。2017—2021年,千岛湖TN呈下降趋势而TP则逐年上升。其中,全湖TN平均浓度下降了22.81%,从2017年1.14 mg/L下降到2021年0.88 mg/L;而TP尽管浓度较低,但上升了58.33%,从0.012上升到0.019 mg/L。氮磷比(TN/TP)下降了36.07%,从2017年的82.03下降到2021年的52.44。2017—2021年年均WT和Temp无显著变化,均值分别为(21.75±6.42)℃和(17.63±8.22)℃。其中夏季(7—9月)平均气温下降,2021年较2017年下降了1.7℃。全湖DO均值为(9.14±1.21) mg/L,在6.75—11.76 mg/L波动。pH为7.26—9.12,呈弱碱性。SD均值为(3.85±1.15) m,2021年较2017年略有增加。2017—2021年,降雨量总体呈上升趋势,2020—2021为暴雨典型年,2020和2021年降雨量分别为2098.4和1900.5 mm,均高于历史年平均降雨量1733 mm[21]。
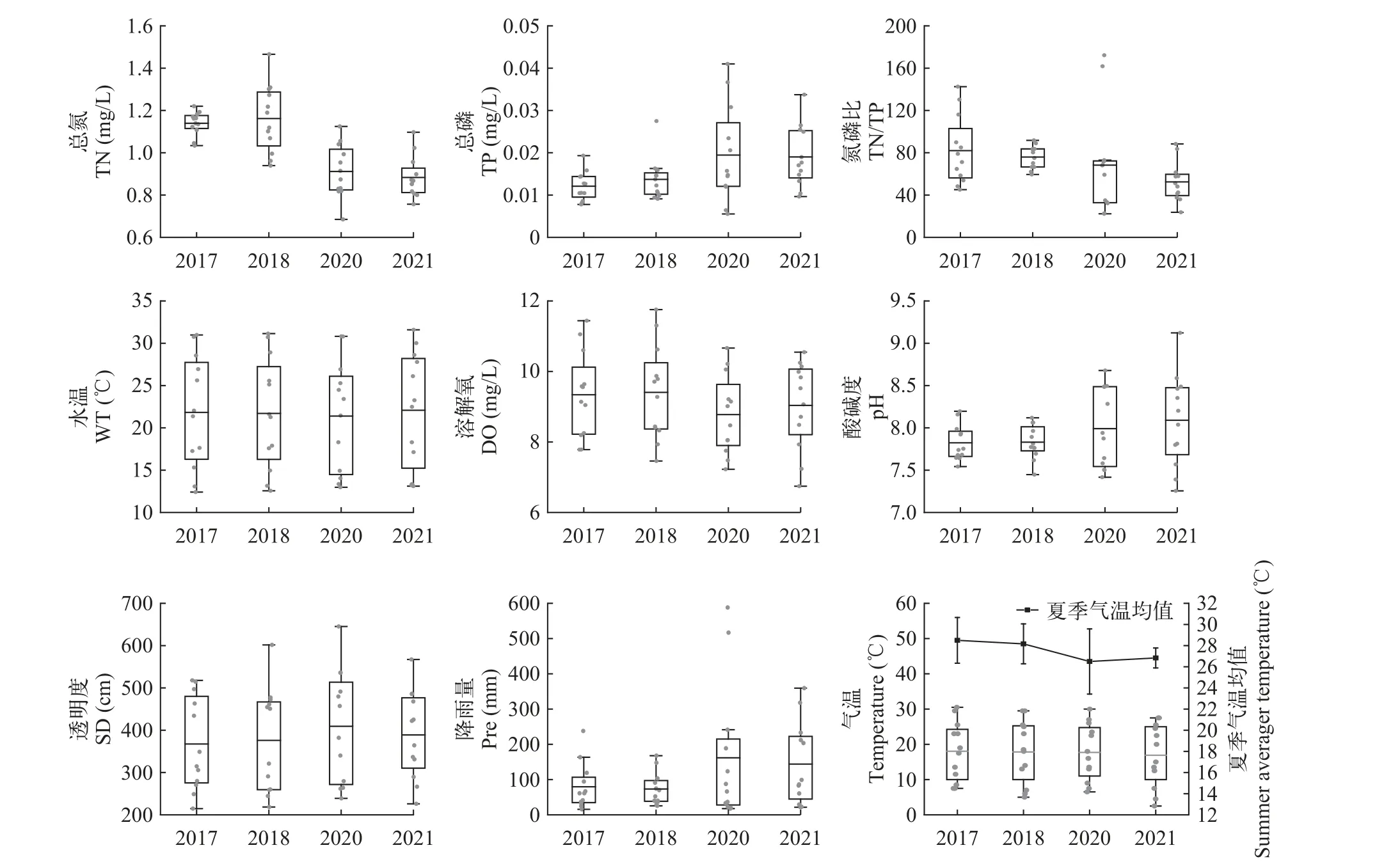
图2 千岛湖2017—2021年理化因子及气象因子年际变化Fig.2 Interannual variation of physicochemical and meteorological factors in Qiandaohu Reservoir from 2017 to 2021
2.2 浮游植物群落结构和优势种演替
在监测期间,共鉴定浮游植物8门92属。其中绿藻门的属最多,达到43属;其次为硅藻门21属;蓝藻门18属;裸藻门、金藻门、甲藻门、隐藻门和黄藻门均少于5属。2017—2021年,千岛湖浮游植物细胞密度呈显著上升趋势(P<0.5),2017年和2018年其年均值分别为5.9×106和5.27×106cells/L,到2020年和2021年,其年均值分别达到1.37×107和1.54×107cells/L(图3a)。相比细胞密度,浮游植物年均生物量略有升高,从2017年的1.46 mg/L增加到2021年的2.23 mg/L,年际间无显著差异(P>0.5;图 3b)。千岛湖浮游植物细胞密度的升高主要由于夏秋季蓝藻门显著增加导致。千岛湖浮游植物密度蓝藻占比最高,其次为硅藻和绿藻;而生物量则是硅藻占比最高,其次为蓝藻、绿藻、隐藻和甲藻。
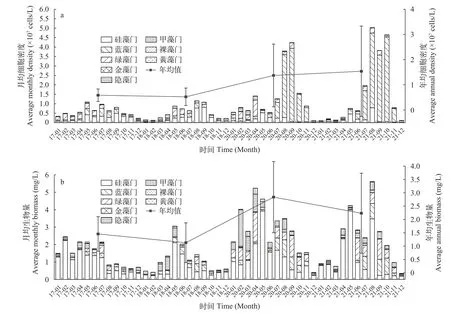
图3 千岛湖浮游植物细胞密度(a)和生物量(b)逐月变化Fig.3 Monthly changes of phytoplankton cell density (a) and biomass (b) in Qiandaohu Reservoir
根据浮游植物分类学优势度的计算结果,全年浮游植物优势属有28属,隶属于蓝藻门、硅藻门、绿藻门、隐藻门和甲藻门。其中,优势度较高的16个属在各门类中占比的逐月变化和年际变化如图4所示。蓝藻门由长孢藻属(Dolichospermum)和微囊藻属(Microcystis)在2017—2018年共同占优势演替为它们与多种丝状蓝藻假鱼腥藻属(Pseudanabaena)、细鞘丝藻属(Leptolyngbya)和尖头藻属(Raphidiopsis)平分秋色,且长孢藻属和微囊藻属占比显著下降。随着蓝藻门优势属的演替,硅藻门优势属也发生了演替,以小环藻属(Cyclotella)和针杆藻属(Synedra)为主要的优势属转变成直链藻属(Melosira)、小环藻属、曲壳藻属(Achnanthes)和脆杆藻属(Fragilaria)多种硅藻共同占优势。2017—2021年,绿藻门中角星鼓藻属(Staurastrum)占比呈上升趋势,卵囊藻属(Oocystis)呈下降趋势;甲藻门中薄甲藻属(Glenodinium)呈上升趋势;隐藻门中蓝隐藻属(Chroomonas)和隐藻属(Cryptomonas)均呈下降趋势。
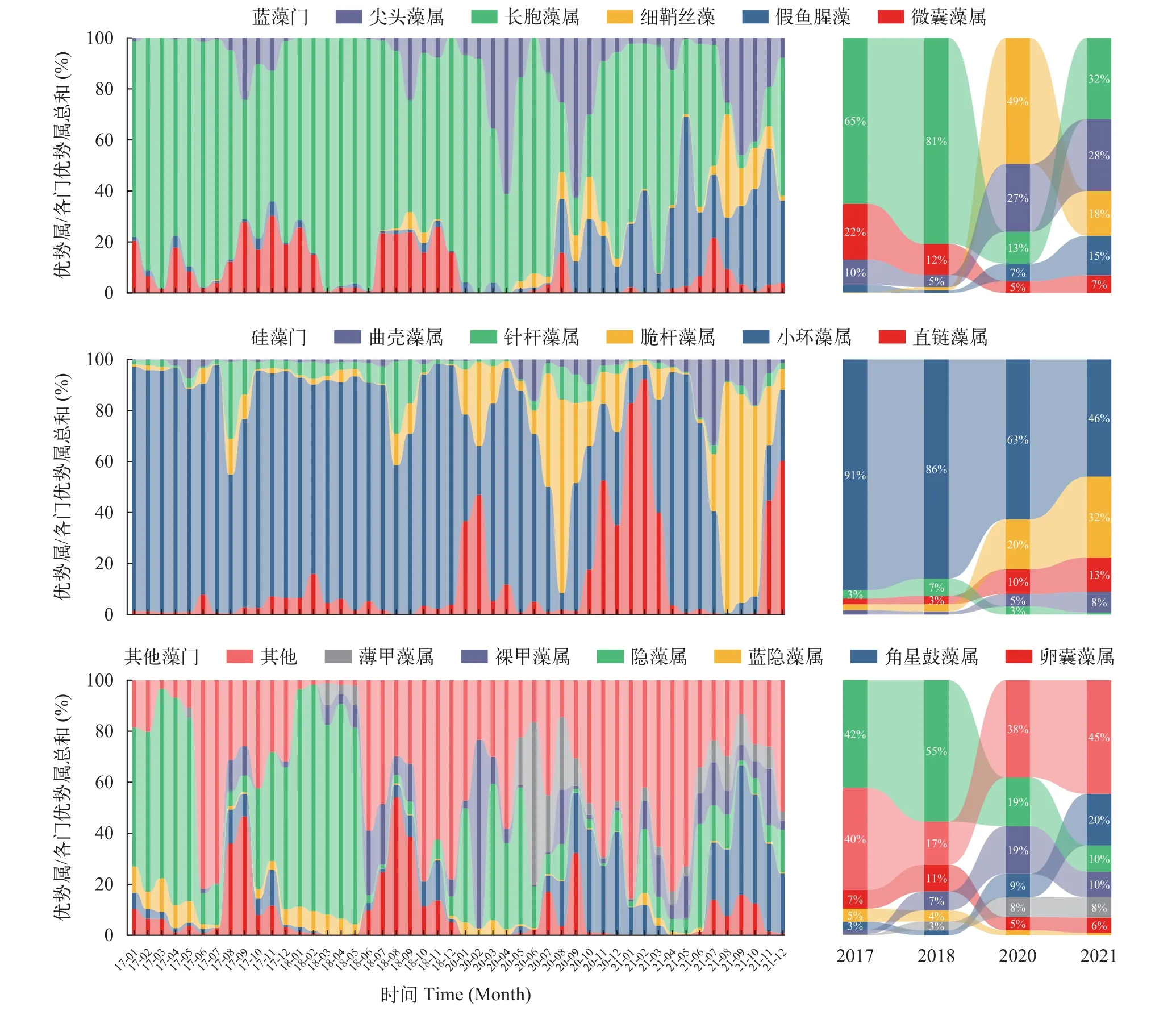
图4 千岛湖浮游植物优势属占比逐月变化和年际变化Fig.4 Percentage of dominant genus in each month and each year in Qiandaohu Reservior
2.3 浮游植物功能群特征及其优势功能群变化
根据Padisak[24]的功能群分类方法,千岛湖浮游植物可划分为 27 个功能群,分别为A、B、C、D、N、P、MP、T、TC、TB、S1、S2、SN、X2、X1、E、Y、F、G、J、K、H1、LO、LM、M、W1和W2(表1)。
其中优势功能群共有17种(图5),2017—2018年优势功能群主要有B、D、P、H1、J、Y和M功能群,2020—2021年优势功能群主要有B、N、P、MP、H1、S1、SN和Y功能群。2020—2021年优势功能群不仅其生物量增加,其组成也更复杂。从2017年以B功能群为绝对优势演替为B、N、P、MP、H1、S1、SN和Y等多种功能群共同占优势。
2.4 浮游植物与环境因子的相关分析
由于蓝藻门年际变化显著,将浮游植物、蓝藻和理化因子月均值进行Mantel Test分析(图6)发现,千岛湖浮游植物总细胞密度与TN、WT、pH、SD和Temp显著相关(P<0.05);总生物量与TP、WT、DO、pH、SD和Temp显著相关(P<0.05)。蓝藻密度和生物量与TN、WT、pH、SD、Pre和Temp显著相关(P<0.05),总磷和降雨量相关性最高(R=0.66;P<0.01),为极显著正相关。
通过结构方程模型(SEM)对千岛湖藻类与环境因子之间的相关关系及作用强度进行进一步分析(图7)。结果表明,千岛湖浮游植物总密度和蓝藻密度与TN、TN/TP和水温显著正相关(图7a)。千岛湖浮游植物总生物量与蓝藻生物量和TP显著正相关,蓝藻生物量与水温正相关,与TN/TP负相关(图7b)。
2.5 浮游植物优势属和优势功能群驱动因子分析
通过冗余分析(RDA)可知,千岛湖浮游植物优势属受TN、TP、WT、SD、pH和Temp共同驱动,其中TN解释率最高,轴1和轴2的解释率分别为23.68%和9.53%,总解释率达到了33.21%(图8a)。TP、WT、pH和Temp与轴1呈正相关,TN、SD与轴1呈负相关。优势属中丝状蓝藻假鱼腥藻属、尖头藻属、细鞘丝藻属及绿藻门的角星鼓藻属均与TN呈负相关,而长胞藻属、小环藻属、蓝隐藻属和隐藻属与TN呈正相关;硅藻门的直链藻属与TP、WT、pH、Temp呈负相关,与SD正相关,蓝藻门的微囊藻属,硅藻门的曲壳藻属、脆杆藻属、针杆藻属,甲藻门裸甲藻属,薄甲藻属及其他优势藻与TP、WT、pH和Temp呈正相关,与SD负相关。
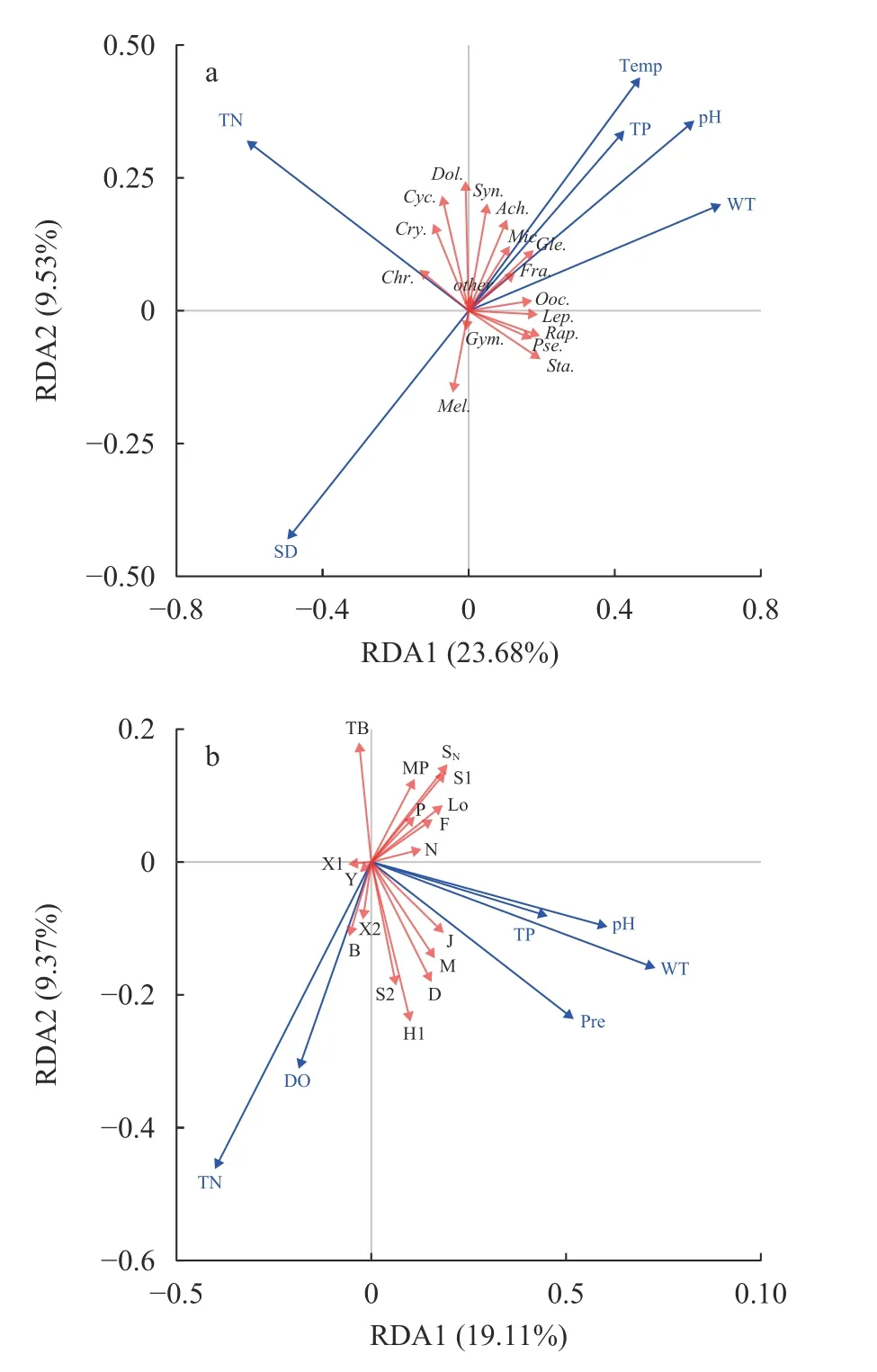
图8 千岛湖优势属(a)和优势功能群(b)与环境因子的冗余分析Fig.8 Redundancy analysis of dominant species (a) and dominant functional groups (b) in Qiandaohu Reservior
由图 8b可知,浮游植物优势功能群演替受TN、TP、WT、DO、pH和Pre共同驱动,轴1和轴2的解释率分别为19.11%和9.37%,6个环境因子共同解释了28.48%的浮游植物优势功能群的变化。其中,TP解释率最高,其次是DO、pH和TN。TN、DO与轴1呈负相关,TP、WT、pH、Pre与轴1呈正相关。SN、S1、F、LO、P、MP、N功能群与TN和DO呈负相关,X2、X1、Y和B功能群与TN和DO呈正相关,M、J、D、H1、S2与TP、WT、pH、Pre呈正相关,TB与TP、WT、pH、Pre呈负相关。
3 讨论
3.1 千岛湖浮游植物群落结构的特征及变化
调查期间,千岛湖浮游植物群落组成以硅藻、蓝藻和绿藻为主,藻类数占浮游植物种类数的90%以上,其优势种的组成决定了千岛湖浮游植物群落结构的特征。2017—2021年,千岛湖浮游植物年均密度升高显著,夏秋季蓝藻门中体积较小的假鱼腥藻属、细鞘丝藻属和尖头藻属等丝状蓝藻密度的显著升高是导致浮游植物密度升高的主要原因。千岛湖浮游植物优势属及其优势度存在显著的季节变化,其优势属种类数呈增加趋势,蓝藻门、硅藻门和其他门优势属种类数在2020—2021均比2017—2018年增多,浮游植物优势属种类及其数量对浮游植物群落结构的稳定性有重要影响,优势属种类数越多且优势度越小,则群落结构越复杂稳定[29]。
浮游植物的生态适应特征和对生长环境的选择机制,是浮游植物在群落结构演替的限制因素[30]。千岛湖营养状态时空差异大,总体处于贫-中营养状态[23]。本研究中功能群可划分为27个,略高于2015年的调查结果(24个)[31]。与分类学优势种变化趋势相似,2020—2021年的优势功能群种类也较2017—2018年相应增加。2017—2018年,B、J和H1功能群为绝对优势,功能群B几乎在全年占优势,代表性属为小环藻属,适合生长在中营养、低光照的水体中;功能群J在春冬季占优势,以栅藻属、盘星藻属和空星藻属等为代表性藻属;功能群H1在夏秋季占优势,代表性属为束丝藻属和长孢藻属等有异形胞的丝状蓝藻,适合生长在富营养、分层和含氮量低的水体中。而2020—2021年功能群B和H1的优势度降低,与N、P、MP、S1、SN和Y等功能群共同占优。2020—2021年千岛湖主要水域水质维持优良[19],较低的氮磷浓度适宜B、N和H1等功能群的生长。而暴雨事件频繁发生、外源营养输入等因素,导致水体搅动程度增加,透明度降低[32],有利于功能群N、P、MP、S1和SN等对扰动、低光照生境适宜的功能群的生长。其中,功能群N、P和MP在春冬季优势度较高;S1和SN在夏秋季有较高的优势度,代表属为细鞘丝藻、假鱼腥藻和尖头藻等体积较小的丝状蓝藻。功能群Y是春冬季的代表性优势功能群,水库春季和冬季混合性较好,水体相对稳定,对静水环境适应较好的功能群 Y较易形成优势,代表性属为隐藻、裸甲藻和薄甲藻等,与2015年调查结果[31]相似。
3.2 千岛湖浮游植物群落结构变化的驱动因子分析
在监测期间,千岛湖水温是驱动总藻密度,蓝藻密度,蓝藻生物量的重要因子;总磷和降雨量为极显著正相关,2020年和2021年6—7月频繁发生极端降雨事件,降雨增加外源性磷输入,贫-中营养水体更易受其影响[33],总磷浓度升高,本研究表明,暴雨导致总磷的升高使浮游植物总生物量和蓝藻生物量均显著升高,磷是湖泊水体中藻类种群和密度的第一限制性营养元素[34],这与史鹏程等[22]研究结果一致。尽管本研究中TP对蓝藻密度无显著影响,但是通过影响TN/TP从而影响蓝藻的生长。低氮磷比促进蓝藻生长的假说一直存在争议[35],然而SEM分析表明,TN/TP降低导致蓝藻生物量增加,TN/TP和TN的降低共同驱动蓝藻密度增加。Lu等[12]研究也发现蓝藻丰度在东平湖温暖时期与TN表现出强烈的负相关性。氮磷比对不同蓝藻生长影响机制有待进一步研究。
3.3 千岛湖浮游植物优势功能群演替与丝状蓝藻增殖驱动因子分析
本研究与许多研究均发现,TN和WT是影响水库中丝状蓝藻生长的主要原因(图9)。Lu等[12]研究发现席藻(Phormidium)、颤藻(Oscillatoria)、束丝藻(Aphanizomenon)和柱孢藻(Cylindrospermum)等与TN呈强烈相关性;李奕真[16]研究发现假鱼腥藻与TN、TN/TP表现为显著相关;Jia等[36]发现,氮是促进拉氏尖头藻(Raphidiopsis raciborskii)在较低温度下形成水华的关键因子。在千岛湖这种大型贫-中营养水库中,丝状蓝藻由于其特殊的细胞结构具有较高的营养亲和力[37],能在氮磷限制的水域环境中竞争成为优势[16]。本研究也发现,假鱼腥藻属、细鞘丝藻属、尖头藻属与TN拟合程度均较好(R2分别为0.46、0.40和0.32;图 10)。由于外源性氮输入的控制,千岛湖TN逐年降低[19],为S1和SN型丝状蓝藻增殖创造了合适的生境。另一方面,丝状蓝藻的增殖引起水体中氮浓度进一步降低,有利于丝状蓝藻保持其优势[38]。因此,丝状蓝藻和TN的相互作用是促进S1和SN型丝状蓝藻增加的主要原因之一。此外,某些丝状蓝藻如水华鱼腥藻(Anabaena flos-aquae)和阿氏浮丝藻(Planktothrix agardhii)等对磷的奢侈消费使其可存储4—11倍生长所需的磷[39],即使在低磷营养盐浓度下,也能保持正常生长甚至出现异常增殖[40]。营养盐的波动,尤其是随着降雨形成的地表径流入库对水体总磷的脉冲式补充,降低了水体氮磷比,增加了水库偶发蓝藻水华的风险[11]。千岛湖2020—2021年降雨量显著高于历史年平均降雨量,导致入库污染负荷增加,尤其是总磷浓度的升高,为丝状蓝藻异常增殖提供了物质基础。Hou等[10]研究发现,丝状蓝藻由于多样性复杂、环境适应性较广,其水华风险在我国淡水生态系统中越来越高。因此,随着千岛湖流域营养的削减,以及极端天气频发,需加强浮游植物调查,尤其需要关注丝状蓝藻水华的发生风险。
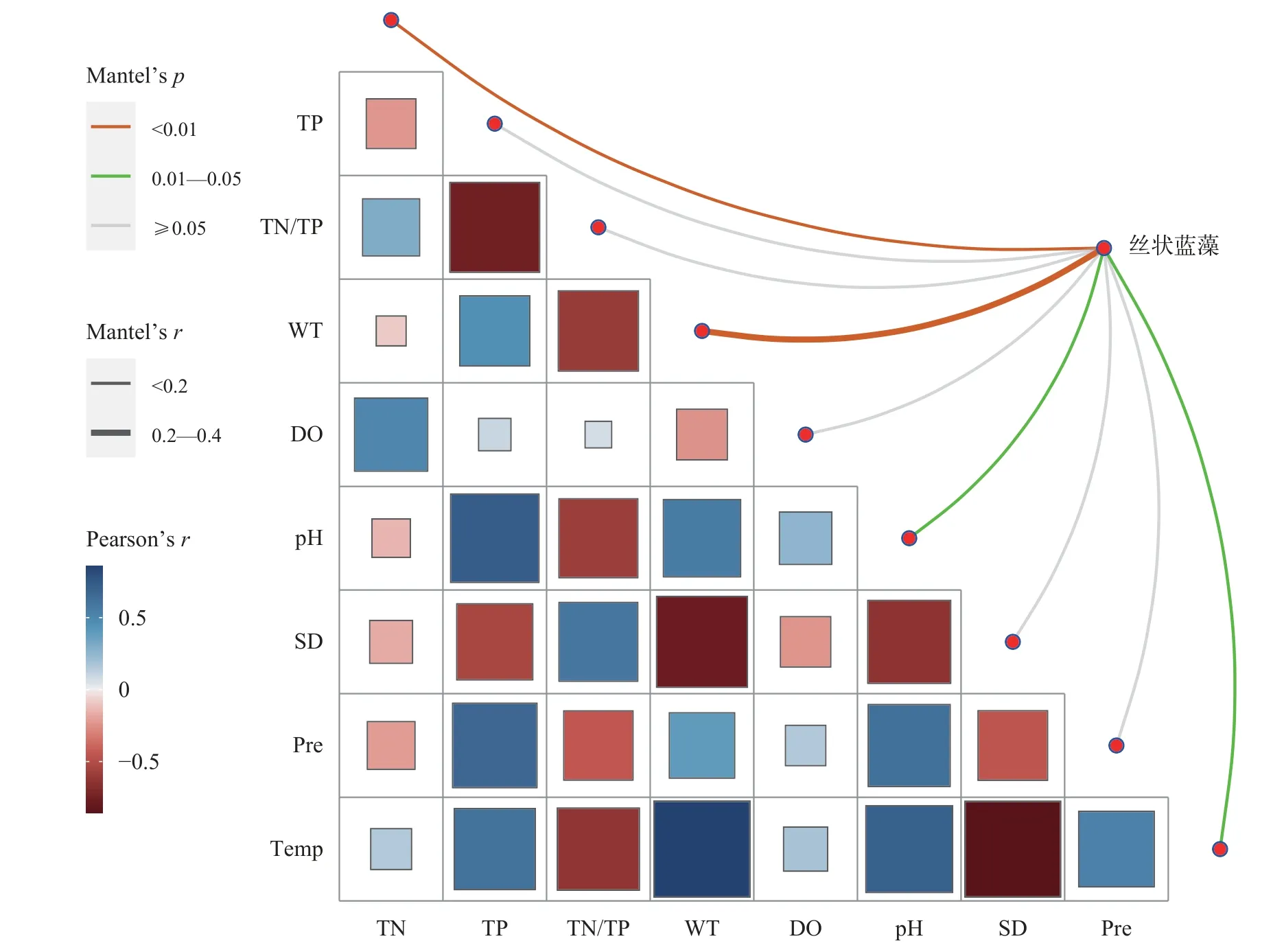
图9 丝状蓝藻生物量和环境因子相关性分析Fig.9 Correlation analysis between filamentous cyanobacteria biomass and environmental factors

图10 假鱼腥藻属(a)、细鞘丝藻属(b)、尖头藻属(c)与TN拟合线性曲线Fig.10 The linear regression relationship between TN and Pseudanabaen (a),Leptolyngbya (b) and Raphidiopsis (c)
浮游植物优势功能群的变化受其生境影响[41]。通过RDA冗余分析可知,千岛湖浮游植物优势功能群的变化受WT、DO、TN和TP的共同影响。WT不仅直接调节浮游植物的生长[31],还能通过改变水库的水体分层结构和营养扩散对其造成影响[42]。本研究发现,功能群SN、S1、F、LO、X1、P与水温正相关,功能群X2和B与WT负相关。在国内外许多水库和湖泊中,功能群S1也是优势功能群且易在夏季暴发形成水华[43]。DO 作为指示水体健康的重要指标,可以影响浮游植物种群变化[44]。本研究中功能群SN、S1、F、LO、X1、P与DO呈负相关,功能群X2、B与DO呈正相关。本研究中功能群SN、S1、F、LO、X1、P与TN负相关,功能群X2和B与TN正相关。功能群N、MP、M、J、D、H1、Y与TP呈正相关,TB与TP呈负相关。降雨的增加不仅导致水体混合透明度降低[21],还导致短期营养盐的增加,使适宜其生境的N、P、MP、S1和SN等功能群成为优势。
