重型β 地中海贫血患儿移植前后肠道菌群变化研究
2023-11-22杨春兰吕佳忆宋欣平张小玲王晓东刘四喜
闻 静 余 阅 杨春兰 吕佳忆 宋欣平 李 越 张小玲 王晓东 刘四喜
1.深圳市儿童医院血液肿瘤科(广东深圳 518038);2.中国医科大学深圳市儿童医院(广东深圳 518038)
地中海贫血(thalassemia,简称地贫)是以α或β珠蛋白链合成障碍为特征的溶血性贫血,也是人类最常见的单基因遗传病之一。重型β地中海贫血(β-thalassemia major,β-TM)患儿的症状在出生后逐渐加重,需终身接受输血和排铁治疗[1]。目前,异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)仍是临床治愈β-TM患儿的首选方法[2]。
人体中存在大量微生物,仅肠道内的菌群就有 1 000多种,但对于单独个体来讲仅有100多种[3]。造血干细胞移植(HSCT)中的预处理化疗、抗生素的使用等势必会造成肠道黏膜损伤,破坏免疫稳态,导致肠道菌群的多样性和丰度发生改变;在这种情况下,会造成多种移植后相关并发症的出现,其中与移植不良结局密切相关的肠道移植物抗宿主病(graft versus-host disease,GVHD)就与微生物组成紊乱密不可分[4]。本研究基于16 SrDNA 技术对37例确诊β-TM 患儿移植过程中的96 份粪便样本的肠道菌群动态变化进行分析,以便更清楚了解移植不同阶段肠道菌群的特征,以期通过优化肠道菌群来改善移植患儿预后。
1 对象与方法
1.1 研究对象
选择2019 年11 月至2020 年6 月在深圳市儿童医院血液肿瘤科行HSCT 的确诊β-TM 的患儿作为研究对象。纳入标准:①年龄0~18岁;②明确诊断β-TM[5]并且拟行HSCT 的患儿。排除标准:①既往有胃肠道疾病史;②中途退出研究。研究方案经深圳市儿童医院医学伦理委员会批准(No.201904602),获得患儿及其父母或监护人的书面知情同意。
1.2 方法
1.2.1 清洁肠道、预处理、预防GVHD 方案 清洁肠道方案:全部入组患儿口服去甲万古霉素+庆大霉素+制霉素。预处理方案:同胞全相合为环磷酰胺(Cy)+环孢素(CSA)+白消安(Bu)+氟达拉滨(Flu)+塞替派(TT)+抗人胸腺细胞球蛋白(ATG);无关供者全相合及单倍体为Cy+Bu+Flu+TT+ATG。预防GVHD 方案:同胞全相合为CSA+吗替麦考酚酯(MMF),无关供者全相合及单倍体为后置环磷酰胺(Pt-Cy)+MMF+他克莫司(FK506)。
1.2.2 临床资料收集 从深圳市儿童医院医疗病历系统中获取患儿基本信息:年龄、性别、供者类型、清洁肠道方案、清髓预处理方案、预防GVHD方案等。
1.2.3 粪便样本收集 收集移植启动前期(移植前15 天至移植前12 天,A 组)、清洁肠道期(移植前11天至移植前9 天,B 组)、预处理期(移植前8 天至移植前1 天,C 组)、干细胞输注期(移植0 天至移植后2天,D组)及移植后细胞植入期(移植后18天至22天,E组)粪便样本共96份。取患儿新鲜粪便2 g装入无菌管中,30分钟内放入-80℃冰箱保存。
1.2.4 粪便样本检测 利用16 SrDNA 基因V 4 区域的Illumina HiSeq测序系统测序粪便样本。取质量合格的基因组DNA样品30 ng及对应的融合引物配置PCR 反应体系,进行PCR 扩增,使用Agencourt AMPure XP 磁珠对PCR 扩增产物进行纯化并溶于洗脱缓冲器,贴上标签,完成建库。使用Agilent 2100 Bioanalyzer对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择HiSeq 平台进行测序。
1.2.5 信息分析流程 下机数据过滤,剩余高质量的数据用于后期分析,将有效数据聚类成分类单元并与数据库比对、物种注释,基于分类单元和注释结果进行样品物种复杂度分析,组间物种差异分析,以及关联分析与模型预测等。采用Alpha多样性指数Chao 1、Ace、Shannon、Simpson 进行分析,以表征样品中物种分布的多样性和均匀度,并直观展示测序深度和数据量情况。Chao1是用Chao1算法估计群落中含分类单元数目的指数,Chao 1在生态学中常用来估计物种总数。Schao 1=Sobs+n 1(n1-1)/2(n2+1),其中Schao1为估计的分类单元数,Sobs 为观测到的分类单元数,n 1 为只有一条序列的分类单元数目,n 2 为只有两条序列的分类单元数目。Chao 1 指数越大,表明群落的丰富度越高。Ace 是用来估计群落中含有分类单元数目的指数,是生态学中估计物种总数的常用指数之一,默认将序列量10以下的分类单元都计算在内,从而估计群落中实际存在的物种数。Ace 指数越大,表明群落的丰富度越高。Shannon 为综合考虑群落丰富度和均匀度的指数,Shannon指数越高,表明群落多样性越高。Simpson 为用来估算样品中微生物多样性的指数之一,在生态学中常用来定量描述一个区域的生物多样性。Simpson指数值越大,说明群落多样性越低。Simpson=1-随机取样的两个个体属于不同种的概率。
1.3 统计学分析
采用SPSS 22.0统计软件进行数据分析。计量资料符合正态分布的以均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;非正态分布的以中位数M(P25~P75)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
研究期间本科诊疗β-TM 577 例次,符合入组标准195 例,其中153 例在知情同意告知时退出,5例有长期腹泻病史被排除。最后入组37 例患儿,其中男27例、女10例,中位年龄7.5(3.0~17.3)岁。部分时间段样本因不合格被剔除,最终纳入分析共96 份样本,A 组28 份、B 组17 份、C 组18 份、D 组21份、E 组12 份。5 组患儿间年龄、性别、供者类型、预处理方案及预防GVHD 方案差异均无统计学意义(P>0.05)。见表1。
2.2 肠道菌群构成
从门水平分析,A组的主要菌门是厚壁菌门、拟杆菌门、变形菌门、放线菌门、梭菌门、疣状菌门。而B 组的主要菌门是厚壁菌门、拟杆菌门、变形菌门、放线菌门、梭菌门、疣状菌门、蓝菌门。C组主要菌门是变形菌门、拟杆菌门、厚壁菌门、梭菌门、疣状菌门。D组主要菌门为变形菌门、拟杆菌门、厚壁菌门、梭菌门。E组则由变形菌门、拟杆菌门、厚壁菌门、放线菌门、梭菌门等菌门组成。
2.3 肠道菌群构成变化
5 组之间厚壁菌门、变形菌门、拟杆菌门、梭菌门、放线菌门、疣状菌门、蓝菌门的丰度差异均有统计学意义(P<0.05)。见表2。
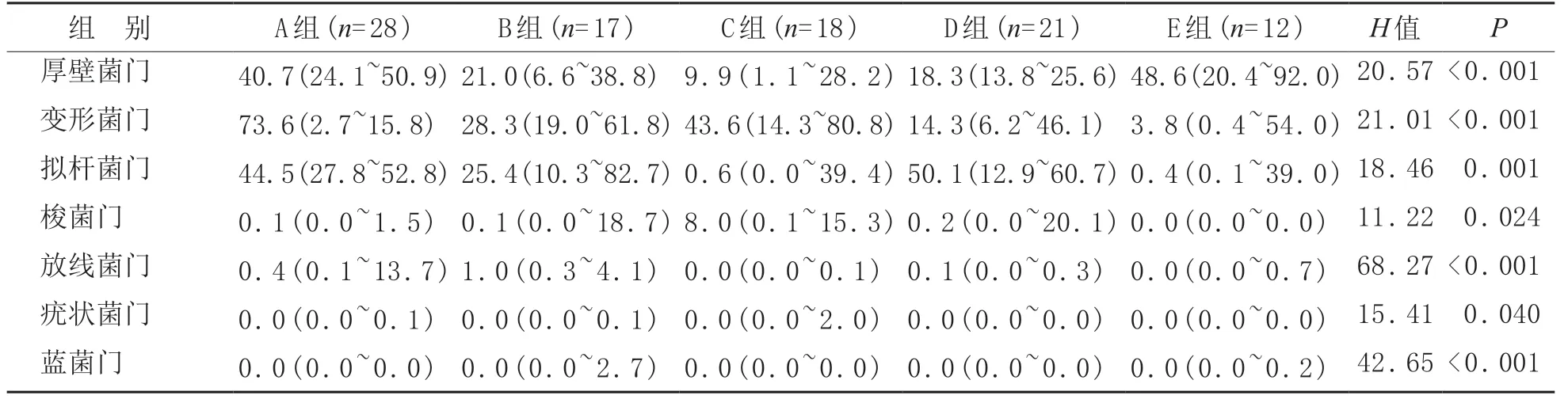
表2 丰度前7的物种组间丰度比较[M(P25~P75),%]
2.4 肠道菌群Alpha丰度及多样性变化
利用Chao 指数比较移植不同时期肠道菌群Alpha丰度。A组Chao指数为225.9(182.0~260.5),B 组为234.6(193.0~311.3),C 组为127.6(81.1~180.0),D组为96.8(71.1~139.9),E组为122.7(97.5~142.7),5组之间差异有统计学意义(H=39.04,P<0.001)。
利用Shannon 指数来预测移肠道菌群Alpha 的多样性。A组Shannon指数为2.9(2.4~3.3),B组为2.2(1.6~2.9)、C组为1.4(1.2~2.0)、D组为2.0(1.4~2.3)、E组为0.9(0.6~2.2),5组之间差异有统计学意义(H=29.39,P<0.001)。
2.5 不同类别抗生素对肠道菌群影响
为研究干细胞输注期不同类别抗菌药物对肠道菌群的影响,本研究对使用万古霉素、使用亚胺培南-西司他丁以及未使用上述两种抗菌药物而使用其他类型广谱抗菌药物(如大环内酯类等)3组进行比较,发现3组间Ace、Chao、Shannon和Simpson指数差异无统计学意义(H=0.66、0.24、1.35、0.96,P>0.05)。见图1。
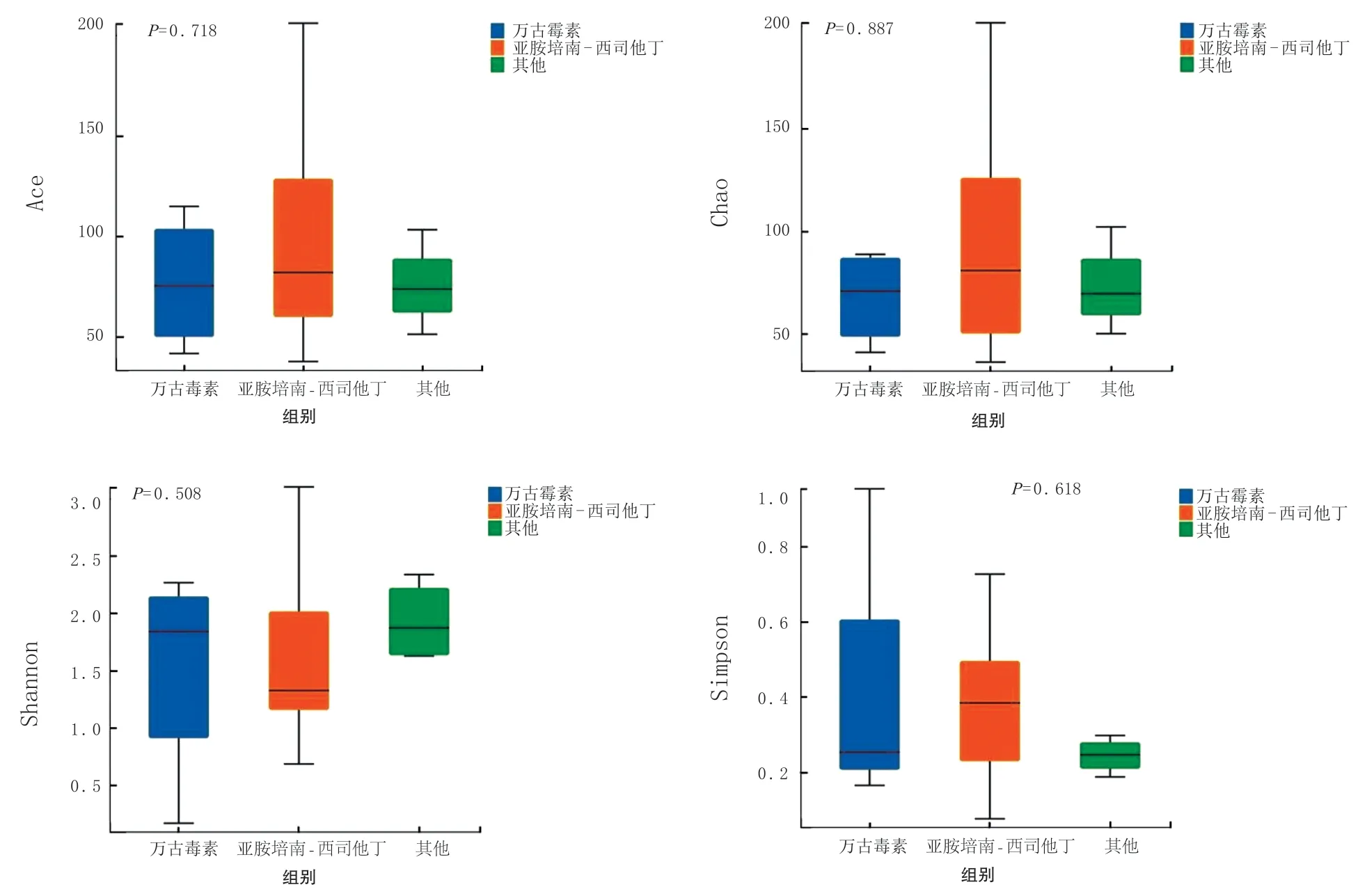
图1 不同抗生素对于干细胞输注期肠道菌群Alpha 多样性影响
3 讨论
HSCT 仍是挽救许多血液系统疾病及恶性肿瘤的有效手段,移植后的免疫重建、感染、以及GVHD等大大影响了移植的成功率[6-8]。近些年由于测序技术的进步,科研人员大规模探索人类肠道菌群的组成和功能,并认识到肠道菌群的损害与多种免疫介导的疾病相关,而移植后的GVHD 与肠道菌群密切相关[9]。
本研究中移植启动前期肠道菌群在门水平上以厚壁菌门、拟杆菌门、放线菌门、变形菌门等为主,且厚壁菌门是最丰富的菌门。既往研究认为健康人体肠道菌群主要由厚壁菌门、拟杆菌门、变形菌门、放线菌门等构成[10]。β-TM患儿移植启动前期的肠道菌群在菌门水平的构成与健康人群相似。
HSCT 前通常经过口服抗生素来清洁肠道菌群,以防止菌群易位而造成感染,同时也可减少移植后GVHD 的发生[11]。既往研究表明使用万古霉素联合多黏菌素B的清肠方案后,菌群的多样性无改变,而丰度较前下降[12],而本研究清肠后,菌群多样性下降,而丰度变化不大,可能与本中心选择的清洁肠道方案相关,菌群多样性的下降可能导致移植相关死亡率上升[4],故而清肠方案是否依据菌群的多样性来优化选择,目前仍有争议。选择性清洁肠道,肠道菌群相对稳定,以拟杆菌为主[13],而全部清洁肠道则拟杆菌的丰度及多样性较低,以肠球菌、链球菌为主,当有对万古霉素、甲硝唑耐药的肠球菌出现时,菌血症的发生率增高[14];而选用环丙沙星与甲硝唑联用方案,可有效减少肠球菌和减轻GVHD[15]。
预处理阶段使用化疗药物来达到清髓目的,但化疗药物对肠道微生物组的损伤机制尚不完全明确,但治疗开始时的早期肠道微生物组变化被认为与化疗相关[16-18]。化疗后,肠道菌群的多样性降低,变形菌门的丰度显著提升[19],这与本研究一致,本研究预处理期变形菌门占最大比例,变形菌门中含大量革兰阴性菌,既往研究认为移植患者变形菌门的相对丰度超过30%,发生革兰阴性菌的菌血症提高5倍[14]。而变形菌门中的伽马变形菌可作为肺部并发症的预测因子,可能预测移植后早期细菌直接转移到肺,或由微生物刺激引起的间接肺损伤[20]。而变形菌门占比增高,也提高了GVHD的风险[21]。
既往研究认为,肠道菌群的重建多在移植后1~3个月[22],本研究移植启动前菌群具有最高的丰度与多样性,移植细胞植入后,肠道菌群的丰度及多样性尚不能完全恢复至移植启动前期水平,故而肠道菌群重建不能在细胞植入期完成,因此在移植后细胞植入期仍需高度警惕感染的发生。
指南推荐在allo-HSCT患者细胞植入前的中性粒细胞减少期预防或治疗性使用广谱抗生素,可减少感染并发症,但使用广谱抗生素可导致肠道菌群受损,特别是碳青霉烯类抗生素,有可能发展为更严重的GVHD[23-24]。本研究中使用万古霉素、亚胺培南-西司他丁与没有使用这两种抗菌药物对比,不同药物之间肠道菌群丰度与多样性差异无统计学意义,因此暂时无法在移植过程中的中性粒细胞缺乏期依据肠道菌群来优化选择抗生素的类型。
既往研究中移植入组患者以成人居多,且病种丰富,不局限于单一病种。本研究为儿童β-TM 单病种。然而,本研究也具有局限性和一些不足。首先,纳入儿童标本具有挑战性,患儿处于特殊敏感的HSCT 时期,依从性相对较差,限制了本研究的标本数量,另一方面由于时间限制,本研究样本量较小,不足以代表整体。其次,肠道菌群受多种因素影响,本研究入组患儿尚未评估地域性、饮食因素等差异对肠道菌群所造成的影响。然而,考虑到越来越多儿童可以通过HSCT 挽救生命,故而未来需要多中心合作,增加纳入样本量来更全面了解肠道菌群,以提高HSCT成功率。
