Caveolin-1 蛋白及其对血脑屏障通透性改变调节作用研究
2023-11-17王娟白雪王廷华李双阳
王娟,白雪,王廷华,李双阳
1 西南医科大学附属中医医院 四川泸州 646000
2 西南医科大学 四川泸州 646000
3 四川大学华西医院 四川成都 610041
中枢神经系统疾病包括感染、创伤、脑卒中及神经退行性病变等,严重影响人类健康和社会发展,治疗也仍是世界重大医学难题。血脑屏障完整性的改变通常是各神经系统疾病临床症状出现前最先出现的病理改变[1]。本综述通过探讨Caveolin-1 调节脑损伤后血脑屏障通透性改变,以期为中枢神经系统疾病的治疗靶点提供一定依据。
血脑屏障是由脑微血管内皮细胞(brain microvascular endothelial cells,BMEC)、内皮细胞紧密连接、神经胶质细胞、星形胶质细胞、周细胞、基膜等组分构成。能够有效的调控中枢与外周血液的物质交换,阻止血液中的亲水极性和大分子进入大脑,保护神经系统内环境的稳定[2]。但同时也使大部分治疗中枢神经系统(central nervous system,CNS)疾病的药物无法穿过BBB,使药物无法在脑内达到有效治疗浓度。作为血液成分进入脑组织的第一道屏障,内皮细胞是血脑屏障的核心组分,具有特殊的结构和分子特性,其通透性改变主要与脑血管内皮细胞及其紧密连接、控制物质外排的P 糖蛋(P-glycoprotein,P-gp)转运体、内皮细胞间隙的孔穴以及胞吞、胞饮等作用密切相关[3]。
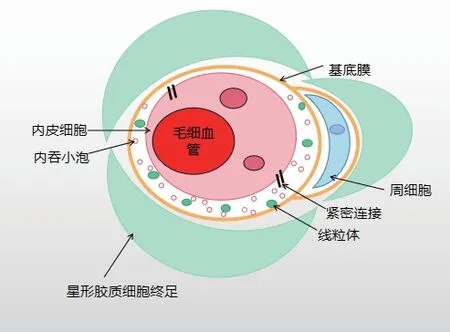
图 血脑屏障结构与组成示意图(抽象示意图,根据文献所绘制)
Caveolin-1 概述
小窝(caveolae)是存在于许多哺乳动物质膜上60- 80nm 的瓶状凹陷结构,它们存在于多种细胞类型中,在脂肪细胞、肌肉和内皮细胞中尤为丰富,具有特殊的脂筏结构,含有丰富的胆固醇、鞘磷脂以及许多跨膜蛋白,它是内皮细胞胞吞、内吞和信号转导的主要位点,其中包括三个成员:CAV1、CAV2 和CAV3,分别编码具有相似结构的蛋白:Caveolin-1(CAV1)、caveolin-2(CAV2) 和caveolin 3(CAV3)[4-5]。Caveolin-1 是小窝的主要结构蛋白之一,是一个178-aa 的质膜蛋白,它在细胞质中采用具有N 端和C 端的发夹状结构,其中心结构域包含在质膜中,在一些神经元和星形胶质细胞中被发现,但主要是存在于大脑血管内皮细胞中[6-7]。
Caveolin-1 作为细胞信号转导的负调控或正调控,主要取决于所研究的细胞类型和特定的细胞信号转导通路。一方面,Caveolin-1 可参与维持血脑屏障完整性,发挥神经保护作用[8]。研究表明,内源性Cav-1 在缺血后最初几天,可以促进新生血管形成、星形胶质细胞增生和瘢痕形成,具有潜在的保护作用[9]。在Bend.3 细胞氧糖剥夺模型中,颅内慢病毒注射靶向Cav1 的短发夹RNA 降低Caveolin-1 的表达,能抑制苦参碱的神经保护功能,破坏神经功能的完整性[10]。在大脑中动脉阻塞(MCAO)大鼠模型中,Cav-1 可通过抑制TJ 蛋白表达的降解来改善血管源性水肿[11]。同时另一方面,Cav-1 在脑出血后早期脑血脑屏障损伤中起着有害作用,Cav-1 敲除的小鼠脑出血后1 天的脑损伤体积更小,神经功能缺损更轻,脑水肿更少,神经元死亡更少[12]。
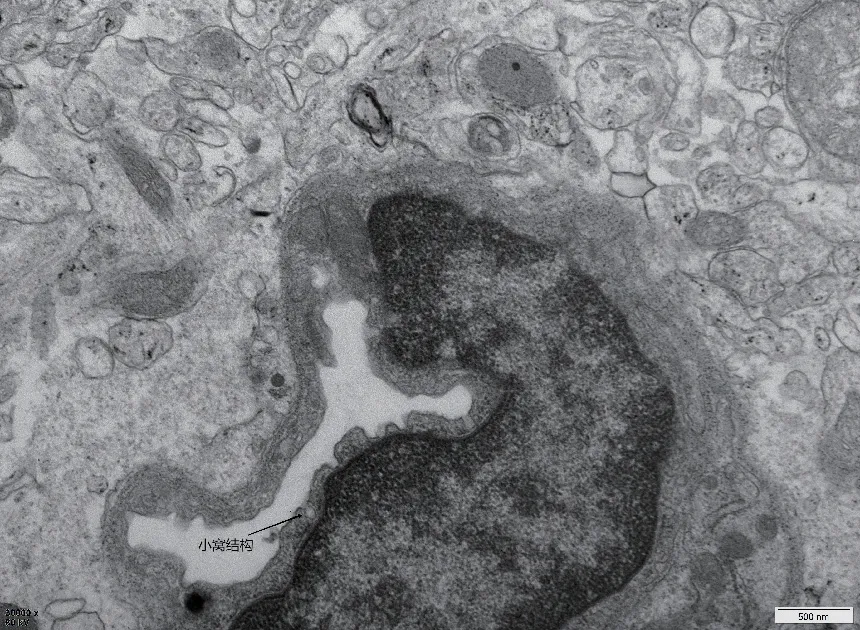
图2 小窝结构(实验室拍摄的透射电镜照片)
Caveolin-1 调节血脑屏障通透性改变
1 调节脑微血管内皮细胞
脑微血管内皮细胞(Brain Microvascular Endothilial Cells,BMECs)是血脑屏障的基本骨架和关键结构,是体循环和脑实质之间交换分子的主要界面。相邻ECs 之间的紧密连接(TJs)复合物保证了脑内皮的物理紧密性[13]。研究发现,Cav-1 在内皮细胞机制转导中发挥重要作用,Cav-1 的缺乏会降低内皮细胞沿血流方向排列的能力,同时cave-1 与血流诱导的血管舒张、血管重塑、NO 生成受损等密切有关。Elizabeth Le Master 等研究发现,Cav-1 可能通过调控CD36 的表达,调节oxLDL 的摄取和oxLDL 诱导的内皮硬化,Cav-1 基因缺失可以消除oxLDL 诱导的内皮硬化[14]。内皮型一氧化氮合酶(eNOS)是血管壁一氧化氮(NO)的主要来源,eNOS 在血管内皮中表达,NO不仅是最重要的内皮源性血管舒张因子,参与调节基线血管张力和功能性充血,而且在神经功能的维持中发挥重要作用[15]。缺氧应激导致eNOS 活性受损和NO 生物利用度降低,使eNOS 和BH4 解耦联,无法催化L-精氨酸产生NO,而与氧(O2)相互作用产生超氧化物,从而影响血管内皮结构与功能稳态。在内皮细胞中,Cav-1 磷酸化负调控eNOS 的活性,在缺血缺氧诱导CAV1 与eNOS 竞争性结合增加,特异地导致eNOS 在丝氨酸1177 位点磷酸化的减少,并导致NO生成的减少,从而出现脑灌注不足,内皮细胞功能障碍和CBF 失调,加重缺血缺氧损伤,进一步损害血脑屏障[16-18]。
2 调节紧密连接
紧密连接蛋白主要由跨膜蛋白、胞质附着蛋白、细胞骨架蛋白三类组成,Esther Sasson 等人研究血脑屏障紧密连接纳米结构发现,在小鼠发育过程中,渗透性TJs 首先对大分子具有限制性,然后才对小分子具有限制性,在这一成熟过程中,claudin-5 蛋白排列紧密,同时,claudin-5 和ZO1 蛋白是以离散簇的中断线组织,形成珠状结构,防止有害物质通过[19]。缺氧会引起内皮细胞紧密连接的破坏触发血脑屏障(BBB)损伤并诱导血管源性水肿。Yan Xue 等人研究表明,缺氧通过激活NRF1 诱导Cav-1 表达上调,下调了紧密连接蛋白,阻断cav -1 介导的细胞内转运可改善缺氧内皮细胞内TJs 的完整性,有效抑制血脑屏障通透性和脑水含量的增加[20]。
基 质 金 属 蛋 白 酶(matrix metalloproteinase,MMPs)是一组锌离子依赖性蛋白酶,主要的功能为降解细胞外基质(extracellular matrix,ECM),可影响紧密连接(TJ)的重塑和降解。在BBB 完整性中的起着重要作用[21]。MMP-9 主要在内皮细胞表达。MMP-2的表达细胞主要有小神经胶质细胞、脂肪细胞、星形胶质细胞、血管内皮细胞。急性脑损伤时,MMP-9 和MMP-2 的高表达加重了血脑屏障的破坏、脑水肿[22]。脑缺血再灌注过程中,Caveolin-1 可以通过抑制RNS的产生和MMPs 的活性,阻止TJ 蛋白的降解,保护BBB 的完整性[23-24]。在体外培养的脑微血管内皮细胞(BMECs)敲除Cav-1 和体内敲除Cav-1 小鼠(KO)中,Cav-1 敲除显著增加了BMECs 中MMPs 的活性,介导了血脑屏障的损伤[25]。NMDA 是一种谷氨酸类似物,可以激活n-甲基-d-天冬氨酸受体(NMDAR),NMDA 暴露抑制了TJ 蛋白 occludin 和 claudin-5 的表达,诱导ZO-1,Cav-1 和ERK1/2 磷酸化的下调,用ERK1/2 抑制剂可防止 NMDA 诱导的紧密连接 ZO-1功能障碍以及脑中的 Cav-1 的表达。靶向Caveolin-1相关的ERK1/2 信号可能是治疗由紧密连接蛋白表达减少引起的血脑屏障功能障碍的方法[26]。研究表明,激活ERK1/2 信号通路有利于降低缺血大鼠脑组织中MMP-9 的活性,减少神经细胞死亡[27]。
3 调节P-糖蛋白(P-gp)转运体
P-糖蛋白(P-gp)是ATP 结合盒转运体家族中重要的外排转运体,能转运内源性代谢产物或外源性异物诱导作用,对维持细胞内环境稳态有重要作用。越来越多的证据表明,ABC 运输蛋白p -糖蛋白(Pgp)是血脑屏障的主要成分,脑源性代谢物通过血脑屏障的脑-血运输障碍是各种中枢神经系统退行性疾病的主要发病机制[28]。一项随机对照实验表明,与对照组相比,轻度AD 受试者的顶颞叶、额叶、后扣带皮层和海马区血脑屏障p -糖蛋白活性显著降低[29]。同时如在肿瘤患者的治疗过程中,P-糖蛋白(P-gp)的存在,使治疗药物排出细胞外,使药物达不到有效生物利用度及多药耐药的存在。从外排转运系统出发探讨Cave-1 调控P-糖蛋白(P-gp)介导血脑屏障通透性改变,调节内环境的稳定。
研究发现,P-gp 除主要表达于脑肿瘤毛细血管内皮细胞的腔膜面外,也部分表达于胶质细胞的足突,共同发挥药物外排功能。荧光双染证实P-gp 与Caveolin-1 在细胞膜上存在共表达现象,内皮细胞的腔膜面以及部分腔膜面与基底面的交界处存在 P-gp和Cav1 的共表达区域,说明 Cav1 可能参与了对 P-gp在细胞膜上的物质转运作用的功能调节[30]。cave-1是Src 等非受体酪氨酸激酶的底物,Src 激酶在小穴介导的内吞作用启动早期被激活。cave-1 的酪氨酸磷酸化发生在酪氨酸-14 处,可诱导小泡囊泡和/或融合[31-32]。Cav1 是一种调节P-gp 功能的支架蛋白,Src 激酶的激活导致Cav1 的Tyr14 快速磷酸化,诱导P-gp 的内化,从而降低血脑屏障的皮质醇外泄功能[33]。Yanling Fan 等人研究发现,Rack1 作为信号枢纽,可以介导Src 与P-gp 结合,从而促进Src 磷酸化Cav1,消除Cav1 对P-gp 的抑制作用[34]。
血管内皮生长因子(VEGF)是一种多效细胞因子,能促进细胞生长、存活和血管生成,VEGF 在大脑和/或大脑微血管系统中的过表达与中枢神经系统病理相关,包括阿尔茨海默病、脑瘤、缺血和脑损伤。Hawkins Brian T and Sykes Destiny B 等人研究发现,使用tyr14 磷酸化特异性抗体,发现将脑毛细血管暴露于VEGF 或Src 激活肽YEEIP 增加了脑毛细血管中酪氨酸-14 小泡蛋白-1 的磷酸化,增加了小洞穴蛋白-1 与p -糖蛋白的关联,并对培养的脑内皮细胞中p -糖蛋白的转运活性起到负调控作用,脑室内注射VEGF 增加了p -糖蛋白底物吗啡和维拉帕米的脑分布[35]。综上所述,P-糖蛋白是血脑屏障重要的外排转运体,cave-1 通过不同信号通路调节p -糖蛋白的转运活性,调节血脑屏障通透性。
4 调节胞吞转运作用
胞吞作用又称内吞作用或入胞作用,它是质膜内陷,包裹细胞外物质,形成胞吞泡,然后脱离细胞膜将其裹进并输入细胞内的过程。根据胞吞物质大小可分为吞噬作用和胞饮作用两种类型。细胞对固体颗粒的摄入过程称为吞噬作用,对液体及溶解在液体中的溶质的摄入过程称为胞饮作用[36]。胞吞转运途径是必需大分子物质(如多肽激素、金属载体、脂蛋白等)入脑的主要途径,在胚胎发育和成年生理状态下,低水平的胞吞转运抑制血脑屏障通透性,而在多种病理条件下其水平升高则对血脑屏障的破坏具有重要的促进作用[37]。
Hamid Salimi 等人研究表明委内瑞拉和西方马脑炎病毒病毒通过小洞穴蛋白-1(Cav-1)介导的胞吞作用(Cav-MT)通过完整的血脑屏障向中枢神经系统进行血行播散[38]。蜘蛛毒液(PNV)诱导血脑屏障(BBB)的破坏,PNV 富含影响谷氨酸处理和干扰离子通道生理的神经毒性肽。小泡蛋白-1 是控制小泡形成的中心蛋白。研究表明pnv 诱导的血脑屏障打开与形成小泡框架的小泡蛋白-1α 的高表达有关,与内化和增强的胞吞过程有关[39]。聚焦超声(FUS)联合一定剂量的微泡治疗可通过上调小泡蛋白-1 的表达水平,进而上调小泡的数量,通过小泡介导的跨细胞途径增强血脑屏障的通透性[40]。
5 调节白细胞粘附作用
白细胞粘附分子可以抑制血液免疫细胞的粘附和转运入脑,趋化因子和趋化因子受体在免疫细胞的募集和激活上起着重要的调控作用,脑缺血后调控外周免疫细胞浸润入脑,例如单核/巨噬细胞。CC 趋化因子受体2(CCR2)是趋化因子受体中的重要一员,与其配体CC 趋化因子配体2(CCL2)在神经炎症中发挥着重要的作用[41]。在脑实质中产生的趋化因子CCL2 如何招募位于血脑屏障(BBB)高度不透水的内皮后的白细胞,一直是一个悖论。Shujun Ge 等人研究表明CCL2 在炎症发作时沉积在脑微血管壁侧,可以通过血脑屏障传递促进白细胞的募集,Caveolin-1参与了ccl2 的这种运输,小泡蛋白-1 的siRNA 敲除,导致CCL2 转运显著增加,增加血脑屏障通透性[42]。
各种药物调节Caveolin-1 介导血脑屏障通透性改变
Caveolin-1 作为调节血脑屏障通透性改变的重要靶点,许多学者通过研究药物干预Caveolin-1 的表达影响血脑屏障通透性改变。研究表明,抑制Cav-1活化后可减轻N- 甲基-D 天冬氨酸(NMDA)诱导HBEC-5i 中紧密连接蛋白ZO-1 的破坏,从而减轻紧密连接屏障的通透性[43]。雌二醇能增加局灶性脑缺血(MCAO)大鼠Caveolin-1、VEGF 的表达,改善模型大鼠的神经功能缺失症状[44]。三七有效成分三七皂苷通过下调MMP2、9,上调半暗带zo1 和claudin5的表达和重新分配环抱素和caveolin,降低了BBB 渗漏和脑梗死体积,减弱了卒中后大鼠神经功能缺损[45]。氧化苦参碱能够通过下调CAV1 和MMP9 表达改善脑缺血再灌注损伤后血脑屏障完整性[46]。养血清脑丸治疗的高血压大鼠,TJ 蛋白表达降低,而小窝的主要蛋白 Caveolin-1 的表达增加,能保持内皮完整,减轻能量代谢紊乱抑制大鼠海马和皮层的血管周围水肿[47]。苦碟子注射液能抑制脑内皮细胞中的Caveolin-1 和 Src 活性,改善血流量,减少梗塞体积和神经功能缺陷,保护血脑屏障通透性[48]。Caveolin-1磷酸化氧化应激导致血管通透性加重,去偶联的槲皮素可以通过抑制Caveolin-1 磷酸化而保护内皮细胞,起到预防氧化应激状态下血管通透性改变的作用[49]。人参皂苷是人参根中主要的具有生物活性化合物,张高娇等研究表明沉默Cav-1 后人参皂苷Rb1 可以改善MCAO 小鼠的神经行为学评分,减少MCAO 小鼠脑梗死体积与脑含水量,增加Bcl-2/Bax 的比率,具有脑保护作用[50]。
总 结
血脑屏障结构和功能完整是治疗脑缺血缺氧的重要突破口,经过以上研究表明,Cave-1 可通过作用于血管内皮细胞功能、紧密连接蛋白,联合控制物质外排的P 糖蛋白、胞吞转运、白细胞黏附等多个方面一起调控血脑屏障通透性。其中Cave-1 与VEGF 关系密切,病理性升高的 VEGF 可通过通过下游 PI3K/AKT 通路增强血管通透性和渗漏,并破坏血脑屏障的完整性,促进血脑屏障泄露,其中蛋白激酶 B(AKT)可特异性磷酸化内皮一氧化氮氧合酶(endothial nitric oxide synapse,eNOS),而在静息状态下,eNOS 钙结合域在内皮细胞中特异性与小窝蛋白 Caveolin-1 结合而失活,当缺血缺氧发生时,eNOS Ser1177 位点磷酸化从 Caveolin-1 解离并催化 L-精氨酸产生一氧化氮(NO)介导血管内皮响应血流量调节。同时,VEGFR-2 是 VEGF 在 CEC 效应的主要受体介质,VEGF 结合 VEGFR-2 同时可激活细胞内酪氨酸激酶Src,Src 是 Caveolin-1 活化的关键激酶,既Src 介导的Caveolin-1 Tyr14 磷酸化会增加其对 eNOS 的竞争性结合,减少后者 Ser1177 磷酸化并提高 Thr495 磷酸化,抑制 eNOS 对脑血流变化的内皮响应,减少 NO 的生成,从而出现脑灌注不足、CEC 功能障碍和 CBF 失调、转运功能障碍的恶性循环,在后期的实验研究中可以进一步探讨。
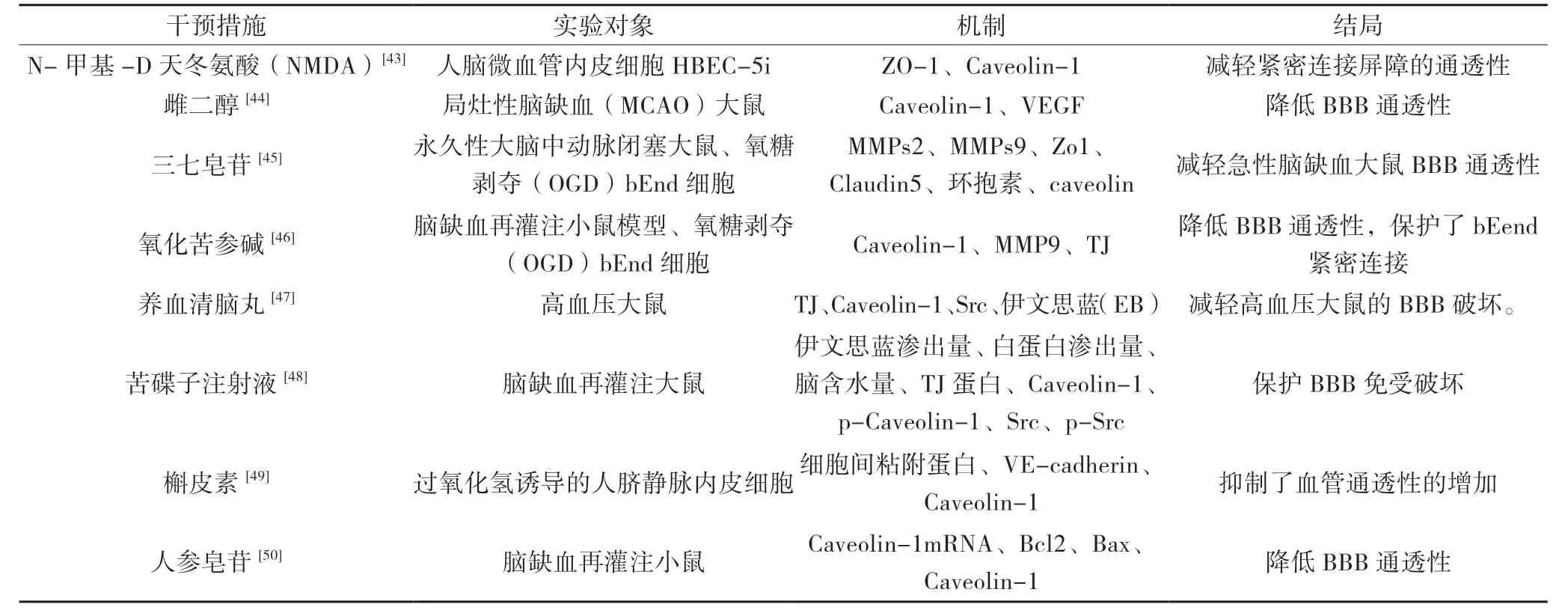
表1 各种药物调节Caveolin-1 保护血脑屏障通透性
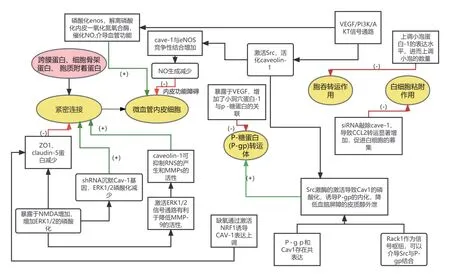
图3 Cave-1 调控血脑屏障通透性主要机制示意图
