浮游植物种群对海洋酸化和光照强度变化的响应:以长江口南毗邻海域为例
2023-11-15李童童冯媛媛王建才王雅婻宋书群白有成
李童童,冯媛媛,王建才,蔡 婷,王雅婻,宋书群,白有成
(1. 天津科技大学 海洋与环境学院,天津 300457;2. 上海交通大学 海洋学院,上海 200030;3. 上海市极地前沿科学研究基地,上海 200030;4. 中国科学院 海洋研究所,山东 青岛 266071;5. 自然资源部 第二海洋研究所,浙江 杭州 310012)
海洋是重要的无机碳储库,随着CO2含量逐渐升高,海水碳酸盐体系受到影响,海水的pH随之降低,导致海洋酸化(Zeebe, 2012)。海洋浮游植物作为海洋中最主要的初级生产者,通过光合作用将CO2转化为有机碳,并通过食物网传输及碳沉降等过程使部分有机碳被转移并埋藏至深海中(Ducklow et al, 2001)。由于当今海水中游离的CO2浓度低于大部分浮游植物光合作用所需的饱和CO2浓度,大部分浮游植物种群进化产生了碳浓缩机制(Carbon Concentration Mechanism, CCM)(Badger et al, 1992),可以同时使用海水中的CO2和HCO3−作为进行光合作用的无机碳源,升高核酮糖-1, 5-二磷酸羧化酶/加氧酶(Rubisco)附近的CO2浓度,以维持细胞较高的光合作用效率(Falkowski et al, 2013)。由于不同浮游植物种群的CCM效率不同,且受海水CO2浓度的影响(Wu et al, 2010),CO2浓度升高对某些浮游植物物种光合作用的促进效率可能会高于其他物种,对较大粒径的浮游植物影响尤其明显(Wu et al, 2014),从而导致海洋浮游植物的群落结构发生变化(Moroney et al,1999)。
光照强度也是影响浮游植物光合作用的重要环境因素(Singh et al, 2015)。浮游植物需要足够的光照强度来进行高效的光合作用,光照强度对浮游植物的色素复合体合成以及光合固碳作用具有显著影响(Hihara et al, 1998)。过高光照强度通常会限制光合色素的生产从而降低浮游植物光合作用的效率(陶宗娅等, 1999),较低光照强度可刺激浮游植物叶绿素的生产,但同时导致光合作用速率降低(Beardall et al, 1976);不同浮游植物种群的光合作用最适宜光照强度有所不同(Thompson, 2010),因此光照强度升高会促进某些未到达光饱和点的浮游植物种群的光合作用,但可能抑制一些光饱和点比较低的浮游植物种群的光合固碳,影响种间竞争和演替(Anderson et al, 1997)。光照强度变化也会影响浮游植物细胞合成脂质,细胞在较高光照强度下更易累积饱和脂肪酸,在低光下则更多累积不饱和脂肪酸(Khotimchenko et al, 2005)。
光照强度往往与气候变化背景下快速变化的其他环境因素同时作用于该海域的初级生产者并产生交互效应,影响生物固碳及相关元素的生物地球化学循环过程(Finkel et al, 2006)。研究表明,南大洋2株硅藻短拟脆杆藻(Fragilariopsis curta)和魏氏齿盘藻(Odontella weisflogii)对CO2分压(pCO2)的变化很敏感,较高的光照强度可促进这2株硅藻在低pCO2下颗粒有机碳的生产(Heiden et al,2016)。在浮游植物群落的层面,海洋酸化与光照强度变化协同降低了南海的浮游植物固碳作用(Gao et al, 2012),并可改变浮游植物种群组成(Domingues et al, 2014)。
东海是我国的边缘海,特别是长江口南毗邻海域的生产力较高,在海洋碳循环过程中有重要的作用(Tseng et al, 2011)。受长江冲淡水的影响,长江口海域理化环境比较复杂,长江径流带来的大量悬浮泥沙及海流扰动产生的再悬浮泥沙导致该海域表层形成透明度3 m及以下的浑浊带(Fang et al, 2006)。长江口毗邻海域沿盐度梯度可分为近河口光限制区、过渡带光和磷酸盐限制区、远河口的氮盐限制区(Filardo et al, 1985)。其中光限制区虽然具有较高含量的营养盐水平,但浑浊带的消光作用导致该区域的初级生产力潜在受到光限制(何文珊等, 2001)。我们以长江口南毗邻海域浮游植物群落为研究对象,设置不同pCO2和光照强度条件,对长江口海域浮游植物群落进行现场模拟培养实验,研究海洋酸化与光照强度变化对浮游植物群落组成及相关生物地球化学参数的交互效应,以期分析和预测该海域浮游植物群落对海洋酸化和光照环境变化的响应趋势。
1 材料和方法
1.1 采样和培养实验设置
2020年春季在“向阳红18”科学考察船上现场采样并进行了为期5 d的现场船基受控培养实验(Hutchins et al, 2003)。2020-05-20于站位S01-1(122°42′00″E,29°59′54″N)采集表层海水水样,采样站位水深35 m,表层海水水温:20.64 ℃,盐度:29.73;营养盐浓度:1.15 μmol·L−1、7.84 μmol·L−1、0.42 μmol·L−1、-Si 20.33 μmol·L−1(图1)。
图1 采样站位()示意图Fig. 1 Schamatic diagram of sampling station ()
将采集的海水水样经孔径200 μm的筛绢过滤,分装至12个4.5 L酸洗后的洁净透明聚碳酸酯培养瓶中,并进行营养盐加富(添加浓度为μmol·L−1、1 μmol·L−1、μmol·L−1)。通过CO2加富器(CE-100型,中国武汉瑞华有限公司生产)调节CO2和空气混合比例,并使用鼓泡曝气的方法(Mcgraw et al, 2010)控制培养瓶中的pCO2分别为模拟现代空气中的41 Pa和预测世纪末的101 Pa(Caldeira et al, 2005)。我们通过测定,采样站位表层海水的光照强度为海表光照强度的30%~50%。参照Feng等的工作(Feng et al, 2010),为了分别模拟表层海水及由于混合层变浅导致的混合层内光照强度升高,通过在培养槽上覆盖中型密度网控制培养瓶内光照强度为50%和75%海表光照强度,共设置4个实验处理:①对照组(41 Pa,50%海表光照强度);②酸化组(101 Pa,50%海表光照强度);③高光组(41 Pa,75% 海表光照强度);④交互组(101 Pa,75% 海表光照强度)。每组3个平行样,培养水槽中的水浴温度使用冷暖水机(HC-1000BH型,中国海利有限公司生产)控制为(20 ± 1) ℃。培养期间每天午间采用光照数据采集器(LI-1500型,美国LICOR有限公司生产)监测培养槽内光照强度(图2)。每天上午08:00−10:00对各培养瓶总叶绿素(Chla)质量浓度测定,隔天采样测定粒径分级Chla质量浓度(粒径范围分别为0.2~ <2.0 μm,2.0~ <20.0 μm,≥20.0 μm),在最终取样日(第5天)收集用于测定颗粒有机磷(POP)、颗粒有机碳(POC)、颗粒有机氮(PON)、生物硅(BSi)浓度的样品、微微型浮游植物样品、16S/18S rRNA扩增子测序样品以及浮游植物群落显微镜检查样品。
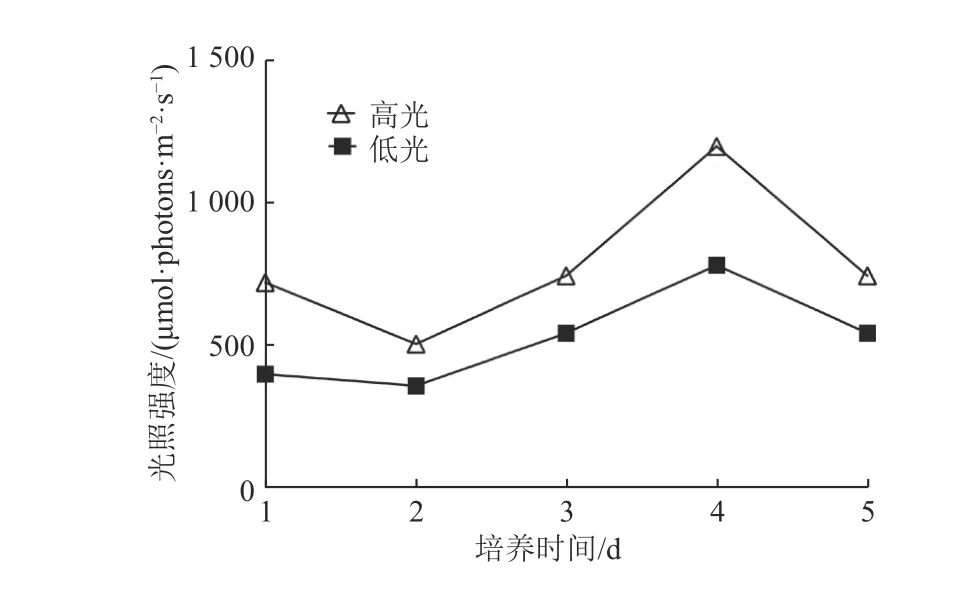
图2 培养过程中光照强度Fig. 2 Light intensity during the course of incubation
1.2 海水碳酸盐化学测定
每天上午08:00−10:00测定船基受控培养样品的pH(Mcgraw et al, 2010)和总碱度(Dickson et al,2007)。采用pH计(SevenCompactTM S210K型,瑞士Mettler Toledo有限公司生产)测定培养体系pH(Mcgraw et al, 2010)。海水总碱度采用总碱度自动滴定仪(G20S型,瑞士Mettler Toledo有限公司生产)测定(Dickson et al, 2007)。海水碳酸盐化学各参数根据样品的pH和总碱度使用CO2SYS软件(Lewis et al, 1998)计算获取(Dickson et al, 1987)。
1.3 浮游植物种群组成分析
使用体积分数40%的甲醛溶液(购自国药平台)对采集后的浮游植物群落样品进行固定,用量为水样体积的4%。固定后常温保存带回实验室。2020-06-02在天津科技大学海洋与环境学院实验室采用Utermöhl计数法检测(Utermöhl, 1958)。将样品沉降24 h后放置在倒置显微镜(AE2000型,厦门麦克奥迪有限公司生产)下进行定种和细胞计数。
1.4 16s/18s rRNA高通量测序
测序样品过滤到孔径0.6 μm聚碳酸酯滤膜(购自美国Millipore有限公司),保存于液氮罐(−180℃)带回实验室后保存在超低温(−180 ℃)冰箱中。2021-03-24委托天津诺禾致源生物信息科技有限公司采用CTAB/SDS(十六烷基三甲基溴化铵/十二烷基磺酸钠)方法提取样品基因组的DNA。利用PCR仪(T100型,美国Bio-rad有限公司生产)扩增出不同区域的16S/18S rDNA基因,产物经检测后使用GeneJET试剂盒(购自美国Thermo Scientific有限公司)进行纯化,再使用TruSeq®DNA PCR-Free Sample Preparation Kit试剂盒(购自美国Illumina有限公司)构建文库,经Qubit(美国Thermo Scientific有限公司生产)定量和文库检测合格后使用NovaSeq6000进行上机测序。对原数据进行拼接、过滤后得到有效数据(Mago et al, 2011),利用Uparse算法(UPARSE v7.0.1001)(Haas et al, 2011)对所有样品的有效数据进行聚类,以97%的一致性将序列聚类成基因序列分类单元(Operational Taxonomic Units,OTUs),得到对应的物种信息和基于物种的丰度分布情况(Edgar, 2013)。
1.5 微微型浮游植物种群组成分析
将含有浮游植物样品的海水经孔径20 μm筛绢后取1.8 mL,使用200 μL多聚甲醛溶液(体积分数为4%,购自国药平台)进行固定后保存在液氮罐(−180 ℃)中,2021-09-23在中国科学院海洋研究所实验室使用流式细胞仪(Accuri C6型,美国Dickinson and Company有限公司生产)进行测定(Jiang et al, 2017)。通过流式细胞仪发出的488 nm激光照射浮游植物样品后反馈的不同信号来划分不同类群:微微型真核藻类的FSC-H信号小于作为内标的2 μm绿色荧光微球,但是FSC-H和FL3-H信号大于原核自养生物;聚球藻含有藻红蛋白,所以FL2-H信号明显高于其他类群;原绿球藻细胞最小,叶绿素含量比异养细菌的高,可根据FSC-H和FL3-H信号强度进行区分(Jiang et al, 2017)。
1.6 浮游植物群落Chl a质量浓度测定
样品采用微压(<0.04 MPa)过滤样品至孔径0.2 μm GF/F膜(购自美国Whatman有限公司生产)上用于测定样品的总Chla质量浓度,粒径分级Chla的样品依次通过孔径为20 μm、2 μm的聚碳酸酯滤膜(购自美国Millipore有限公司)和GF/F膜过滤采样,于−20 ℃保存。2020-06-02在天津科技大学海洋与环境学院实验室进行分析,采用体积分数为90%的丙酮溶液萃取后,用Turner荧光仪(美国Turner Designs有限公司生产)酸化模块(Welschmeyer, 1994)测定细胞Chla质量浓度。
1.7 浮游植物群落元素组成测定
POC和PON样品过滤至灼烧(450 ℃,4 h)过的GF/F膜上常温保存,2021-03-30在自然资源部第二海洋研究所烘干后采用元素分析仪(ECS4010型,意大利Costech有限公司生产)测定(Hutchins et al, 1998)。POP样品经灼烧过的GF/F膜过滤后转入20 mL同样灼烧过的玻璃瓶中,加入2 mL浓度为0.017 mol·L−1的MgSO4溶液,于60 ℃烘干后常温保存。样品于2020-06-14在天津科技大学海洋与环境学院实验室使用紫外可见分光光度计(UV-2550型,日本岛津有限公司生产)采用磷钼蓝显色法测定(Solórzano et al, 1980)。BSi样品用0.6 μm孔径聚碳酸酯滤膜(购自美国Millipore有限公司)过滤后装入10 mL离心管中常温保存,于测定POP样品的第2天放入60 ℃的烘箱内烘干后用1 mol·L−1的HCl溶液消解后采用硅钼蓝显色法测定样品中BSi的含量(Brzezinski et al, 1995)。
1.8 浮游植物群落沉降速率测定
船基培养实验的第0天和第5天在船上采用同源性采样法(SETCOL)测定浮游植物群落的沉降速率(Bienfang, 1981)。根据Bienfang的沉降公式(Bienfang, 1981)计算浮游植物群落藻细胞的沉降速率。
1.9 数据分析
单一环境因素酸化(A)、高光(L)及2个环境因素共同变化(A+L)下对某生理生化参数的观测影响(observed effect, OE)依照该处理组与对照组的变化百分比计算而得(正值为正向升高效应,负值为负向降低效应),二者的交互效应(multiplicative effect, ME)采用Folt等方法(Feng et al, 2020)计算。当OEA和OEL均为正或均为负时,在|OEA+L| > |MEA+L|条件下,2种环境因素为协同性交互效应,在|OEA+L| < |MEA+L|条件下,2种环境因素为拮抗性交互效应;当OEA和OEL为一正一负时,2种环境因素为拮抗性交互效应。采用双因素方差分析(ANOVA)检验变量之间的交互作用(α=0.05水平),组间显著性差异采用t-test分析。
2 结 果
2.1 碳酸盐化学参数
在培养期间,不同pCO2处理组之间的pH存在显著差异。最终采样时各处理组海水碳酸盐化学各参数见表1。

表1 培养第5天时培养瓶中碳酸盐化学参数Table 1 Chemical parameters of carbonate in the four experimental treatment groups on the fifth day incubation
2.2 Chl a质量浓度
对照组和交互组的总Chla质量浓度均在培养第2天达到最大值(7.84 ± 1.00) μg·L−1,酸化组在第3天达到(9.21 ± 2.87) μg·L−1,高光组最大值(9.48 ± 1.47) μg·L−1出现在第4天(图3a)。与其他处理组相比,高光组中的总Chla质量浓度在第4天和第5天均为各组中最高。
最终采样日(第5天)粒径分级Chla质量浓度结果表明,在浮游植物种群中粒径范围2.0~ <20.0 μm的微型浮游植物占比最高,对照组为(61 ± 6)%、酸化组为(60 ± 2)%、高光组为(52 ±3)%、交互组为(64 ± 6)%,均超过50%。酸化主要使粒径≥20.0 μm的小型浮游植物Chla质量浓度占比升高,随光照强度升高小型和微微型(0.2~ <2.0 μm)浮游植物Chla质量浓度占比升高。小型浮游植物Chla质量浓度在对照组最低为(30 ± 9)%,酸化组(34 ± 2)%较对照组上升了4%,而高光组(37 ±6)%上升了7%,交互组(31 ± 5)%上升了1%;微微型浮游植物Chla质量浓度占比最低,与对照组的(10 ± 3)%相比,高光组的(11 ± 4)%升高2%,酸化组的(7 ± 1)%和交互组的(5 ± 1)%分别降低3%和4%(图3b)。
2.3 浮游植物种群组成
酸化显著提升了微微型浮游植物的细胞丰度,对聚球藻(Synechococcus)的影响尤其明显。流式细胞仪的检测结果表明酸化组和交互组分别是对照组[(426 ± 177)个·L−1]的32.72倍和31.58倍(p<0.05,表2),而高光组[(864 ± 46)个·L−1]较对照组升高10.28%(p<0.05);真核微微型浮游植物只在交互组显著高于对照组(p<0.05)。在各处理中未有原绿球藻(Prochlorococcus)信号检出。
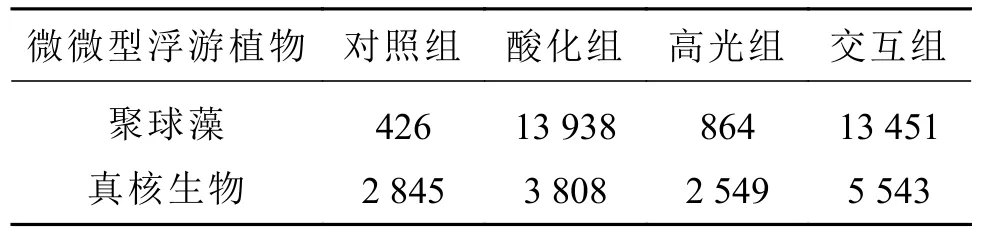
表2 基于流式细胞仪检测的培养第5天4个处理组的微微型浮游植物细胞丰度(个·L−1)Table 2 Abundances of microtype phytoplankton cells based on flowcytometry on the fifth day incubation (cells·L−1)
显微镜检结果表明硅藻中海链藻(Thalassiosiraspp.)、甲藻中卡尔藻(Karlodiniumsp.)、原甲藻(Prorocentrumsp.)在各组均为优势种,海链藻在对照组、酸化组、高光组和交互组中的占比分别为42%、59%、66%和56%。对照组中海链藻丰度为5.60×105个·L−1,酸化组、高光组和交互组分别比对照组降低48%、34%和30%;卡尔藻在对照组中丰度为2.66×105个·L−1,酸化组和交互组分别比对照组升高5%和11%,高光组比对照组降低53%;原甲藻在酸化组、高光组和交互组中的丰度分别比对照组2.95×104个·L−1降低76%、91%和94%(图4)。筛链藻(Coscinosira polychorda)、柔弱拟菱形藻(Pseudo-nitzschia delicatissima)和冠盖藻(Stephanopyxisspp.)分别在酸化组、高光组和交互组中占据一定优势。由于有效样品数量不足,最终数据间没有体现出显著性差异。
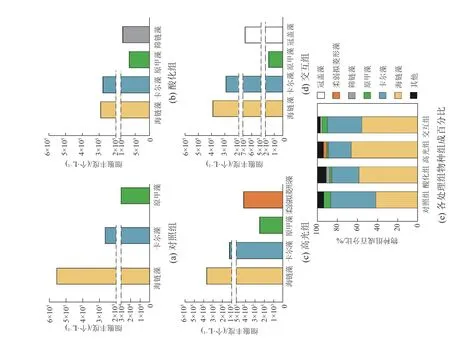
图4 培养第 5 天显微镜检的 4 个处理组浮游植物优势物种丰度和各处理组的物种组成百分比Fig. 4 Microscopic dominant phytoplankton species composition in the batch culture and the percentage of the phytoplankton species composition in the fourexperimental treatment groups on the fifth day incubation
高通量测序结果与显微镜检结果相似,酸化组、高光组和交互组中硅藻的基因拷贝数均高于对照组,在高光组尤为显著,较对照组提升了231%(图5a);金藻的基因拷贝数在酸化组最高,较对照组提升了3464%,而高光组和交互组比对照组分别提升了237%和1128%(图5b);蓝藻的基因拷贝数最高值也出现在交互组,酸化组、高光组和交互组分别比对照组增长156%、78%和359%(图5c);与对照组相比,甲藻的基因拷贝数在其他3个处理组均有降低,在酸化组降低程度最高(68%,图5d);浮游植物群落中隐藻的基因拷贝数的变化和硅藻相似,在高光组的基因拷贝数最高(图5e),由于隐藻基因拷贝数在对照组、酸化组、高光组和交互组中组成百分比均仅为0.2%及以下,故不体现在各种群组成百分比中(图5f)。
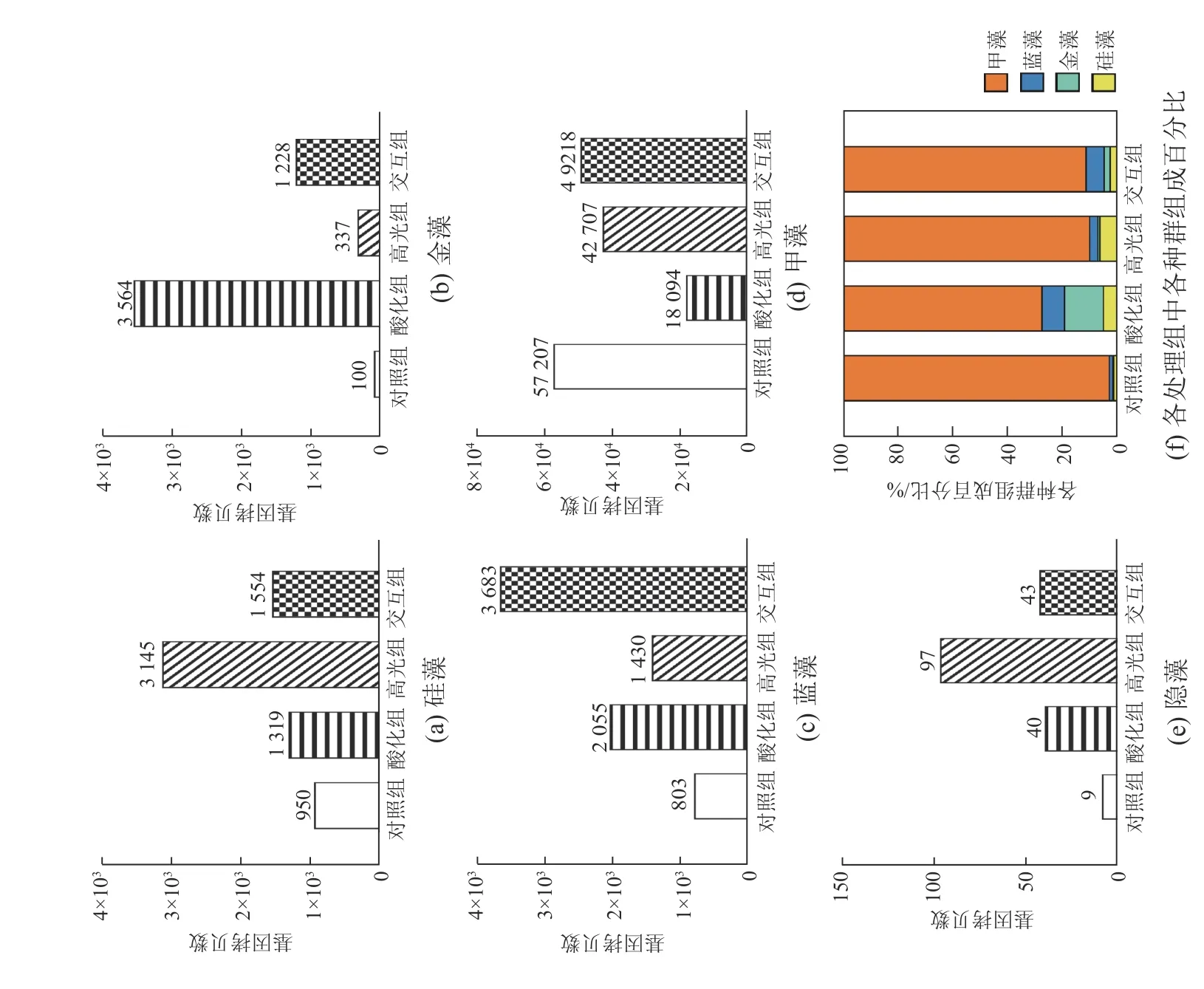
图5 培养第 5 天高通量测序的 4 个处理组基因拷贝数和各种群组成百分比Fig. 5 Gene copies and the percentage of different populations in the four experimental treatment groups on the fifth day incubation based on high-throughput sequencing
对照组中共发现浮游植物5门85种。与显微镜检结果相似,硅藻中海链藻属(Thalassiosira)基因拷贝数最高,甲藻中卡尔藻属(Karlodinium)、金藻中近囊胞藻属(Paraphysomonas)、蓝藻中聚球藻属(Synechococcus)基因拷贝数较高。酸化组记录5门103种,其中硅藻中海链藻属基因拷贝数最高,甲藻中别什莱藻属(Biecheleria)和原甲藻属(Prorocentrun)基因拷贝数相近,对照组中的占优的卡尔藻属基因拷贝数比对照组降低95%;金藻近囊胞藻属的基因拷贝数则为对照组的40倍;蓝藻中聚球藻属基因拷贝数较高,比对照组升高151%,聚球藻属的拷贝数变化趋势与流式细胞仪检测结果相吻合(表2)。高光组中记录了5门92种,其中硅藻海链藻属基因拷贝数最高,是对照组的2倍(图4e),这个结果同显微镜检结果相似;甲藻中卡尔藻属比对照组降低52%;金藻近囊胞藻属比对照组升高232%;蓝藻优势属聚球藻属比对照组升高72%。交互组记录5门97种,其中硅藻海链藻属高于对照组45%(图4e),与显微镜检结果相印证;甲藻中别什莱藻属的基因拷贝数为对照组的18倍,其次为华鳍藻属(Sinophysis),其基因拷贝数为对照组的167倍之多;金藻中近囊胞藻属的拷贝数为对照组10倍;与流式细胞仪结果相似(表2),蓝藻中聚球藻属基因拷贝数最高,且在4个处理组中交互组基因拷贝数最高,次高出现在酸化组(图6)。
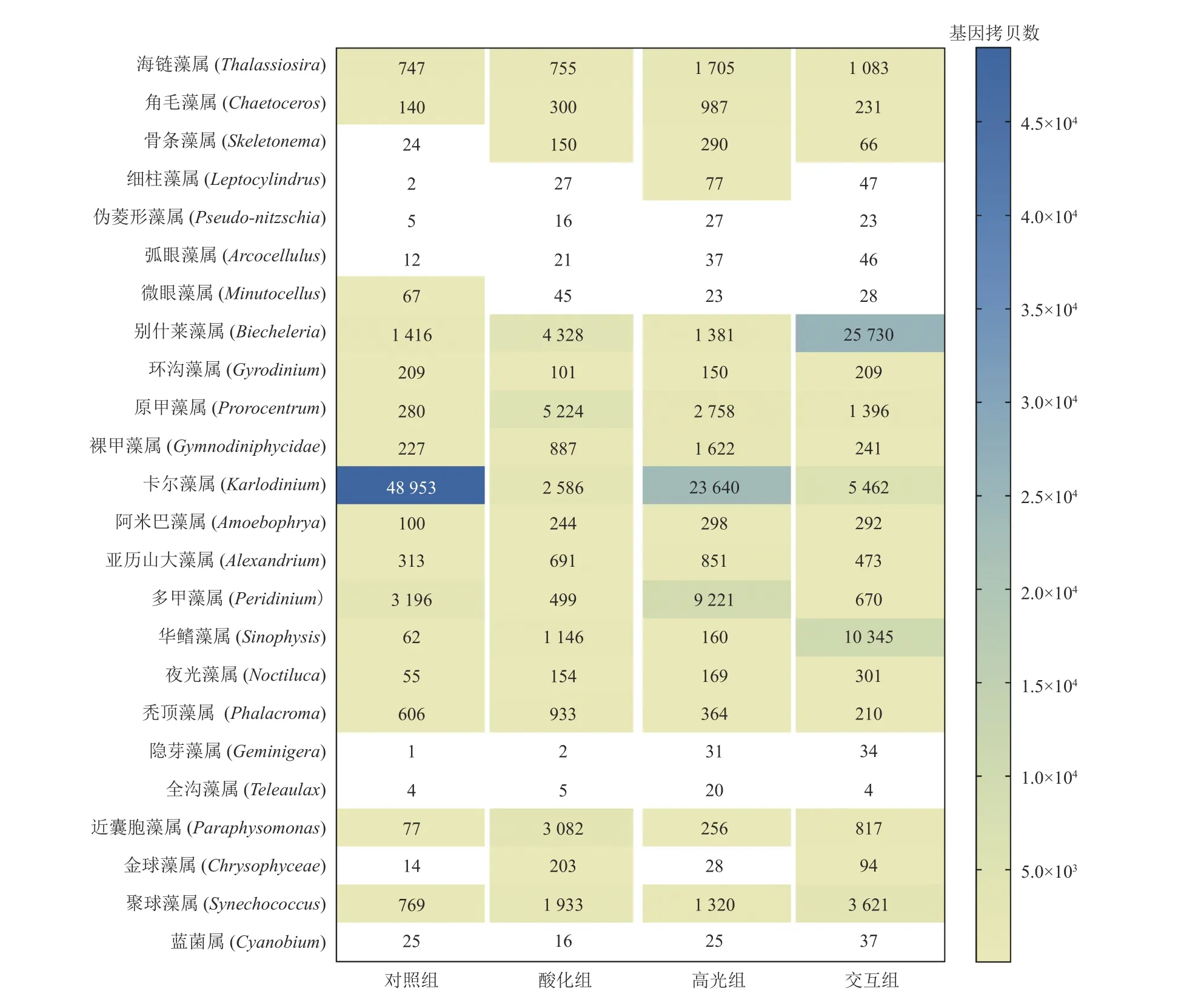
图6 培养第5天4个处理组的浮游植物优势物种组成热图(16s/18s rRNA扩增子测序基因拷贝数)Fig. 6 Heat map of main phytoplankton dominant species composition in the batch culture in the four experimental treatment groups on the fifth day incubation (16S/18S rRNA amplicon sequencing copy numbers)
2.4 元素组成和沉降速率
高光组和交互组的POC、PON及BSi浓度高于对照组的及酸化组的,最高值均出现在交互组。但在各处理组间POC、PON、POP及BSi浓度及元素比由于数据间方差较大,没有显示出统计学显著差异(p>0.05, 表3)。
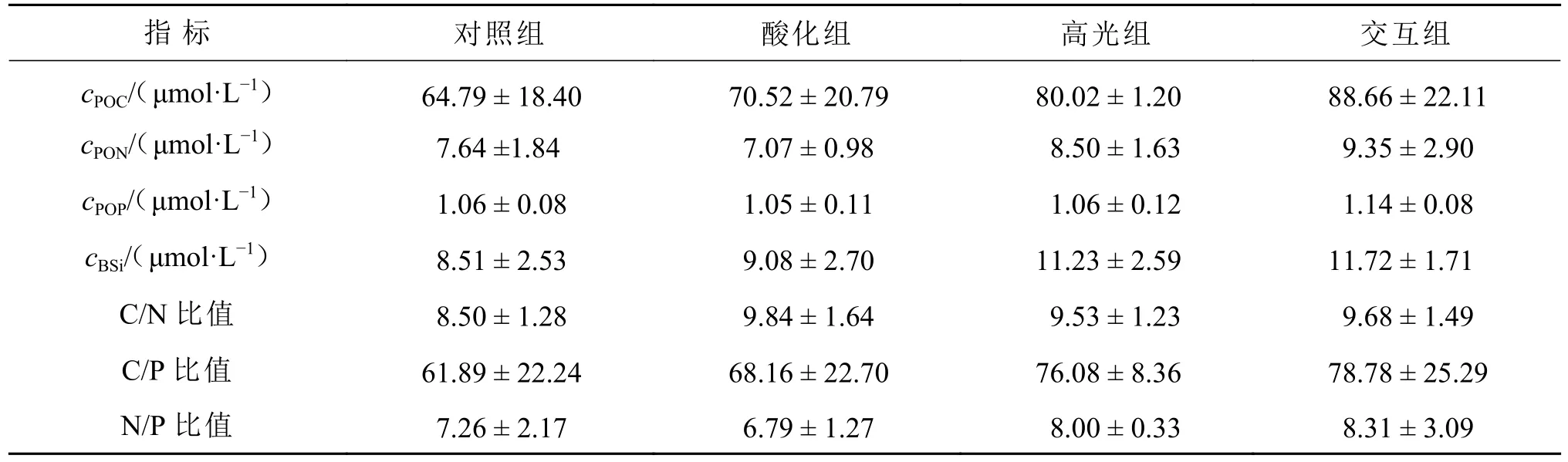
表3 培养第5天4个处理组中各元素浓度与元素摩尔比Table 3 Elemental concentrations and elemental molar ratios in the four experimental treatments groups on the fifth day of the incubation
培养实验表明,酸化条件对浮游植物种群的沉降有显著作用(图7)。培养第5天酸化组的沉降速率为(1.47 ± 0.13) m·d−1,显著高于其他3个处理组(p<0.05),是对照组的3倍;交互组的沉降速率为高光组的2倍。
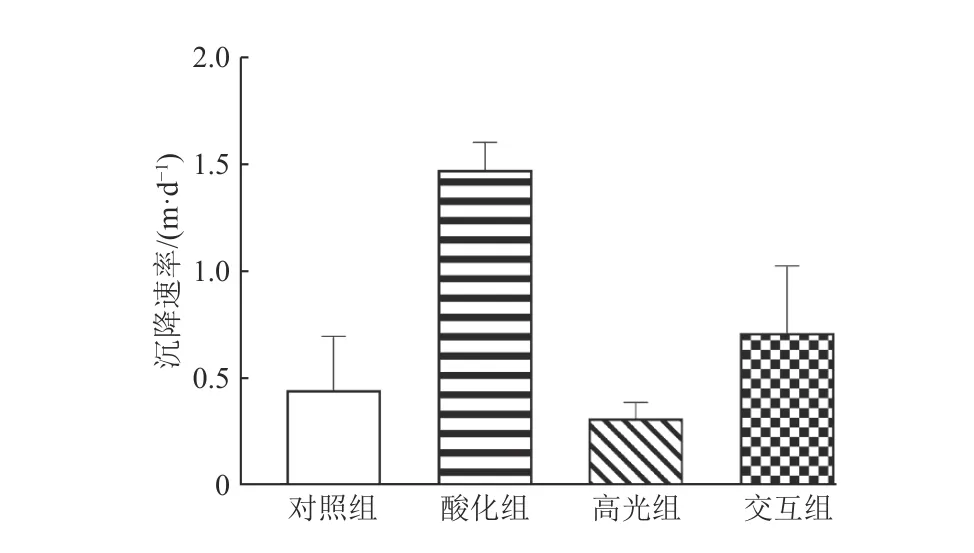
图7 培养第5天4个处理组的浮游植物种群沉降速率(误差棒代表平行样间标准偏差,n=3)Fig. 7 Sinking rates of phytoplankton composition in batch culture of four experimental treatment groups on the fifth day incubation(the error bars represent standard deviations of triplicate samples, n=3)
2.5 双因素交互作用
计算结果表明酸化和高光照强度对POC浓度、POP浓度具有协同性交互效应,而对总Chla质量浓度、小型、微型和微微型浮游植物Chla质量浓度、PON浓度、BSi浓度、C/N比值、N/P比值、C/P比值、C/Si比值、沉降速率、硅藻以及甲藻丰度产生拮抗性交互效应(表4)。
3 讨论
我们的研究结果表明海洋酸化程度与光照强度变化对浮游植物生长及种群组成产生了不同的影响,2种环境要素的变化可产生交互效应。在350~1200 μmol·photons·m−2·s−1光照强度下,光照强度升高促进浮游植物的生长及生物量积累,如中心纲硅藻的丰度在高光条件下显著升高。pCO2为101 Pa的酸化更有利于聚球藻的生长,可显著降低微微型及微型浮游植物的Chla质量浓度组成百分比,可提升小型浮游植物Chla质量浓度占比,浮游植物种群粒径增大导致沉降速率升高。酸化和高光均可降低甲藻的优势度,而在酸化低光条件下更适合金藻和蓝藻的生长。
长江口海域因为受到长江冲淡水、台湾暖流和江浙沿岸流等多个复杂水动力条件的共同作用,形成了特有的海洋理化环境(马永存, 2013),长江径流每年向长江口水域汇入大量泥沙,叠加潮流的影响,在长江的咸淡水交汇区出现长江口浑浊带(周华君, 1994),从而降低海表浮游植物受到的有效辐射光照强度,因此光照强度成为该海域浮游植物的典型限制因素(Domingues et al, 2014)。为了提高光子捕获效率,浮游植物单位细胞的Chla含量通常在高光条件下有所降低(Agustí, 1991)。本调查站位位于长江口以南毗邻海域的浑浊带中,同样受到复杂海洋理化环境影响。在本实验高光条件下浮游植物总Chla质量浓度显著高于低光条件的,这也印证了浮游植物生长的潜在光限制。影响浮游植物吸收光照的最主要因素是色素(梁桥等, 2020),不同浮游植物种群的色素组成不同会导致对太阳光吸收、利用的特性不同,例如硅藻和甲藻虽然仅有类胡萝卜素类的辅助色素组成不同,但它们的吸收特性仍表现出差异(梁桥等, 2020)。这导致不同的光照强度下浮游植物种群组成也有所不同。在本研究中,硅藻的基因拷贝数在高光条件下最高,海链藻、角毛藻(Chaetoceros)和骨条藻(Skeletonema)的基因拷贝数均较对照组显著升高。另外,我们还发现在高光条件下细胞粒径大的浮游植物的占比增加,印证了大粒径(>10 μm)浮游植物的光能利用效率更高的结论(Hashimoto et al, 2002)。
酸化对浮游植物种群组成产生的影响与不同浮游植物种群的碳浓缩机制(CCMs)效率有关。在本研究中,酸化条件下金藻和聚球藻的基因拷贝数显著升高,这是因为这些种群具有较低的CCM效率(Wei et al, 2021),pCO2升高可缓解其光合作用的潜在碳限制进而促进其生长(Low-décarie et al,2014)。而像硅藻这类具有高效CCMs的种群对pCO2上升的响应并不显著(Reinfelder, 2011; Wu et al,2014)。我们的实验结果表明在酸化以及交互的条件下,硅藻基因拷贝数的增长明显低于高光条件。但已有研究表明,pCO2升高更有利于体积较大的硅藻的生长,例如Tortell和Trimborn对柔弱角毛藻(Chaetoceros debilis)和伪菱形藻(Pseudo-nitzschia)在不同pCO2下(16 Pa、40 Pa和101 Pa)的培养实验结果表明体积更大的中心纲硅藻柔弱角毛藻(Chaetoceros debilis)的生长速率受到pCO2增长的刺激更显著(Tortell et al, 2008; Trimborn et al, 2013)。因此,我们观测到酸化组中小型浮游植物生物量占比也显著高于对照组。
浮游植物细胞的沉降速率与浮游植物的碳输出和碳沉降一定程度上存在相关性。本研究的结果表明酸化和高光对浮游植物群落的沉降速率具有相反的影响。与41 Pa相比,pCO2为101 Pa的酸化条件显著升高了浮游植物的沉降速率,这主要是由于酸化引起的种群组成变化导致的。在酸化条件下浮游植物种群粒径增大,根据斯托克斯公式(Stokes' Law)(Stokes, 1850),其沉降速率也会升高。此外,酸化也可导致浮游植物细胞内生化组成发生改变(Bienfang et al, 1982),使其相对于海水的密度升高,另外单个浮游植物细胞的大小、细胞是否成链也会影响其沉降速率(Guo et al, 2016),本研究显微镜检结果表明酸化处理组中海链藻较少成链,这也可能是导致沉降加快的因素。500~1200 μmol·photons·m−2·s−1的高光条件则降低了浮游植物的沉降速率。一些之前的研究也表明浮游植物的沉降速率在较低光照强度下会有所增加(Riebesell, 1989),Bienfang发现亚热带海域的浮游植物细胞在夜晚时的沉降速率是白天光照充足时的2倍(Bienfang, 1985)。Steele和Yentschd发现藻细胞处于活跃分裂状态时的沉降速率比衰老状态时减缓50%(Steele et al, 1960)。而较高的光照强度也提供给浮游植物足够的能量来调整自身的沉降能力(Riebesell, 1989)。在酸化和高光的耦合作用下浮游植物的沉降速率处于升高的状态,但升高的程度较单酸化条件有所缓慢,2个条件对浮游植物的沉降速率表现出拮抗作用。十几年来,长江口区域底层缺氧现象可引发的海洋相关生态灾难引起了越来越多的关注(Zhu et al, 2011)。而除水文动力学条件影响,表层水体浮游植物水华后颗粒物会大量向深层沉降,有机物的降解过程的耗氧为该海域水体缺氧的一个重要产生因素。因此表层水体中浮游植物沉降速率的变化对该海域的碳输出产生影响,也对其缺氧现象的产生有重要意义。我们的研究结果一定程度上佐证了酸化引起的浮游植物沉降速率升高可促进长江口海域的底层缺氧的发生(Zhu et al, 2011)。
4 结论
2020年5月在长江口南毗邻海域的浑浊带区域对浮游植物种群现场采样并进行船基受控培养,通过测定培养后浮游植物群落的不同化学参数并结合传统显微镜检和高通量测序两种方法来鉴定浮游植物的种类、统计浮游植物的丰度,探究了海洋酸化和光照强度变化以及二者之间的交互作用对长江口以南毗邻光限制区域的浮游植物生理指标和群落组成变化的影响。
我们的研究结果表明海水酸化程度与光照强度变化对浮游植物生长及种群组成产生了不同的影响,2种环境要素的变化可产生交互效应。测定获得的15个参数充分体现了浮游植物群落的生物量、化学元素组成和群落结构组成等方面随环境变化做出的响应。500~1200 μmol·photons·m−2·s−1的高光更促进浮游植物的生长及生物量积累,尤其是中心纲硅藻的丰度;pCO2为101 Pa的酸化更有利于聚球藻的生长,同时显著提高了小型浮游植物Chla质量浓度组成百分比并导致浮游植物种群粒径增大;酸化和高光均降低了甲藻的优势度,而酸化条件下更适于金藻和蓝藻的生长。浮游植物种群组成的改变将对该海域的碳沉降及缺氧区的形成产生深远影响。以上研究结果有助于我们进一步理解和预测海洋酸化和光照强度变化对近岸低光浑浊带的长江口南毗邻海域的浮游植物的耦合作用及其生物地球化学效应。已有的研究结果在时空上还存在较大局限性,今后的研究应加强更多季节、更多典型站位研究,结合长期观测数据进一步拓展完善我们的趋势性和机制性认知。此外,有研究表明温度升高和营养盐浓度水平的变化(江志兵等, 2014; Liu et al, 2020)也可引起长江口海域浮游植物种群组成的显著变化,对能量向上传递及渔业资源产生影响。今后的研究还要进一步结合多重环境变化因素深入探究海洋环境快速变化对相应海域的生态、生物地球化学效应及其对气候的反馈机制。
致谢:本研究的数据及样品采集得到国家自然科学基金委员会共享航次计划项目(项目批准号:41676160和41606128) 的资助。 该航次(航次编号:NORC2020-02)由“向阳红18”号科考船实施,在此一并致谢。
