岩藻多糖对高脂饮食诱导的非酒精性脂肪性肝病的预防作用
2023-11-14刘希鹏张海峰
刘希鹏,孙 娟,张海峰
(上海交通大学医学院附属第九人民医院临床营养科,上海 200011)
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是一种慢性代谢性肝病,表现为肝细胞内脂肪过量积聚[1]。NAFLD 是导致慢性肝病的常见原因[2,3]。若未得到有效治疗,NAFLD 可能会发展为威胁生命的疾病,如肝硬化、肝癌等[4]。除了对肝脏造成损害外,NAFLD 还与糖尿病、高血压、代谢综合征、动脉硬化性心脑血管疾病等密切相关[5,6]。随着经济发展和生活水平提高,人们脂肪摄入过多,进一步增加了NAFLD 的患病风险[7]。NAFLD 对人类健康构成严重威胁,并给医疗系统带来沉重负担。然而,目前仍缺乏有效的对于NAFLD 治疗方法。
岩藻多糖是一种存在于海带等褐藻中的水溶性化学物质,被称为硫酸酯化杂多糖。它具有多种生物活性,包括抗炎、抗氧化、抗肿瘤和降血脂等[8-12]。有研究表明,低分子量的岩藻多糖结合高稳定性褐藻黄质可以调节脂肪细胞和肝细胞中的瘦素-脂联素轴,进而调控脂质和糖原代谢,减轻胰岛素抵抗,对NAFLD 有一定的抑制作用[13]。然而,目前还没有足够的研究结果来证明岩藻多糖单独是否对NAFLD具有抑制作用。本研究使用高脂饮食诱导的NAFLD 小鼠模型,重点研究了岩藻多糖对小鼠肝脏脂质积聚、炎症反应和氧化应激的影响,旨在为预防高脂饮食诱导的NAFLD 提供新的研究方向。
1 材料与方法
1.1 材料
1.1.1 主要材料与试剂 岩藻多糖,购自北京奇松生物科技有限公司。总胆固醇(TC)、甘油三酯(TG)、谷丙转氨酶(ALT)、谷草转氨酶(AST)检测试剂盒购自南京建成生物工程研究所。超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)测定试剂盒购自上海源叶生物公司。小鼠IL-6 和小鼠肿瘤坏死因子(TNF-α)ELISA 试剂盒购自北京同立海源生物科技公司。
1.1.2 实验动物及饲料 本研究选用了18 只SPF级C57BL/6J 雄性小鼠,体重范围18~25 g。小鼠常规饲养在拥有独立通气笼盒(IVC)的动物房内常规饲养,每天提供12 h 的光照和夜间的循环。动物房的温度22 ℃,湿度50%~60%。采用南京协同医药生物工程有限责任公司提供的高脂饲料(XTHF60),该饲料的组成为脂肪60%、碳水化合物20%、蛋白质20%。本研究方案于2022 年2 月8日经由上海交通大学医学院附属第九人民医院动物伦理委员会批,批号:SH9H-2022-A023-SB,符合实验室动物管理与使用准则。
1.2 方法
1.2.1 分组、建模和给药 经过1 周的适应性喂养,将C57BL/6 雄性小鼠随机分为3 组:对照组、高脂饮食组和岩藻多糖干预组,每组6 只。对照组小鼠继续以标准饲料进行喂养,其余两组小鼠则接受高脂饲料喂养。同时,对照组和高脂饮食组的小鼠给予生理盐水,岩藻多糖干预组的小鼠则给予100 mg∙kg-1∙d-1的岩藻多糖溶液进行灌胃。每天给药一次,共进行12 周给药实验。
1.2.2 体质量、肝质量和肝指数测定 末次给药后12 h 后,使用颈椎脱臼法处死小鼠并摘取眼球血样。随后,将小鼠的肝脏组织分离出来,并使用滤纸吸去表面的组织液。使用精密天平称量肝脏的质量,并计算肝指数(肝指数%=肝脏质量/体质量×100%)。
1.2.3 测定小鼠肝脏组织中TC 和TG 的含量 取相同部位的小鼠肝组织,放入预冷的生理盐水中,然后放在冰水中,剪碎后使用组织匀浆机进行匀浆。然后,以4 ℃、10 000g的速度离心10 min,取上清置于冰上待测。根据试剂盒说明书的操作步骤,测定各组小鼠肝组织中TC 和TG 的含量。
1.2.4 小鼠肝脏组织HE 染色 研究各组小鼠的肝脏组织病理形态的改变情况,取相同部位的肝组织,并将其浸泡在10%甲醛溶液中24 h。接着,进行脱水、透明、浸蜡和石蜡包埋等处理步骤后,使用切片机对肝组织进行切片并烘干。按照HE 染色试剂盒的说明书进行染色,在光镜下观察各组小鼠的肝脏组织病理形态的改变情况。
1.2.5 小鼠肝脏组织炎症和氧化应激水平测定取相同部位的小鼠肝脏组织,按照上述步骤均匀搅拌,4 ℃,10 000g离心10 min,取上清液放置在冰上待测。按照试剂盒说明书的操作步骤,酶联免疫吸附试验法测定各组小鼠肝脏组织中炎症反应指标IL-6 和TNF-α 的含量。利用分光光度法测定各组小鼠肝脏组织中氧化应激相关指标SOD、谷胱甘肽过氧化物酶(GSH-Px)活性和MDA 含量的变化情况。
1.3 统计学处理
使用SPSS 26.0 软件对收集到的数据进行统计分析。采用Shapiro-Wilk 法检验数据的正态,使用Levene 法检验数据的方差齐性。数据符合正态分布且满足方差齐性条件,以(±s)表示。多个组别比较采用单因素方差分析,组别间比较采用t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 比较不同组别小鼠的体重、肝脏质量和肝脏指数
结果显示在高脂饮食组中,小鼠的体重、肝脏质量和肝指数均明显高于对照组(P<0.01)。表明高脂饮食可能导致小鼠发胖并引发NAFLD。另外,与高脂饮食组相比,加入岩藻多糖的干预组中,小鼠的体重、肝脏质量和肝指数均显著降低(P<0.01),见表1。
表1 各组小鼠体重、肝质量和肝指数测定结果(n=6,±s)Tab 1 Determination results of body weight,liver weight and liver index of mice in each group(n=6,±s)

表1 各组小鼠体重、肝质量和肝指数测定结果(n=6,±s)Tab 1 Determination results of body weight,liver weight and liver index of mice in each group(n=6,±s)
注:与对照组比较,*P<0.01;与高脂饮食组比较,#P<0.01。
组别对照组高脂饮食组岩藻多糖干预组F肝指数(%)4.27±0.21 6.00±0.19*5.06±0.24#96.61体重(g)30.83±1.92 43.23±0.99*39.00±1.28#63.12肝质量(g)1.32±0.15 2.60±0.21*1.97±0.15#83.67
2.2 各组小鼠肝脏组织中脂质含量的比较
对照组小鼠与高脂饮食组小鼠进行对比,高脂饮食组小鼠的肝脏中TC 和TG 含量明显增加(P<0.01)。在岩藻多糖干预组中,与高脂饮食组小鼠相比,肝脏中的TC 和TG 含量都有不同程度的降低(P<0.01)。见表2。
表2 各组小鼠肝组织中TC 和TG 含量测定结果(n=6,±s,mmol/g protein)Tab 2 Content determination results of TC and TG in liver tissue of mice in eachgroup(n=6,±s,mmol/g protein)

表2 各组小鼠肝组织中TC 和TG 含量测定结果(n=6,±s,mmol/g protein)Tab 2 Content determination results of TC and TG in liver tissue of mice in eachgroup(n=6,±s,mmol/g protein)
注:与对照组比较,*P<0.01;与高脂饮食组比较,#P<0.01。
TG 0.19±0.03 0.47±0.06*0.27±0.06#46.37组别对照组模型组岩藻多糖干预组F TC 0.22±0.04 0.54±0.08*0.42±0.06#44.18
2.3 小鼠肝脏组织病理学分析结果
经过HE 染色后,观察发现与对照组相比,高脂饮食组的小鼠出现了明显的病理学改变。这些改变包括肝细胞肿大、炎症细胞浸润明显增多,肝细胞内可见到大小不一的脂滴,并且部分肝细胞发生了气球样变。而在岩藻多糖干预组的小鼠中,与高脂饮食组相比,肝组织病理学情况得到了显著的改善。以上结果进一步证明了岩藻多糖能够减轻高脂饮食引发的非酒精性脂肪肝的肝脏病变,并且还能减少肝脏中的脂质积累。见图1。

图1 各组小鼠肝组织病理情况(HE 染色,×200)Fig 1 Pathological conditions of liver tissues in each group (HE, ×200)
2.4 比较不同组小鼠肝功能情况
接受高脂饮食的小鼠的肝脏组织中AST 和ALT 水平明显高于对照组小鼠,两组之间的差异具有显著统计学意义(P<0.01)。给予岩藻多糖干预后,高脂饮食组小鼠的肝脏组织中AST 和ALT 的水平均明显下降,差异具有显著统计学意义(P<0.01),见表3。
表3 各组小鼠肝组织中AST 和ALT 水平测定结果(n=6,±s,U/L)Tab 3 Activity determination results of AST and ALT in liver tissue of mice in each group(n=6,±s,U/L)

表3 各组小鼠肝组织中AST 和ALT 水平测定结果(n=6,±s,U/L)Tab 3 Activity determination results of AST and ALT in liver tissue of mice in each group(n=6,±s,U/L)
注:与对照组比较,*P<0.01;与高脂饮食组比较,#P<0.01。
ALT 11.16±3.65 42.17±4.71*31.33±5.16#71.62组别对照组高脂饮食组岩藻多糖干预组F AST 17.50±5.17 55.83±5.98*33.5±4.23#83.02
2.5 比较不同组别小鼠的肝脏组织中的炎症水平
结果显示,与对照组相比,高脂饮食组小鼠的肝脏组织中IL-6 和TNF-α 的水平显著升高(P<0.01)。与高脂饮食组相比,岩藻多糖干预组小鼠的肝脏组织中IL-6 和TNF-α 的水平明显下降(P<0.01),这表明岩藻多糖可以抑制高脂饮食引起的炎症因子过度升高。见表4。
表4 各组小鼠肝组织中TNF-α 及IL-6 含量测定结果(n=6,±s,pg/mL)Tab 4 Content determination results of TNF-α and IL-6 in liver tissue of mice in each group(n=6,±s,pg/mL)

表4 各组小鼠肝组织中TNF-α 及IL-6 含量测定结果(n=6,±s,pg/mL)Tab 4 Content determination results of TNF-α and IL-6 in liver tissue of mice in each group(n=6,±s,pg/mL)
注:与对照组比较,*P<0.01;与高脂饮食组比较,#P<0.01。
组别对照组模型组岩藻多糖干预组F TNF-α 23.69±4.79 75.67±6.02*48.90±5.73#132.00 IL-6 10.93±1.07 54.37±6.56*32.09±5.34#116.74
2.6 比较不同组小鼠肝脏组织中氧化应激水平
该研究结果显示,高脂饮食会导致小鼠肝脏组织中SOD 和GSH-Px 的活性明显低于对照组(P<0.01),同时MDA 含量明显高于对照组(P<0.01)。这表明高脂饮食会引起小鼠肝脏的氧化应激反应。另外,实验结果显示,岩藻多糖干预组小鼠肝脏组织中SOD 和GSH-Px 活性虽然低于对照组,但显著高于高脂饮食组小鼠(P<0.01)。同时MDA 含量也明显低于高脂饮食组(P<0.01)。这表明岩藻多糖能够激活小鼠肝脏组织的抗氧化应激反应,降低肝脏的过氧化应激水平。见表5。
表5 各组小鼠肝组织中SOD、GSH-Px 活性及MDA 含量测定结果(n=6,±s)Tab 5 Determination results of SOD and GSH-Px activities and MDA content in liver tissue of micein each group(n=6,±s)
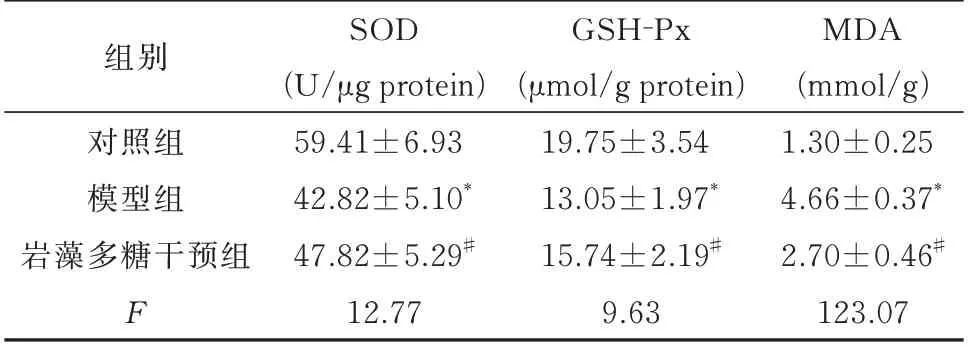
表5 各组小鼠肝组织中SOD、GSH-Px 活性及MDA 含量测定结果(n=6,±s)Tab 5 Determination results of SOD and GSH-Px activities and MDA content in liver tissue of micein each group(n=6,±s)
注:与对照组比较,*P<0.01;与高脂饮食组比较,#P<0.01。
对照组模型组岩藻多糖干预组F MDA(mmol/g)1.30±0.25 4.66±0.37*2.70±0.46#123.07组别SOD(U/μg protein)59.41±6.93 42.82±5.10*47.82±5.29#12.77 GSH-Px(μmol/g protein)19.75±3.54 13.05±1.97*15.74±2.19#9.63
3 讨论
NAFLD 最早以肝脏内脂肪异位沉积为特征[14,15]。根据NAFLD 的程度,可以分为非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)、肝硬化和肝细胞癌等不同阶段[4,7,16,17]。目前全球NAFLD 的发病率在升高,并且与肥胖的发病率密切相关。研究表明,全球NAFLD 的患病率约为25%,而在肥胖人群中NAFLD 的患病率远高于一般人群,达到了65%~85%[18]。我国也是NAFLD患病率较高的国家之一,根据流行病学调查数据显示,中国大陆NAFLD 的患病率12.5%~38%,NAFLD 成为我国肝功能异常和慢性肝病的第二大原因[19]。
肝脏是人体参与脂肪代谢的主要器官。当人长期摄入高脂饮食时,肝脏会增加对饮食中脂肪的吸收[20]。如果肝脏脂肪摄取速度超过排出速度,就会导致肝脏内脂肪过度积累,从而引发NAFLD[21]。通过给小鼠喂食高脂饮食,可以有效模拟人类NAFLD 的发生和发展过程,已广泛应用于研究[14,17,22]。因此,本研究通过给C57BL/6J 小鼠喂食高脂饮食,构建NAFLD 动物模型。本研究发现高脂饮食12 周后,小鼠的体重、肝脏重量和肝脏指数显著增加,肝脏组织病理学检测显示大量脂滴积聚在肝脏中,同时伴有炎症细胞浸润,表明高脂饮食引发了小鼠的肥胖及肝脏内脂肪堆积。将同时摄入岩藻多糖(100 mg∙kg-1∙d-1)的小鼠与单纯高脂饮食组小鼠进行对比,发现岩藻多糖可以明显降低小鼠的体重、肝脏重量和肝脏指数,并且可以改善肝组织的病理学状况。这一研究结果表明,岩藻多糖具有抑制高脂饮食引起NAFLD 发生和发展的能力。
在NAFLD 的发病过程中,肝细胞中三酰甘油(TAG)的积累被认为是一个初始步骤[1]。因此,减少肝脏组织中脂肪过度积累的情况,特别是减少肝细胞内TAG 的聚集,对于NAFLD 的治疗和预防至关重要。本研究发现食用高脂饮食的小鼠肝脏组织中的TG 和TC 含量明显高于对照组,而经岩藻多糖干预的小鼠肝脏组织中的TG 和TC 含量显著低于单纯高脂饮食的小鼠。此外,研究还发现,岩藻多糖的干预可以显著降低高脂饮食引起的小鼠肝脏组织中ALT 和AST 的增加。这一结果表明,岩藻多糖可以减少肝脏组织内脂质的积聚,并改善高脂饮食引起的肝功能紊乱。
炎症反应在NAFLD 的发生和发展过程中扮演着重要角色[23,24]。NASH 是NAFLD 中最为严重的一种表型,除了肝脏组织出现脂肪变性外,NASH的病理特征还包括肝细胞肿胀、肝小叶炎症以及伴随或不伴随肝纤维化[25]。本研究发现,高脂饮食可以明显增加小鼠肝脏组织中的炎症因子TNF-α 和IL-6 的水平。而TNF-α 和IL-6 等炎症细胞因子可以促进肝细胞脂肪变性、周围脂肪分解、坏死、凋亡以及炎症反应,最终导致NASH 的发生[26]。添加岩藻多糖的干预组小鼠与单纯高脂饮食组相比,小鼠肝组织中TNF-α 和IL-6 的水平显著下降,这表明岩藻多糖可以抑制高脂饮食引起的NAFLD 小鼠肝脏组织炎症反应。此外,还有研究表明,氧化应激是高脂饮食诱导肝损伤的重要原因,并且在NAFL 发展到NASH 的过程中发挥着至关重要的作用。MDA 是脂质过氧化的重要标志物,常被用来评估组织氧化损伤的程度,而SOD 和GSH-Px 则是机体内源抗氧化系统的重要组成部分,具有清除ROS 和防止发生脂质过氧化的作用[1,6]。因此,本研究还检测了小鼠肝脏组织中SOD、GSH-Px 和MDA 的水平[6,25]。结果表明,岩藻多糖可以显著抑制高脂饮食诱导的小鼠肝组织中SOD 和GSH-Px 水平的降低以及脂质过氧化标志物MDA 的产生,说明岩藻多糖对高脂饮食诱导的NAFLD 小鼠肝脏组织过氧化应激反应具有一定的抑制作用。
综上所述,岩藻多糖可以改善高脂饮食引起的肝细胞脂肪异位沉积,并且可以通过抗炎及抑制氧化应激水平,抑制NAFL 向NASH 的发展,但具体的分子机制还有待进一步的研究。
作者贡献度说明:
刘希鹏:负责课题设计,进行相关实验,资料分析,拟定写作思路,撰写论文;孙娟:参与资料分析,修改论文;张海峰:负责指导撰写文章并最后定稿。
所有作者声明不存在利益冲突关系。
