大黄素通过减少DNMTs的表达对胰腺癌细胞抑癌基因ppENK发挥去甲基化作用研究
2023-11-13陈亮唐坚褚永权叶剑宏沈超钱晓宇
陈亮,唐坚,褚永权,叶剑宏,沈超,钱晓宇
大黄素通过减少DNMTs的表达对胰腺癌细胞抑癌基因ppENK发挥去甲基化作用研究
陈亮,唐坚,褚永权,叶剑宏,沈超,钱晓宇
嘉兴市第一医院头颈外科,浙江嘉兴 314000
研究大黄素对胰腺癌细胞Panc1 DNA甲基转移酶(DNA methyltransferases,DNMTs)的影响,及其对抑癌基因前脑啡肽原(pre-proenkephalin,ppENK)启动子区CpG岛的去甲基化作用,探讨大黄素是否可通过降低DNMTs的表达逆转ppENK的甲基化状态。CCK-8检测不同浓度大黄素对Panc1细胞生长的影响,探索最佳用药浓度,重亚硫酸盐测序PCR(bisulfite genomic sequencing PCR,BSP)检测不同浓度大黄素对ppENK基因甲基化状态的影响,PCR和Western Blot检测ppENK及甲基转移酶DNMT1、DNMT3a的mRNA和蛋白表达情况。大黄素以时间梯度和浓度梯度依赖性抑制Panc1细胞生长,其半数最大抑制浓渡(half maximal inhibitory concentration,IC50)约为40μmol/L,大黄素可使ppENK甲基化状态减弱,非甲基化状态增强;可减弱DNMTs的mRNA和蛋白表达,增强ppENK mRNA和蛋白表达。大黄素可不同程度地使Panc1 ppENK抑癌基因去甲基化,使抑癌基因重新表达。大黄素抑制胰腺癌细胞生长和其去甲基化作用有关,推测大黄素发挥去甲基化作用和其抑制甲基转移酶表达相关。
大黄素;胰腺癌;去甲基化;DNA甲基转移酶;重亚硫酸盐测序PCR
胰腺癌是一种常见的恶性肿瘤,具有侵袭性强、早期症状不典型、术后易转移复发等特点。据国际癌症研究机构统计,胰腺癌的死亡率居第7位,发病率居36种常见恶性肿瘤的第14位[1]。另一项统计数据表明,美国2021年新增胰腺癌确诊病例60 430例,死亡病例48 220例,到2030年胰腺癌或将成为美国癌症相关死亡的第二大原因[2-3]。
肿瘤发生、发展过程中的表观遗传修饰变化备受关注,表观遗传修饰主要包括:DNA甲基化和羟甲基化、染色质重塑、组蛋白甲基化和乙酰化、RNA干扰、基因组染色等。催化DNA甲基转移酶(DNA methyltransferases,DNMTs)有DNMT1、DNMT3a和DNMT3b,进而形成5mC[4]。DNA甲基化修饰与转录失活、基因印记、X染色体失活密切相关,大量研究证据表明,DNA多重甲基化在多种恶性肿瘤的发生、发展中起重要作用[5]。
研究发现在胰腺癌中,许多抑癌基因存在甲基化异常,包括CDKN1C、SPARC、P16、RASSF1A和ppENK等,都伴随着不同程度的甲基化,而其mRNA表现出不同程度的表达缺失[6-10]。这些抑癌基因中,以ppENK研究相对比较明确。Ueki等[10]和Fukushima等[11]报道超过90%的胰腺癌ppENK基因甲基化水平上升。
既往研究发现大黄素可抑制胰腺癌细胞生长,致基因组5mC水平下降,使抑癌基因ppENK的甲基化水平下降,非甲基化水平上升,本文是后续研究,探讨大黄素对Panc1 DNMTs的影响,对ppENK的去甲基化作用,探讨大黄素是否可通过降低DNMTs的表达逆转ppENK的甲基化状态,从而使其重新表达生物活性(mRNA和蛋白水平),这一发现将为大黄素的临床抗肿瘤治疗奠定理论基础。
1 材料与方法
1.1 材料
大黄素、5AzA-cdR购自Sigma公司,CCK-8试剂盒购自Gibco公司。细胞/组织基因组DNA提取试剂盒(离心菌株型)购自上海杰瑞生物工程有限公司,EpiTect®bisulfite kit改良试剂盒和ppENK抗体购自Abcam公司。
1.2 方法
1.2.1 细胞系和培养 本研究引进并保藏人胰腺癌细胞系Panc1细胞株,培养于含胎牛血清、链霉素和青霉素的DMEM培养基中,每2~4d更换一次培养基,当生长到70%~80%时传代进行实验。
1.2.2 细胞增殖实验(CCK-8) 取对数生长期的Panc1细胞,分别使用浓度为0μmol/L、10μmol/L、20μmol/L、40μmol/L、80μmol/L的大黄素处理细胞24h、48h和72h。用酶标仪测定各孔在450nm波长下的吸光度(optical density,OD)值,实验重复3次。计算细胞抑制率:细胞抑制率(%)=(1–实验组OD值/对照组OD值)×100%。实验组为含有细胞的培养基、CCK-8及浓度为10μmol/L、20μmol/L、40μmol/L、80μmol/L的大黄素处理组;对照组为含有细胞的培养基、CCK-8组,每组3个副孔。
1.2.3 DNA的提取与亚硫酸盐修饰 使用细胞/组织基因组DNA提取试剂盒按说明书分别提取DNA,检查DNA的纯度和浓度后,取1μg DNA进行亚硫酸盐修饰,修饰过程按亚硫酸盐修饰试剂盒说明书进行。
1.2.4 焦磷酸盐测序PCR(bisulfite genomic sequencing PCR,BSP) 提取各组DNA,取1μg DNA进行亚硫酸盐修饰,修饰过程参照EpiTect®bisulfite kit modification kit说明书进行。取10μl PCR产物进行凝胶电泳,结束后检查BSP反应产物,回收后送上海麦普生物技术有限公司进行克隆,使用BiQ Analyzer软件分析样本的甲基化状态。
1.2.5 聚合酶链反应(polymerase chain reaction,PCR) 提取细胞总RNA,按RNA逆转录试剂盒说明书逆转录合成cDNA,制备10μl反应体系,加一个标准孔和两个副孔,上机(罗氏公司)扩增45个循环,结果用LightCycler480软件分析,独立重复实验3次。
1.2.6 Western Blot 用RIPA提取各组蛋白,按BCA试剂盒说明书测定蛋白浓度,配制50μg体系,经电泳、转膜、封闭,4℃孵育各种浓度、种类的一抗,GAPDH作为内参,以目的蛋白灰度值与GAPDH灰度值的比值作为衡量蛋白表达差异的参考,实验重复3次。
1.3 统计学方法

2 结果
2.1 大黄素对胰腺癌细胞Panc1的生长抑制作用
本研究用浓度为0μmol/L、10μmol/L、20μmol/L、40μmol/L和80μmol/L的大黄素处理Panc1细胞24h、48h、72h(图1),发现大黄素以时间和浓度梯度形式抑制Panc1细胞的生长,结果与Sheng等[12]研究类似。40μmol/L浓度处理Panc1细胞72h后,生长抑制率为49.4%;80μmol/L浓度时其抑制率达到64.4%。鉴于低浓度药物不会对细胞产生毒副作用,故大黄素的实验用药浓度为0μmol/L、10μmol/L、20μmol/L和40μmol/L,用于后续研究。
2.2 BSP
为验证上述结果的可靠性,笔者进一步用BSP方法检测ppENK的甲基化水平,BSP测序结果,见图2。0μmol/L、10μmol/L、20μmol/L和40μmol/L的大黄素均可致ppENK不同程度去甲基化。ppENK基因测序范围包括11个CpG岛,随机选取10个用于克隆,各组的大黄素分别作用于Panc1细胞72h后,ppENK基因甲基化率分别为86.4%、82.7%、67.3%、52.7%,5Aza-cdR组ppENK的甲基化率达39.1%。该结果进一步证明大黄素可使ppENK的甲基化水平下降。

图1 CCK-8实验检测结果

图2 BSP实验结果
注:黑色圆圈代表甲基化,空白圆圈代表非甲基化;*<0.05,#<0.01
2.3 大黄素对ppENK和DNMTs转录水平的影响
根据上述结果,大黄素、5AzA-cdR使ppENK的甲基化水平不同程度的降低,进一步检测了其对ppENK和DNMTs转录水平的影响。大黄素和1μmol/L 5AzA-cdR均能不同程度地增加ppENK的表达,且5AzA-cdR的作用强于大黄素,同时大黄素、5AzA-cdR可不同程度地降低DNMT1和DNMT3a的表达,见图3。
2.4 大黄素对ppENK和DNMTs的蛋白水平的影响
根据上述结果,大黄素可不同程度地增强ppENK和DNMTs的mRNA表达,本研究用Western Blot检测是否有相应的蛋白重新表达,见图4。结果表明大黄素和5AzA-cdR组ppENK的蛋白表达水平较对照组显著升高,同时伴随DNMT1和DNMT3a的蛋白表达减弱。
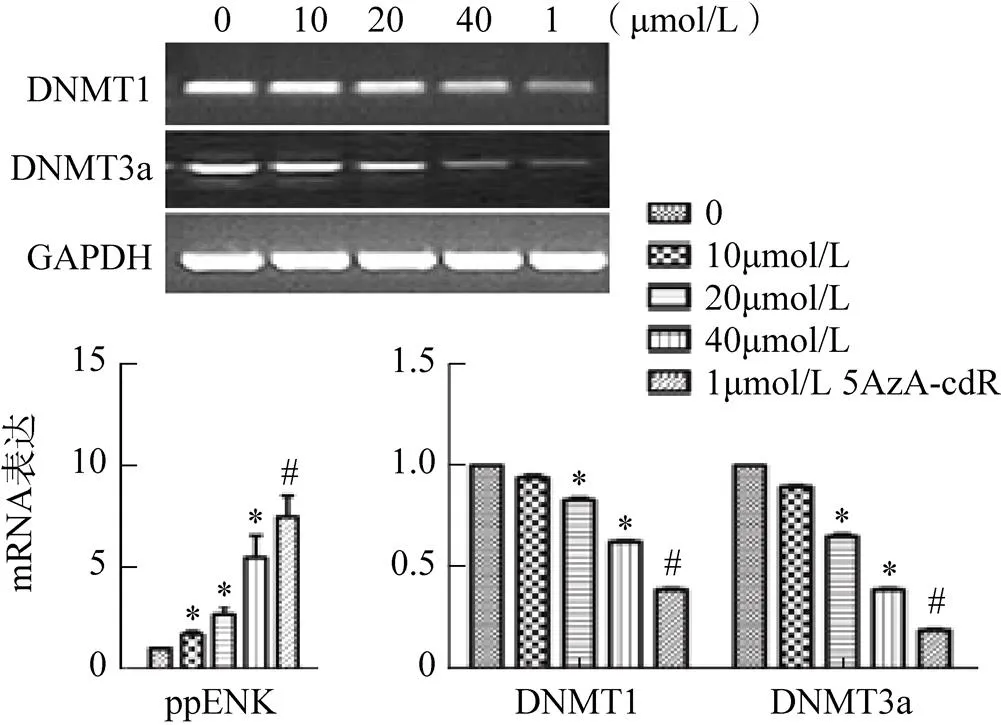
图3 PCR实验检测结果
注:0为对照组,*<0.05,#<0.01
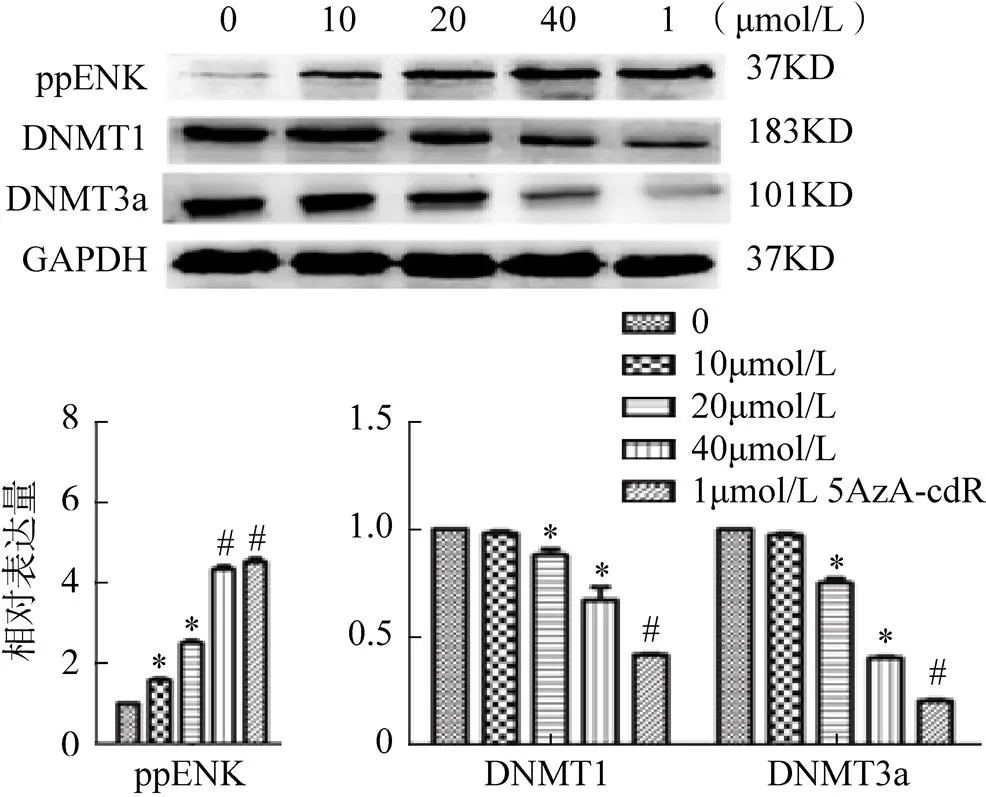
图4 蛋白质印迹(Western Blot,WB)实验检测结果
注:0为对照组;*<0.05,#<0.01
3 讨论
胰腺癌发病率逐年升高,且病死率高。由于发病机制不明,胰腺癌的治疗仍是一个重大挑战[13]。大黄素对胰腺癌有一定的临床疗效,可诱导胰腺癌细胞凋亡,抑制新生血管形成,与吉西他滨合用可提高胰腺癌细胞对吉西他滨的耐药性,但具体机制尚不清楚[12-14]。
胰腺癌抑癌基因的启动子区CpG岛甲基化被认为是表达失活的主要原因之一[15]。ppENK基因与肿瘤细胞生长迟缓有关,ppENK基因位于8q23~24,由4个外显子和3个内含子组成,ppENK基因编码的产物是阿片类生长因子,对包括胰腺癌在内的多种肿瘤都具有生长抑制作用,在胰腺癌细胞中检测到ppENK的高甲基化[16]。本课题组既往MSP实验只能定性检测甲基化的状态,不能定量反应甲基化的比例,故本研究应用BSP实验定量检测甲基化水平,数据显示在0μmol/L、10μmol/L、20μmol/L和40μmol/L的大黄素作用下,ppENK甲基化率分别为86.4%、82.7%、67.3%、52.7%,说明大黄素可对Panc1细胞的ppENK发挥不同程度的去甲基化作用。甲基化常导致抑癌基因表达缺失,其表达量与CpG岛甲基化密度成反比,往往较低水平的甲基化导致抑癌基因失表达,高密度的甲基化则可引起抑癌基因的完全失表达[17]。PCR结果也证实大黄素可使ppENK重新表达,随着药物浓度的增加和作用时间的延长,其表达量有增加的趋势,Western Blot结果也与PCR结果一致,进一步证明大黄素对Panc1细胞具有去甲基化作用。
在生物体中,甲基化反应主要由甲基转移酶(DNMT1、DNMT3a、DNMT3b)催化,抑癌基因去甲基化的途径主要有抑制甲基转移酶活性和降低甲基转移酶表达两种方式。根据本研究中PCR和Western Blot的结果,40μmol/L大黄素和1μmol/L 5AzA-cdR可显著降低DNMT1和DNMT3a的表达,因此推测大黄素发挥去甲基化作用可能与其一定程度上抑制甲基转移酶的表达有关,能否抑制甲基转移酶活性有待后续研究。
综上所述,BSP证实大黄素可在一定程度上使Panc1中的抑癌基因ppENK去甲基化,PCR及Western Blot结果证明大黄素可增强ppENK的表达,减弱DNMT1和DNMT3a的表达,证明大黄素可通过抑制DNMTs的表达发挥其去甲基化的作用。本结果为大黄素治疗胰腺癌的作用机制提供了新的认识,在临床上,大黄素治疗胰腺癌不仅是通过抑制细胞凋亡和血管生成,表观遗传学中的去甲基化作用也是一个重要机制。
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209–249.
[2] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7–33.
[3] RAHIB L, SMITH B D, AIZENBERG R, et al. Projecting cancer incidence and deaths to 2030: The unexpected burden of thyroid, liver, and pancreascancers in the United States[J]. Cancer Res, 2014, 74(11): 2913–2921.
[4] CHENG X, BLUMENTHAL R M. Mammalian DNA methyltransferases: A structural perspective[J]. Structure, 2008, 16(3): 341–350.
[5] BLAZE J, WANG J, HO L, et al. Polyphenolic compounds alter stress-induced patterns of global DNA methylation in brain and blood[J]. Mol Nutr Food Res, 2018, 62(8): 1700722.
[6] MATSUOKA S, EDWARDS M C, BAI C, et al. P57KIP2, a structurally distinct member of the p21CIP1 Cdk inhibitor family, is a candidate tumor suppressor gene[J]. Genes Dev, 1995, 9(6): 650–662.
[7] SATO N, FUKUSHIMA N, MAEHARA N, et al. SPARC/osteonectin is a frequent target for aberrant methylation in pancreatic adenocarcinoma and a mediator of tumor-stromal interactions[J]. Oncogene, 2003, 22(32): 5021–5030.
[8] ATTRI J, SRINIVASAN R, MAJUMDAR S, et al. Alterations of tumor suppressor gene p16INK4a in pancreatic ductal carcinoma[J]. BMC Gastroenterol, 2005, 5: 22.
[9] DAMMANN R, SCHAGDARSURENGIN U, LIU L, et al. Frequent RASSF1A promoter hypermethylation and K-ras mutations in pancreatic carcinoma[J]. Oncogene, 2003, 22(24): 3806–3812.
[10] UEKI T, TOYOTA M, SKINNER H, et al. Identification and characterization of differentially methylated CpG islands in pancreatic carcinoma[J]. Cancer Res, 2011, 61(23): 8540–8546.
[11] FUKUSHIMA N, SATO N, UEKI T, et al. Aberrant methylation of preproenkephalin and p16 genes in pancreatic intraepithelial neoplasia and pancreatic ductal adenocarcinoma[J]. Am J Pathol, 2002, 160(5): 1573–1581.
[12] SHENG Z L, WEI T W, HUI C, et al. Antitumor activity of emodin against pancreatic cancer depends on its dual role: Promotion of apoptosis and suppression of angiogenesis[J]. PLoS One, 2012, 7(8): e42146.
[13] LIU A, LUO J, ZHANG J H. Emodin combined gemcitabine inhibited the growth of pancreatic cancer in vitro and in vivo and its mechanisms study[J]. Zhongguo Zhong Xi Yi Jie He Za Zhi, 2012, 32(5): 652–656.
[14] CHEN H, WEI W, GUO Y, et al. Enhanced effect of gemcitabine by emodin against pancreatic cancer in vivo via cytochrome C-regulated apoptosis[J]. Oncol Rep, 2011, 25: 1253–1261.
[15] UEKI T, TOYOTA M, SOHN T, et al. Hypermethylation of multiple genes in pancreatic adenocarcinoma[J]. Cancer Res, 2000, 60(7): 1835–1839.
[16] DENNING G M, ACKERMANN L W, BARNA T J, et al. Proenkepha-lin expression and enkephalin release are widely observed in non-neuronal tissues[J]. Peptides, 2008, 29(1): 83–92.
[17] TAHILIANI M, KOH K P, SHEN Y, et al. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1[J]. Science, 2009, 324: 930–935.
Emodin plays a demethylation role in tumor suppressor gene ppENK by reducing the expression of DNMTs in pancreatic cancer cells
Department of Head and Neck Surgery, Jiaxing First Hospital, Jiaxing 314000, Zhejiang, China
To study the effect of emodin on pancreatic cancer cell Panc1 DNA methyltransferases (DNMTs) and its demethylation of CpG island in the promoter region of tumor suppressor gene pre-proenkephalin (ppENK), and to explore whether emodin can reverse the methylation of ppENK by reducing the expression of DNMTs.CCK-8 was used to detect the effect of different concentrations of emodin on the growth of Panc1 cells, and to explore the optimal drug concentration. Bisulfite genomic sequencing PCR (BSP) was used to detect the effect of different concentrations of emodin on the methylation status of ppENK gene. PCR and Western Blot were used to detect the mRNA and protein expression of ppENK and methyltransferases DNMT1 and DNMT3a.Emodin inhibited the growth of Panc1 cells in a time-dependent and concentration-dependent manner, half maximal inhibitory concentration (IC50) was approximately 40μmol/L, emodin can weaken the methylated state of ppENK and enhance the non-methylated state. Emodin can weaken the mRNA and protein expression of DNMTs and enhance the mRNA and protein expression of ppENK.Emodin can demethylate the tumor suppressor gene of Panc1 ppENK in varying degrees and re-express the tumor suppressor gene. The inhibition of emodin on the growth of pancreatic cancer cells is related to its demethylation. It is speculated that the demethylation effect of emodin is related to its inhibition on the expression of methyltransferase.
Emodin; Pancreatic cancer; Demethylation; DNMTs; BSP
R733
A
10.3969/j.issn.1673-9701.2023.30.002
浙江省基础公益研究计划项目(LQ20H160059)
陈亮,电子信箱:jxsdyyy10711@163.com
(2023–03–02)
(2023–10–24)
