发酵软颗粒饲料对凡纳滨对虾生长性能、血清指标、肝胰腺和肠道形态以及肠道菌群的影响
2023-11-10韩瑞玲王珊珊宋俊英王丹玉易敢峰周志刚
韩瑞玲 王珊珊 宋俊英 王丹玉 汪 攀* 易敢峰* 周志刚
(1.北京大北农科技集团股份有限公司,福建省水产功能性饲料及养殖环境调控重点实验室,漳州 363500;2.中国农业科学院饲料研究所,中国-挪威鱼类消化道微生物联合实验室,北京 100081)
凡纳滨对虾(Litopenaeusvannamei)又名南美白对虾,是我国重要的经济虾类之一。因其壳薄体肥,肉质鲜美,营养丰富,市场需求日益增加,养殖业得以蓬勃发展,2021年我国凡纳滨对虾养殖产量超过127万t[1]。然而,随着养殖规模的扩大和集约化程度的提高,养殖水体环境失调,养殖动物疾病频发,这严重阻碍了对虾养殖业的发展[2-3]。养殖过程使用抗生素是防控疾病较为常见的手段,但随着病原菌抗药性的增强和药物残留等问题的日趋严重,寻找药物防控的替代手段已成为当务之急[4]。益生菌可改善肠道菌群平衡、生长性能、饲料转化、免疫状态、疾病防御和抗应激能力,进而促进宿主健康,是抗生素的有效替代品[5]。但是对虾饲料加工过程中的高温熟化过程会使益生菌失活,因此益生菌在对虾饲料中的应用受到一定的限制。
发酵软颗粒饲料是指利用一些特种功能性微生物对全价颗粒饲料进行发酵,最终制成的含有特定量活性益生菌及其代谢产物的湿颗粒饲料。发酵软颗粒饲料采用先造粒后发酵的生产工艺,具有全价配合饲料和益生菌的双重优势。首先,其具有常规颗粒饲料的营养组成与形状,在满足动物生长需求的同时还便于投喂与采食;其次,发酵过程中微生物对常规饲料进行了预消化,营养成分更有利于吸收,抗营养因子被降解;最后,发酵软颗粒饲料中含有活性益生菌及其全部代谢产物,它们可增加常规颗粒饲料的益生功能。刘志云等[6]用发酵全价饲料阶段性饲喂生长猪30 d,结果表明发酵全价饲料可提高平均日采食量(ADFI)、平均日增重(ADG)和饲料转化率,降低死淘率及粪便臭味物质含量,具有很好的抗生素替代效果;陈志敏等[7]研究发现,10%的发酵全价饲料替代肉鸡饲粮可降低料重比,提高平均日增重,10%和20%发酵全价饲料替代组肉鸡十二指肠绒毛高度以及十二指肠和空肠绒毛高度/隐窝深度值显著高于对照组;何如芳[8]在断奶仔猪饲粮中添加30%的发酵全价饲料,饲喂28 d,结果表明发酵全价饲料可提高断奶仔猪的生长性能,改善肠道健康,提高断奶仔猪的抗病力;胡新旭等[9]用含20%固态发酵全价饲料的饲粮饲喂生长育肥猪154 d,可提高生长育肥猪的生长性能,增强免疫力,改善肉品质,实现无抗饲养;Zhang等[10]研究发现,混合菌株发酵全价饲料可通过改善凡纳滨对虾的生长、抗氧化能力、消化以及肠道菌群,进而维持其健康状态,促进其生长,其混合菌株组成为植物乳杆菌(Lactobacillusplantarum)、酿酒酵母(Saccharomycescerevisiae)和沙福芽孢杆菌(Bacillussafensis),添加水平为1×108CFU/g。目前,发酵全价饲料的研究主要集中在猪、鸡等动物上,在水产动物凡纳滨对虾上的研究较少。因此,本试验以凡纳滨对虾配合颗粒饲料为发酵底物,利用由鼠李糖乳杆菌(Lactobacillusrhamnosus)、枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母和索氏鲸杆菌(Cetobacteriumsomerae)复配的发酵菌剂进行发酵,制备凡纳滨对虾发酵软颗粒饲料,并按一定比例替代常规配合饲料投喂凡纳滨对虾,从生长性能、血清指标、肝胰腺和肠道形态以及肠道菌群等多方面入手,探讨发酵软颗粒饲料对凡纳滨对虾的影响,以期为发酵软颗粒饲料在凡纳滨对虾养殖中的应用提供参考依据。
1 材料与方法
1.1 发酵软颗粒饲料的制备
以鱼粉和豆粕为蛋白质源,大豆油、鱼油和卵磷脂为脂肪源配制成粗蛋白质约为42.0%、粗脂肪约为7.0%的基础饲料(粒径1.0 mm),其组成及营养水平见表1。将5 kg复合菌发酵剂(购自北京某水产科技有限公司,主要成分为鼠李糖乳杆菌、枯草芽孢杆菌及酿酒酵母等益生菌,活菌数量为1010CFU/g)溶于200 kg、37 ℃温水中,再与800 kg基础饲料混合,随后将混合均匀的物料装入带有出气阀的发酵袋中(5 kg/袋),加热密封,28 ℃静置发酵7 d,发酵结束后将其保存于4 ℃冰箱中备用。

表1 基础饲料组成及营养水平(风干基础)
1.2 发酵软颗粒饲料成分测定
发酵软颗粒饲料粗蛋白质含量参照GB/T 6432—2018测定,粗脂肪含量参照GB/T 6433—2006测定,粗纤维含量参照GB/T 6434—2006测定,酸溶蛋白质含量参照NY/T 3801—2020测定。发酵软颗粒饲料益生菌数量采用平板菌落计数法测定;其中,乳酸菌计数采用MRS琼脂培养基,芽孢杆菌计数采用营养琼脂培养基,酵母菌计数采用孟加拉红琼脂培养基,均在37 ℃下培养24 h后进行菌落计数。上述培养基购自北京陆桥技术股份有限公司。

续表1项目 Items含量 Content玉米蛋白粉 Corn gluten meal3.00米糠 Rice bran2.00维生素C酯 Vitamin C ester0.15氯化胆碱 Choline chloride0.25维生素预混料 Vitamin premix1)0.10矿物质预混料 Mineral premix2)0.50磷酸二氢钙 Ca(H2PO4)21.50膨润土 Bentonite2.00合计 Total100.00营养水平 Nutrient levels3)水分 Moisture9.90粗蛋白质 CP42.00粗脂肪 EE7.00
1.3 试验动物及饲养管理
预试验在福建省诏安县梅岭镇南门村大北农水产养殖试验基地进行。对虾在循环水桶驯化2周后,选用450只健康、规格一致[(3.24±0.10) g]的个体,将其随机分到9个500 L的循环水养殖桶中,每桶50只。将9个养殖桶随机分为3组,每组3个重复,每天饱食投喂3次(08:00、14:00和19:00),3组对虾分别用发酵软颗粒饲料按2.5%、5.0%和10.0%的比例替代基础饲料,进行为期2周的预试验。期间观察对虾的采食速度、采食量、肠道健康状况和对虾粪便形态。根据预试验结果,选择按5.0%比例替代基础饲料进行养殖试验。
养殖试验在福建省诏安县梅岭镇南门村大北农水产养殖试验基地进行。对虾在循环水桶用基础饲料暂养2周后,选用300只健康、规格一致[(3.35±0.08) g]的个体,将其随机分到6个500 L的循环水养殖桶中,每桶50只。将6个养殖桶随机分为2组,每组3个重复。对照组和试验组对虾分别投喂基础饲料和试验饲料,其中试验饲料现用现配,每次将5%的发酵软颗粒饲料和95%的基础饲料混合均匀即为试验饲料,开袋后剩余的发酵软颗粒饲料封口后继续存放于4 ℃冰箱中。养殖试验持续6周,每天08:00、14:00和19:00进行投喂,根据对虾进食情况和天气变化调整具体投喂量,总投喂量为对虾体质量的4%~5%。养殖期间,每天换水1次,每次换水量为养殖水体的1/4,并记录每个试验桶中对虾的摄食和死亡情况。养殖用水采用经过滤和紫外消毒的天然海水,水温22~28 ℃,盐度28‰~32‰,pH为8.4~8.6,通过底部曝气保证水中溶解氧含量在5 mg/L以上。
1.4 样品采集
养殖试验结束后,凡纳滨对虾禁食24 h,称重并记录每桶总数,计算生长性能。从每个养殖桶中随机抽取10尾对虾取血,放于4 ℃冰箱中静置12 h,3 500 r/min 离心10 min,取上清液,保存于-80 ℃冰箱,用于后续血清指标的测定;采集3尾虾中肠和肝胰腺用Bouin’s固定液进行固定,于4 ℃冰箱保存用于后期组织切片的制作;另取3尾虾肠道(不含内容物),放置于灭菌的冻存管内,转移至液氮罐中,之后保存于-80 ℃冰箱,用于肠道菌群的测定。
1.5 测定指标及方法
1.5.1 生长性能
凡纳滨对虾生长性能相关指标增重率(WGR)、特定生长率(SGR)、饲料系数(FCR)和成活率(SR)计算公式如下:
WGR(%)=100×(Wt-W0)/W0;
SGR(%/d)=100×(lnWt-lnW0)/t;
FCR=Wf/(Wm-Wn);
SR(%)=100×Nt/N0。
式中:Wt为终末均重(g);W0为初始均重(g);Wf为摄入饲料量(干重,g);Wm和Wn分别为终末总重和初始总重(g);Nt和N0分别为终末尾数和初始尾数;t为养殖天数(d)。
1.5.2 血清指标
血清酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)、总超氧化物歧化酶(T-SOD)和酚氧化酶(PO)活性以及丙二醛(MDA)含量采用购买于南京建成生物工程研究所的试剂盒进行测定。
1.5.3 肝胰腺和肠道形态
将采集的对虾肝胰腺和中肠组织用Bouin’s固定液固定24 h后,制备肠道组织切片,采用苏木素-伊红(HE)染液进行染色,中性树胶封片,并在光学显微镜(Nikon Eclipse E100)下进行观察;最后用MShot数字成像系统软件(广州明美科技有限公司)评估不同组对虾肝胰腺和肠道形态结构的差异。
1.5.4 肠道菌群
肠道菌群总DNA提取、扩增和测试:采用FastDNA®Spin Kit试剂盒提取总DNA,按照说明书进行操作;采用通用引物338F(5′-ACTCCGGGAGCAGCA-3′)和806R(5′-GGACTACHVGGTWTCTAAT-3′)扩增凡纳滨对虾肠道菌群16S rRNA基因的V3~V4区域[11];利用AxyPrep DNA Gel Extraction Kit进行PCR产物纯化,NEXTflexTMRapid DNA-Seq Kit(Bio Scientific)进行建库,按照说明书进行操作;最后,在Illumina MiSeq PE300平台进行测序,由上海美吉生物医药科技有限公司完成。
生物信息分析在美吉生信云平台(https://cloud.majorbio.com)完成。数据优化:使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH(http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件进行拼接。操作分类单元(OTU)聚类:使用UPARSE软件(http://drive5.com/uparse/,version 7.1),根据97%的相似度对序列进行OTU聚类。分析软件及算法使用Qiime平台(http://qiime.org/scripts/assign_taxonomy.html)。利用RDP classifier(http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v138),设置比对阈值为70%。
凡纳滨对虾肠道菌群测序原始数据已上传至NCBI的SRA数据库,登录号为PRJNA954170。
1.6 数据统计与分析
试验数据采用SPSS 10.0软件进行t检验(t-test),P<0.05为差异显著,结果数据用“平均值±标准差”表示。
2 结果与分析
2.1 基础饲料发酵前后成分变化
由表2可知,基础饲料经过复合菌发酵剂发酵后,粗蛋白质、酸溶蛋白质、粗脂肪和粗纤维含量分别提高了8.49%、42.54%、3.71%和3.97%。发酵软颗粒饲料中乳酸菌、芽孢杆菌数和酵母菌数量分别为7.64×109、6.32×107和3.41×107CFU/g。
表2 基础饲料发酵前后成分变化(风干基础)
2.2 发酵软颗粒饲料对凡纳滨对虾生长性能的影响
由表3可知,试验组凡纳滨对虾WGR、SGR和SR均显著高于对照组(P<0.05),FCR显著低于对照组(P<0.05)。

表3 发酵软颗粒饲料对凡纳滨对虾生长性能的影响
2.3 发酵软颗粒饲料对凡纳滨对虾血清指标的影响
发酵软颗粒饲料对凡纳滨对虾血清非特异性免疫指标的影响如图1所示,试验组血清酸性磷酸酶和溶菌酶活性均显著高于对照组(P<0.05);血清碱性磷酸酶和酚氧化酶活性与对照组相比有所提升,但差异不显著(P>0.05)。发酵软颗粒饲料对凡纳滨对虾血清抗氧化指标的影响如图2所示,试验组血清丙二醛含量显著低于对照组(P<0.05);血清总超氧化物歧化酶活性高于对照组,但差异不显著(P>0.05)。

图1 发酵软颗粒饲料对凡纳滨对虾血清非特异性免疫指标的影响
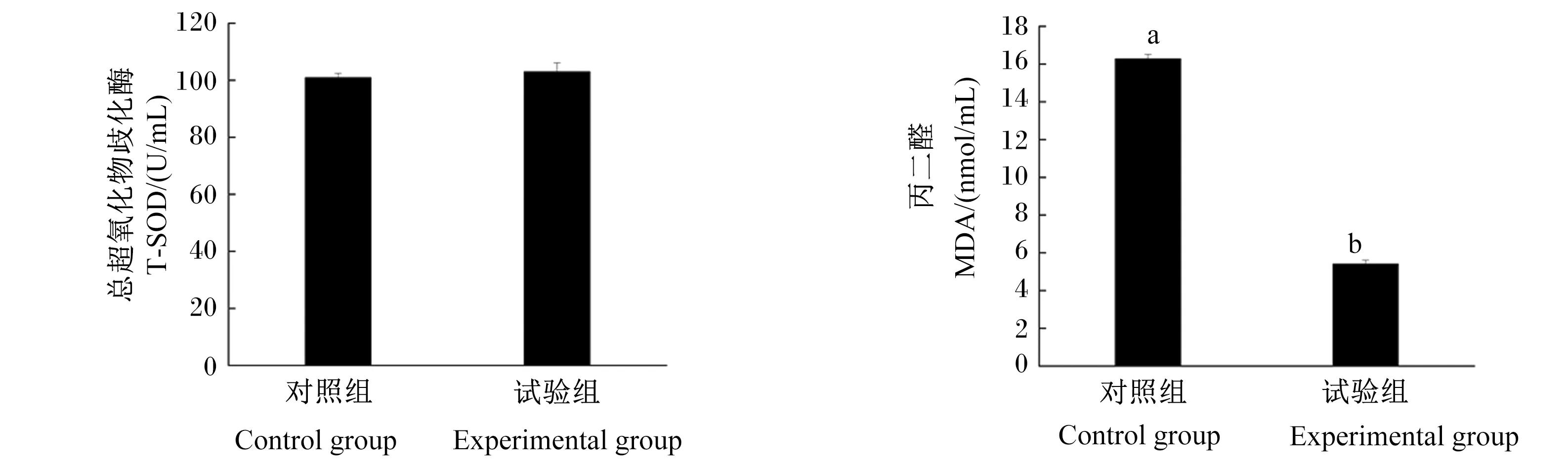
图2 发酵软颗粒饲料对凡纳滨对虾的血清抗氧化指标影响
2.4 发酵软颗粒饲料对凡纳滨对虾肝胰腺和肠道形态的影响
发酵软颗粒饲料对凡纳滨对虾肝胰腺形态的影响如图3所示,试验组肝小体排列紧密,肝小体之间基底膜完整,B细胞和R细胞数量较为丰富;而对照组肝小体排列松散,基底膜脱落,B细胞有损伤,R细胞和E细胞数量减少。发酵软颗粒饲料对凡纳滨对虾肠道形态的影响如图4所示,对照组肠上皮细胞与基底膜分离(箭头X),肠上皮细胞轻度损伤(箭头Z);试验组肠上皮细胞与基底膜紧密相连(箭头Y),肠道未见明显损伤;试验组肠道绒毛高度高于对照组,而肠肌厚度2组之间差异不明显。
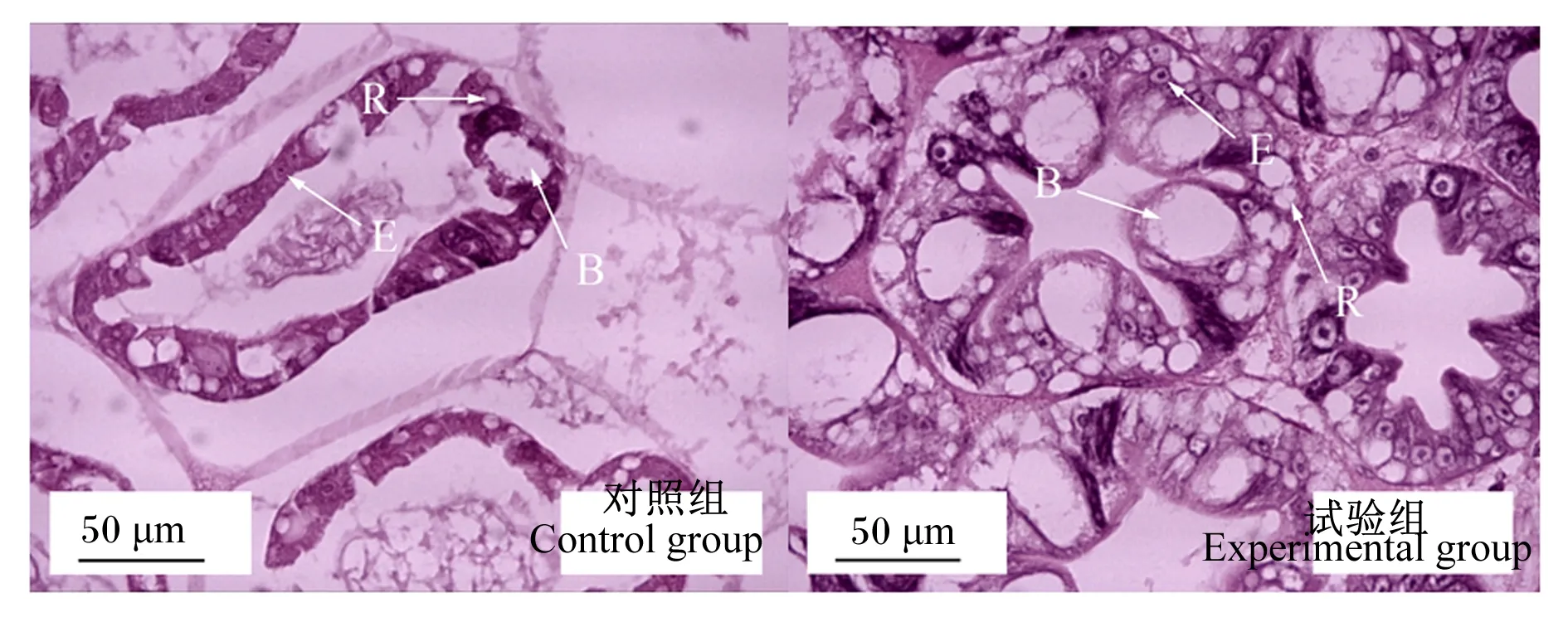
B:B细胞 B cell;E:E细胞 E cell;R:R细胞 R cell。
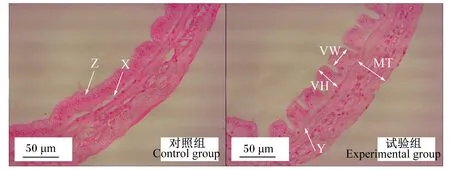
MT、VH和VW箭头分别代表肠肌厚度、绒毛高度和绒毛宽度。箭头X显示肠上皮细胞完全脱离基底膜,箭头Y显示肠上皮细胞与基底膜紧密结合,箭头Z显示肠上皮细胞轻度损伤。
2.5 发酵软颗粒饲料对凡纳滨对虾肠道菌群的影响
2.5.1 凡纳滨对虾肠道菌群alpha多样性分析
由表4可知,试验组凡纳滨对虾肠道菌群Sobs指数、Chao1指数和Ace指数与对照组相比有所降低,但差异不显著(P>0.05);肠道菌群Shannon指数和Simpson指数在2组之间亦无显著差异(P>0.05)。
2.5.2 凡纳滨对虾肠道菌群beta多样性分析
凡纳滨对虾肠道菌群主坐标分析(PCoA)如图5所示,试验组肠道样品点与对照组样品点距离较远,且各自形成明显的团簇,说明试验组与对照组的微生物群落有显著差异(P<0.05)。凡纳滨对虾肠道菌群非度量多维尺度(NMDS)分析如图6所示,结果与PCoA结果相一致。
2.5.3 凡纳滨对虾肠道菌群组成分析
凡纳滨对虾肠道菌群组成如图7所示。在门水平上,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)和放线菌门(Actinobacteriota)是对虾肠道中最主要的门,但各门相对丰度在2组间存在一定差异。与对照组相比,试验组变形菌门和拟杆菌门的相对丰度均有所提高(变形菌门的相对丰度从54.83%提高到65.60%,拟杆菌门的相对丰度从13.96%提高到21.39%),而厚壁菌门(Firmicutes)和疣微菌门(Verrucomicrobiota)的相对丰度有所降低(厚壁菌门的相对丰度从8.99%降低到2.67%,疣微菌门的相对丰度从8.22%降低到1.74%)。在属水平上,与对照组相比,试验组未分类_f_红杆菌科(unclassified_f_Rhodobacteraceae)、鲁杰氏菌属(Ruegeria)、噬冷菌属(Algoriphagus)、假交替单胞菌属(Pseudoalteromonas)、Nautella、Marinovum和发光杆菌属(Photobacterium)的相对丰度有所提高,Psedoruegeria、未分类_f_黄杆菌科(unclassified_f_Flavobacteriaceae)、脱甲基醌菌属(Demequina)、运动单胞菌属(Motilimonas)、玫瑰色小杆菌属(Roseibacillus)、未定级_f_丙酸杆菌科(norank_f_Propionibacteriaceae)、Haloferula、狭义梭菌属1(Clostridium_sensu_stricto_1)、未定级_f_红杆菌科(norank_f_Rhodobacteraceae)、芽孢杆菌属(Bacillus)和节旋藻属PCC-7345(Arthrospira_PCC-7345)相对丰度有所降低。

表4 凡纳滨对虾肠道菌群alpha多样性

图5 凡纳滨对虾肠道菌群主坐标分析

图6 凡纳滨对虾肠道菌群非度量多维尺度分析
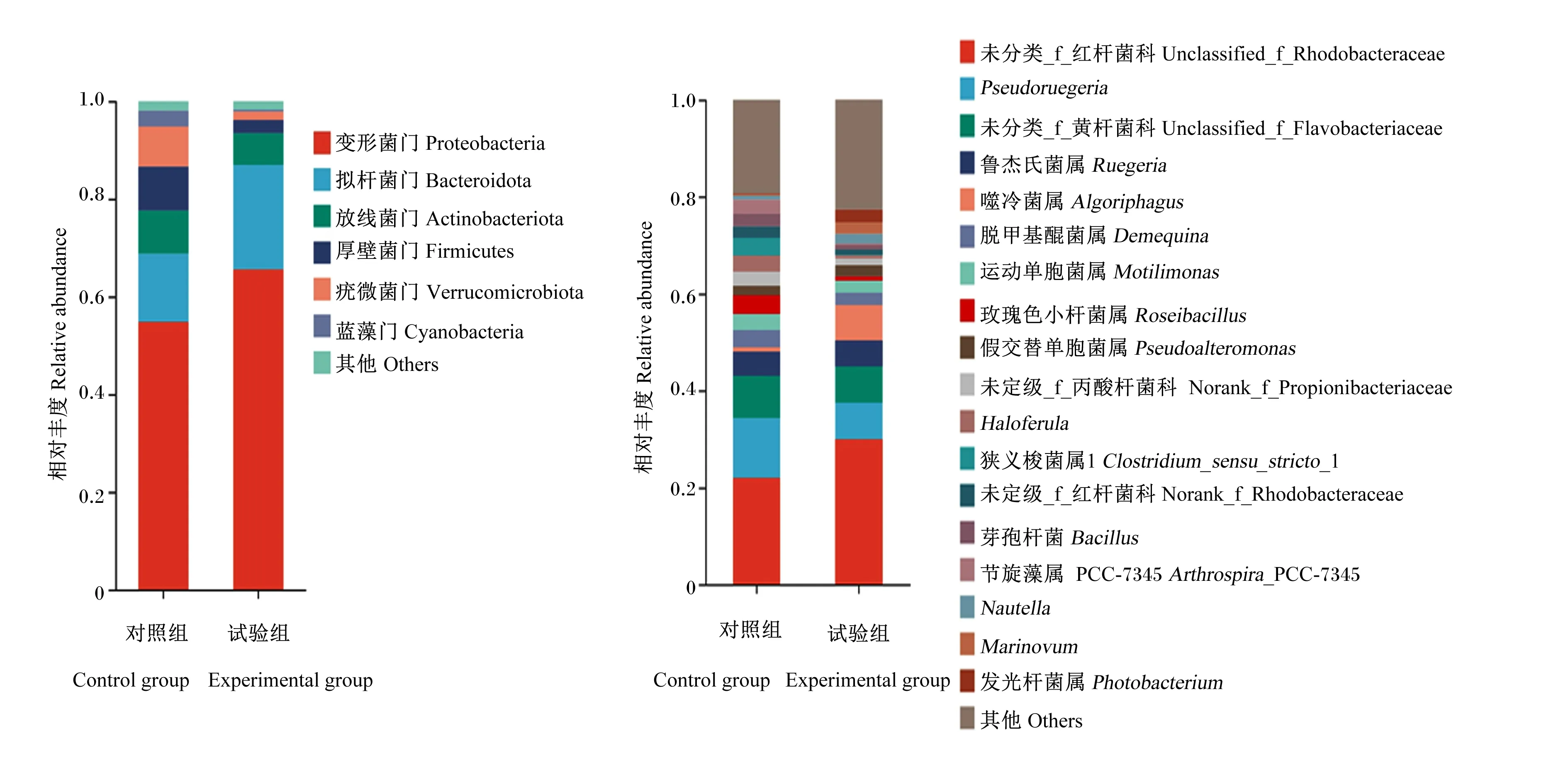
图7 凡纳滨对虾肠道菌群在门(左)和属(右)水平上的组成
3 讨 论
3.1 发酵软颗粒饲料对凡纳滨对虾生长性能的影响
本试验所用发酵软颗粒饲料主要是以乳酸菌、酵母菌和芽孢杆菌为主的复合功能性菌种对全价颗粒饲料进行发酵而得,兼具营养性和功能性双重功效。乳酸菌作为应用最为广泛的一种益生菌添加剂,无论是对人类的消化系统还是对动物胃肠道消化系统均有着积极的作用[12]。因此,微生物发酵饲料相比于普通饲料而言,不仅营养价值高,并且可以有效促进水产养殖动物对饲料的消化吸收,从而起到促进生长的作用。王军等[13]研究发现,在养殖过程中持续投喂适宜比例的发酵饲料,能显著促进凡纳滨对虾幼虾的生长,提高虾苗SR及饵料效率,且与对照组比较,试验组虾苗体色透明,摄食时间缩短;孟阳[14]研究发现,地衣芽孢杆菌(Bacilluslicheniformis)、产朊假丝酵母(Candidautilis)、植物乳杆菌发酵饲料能显著提高凡纳滨对虾的SR和SGR,且SR相较于对照饲料组提高了8.34%。本研究结果显示,发酵软颗粒饲料按5%比例替代基础饲料相比于直接投喂基础饲料而言,凡纳滨对虾的WGR、SGR和SR均显著提高,分别提高了30.10%、16.46%和5.12%,而FCR同对照组相比显著降低,降低了11.94%。这说明发酵软颗粒饲料相比于基础饲料而言,能促进凡纳滨对虾的生长。
3.2 饲喂发酵软颗粒饲料对凡纳滨对虾血清指标的影响
凡纳滨对虾作为一种无脊椎动物,其免疫系统不完善,主要依靠其有效的细胞和体液固有免疫反应来对抗传染源[15];其中,溶菌酶是对虾先天免疫系统中的重要防御物质,可通过溶解细胞壁来抵抗外界病原菌的入侵[16]。张盛静等[17]研究发现,凡纳滨对虾感染副溶血弧菌后,饲料中添加芽孢杆菌可提高溶菌酶的mRNA相对表达量。本试验中,投喂发酵软颗粒饲料可以显著提高凡纳滨对虾血清溶菌酶活性,这与他人关于在对虾上饲喂凝结芽孢杆菌(Bacilluscoagulans)、地衣芽孢杆菌+枯草芽孢杆菌、丁酸梭菌(Clostridiumbutyricum)和多黏类芽孢杆菌(Paenibacilluspolymyxa)等益生菌研究结果[18-20]一致。酸性磷酸酶和碱性磷酸酶是对虾抗疾病系统的重要组成部分[21]。酸性磷酸酶是溶酶体酶的关键成分,可抵御无脊椎动物的入侵生物体[22];碱性磷酸酶是一种参与免疫系统催化和代谢的金属酶[23]。研究表明,使用益生菌可以增强水产动物这2种酶的活性。Yi等[24]研究发现鲫鱼(Carassiusauratus)摄食添加了芽孢杆菌的饲料,其血清酸性磷酸酶和碱性磷酸酶活性均显著提高;Li等[25]研究发现,芽孢杆菌能显著提高凡纳滨对虾血清酸性磷酸酶活性。在本试验中,试验组凡纳滨对虾血清酸性磷酸酶和碱性磷酸酶活性均高于对照组,且血清酸性磷酸酶活性显著提高。
丙二醛是脂质过氧化分解代谢的产物,与机体自由基产生量成正比。当机体内存在的过量自由基不能被及时清除时,即可攻击细胞膜上的不饱和脂肪酸,导致细胞膜脂质过氧化、丙二醛含量增加,故丙二醛的含量常常可以反映出机体细胞受自由基攻击和脂质过氧化的程度,从而间接地反映出细胞损伤程度的严重性[26-27]。本试验中,与对照组相比,试验组凡纳滨对虾血清丙二醛含量显著降低,这说明发酵软颗粒饲料可降低对虾体内脂质过氧化物和氧自由基的积累,抵抗氧化损伤。超氧化物歧化酶是生物体内一种重要的抗氧化酶,可以将生物体内的超氧阴离子转变成过氧根离子,超氧化物歧化酶常与丙二醛一起作为评价动物机体抗氧化能力的重要指标[28]。研究表明,芽孢杆菌可以提高凡纳滨对虾和草鱼血清超氧化物歧化酶活性[29]。但在本试验中,试验组血清总超氧化物歧化酶活性相比于对照组有所提高,但差异不显著。以上结果表明,发酵软颗粒饲料可提高凡纳滨对虾的非特异免疫酶活性,进而达到增强对虾免疫力、维护机体健康生长状态的作用。
3.3 发酵软颗粒饲料对凡纳滨对虾肝胰腺和肠道形态的影响
肝胰腺是凡纳滨对虾体内重要的免疫器官[30],也是甲壳动物重要的消化器官,能分泌消化酶,促进消化吸收,储存营养物质,此外还兼具解毒功能[31]。E细胞为肝胰腺干细胞,可通过分裂和分化产生其他类型的肝细胞,从而补充一些退化损耗的细胞;R细胞的功能是吸收储存营养和参与脂蛋白的代谢;B细胞负责营养吸收,是消化酶合成的主要场所[32]。有研究表明,饲料中添加复合酶制剂和复合菌制剂时,凡纳滨对虾的肝小管排列整齐、紧密,B细胞和R细胞数量均较为丰富[33]。本研究结果显示,饲喂发酵软颗粒饲料与饲喂基础饲料的凡纳滨对虾相比,肝小体排列紧密,肝小体之间基底膜完整,B细胞、R细胞和E细胞数量均较为丰富,说明发酵软颗粒饲料有利于维持凡纳滨对虾的肝胰腺健康状态,改善其生长性能。
肠道不仅是对虾消化吸收营养物质的重要器官,还是病原菌入侵机体的门户,因此肠道的形态和结构与对虾的生长性能和健康水平密切相关[34]。研究表明,肠道微绒毛与肠道吸收面积密不可分,提高肠道微绒毛高度和密度可以使消化酶与食糜更充分地接触,增大营养物质运输面积,提高肠道对营养物质的吸收利用[35]。本研究结果显示,与饲喂基础饲料相比,饲喂发酵软颗粒饲料可明显提高凡纳滨对虾的肠绒毛高度,说明发酵软颗粒饲料可以促进对虾肠道对营养物质的吸收利用,进而维持肠道的发育和健康。
3.4 发酵软颗粒饲料对凡纳滨对虾肠道菌群的影响
肠道益生菌可通过促进机体对食物的消化吸收以及竞争性的抑制肠道有害微生物生长,进而维持机体肠道内生态平衡,促进机体健康生长[36]。本试验研究了发酵软颗粒饲料对凡纳滨对虾肠道菌群的影响,PCoA和NMDS分析结果显示,饲喂发酵软颗粒饲料的凡纳滨对虾与对照组相比,肠道微生物群落结构有明显的变化,说明发酵软颗粒可以调节凡纳滨对虾肠道菌群,改变肠道微生物组成。大量研究表明,变形菌门是对虾肠道中的主要优势菌门[37-38],该门的一些成员参与了氮循环和有机化合物的矿化过程[39-40]。在本研究中,凡纳滨对虾肠道变形菌门相对丰度最高,其次是拟杆菌门、放线菌门和厚壁菌门,这与Wang等[5]的研究结果一致。在属水平上,凡纳滨对虾肠道以未分类_f_红杆菌科、Psedoruegeria和未分类_f_黄杆菌科为主。红杆菌科细菌在健康对虾肠道中具有较高的相对丰度,是指示对虾健康的关键微生物类群,被认为是抗逆防病的益生菌资源[41]。研究表明,鲁杰氏菌属与对虾SR呈显著正相关[42]。黄杆菌科包括多种致病菌,可导致鱼和虾的腮部病变[43-44],对水产动物是有害的微生物类群。本研究发现,饲喂发酵软颗粒饲料的凡纳滨对虾肠道中未分类_f_红杆菌科和鲁杰氏菌属的相对丰度提高,未分类_f_黄杆菌科的相对丰度降低,这表明饲喂发酵软颗可使等对虾肠道菌群结构向有利于健康的方向调整,这一结果进一步证实了发酵软颗饲料对凡纳滨对虾健康的调节作用。
4 结 论
饲料中添加5%发酵软颗粒饲料可提高凡纳滨对虾WGR、SRG和SR,降低FCR,增强非特异性免疫力,改善肝胰腺健康,调节肠道菌群结构并改善肠道形态。
