母猪胎盘发育的营养调控
2023-11-10王新宇李延龙曾祥芳
黄 俊 王新宇 李延龙 曾祥芳
(中国农业大学动物科技学院,畜禽营养与饲养全国重点实验室,北京 100193)
胎盘发育及其功能的完整性是保障胎儿正常生长发育的前提条件,胎儿初生重受胎盘发育影响[1]。妊娠过程中,胎盘经历了新血管的快速形成时期。胎盘血管化不充分将导致胎盘功能受损,胎盘向胎儿输送的氧气及营养物质减少,导致宫内发育迟缓,胎儿初生重降低,甚至死胎[2]。研究发现,氨基酸、脂肪酸、维生素和微量元素等营养素均会影响胎盘的正常发育。因此,探索有效改善胎盘发育的营养方案,对改善窝产活仔数、初生重,以及提高断奶仔猪成活率具有重要意义。本文综述了几种主要营养物质(氨基酸、脂肪酸、维生素和矿物质)对母猪胎盘发育和功能的影响及其潜在调控机制,以期为提高母猪繁殖生产效率提供参考。
1 猪的胎盘发育
胎盘的英文字面意思是“生命之树”,它是一种高度精密的“多功能机器”:像肺一样进行氧气和二氧化碳交换;像消化系统,胎儿从母体吸收生长发育的所有营养物质;像肾脏可以排出胎儿的代谢产物;在机体内起免疫屏障作用,保护胎儿免受母体排斥;是造血干细胞的来源[3]。胎盘按形态和绒毛可分为:弥散型胎盘、子叶型胎盘、环带型胎盘和盘状胎盘;按有无蜕膜可分为:非蜕膜型胎盘和蜕膜型胎盘,其中猪属于非脱膜弥散型上皮绒毛膜胎盘[4]。妊娠过程中,猪胚胎附着在子宫腔上皮,胎盘绒毛与子宫连接不紧密[5]。
妊娠第20天至第60天之间猪胎盘生长迅速,而第70天(胎儿快速生长之前的一段时期)是猪胎盘发育鼎盛时期[2]。血管化程度是影响胎盘发育的重要因素,此过程需众多细胞、生物分子及信号通路的共同参与[6](表1)。胎盘内物质交换依赖于子宫和脐带的血液流动,而血流量在很大程度上又依赖于胎盘的血管化[7]。梅山猪窝产活仔数比美国或欧洲猪多3~5头,其胎盘血管化程度更高[8]。此外,胚胎滋养层细胞和子宫内膜上皮细胞是母猪胎盘形成的基础,它们受各种营养物质调控,营养水平不足或不平衡均会影响母胎的发育[9]。同一胎次的不同胎猪的胎盘大小、长度和表面积存在显著差异,导致仔猪初生重存在显著差异,与体重小的胎猪相比,体重大的胎猪对应的胎盘重量显著增加,提示胎盘的正常发育对于提高仔猪初生重具有重要意义[10]。
2 氨基酸对胎盘发育的影响及机制
氨基酸在胎盘发育过程中参与合成蛋白质以维持滋养外胚层和内皮细胞的增殖[1]。此外,氨基酸也是含氮化合物[如一氧化氮(NO)、多胺和谷胱甘肽]的前体物质,对胎盘生长、血管生成、胚胎发育或清除自由基以防止胎盘氧化损伤等各个方面至关重要[18]。目前,在胎盘发育营养调控方面,研究较为系统的几种氨基酸包括精氨酸、脯氨酸、支链氨基酸和蛋氨酸。
2.1 精氨酸
饲粮中添加精氨酸,可以促进母猪胎盘发育、改善其繁殖性能[19]。精氨酸调节胎盘发育的途径有2种(图1):1)在精氨酸酶作用下分解为鸟氨酸,在其脱羧酶(ornithine decarboxylase,ODC)催化下生成多胺[20]。多胺是猪胎盘生长和胚胎发育关键的活性物质[21]。值得注意的是,虽然精氨酸是合成多胺的常见底物,但妊娠期间机体会优先将精氨酸供应给胎猪,一般情况下,多胺通过脯氨酸途径生成[22];2)通过氧化途径,在四氢生物蝶呤4(tetrahydrobiopterin 4,BH4)的辅助下经一氧化氮合成酶(NOS)催化生成NO和瓜氨酸[23]。NO在猪胎盘发育过程中起重要作用:一方面,NO作为血管扩张因子和血管生成因子,促进胎盘血管生成;另一方面,NO通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路调节滋养层细胞增殖分化和凋亡,影响胎盘发育[24]。实际生产中,母猪限饲导致精氨酸摄入量不足,引发宫内发育迟缓(IUGR)[25]。所以妊娠不同时期补充适量精氨酸对预防妊娠并发症具有重要意义。试验证明,在妊娠第1~25天,添加0.8%的L-精氨酸可增加胎盘血管数量和直径[26];在妊娠第30~114天,添加0.4%的L-精氨酸可提高10%的总窝重[2]。此外,N-氨甲酰谷氨酸(NCG)能促进内源性精氨酸生成,它可以发挥精氨酸在猪胎盘内具有的生理功能[27]。NCG已被证明可通过调节靶向基因和代谢途径提高母猪繁殖性能[28]。试验表明,妊娠期饲粮中每天添加0.3~1.2 kg NCG,窝产仔数提高1头左右;妊娠后期饲粮中每天添加0.8~1.5 kg NCG,初生窝重提高1~3 kg[29]。
2.2 脯氨酸
脯氨酸属于亚氨基酸,具有促进蛋白质合成、调节基因表达、清除自由基和维持细胞内氧化还原状态等多种功能[30]。母猪妊娠第20~40天,胎盘脯氨酸浓度逐渐升高,妊娠第60天时,脯氨酸浓度升至最高,而此时正是胎盘生长发育最快的时期,提示脯氨酸对于胎盘发育的重要性[31]。脯氨酸在胎盘发育过程中的调控作用体现在:1)与精氨酸家族的氨基酸共同激活mTOR信号通路促进胎盘蛋白质合成及滋养层细胞生长,进而促进胎盘发育[32];2)增加胎盘迷宫区面积,构成更大的营养和氧气交换界面,提高母胎之间营养物质的交换效率[33];3)脯氨酸经鸟氨酸途径,在鸟氨酸脱羧酶和鸟氨酸转氨酶催化下生成多胺,间接调控胎盘发育[31]。在小鼠试验中,母体补充脯氨酸通过激活哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)以及抑制广义控制非拷贝性2-转化起始因子2α-激活转录因子4(general control non-derepressible 2-eukaryotic initiation factor 2 alpha-activating transcription factor 4,GCN2-eIF2α-ATF4)信号通路来调节胎盘血管发育及营养物质转运效率,进而提高小鼠的繁殖性能[33]。实际生产中,在妊娠前期母猪饲粮中添加1%的脯氨酸可显著提高其窝重[34]。以上研究表明,脯氨酸可协同其他营养物质通过不同途径调控母猪的胎盘发育。
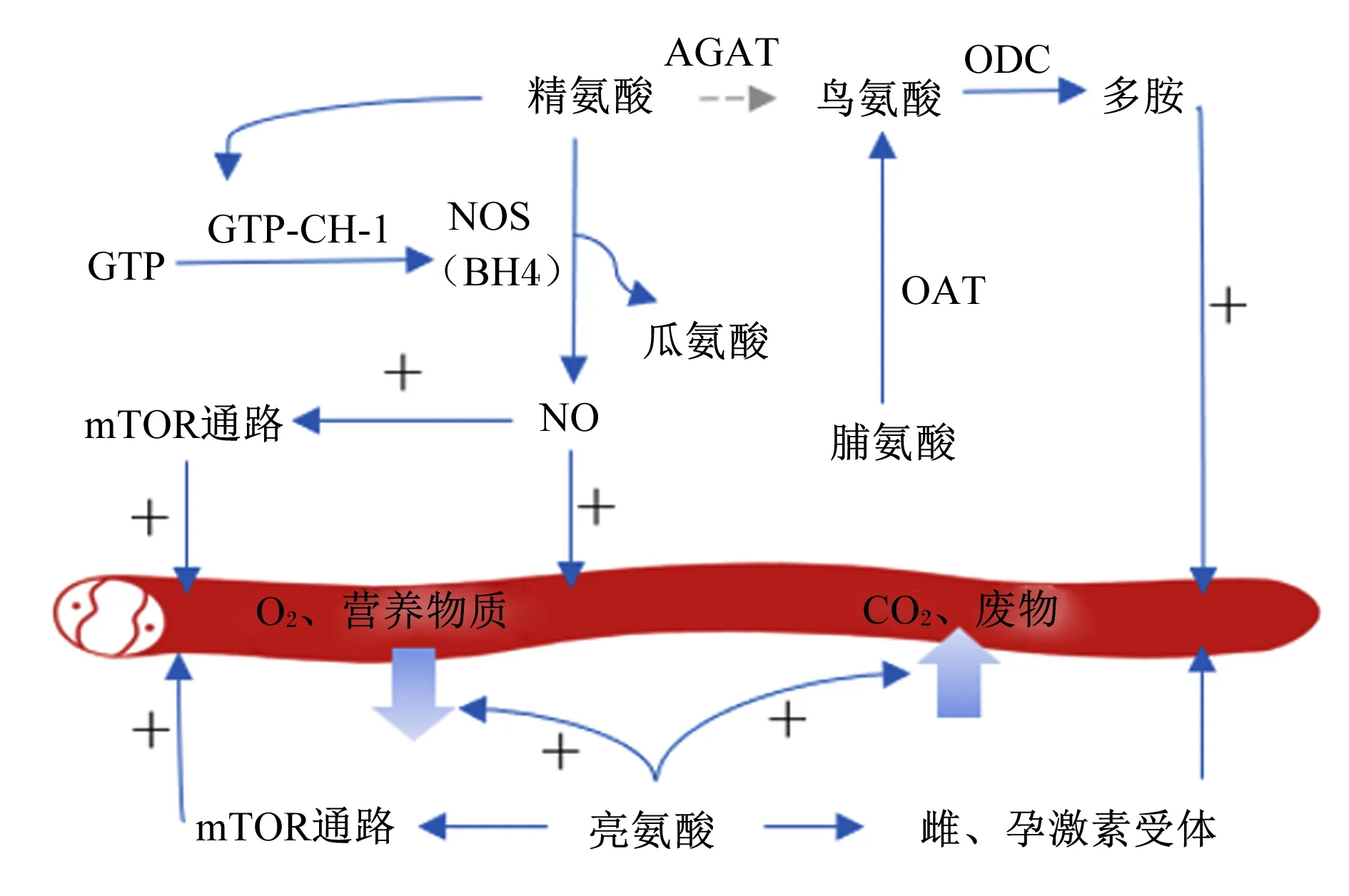
AGAT:精氨酸甘氨酸转氨酶 arginine glycine transaminase;mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;GTP:鸟苷三磷酸 guanosine triphosphate;GTP-CH-1:Ⅰ型三磷酸鸟苷环化水解酶 type Ⅰ guanosine triphosphate cyclohydrolase;BH4:四氢生物蝶呤tetrahydrobiopterin 4;NO:一氧化氮 nitric oxide;NOS:一氧化氮合酶 nitric oxide synthase;CO2:二氧化碳 carbon dioxide;O2:氧气 oxygen;ODC:鸟氨酸脱羧酶 ornithine decarboxylase;OAT:鸟氨酸转氨酶 ornithine transaminase;+:促进作用 promoting effect。
2.3 支链氨基酸(BCAAs)
BCAAs占大多数哺乳动物必需氨基酸的35%,因有1条支化侧链而得名[35]。BCAAs只能在细菌、真菌和植物中合成,其中缬氨酸和异亮氨酸由相同酶催化生成,亮氨酸由α-酮异戊酸酯转化生成[36]。亮氨酸在胎盘发育中发挥的作用体现在以下几个方面(图1):1)协同精氨酸激活mTOR通路促进胎盘血管生成;通过哺乳动物雷帕霉素靶蛋白激酶-核糖体蛋白S6激酶-核糖体蛋白S6-翻译起始因子4E结合蛋白1(mTOR-RPS6K-RPS6-EIF4EBP1)信号转导途径刺激猪滋养外胚层细胞增殖[37];2)为胎盘转运蛋白的合成提供能量,增强其转运功能[38];3)激活磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白激酶(phosphoinositide 3-kinase/protein kinase B/mammalian target of rapamycin,P13K/Akt/mTOR)信号通路调节母猪胎盘代谢,并促进母胎之间氨基酸、葡萄糖和脂肪酸的运输[39];4)调控子宫雌激素和孕激素受体的表达,提高子宫对激素的应答能力,间接调控胎盘血管的生成[40]。实际生产中,因为亮氨酸不能在母猪体内合成以及亮氨酸在胎盘发育中发挥重要作用,需要在饲粮中额外添加亮氨酸以满足母体需要。研究表明,妊娠后期添加0.8%亮氨酸可以显著提高仔猪的初生重[41]。虽然亮氨酸在胎盘发育方面的作用已得到广泛研究,但有关异亮氨酸和缬氨酸的报道较少,需要更多的研究来揭示它们对猪胎盘发育的影响。
2.4 蛋氨酸
作为猪的第二限制性氨基酸,蛋氨酸在胎盘发育期间承载着“生命性氨基酸”的作用[42]。胎盘形成早期,蛋氨酸通过调控DNA损伤诱导转录因子3(DNA damage-inducible transcript 3,DDIT3),增强胱硫醚β合成酶(cystathionine beta-synthase,CBS)和蛋氨酸腺苷转移酶2A(methionine adenosyltransferase 2A,MAT2A)的表达,激活甲硫氨酸合成酶相关调节因子/哺乳动物雷帕霉素靶蛋白复合物1/核糖体蛋白S6激酶1/胞嘧啶核苷酸二磷酸酶(SAMTOR/mTORC1/S6K1/CAD)通路,促进pTr细胞的DNA合成效率和增殖,间接调控胎盘发育[43]。除此之外,通过转甲基和再甲基作用,蛋氨酸生成S-腺苷蛋氨酸(SAM)、S-腺苷高半胱氨酸(SAH)和同型半胱氨酸(Hcy)[44]。SAM除了可以提供甲基还可以合成多胺,提高胚胎植入率,进而促进胎盘的形成[45]。但也有研究发现,妊娠期间蛋氨酸过量易造成Hcy累积,引起胎盘细胞内SAH积累,导致SAM/SAH的比例下降,降低细胞甲基化水平,干扰细胞功能并阻碍细胞生长[46]。蛋氨酸还是谷胱甘肽(GSH)的前体物,GSH可减少胎盘内氧化应激损伤,维持胎盘内环境稳定[44]。实际生产中,母猪妊娠早期饲喂蛋氨酸水平为0.38%的饲粮可提高母猪窝产仔数2.29头和窝产活仔数1.62头[47-48]。目前,工业合成且被广泛使用的蛋氨酸有多种,然而不同形式的蛋氨酸产品在肠道吸收、细胞代谢、生理功能和对猪生产性能的影响等方面存在一定差异[49],需要进一步研究来探索不同产品之间猪蛋氨酸营养价值的差异。
3 脂肪酸对胎盘发育的影响及机制
脂肪酸种类丰富,根据碳链长短分为短、中和长链脂肪酸;根据饱和度分为饱和、单不饱和及多不饱和脂肪酸;根据距羰基端最近双键位置分为n-3、n-6及n-9脂肪酸[50]。一方面,脂肪酸可以通过氧化提供能量;另一方面,脂肪酸通过膜受体和核受体发挥信号传导功能,调节机体多种生理反应[51-53]。
3.1 脂肪酸调控胎盘发育的机制及应用
在调控猪胎盘发育方面,短链脂肪酸通过NO途径提高促血管生成素-2(Ang-2)的合成,进而促进小鼠胎盘血管的发育[54]。通过对滋养层细胞基质管形成(作为血管生成的衡量标准)的探究,发现二十二碳六烯酸(DHA)通过刺激血管内皮细胞生长因子(VEGF)的mRNA表达和蛋白质分泌显著促进了血管的形成,与DHA不同的是花生四烯酸(ARA)、二十碳五烯酸(EPA)和油酸(OA)则通过刺激血管生成素4(angiopoietins 4,ANGPTL4)的表达和蛋白质的分泌促进血管的形成[55]。实际生产中,在母猪妊娠后期饲粮中添加亚油酸和α-亚麻酸可显著提高仔猪的断奶重和平均日增重[56]。n-6与n-3脂肪酸在妊娠母猪饲粮中的添加比例一直被关注,虽然最佳比例仍在讨论中,但已有研究发现低n-6∶n-3比例的饲粮可以提高仔猪初生重和断奶存活率[57]。值得注意的是,脂肪酸及其代谢物种类繁多,目前研究大多聚焦于单一脂肪酸对母猪繁殖性能的影响,但这并不能真正反映脂肪酸对整个胎盘发育过程的影响。下一步研究应更加关注脂肪酸种类的筛选,建立猪胎盘发育的理想脂肪酸模型。
3.2 脂肪酸调控胎盘发育的问题与展望
母猪妊娠期间背膘过厚会导致胎盘发生与肥胖相关的脂毒性,影响胎盘发育[58]。胎盘脂毒性表现在3个方面:1)导致活性氧(ROS)积累,进而引起胎盘氧化应激;2)通过激活Mark4和核因子-κB(NF-κB)信号通路以及抑制单磷酸腺苷活化的蛋白激酶(AMPK)信号通路破坏线粒体内核酸和蛋白质,导致胎盘内线粒体功能不全,阻碍胎盘正常发育[59];3)引起胎盘内促炎因子增加,进而激活p38线粒体蛋白激酶和信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)炎症通路,影响胎盘细胞功能[60]。综上所述,妊娠期合理的脂肪酸营养状态是母猪胎盘正常发育的前提。
近些年,结构脂在畜牧领域的应用越来越被重视。结构脂是通过人工方式合成的具有特定脂肪酸排列规律的甘油酯分子,其更加优化的分子结构既能发挥特定脂质的功能,又能避免普通脂类带来的负面影响,是一种为应用场景量身定做的脂质分子。未来可以利用酶法转化等技术设计一种或多种能有效调控猪胎盘发育并且可以避免发生脂毒性的结构脂。需要注意的是,在应用结构脂时需要进行充分的安全性评估,以确保其在畜牧业中的应用安全可靠。同时,需要更加重视与结构脂相关的研究,以便更好地利用这种脂质分子来提高母猪的繁殖性能。
4 维生素和矿物质对胎盘发育的影响及机制
维生素和矿物质在动物营养中具有重要作用,是生命活动所必需的微量营养素。不仅能够维持动物的生长和发育,还能够调节动物的代谢和免疫系统[61]。微量营养素在动物饲粮中的添加和营养调控中的应用非常重要,可以提高动物的生产性能和健康水平,同时减少养殖过程中的疾病和死亡率,为畜牧业的可持续发展做出重要贡献。
4.1 微量营养素调控胎盘发育的机制
研究发现,维生素C通过上调碱性-螺旋-环-螺旋(bHLH)转录因子Hand1的稳定性和蛋白水平,进而诱导滋养层干细胞(trophoblast stem cell,TSC)选择性分化为迷路层窦状巨细胞(sinosoidal trophoblast giant cell,S-TGC)。缺乏维生素C导致胎盘迷路层结构发生紊乱、母胎之间血管交汇不足,严重时导致妊娠失败[62]。缺乏维生素D除了影响胎盘的钙质转运,还通过激活Hippo-YAP信号通路抑制细胞生长,导致胎盘血管发育受损,进而诱发IUGR[63]。体内试验也证明,缺乏维生素D会影响胎盘血管发育,用缺乏维生素D的饲粮饲喂小鼠发现胎盘的血管直径显著减小[64]。目前,越来越多的研究以Hippo信号通路为靶点进行疾病的治疗[65-66],可以将此思路应用到改善猪胎盘发育上。α-生育酚可磷酸化为α-生育酚磷酸酯,通过促进VEGF的生成调控胎盘血管生长[67]。当敲除α-生育酚的转运蛋白后,迷路滋养层细胞明显减少,胎盘发育严重受损[68]。此外,叶酸在胎盘发育过程中扮演着重要角色。叶酸通过调控VEGF及其受体Flt1的表达,增加胎盘血管密度,促进胎盘发育[69]。同时,叶酸还可以促进绒毛外滋养层(extravilloustrophoblast,EVT)对子宫内膜的侵入,从而预防因EVT侵袭不足而导致的妊娠障碍[70]。矿物质元素在胎盘发育过程中同样发挥重要生理功能:钙是胎盘内许多酶的激活剂;磷是遗传物质的组成成分、构成ATP参与能量代谢、生物膜不可缺少的成分;钠、钾和氯共同维持体液的平衡;铁参与构成多种酶并促进胎盘血管的生成;硒发挥抗氧化作用,保证细胞功能正常运行等[71-72]。妊娠期间微量营养素无论缺乏还是过量,均会对胎盘发育产生不利影响,合理配比才是胎盘正常发育的保障[73]。
4.2 微量营养素调控胎盘发育的应用及展望
实际生产中,饲喂高锌饲粮能提高母猪的免疫力和抗氧化能力,从而提高分娩期和断奶前仔猪的存活率[74]。补充铁制剂可以增强母猪胎盘的抗氧化能力,预防仔猪缺铁性贫血[75]。此外,有机硒的添加能提高母猪的繁殖性能、产仔数、仔猪初生重、断奶重和初乳质量[76]。与无机微量元素相比,有机微量元素对母猪的繁殖性能提升更为明显[77]。近些年,随着产仔数提高,母猪对微量营养素需要量也随之升高,需要根据不同妊娠阶段和胎次调整饲粮中微量营养素的含量,以满足母胎的营养需求[78]。目前,大多研究仍集中在基础研究层面,尚未形成实用化的技术。未来的研究应该注重以下方面:首先,深入探索维生素和矿物质对母猪繁殖性能的细胞和分子机制,进一步深入理解其调控母猪胎盘发育的机理。其次,应该开发新型针对母猪繁殖性能的维生素和矿物质营养素产品,并建立相应的营养指南,以实现精准的繁殖性能调控。此外,需要建立更完整的营养调控体系,深入探究维生素和矿物质营养素与其他营养素之间的相互作用,以及与遗传、环境等因素的交互作用。
5 小结与展望
综上所述,把握妊娠过程中母猪胎盘发育的营养调控机制,对促进其正常发育具有重要意义。本文总结了几种主要营养物质(氨基酸、脂肪酸、维生素和矿物质)对母猪胎盘发育和功能的影响及机制,为充分发挥母猪繁殖潜能提供营养调控策略。但还存在许多问题有待解决,如氨基酸之间适宜的组合和比例、不同营养物质之间的相互作用以及其他种类的营养素对胎盘发育的影响仍未明确;胎盘的脂毒性危害尚未完全解决;微量营养素的需要量还未及时更新等。随着集约化精准饲养的不断推进,建立利于猪胎盘发育的理想氨基酸和脂肪酸模型将会进一步优化饲料配方。随着多组学等技术的发展,有望更好地了解母猪胎盘营养调控机制的分子基础及解决营养调控剂量和配比的问题。此外,应用生物技术和基因编辑技术等手段,也有望开发出更加高效、精准的营养调控策略,进一步提高母猪的繁殖性能和生产效益。
