二氢槲皮素对大肠杆菌的抑菌作用机理
2023-11-08王梦亮
蔡 瑾,闫 然,王梦亮,王 琪
(1.山西大学应用化学研究所,山西 太原 030006;2.山西大学中医药现代研究中心,山西 太原 030006;3.山西大学 化学生物学与分子工程教育部重点实验室,山西 太原 030006;4.山西大学生命科学学院,山西 太原 030006)
食品工业是国民经济的重要组成部分。随着我国经济的发展,食品的质量和安全问题愈发引起人们的关注,其中由大肠杆菌等食源性病菌导致的食品安全问题尤为突出。食用被大肠杆菌污染的食物往往会造成伤害,如群发性腹泻、呕吐等[1]。食品中添加防腐剂可以抑制食物源病菌的增长,有效避免食物源病菌对人体造成的危害[2]。食品防腐剂主要分为两类,即化学防腐剂和天然防腐剂[3]。化学防腐剂是在食品中使用最广泛的一类防腐剂,但其具有一定的致畸性、致癌性,残存在食品中也会对环境产生影响[4-5];天然防腐剂是从植物、动物和微生物中获得的具有抗菌和防腐活性的物质,安全性高且对环境友好[6]。天然植物防腐剂的主要成分种类繁多、绿色健康且具有良好抗菌性能,可从植物的根、茎、叶等处提取得到[7]。植物源食品防腐剂符合现代社会对绿色健康消费新趋势的追求[8]。
二氢槲皮素(dihydroquercetin,DHQ),也称黄杉素、紫杉叶素、花旗松素,是一种从植物中提取出的二氢黄酮醇类化合物,广泛存在于松科、蔷薇科等植物中[9-10]。有多项研究表明DHQ具有抑菌活性[11-13],在食品工业领域可作为食品防腐剂[14-16]。但是目前鲜见DHQ抑菌机理相关研究的报道,因此本研究测定了DHQ对常见食源性病菌的抑制活性,在确定大肠杆菌作为指示菌的基础上,观察大肠杆菌被DHQ作用后的形态变化,检测其胞内活性氧(reactive oxygen species,ROS)水平、细胞受损伤程度、膜电位变化、胞内Ca2+含量以及细胞周期变化,进而分析大肠杆菌受DHQ抑制的机理。
1 材料与方法
1.1 菌株、材料与试剂
革兰氏阳性菌:金黄色葡萄球菌(Staphylococcus aureus、ATCC 25923)、枯草芽孢杆菌(Bacillus subtilis、ATCC 6633)。革兰氏阴性菌:大肠杆菌(Escherichia coli、ATCC 25922)、普通变形杆菌(Proteus vulgaris、ATCC 13315)、产气肠杆菌(Enterobacter aerogenes、ATCC 13048)。酵母菌:热带假丝酵母菌(Candida tropicalis、ATCC 750)。所有菌种均保藏于山西大学微生物学实验室。
供试培养基:细菌培养基(营养琼脂(nutrient agar,NA)培养基、营养琼脂肉汤(nutrient broth,NB)培养基);酵母菌培养基(酵母甘露醇琼脂(yeast mannitol agar,YMA)培养基、酵母甘露醇肉汤(yeast mannitol broth,YMB)培养基)。
戊二醛、罗丹明123(rhodamine 123,RH-123)、醋酸铀、柠檬酸铅 德国Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO)天津市大茂化学制剂厂;2’,7’-二氯荧光素二乙酸酯荧光探针(2’,7’-dichloro dihydrofluorescein diacetate,DCFH-DA)南京建成生物工程研究所;膜联蛋白V-异硫氰酸荧光素/碘化丙啶(annexin V-fluorescein isothiocyanate isomer/propidium iodide,Annexin V-FITC/PI)试剂盒 苏州宇恒生物科技有限公司;钙荧光探针(fluo-4 acetoxymethyl ester,Fluo-4 AM)美国Invitrogen公司;碘化丙啶/核糖核酸酶(propidium iodide/ribonuclease,PI/RNase)染色缓冲液 美国Becton dickinson公司。
1.2 仪器与设备
FACS Calibur流式细胞仪 美国Becton dickinson公司;JSM-35C扫描电子显微镜(scanning electron microscope,SEM)、JEM-1011透射电子显微镜(transmission electron microscope,TEM)日本JEOL公司。
1.3 方法
1.3.1 菌株培养
在NB培养基中接种金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、普通变形杆菌、产气肠杆菌,摇床培养(160 r/min、37 ℃、12 h);将热带假丝酵母菌接种在YMB培养基上,摇床培养(160 r/min、25 ℃、12 h)。
1.3.2 抑菌活性检测和最低抑菌浓度测定
DHQ对上述6 种食源性细菌的抑制活性通过琼脂板打孔法测定[17]。用20%(体积分数,下同)DMSO助溶DHQ,加入到无菌水中,使DHQ的质量浓度达到8 mg/mL。将1.3.1节的菌液用生理盐水稀释至108CFU/mL。在相应的固体培养基上均匀涂布各受试菌液200 µL,用10 mm打孔器在培养基上对称打两个孔。在一个孔中加入上述质量浓度为8 mg/mL的DHQ溶液200 µL,另一个孔加入200 µL的20% DMSO作为阴性对照。5 种细菌培养条件为37 ℃、24 h,热带假丝酵母菌培养条件为25 ℃、48 h,培养后测量抑菌圈直径。
DHQ对上述6 种食源性致病菌的最低抑菌浓度(minimum inhibitory concentration,MIC)使用96 孔板测定[18]。用含7% DMSO液体培养基溶解DHQ,利用二倍稀释法,使DHQ质量浓度范围达到20~0.02 mg/mL。在96 孔板的各孔中加入200 µL含上述不同质量浓度的DHQ液体培养基和5 µL(108CFU/mL)的菌液。阴性对照为只含7% DMSO液体培养基和5 µL菌液,不加DHQ样品。5 种细菌的培养条件为37 ℃、24 h,热带假丝酵母菌的培养条件为25 ℃、48 h。培养后用肉眼观察孔中菌液的浊度,选定使菌液澄清透明的最低DHQ质量浓度为MIC。
根据抑菌活性和MIC实验的结果,确定下一步实验的指示菌。
1.3.3 SEM和TEM观察
使用SEM和TEM来观察大肠杆菌被DHQ抑制后的外部形态及内部结构变化。将DHQ溶解于含0.8% DMSO液体培养基中,使DHQ的最终质量浓度达到1/2 MIC、MIC和2 MIC,并以仅含0.8% DMSO的液体培养基作为阴性对照。吸取100 µL的1.3.1节培养的大肠杆菌菌液(108CFU/mL)加入到100 mL上述液体培养基中,摇床培养(120 r/min、37 ℃、12 h)。样品8 000 r/min离心5 min后,弃去上清液,用2.5%戊二醛在4 ℃下固定过夜,然后用1% OsO4固定3 h。
SEM观察:固定的样品依次用体积分数30%、50%、70%和100%乙醇溶液做脱水处理20 min。处理后的样品在-80 ℃下冷冻干燥,离子喷金,用SEM观察细胞表面形态。
TEM观察:用Epon 618渗透包埋固定后的样品,进行切片处理。用醋酸铀和柠檬酸铅将切片进行双染色,两种染色剂各染15~30 min,用TEM观察菌体内部结构变化。
1.3.4 胞内ROS水平检测
根据1.3.3节方法培养菌液,在2 000 r/min下离心10 min,收集菌体,用磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L,pH 7.2~7.4,下同)洗两次后,悬浮在20 μmol/L DCFH-DA溶液中,避光孵育(37 ℃、20 min)。3 000 r/min离心5 min收集菌体,PBS洗涤两次后重悬,在激发波长488 nm及发射波长535 nm的条件下使用流式细胞仪测定其ROS水平。
1.3.5 Annexin V-FITC/PI检测
根据1.3.3节方法培养菌液,在2 000 r/min离心10 min,收集菌体并重新悬浮在PBS中。根据Annexin V-FITC/PI试剂盒说明书所述方法处理重悬液,避光孵育(37 ℃、20 min),在3 000 r/min下离心5 min,收集菌体,PBS洗涤两次后重悬,使用流式细胞仪在激发波长488 nm及发射波长530 nm的条件下测定细胞受损程度。
1.3.6 细胞膜电位检测
按1.3.5节方法得到PBS重悬后的菌液,加入RH-123使染液浓度达到20 μmol/L,避光孵育(37 ℃、20 min),3 000 r/min离心5 min,收集菌体,用PBS洗两次后重新悬浮,使用流式细胞仪在激发波长507 nm,发射波长529 nm的条件下测定样品的膜电位。
1.3.7 胞内Ca2+含量测定
按1.3.5节方法得到PBS重悬后的菌液,加入Fluo-4 AM使染料终浓度达到4 μmol/L,避光孵育(37 ℃、30 min),3 000 r/min下离心5 min,收集菌体,用PBS洗两次后重新悬浮,细胞内Ca2+含量使用流式细胞仪在激发波长490 nm、发射波长520 nm的条件下测定。
1.3.8 细胞周期分析
按1.3.3节方法培养得到菌液,2 000 r/min离心10 min,收集菌体,PBS洗涤两次后在4 ℃下用体积分数75%乙醇溶液固定过夜后,3 000 r/min离心5 min,将菌体重悬于质量浓度为50 μg/mL的含有RNase的PI缓冲液,避光孵育30 min,在激发波长488 nm及发射波长530 nm的条件下使用流式细胞仪测定样品细胞周期。
1.4 数据处理与分析
所有上述实验都平行进行3 次。用SPSS软件对数据进行方差分析(ANOVA)或t检验。图中数据表示为平均值±标准差。使用Origin 2018软件作图。
2 结果与分析
2.1 DHQ对6 种食源性病菌的抑菌活性
对各供试菌的实验组及阴性对照组两者之间的抑菌圈直径进行t检验,图1结果表明DHQ对6 种食源性病菌的抑菌圈直径均在10 mm以上,均显著大于阴性对照的抑菌圈直径(P<0.05),即DHQ对6 种食源性病菌均有显著的抑制效果(P<0.05)。经ANOVA分析确定DHQ对6 种食源性病菌抑制作用强弱差异,结果表明DHQ对大肠杆菌有最佳的抑制作用(21.13 mm)(P<0.05),对普通变形杆菌和热带假丝酵母菌的抑制作用次之(18.88、18.40 mm),对枯草芽孢杆菌以及产气肠杆菌的抑制作用较弱(14.67、13.90 mm),抑制金黄色葡萄球菌的作用最弱(12.35 mm)。

图1 DHQ对食源性致病菌的抑制活性Fig.1 Antimicrobial activities of DHQ against foodborne pathogens
美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute/National Committee for Clinical Laboratory Standards,CLSI/NCCLS)[19]规定,可以在不搅拌的情况下用肉眼观察并判断MIC,将抑制程度划分为5 个等级:0级,肉眼未见生长或观察澄清(100%抑制);1级,肉眼可见轻微模糊(80%抑制);2级,浊度明显降低(50%抑制);3级,浊度轻微降低(轻微抑制);4级,浊度未降低(无抑制)。如表1所示,当DHQ对金黄色葡萄球菌和产气肠杆菌的处理质量浓度为0.02~1.25 mg/mL时,培养基呈现不同程度的浑浊现象;当处理质量浓度为2.5~20 mg/mL时,培养基清澈,没有病菌生长,因此质量浓度2.5 mg/mL被确定为DHQ对金黄色葡萄球菌和产气肠杆菌的MIC。当DHQ以0.020~0.625 mg/mL的质量浓度处理枯草芽孢杆菌、普通变形杆菌和热带假丝酵母菌时,培养基表现出不同的浑浊度;当处理质量浓度为1.25~20.00 mg/mL时,培养基是清澈的,确定DHQ对枯草芽孢杆菌、普通变形杆菌和热带假丝酵母菌的MIC为1.25 mg/mL。当DHQ对大肠杆菌的处理质量浓度为0.020~0.313 mg/mL时,培养基出现浑浊现象;当处理质量浓度为0.625~20.000 mg/mL时,没有病菌生长,确定0.625 mg/mL为DHQ对大肠杆菌的MIC。
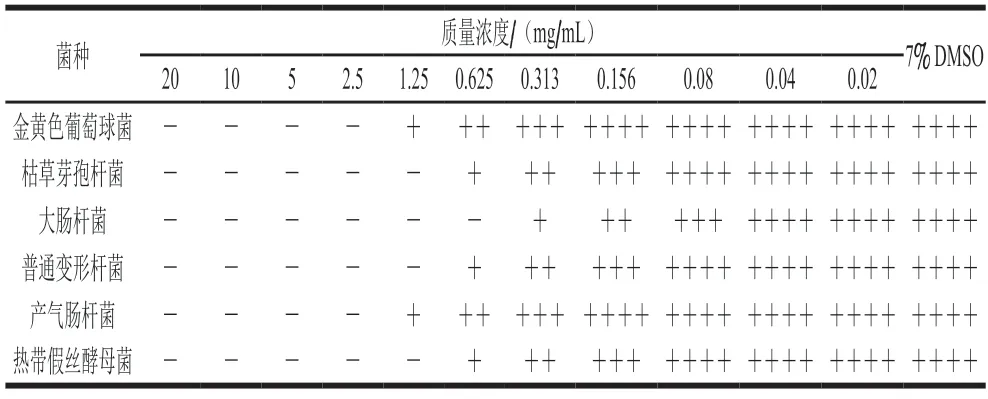
表1 DHQ对食源性致病菌的MICTable 1 Minimum inhibitory concentration of DHQ against foodborne pathogens
结合抑菌圈直径和MIC检测结果,可以看出DHQ对大肠杆菌具有最强的抑制活性,因此选择大肠杆菌作为进一步研究DHQ抑菌机理的指示菌。
2.2 DHQ对大肠杆菌细胞形态及结构的影响
SEM和TEM的结果能够直观地反映大肠杆菌被DHQ破坏的情况(图2)。对照组中大肠杆菌细胞表面光滑,呈现出规则的杆状结构(图2A-1、图2E-8)。经DHQ处理后,大肠杆菌的形态与对照组相比有明显不同(图2B~D、F~H)。图2B、F为由1/2 MIC的DHQ处理的大肠杆菌,虽然有些菌体细胞形态完好,但已经开始出现溶胀聚集现象(图2B-2),内容物溢出形成了空洞(图2F-9、10),有些细胞出现轻微的质壁分离现象(图2F-11)。经质量浓度为MIC的DHQ处理(图2C、G)后,细胞出现折叠黏连现象(图2C-3、4、5),亦有空泡结构(图2G-12),质壁分离明显(图2G-13)。大肠杆菌被2 MIC的DHQ处理后,亦有折叠现象(图2D-6),菌体结构出现明显的变形(图2H-14、15)、破裂(图2H-16)、降解(图2D-7)。DHQ的化学名为3,5,7,3’,4’-五羟基-2,3双氢黄酮醇,具有黄酮类化合物的基本结构。DHQ的多羟基位于其结构内部斥电子的大P-π共轭体系中,羟基中的氢原子容易脱离。因此,推测DHQ作用大肠杆菌后,羟基中的氢原子可能与细胞膜中的磷脂分子以氢键的形式相结合,使得膜结构变得疏松[20-21],导致膜通透性增加,出现菌体肿胀、质壁分离等现象。当DHQ的质量浓度进一步增加,菌体结构变形,并出现黏连破裂等现象。
2.3 DHQ对大肠杆菌细胞内ROS水平的影响
ROS是生物细胞在代谢过程中产生的一种有氧代谢物,它能维持细胞内氧化还原平衡,与细胞的生长和死亡密切相关[22],ROS水平失衡将会引发细胞的一系列功能障碍。DCFH-DA自身不会发出荧光,能够自由进出细胞,并能在细胞内被水解为DCFH,DCFH不能穿透细胞膜,使探针更易在细胞内被装载。无荧光的DCFH能够被ROS氧化为有荧光的DCF,因此细胞内的ROS水平可以通过DCF的荧光强度反映。
由图3可知,与对照组荧光强度(36.65)相比,DHQ处理组的荧光强度分别增加到了41.14(1/2 MIC)、56.99(MIC)以及65.94(2 MIC)。经DHQ处理的大肠杆菌细胞的荧光强度显著高于阴性对照的荧光强度(P<0.05)。ROS主要通过氧化呼吸链产生和累积。细菌的呼吸作用主要由细胞膜上相关的酶催化反应进行,因此细胞膜是细菌产生ROS的主要位点。经DHQ处理后,DCFH-DA探针的荧光强度显著增强,推测DHQ可以刺激胞内的ROS过度产生。细胞膜中的脂质会因为过多的ROS而过氧化,导致细胞膜的流动性降低[23-25]。


图3 不同质量浓度DHQ作用下大肠杆菌胞内ROS水平Fig.3 Intracellular ROS levels of Escherichia coli under different mass concentrations of DHQ
2.4 DHQ对大肠杆菌细胞膜通透性和完整性的影响
磷脂酰丝氨酸(phosphatidylserine,PS)通常位于细胞膜的内侧,并会在细胞受损的早期阶段从细胞膜的内侧向外侧移动;Annexin V是一种磷脂结合蛋白,具有与PS特异性结合的高亲和力。Annexin V被FITC荧光素标记后可以作为荧光探针,用于定量检测PS从内侧向外侧的转移,可在流式细胞仪中检测细胞受损的进展情况[26]。PI是一种核酸染料,在细胞膜的完整性受到破坏后会将核酸染成红色[27]。因此,以Annexin V-FITC/PI染色后可以通过流式细胞仪检测出大肠杆菌活细胞、受伤细胞和死亡细胞。AnnexinV-FITC/PI双标记图显示4 种不同状态的细胞,左下(LL)、右下(LR)、右上(UR)、左上(UL)分别表示活细胞、受伤细胞、死细胞、坏死细胞与碎片[28]。
结合图4A~D可以看出,大肠杆菌在LL区的占比随着DHQ质量浓度的增加而逐渐减少,而LR区域大肠杆菌的占比增加。从图4E、F可以看出,与阴性对照相比,MIC和2 MIC DHQ处理后,正常的大肠杆菌占比显著下降(P<0.05),受损细胞占比显著上升(P<0.05)。由此推测,DHQ的处理可以使大肠杆菌细胞膜的通透性增加,完整性被破坏,从而影响细胞的正常生理活动,使活细胞减少。

图4 不同质量浓度DHQ作用下大肠杆菌细胞膜的通透性Fig.4 Evaluation of cell membrane permeability of Escherichia coli under different mass concentrations of DHQ
2.5 DHQ对大肠杆菌细胞膜电位的影响
膜电位是由细胞膜内外电势差产生的,反映了菌体新陈代谢。因此,细胞膜电位是细胞的一种功能性参数,在细菌代谢活动中起着重要作用,可反映细胞膜的完整性和菌体生理状态[29]。RH-123是一种阳离子亲脂性荧光物质,可以通过跨膜电位进入细胞,其荧光强度通过流式细胞仪检测后可反映膜电位的变化[30]。如图5所示,阴性对照表现出较强的荧光强度,为68.97,随着DHQ质量浓度的增加,荧光强度逐渐降低,1/2 MIC、MIC、2 MIC DHQ处理后的大肠杆菌荧光强度分别为43.38、35.07、34.69。与阴性对照相比,DHQ处理后的大肠杆菌细胞荧光强度显著降低(P<0.05)。以上结果表明,RH-123进入细胞内的动力减弱,即细胞膜内外电势差减少,由此可以推测出DHQ会引起大肠杆菌细胞膜去极化,使膜电位降低,进一步造成胞内离子紊乱,细胞的正常生理功能受到损伤。

图5 不同质量浓度DHQ作用下大肠杆菌细胞膜电位水平Fig.5 Cell membrane potential levels of Escherichia coli under different mass concentrations of DHQ
2.6 DHQ对大肠杆菌细胞内Ca2+含量的影响
胞内Ca2+是一种调节细胞功能的重要因子,可以作为第二信使广泛参与细胞运动、代谢等多种功能活动,还参与维持细胞跨膜运输[31]。如图6所示,与对照组的荧光强度(44.31)相比,DHQ处理组的荧光强度减少到了33.13(1/2 MIC)、29.82(MIC)以及28.33(2 MIC)。大肠杆菌被DHQ处理后的荧光强度与阴性对照相比显著降低(P<0.05)。在正常细胞中,胞内Ca2+的含量处在稳定水平,当细胞膜通透性受损后,会导致Ca2+的外漏。因此,胞内Ca2+含量的变化可以反映出细胞膜通透性的变化。以上结果表明DHQ处理后的大肠杆菌胞内Ca2+含量减少,推测DHQ可导致细胞膜损伤、Ca2+外漏,并直接影响到由Ca2+所参与的菌体的正常生长代谢和功能活动。

2.7 DHQ对大肠杆菌细胞周期的影响
原核细胞周期中的I期为DNA复制准备期,R期为DNA复制期。图7显示了DHQ处理后对大肠杆菌细胞周期的影响。经DHQ处理后,处于I期的大肠杆菌占比从82.99%(阴性对照)下降到了73.26%(1/2 MIC)、71.96%(MIC)、64.84%(2 MIC),处于R期的大肠杆菌占比从17.01%(阴性对照)上升到了26.74%(1/2 MIC)、28.04%(MIC)、35.16%(2 MIC)。DHQ处理后大肠杆菌处于I期的占比与对照组相比显著下降(P<0.05),处于R期的占比显著上升(P<0.05)。以上结果表明,DHQ对大肠杆菌的抑制作用与其干扰细胞周期有关。推测原因可能为DHQ损伤菌体的细胞膜,进入细胞内部,引起ROS在菌体内聚集,破坏了与DNA合成有关的酶或蛋白质,从而干扰了大肠杆菌正常的细胞周期[32]。
3 结论
从植物中提取的DHQ可以抑制金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、普通变形杆菌、产气肠杆菌和热带假丝酵母菌的生长,其中对大肠杆菌的抑菌效果最好,所以选择大肠杆菌作为抑菌机理实验的指示菌。DHQ会使得菌体内ROS含量增加,细胞膜的完整性和通透性受到损坏,细胞严重变形,出现黏连、折叠等现象;细胞膜电位降低,发生去极化现象,造成胞内离子紊乱,导致Ca2+等离子外漏,影响细胞生长代谢;使细胞周期滞留在R期,正常的细胞周期受到了干扰。本实验证实了DHQ对大肠杆菌等食源性病原菌具有显著抑制活性,并阐述了其抑菌机理。实验结果可为DHQ作为植物源食品防腐剂应用于食品安全领域提供理论参考。
