日粮添加丁酸梭菌对小尾寒羊脂肪酸代谢和肉品质的影响
2023-11-07王威皓康乐天王宏迪赵丽华武海峰
王威皓,窦 露,康乐天,王宏迪,段 艳,苏 琳,赵丽华,武海峰,靳 烨,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.察哈尔右翼中旗农畜产品质量安全中心,内蒙古 乌兰察布 013550)
羊肉具有肉嫩味鲜、低脂肪和高蛋白等特点,随着生活水平的提升和健康意识的增强,人们对肉类食品的食用品质以及营养价值的追求越来越高。肉中的脂肪酸不仅具有较高的营养价值,还可以影响肉类食品的风味。前人研究发现脂质化合物(如磷脂酰胆碱、甘油三酯、饱和脂肪酸和不饱和脂肪酸)是肉类风味形成中重要的前体物质,多不饱和脂肪酸氧化产生醛、醇、酮及酯类等挥发性物质在适宜范围内能提高肉质的香味[1]。在肌肉中,脂肪酸主要存在于肌内脂肪,与肉质的多汁性、适口性及嫩度密切相关,因此提高肌内脂肪沉积也成为高档羊肉生产过程中的关键技术难点和突破点[2]。
反刍动物产品中的脂肪酸组成及含量主要受日粮营养、瘤胃微生物代谢以及脂肪代谢相关分子调控网络的影响,其中瘤胃微生物可通过生物氢化作用和瘤胃发酵影响肌肉的脂肪酸组成[3]。Gillis等[4]研究发现瘤胃微生物可将68%~84%的不饱和脂肪酸氢化为饱和脂肪酸。Dai Xiaoxia等[5]研究发现瘤胃内Selenomonas_l属的丰度与α-亚麻酸的含量呈负相关,该菌属通过参与琥珀酸-丙酸途径产生ATP,为氢化α-亚麻酸提供能量。因此调控瘤胃微生物结构组成可以促进肌肉中有益脂肪酸的沉积。已有研究发现益生菌在调节动物胃肠道微生态平衡、改善动物生长性能和提高肉品品质方面均具有良好的特性[6]。丁酸梭菌(Clostridium butyricum)是一种革兰氏阳性益生菌,能够在机体中发挥免疫、抗氧化以及抑制致病菌的作用。此外,丁酸梭菌代谢产生的短链脂肪酸-乙酸和丁酸是肌内脂肪合成过程中重要的前体物质[7]。Cai Qiaoli等[8]在环江小型猪日粮中添加丁酸梭菌,发现环江小型猪肌肉中非必需氨基酸含量、单不饱和脂肪酸含量和大理石纹评分显著提高。Tian Zhimei等[9]发现罗伊氏乳杆菌能促进育肥猪肌肉中硬脂酰辅酶A去饱和酶(stearoyl-CoA desaturase,SCD)基因表达,提高肌内脂肪的含量。以上研究证明益生菌能影响机体脂肪酸代谢和肌肉品质,但通过饲喂益生菌建立反刍动物瘤胃微生物和脂肪代谢相关基因与脂肪酸代谢的关系,进而改善肉品质的研究相对较少。因此本实验基于宏基因组测序及实时荧光定量聚合酶链式反应(real time quantitative polymerase chain reaction,qPCR)分析日粮添加丁酸梭菌对小尾寒羊脂肪酸代谢和肉品质的影响,为改善羊肉品质提供新的营养干预策略。
1 材料与方法
1.1 材料、菌株与试剂
3 月龄小尾寒羊共24 只(体质量(28.85±2.01)kg)选取自内蒙古自治区呼和浩特市和林格尔县牧场。
丁酸梭菌 山东宝来利来生物工程股份有限公司。 E.Z.N.A.D N A 试剂盒 美国Omega 公司;琼脂糖 西班牙Biowest公司;37 种脂肪酸甲酯混合标准品 美国Sigma公司;RNAiso Plus总RNA提取试剂盒、SYBR®Premix ExTaqTMII qPCR试剂盒 大连宝生物工程有限公司。
1.2 仪器与设备
TU-1810型紫外分光光度计 北京普析通用仪器有限公司;TCP2全自动测色色差计 上海生物生化实验仪器公司;DYY-6C电泳仪 北京市六一仪器厂;8890气相色谱仪 美国安捷伦公司;LightCycler®480 qPCR仪罗氏诊断产品(上海)有限公司;pH-STAR型胴体直测式pH计 北京赛多利斯科学仪器有限公司;C-LM3B型数显式肌肉嫩度仪由东北农业大学研发制备。
1.3 方法
1.3.1 实验设计
采用单因素随机设计,将24 只小尾寒羊分为对照组和丁酸梭菌组,公母各半,每组3 个重复,每个重复4 只。对照组每日8∶00和15∶00提供基础日粮(青贮33.4%(以体系质量计,下同)、玉米46.6%、豆粕15.7%、石粉1.1%、食盐0.8%、磷酸氢钙0.4%、矿物质2%),丁酸梭菌组每只羊在饲喂基础日粮的基础上,参考Tian Zhimei等[9]的实验方法进行饲喂,每天添加5 g丁酸梭菌于晨饲前与精料混合。基础日粮营养成分含量(以干质量计)为粗蛋白35.6 g/100 g、粗灰分24.8 g/100 g、粗纤维7.6 g/100 g、钙1.13 g/100 g、磷0.67 g/100 g、氯化钠0.9 g/100 g、赖氨酸0.6 g/100 g、增重净能9.62 MJ/kg,除增重净能为计算值外,其余均为实测值。丁酸梭菌由山东宝来利来生物工程股份有限公司提供,活菌数为5×108CFU/g。实验期间自由采食和饮水,并定期清理羊舍。预试期7 d,正试期90 d。
1.3.2 样品采集与处理
实验期结束禁食禁水12 h,屠宰后每组取6 只羊的瘤胃内容物,用4 层纱布过滤出瘤胃液,分装于无菌无酶的5 mL冻存管中,置于液氮中存放。屠宰后每只羊采集10~13 根肋间背最长肌2 份,每份约150 g,其中一份沿肌纤维方向进行分割处理,取3 块1 cm2肉块置于无菌无酶管于液氮中存放,用于脂肪酸代谢相关基因测定,剩余肉样在宰后1 h内用于肌肉色泽、蒸煮损失率和嫩度等品质指标的测定。另一份肉样在-20 ℃条件下冷冻运送回实验室,用于脂肪酸分析。
1.3.3 肉品质的测定
pH值的测定:用pH-STAR型胴体直测式pH计测定肌肉45 min和4 ℃排酸24 h的pH值(pH45min和pH24h),每块样品重复测定3 次。
色泽的测定:使用TCP2全自动测色色差计对背最长肌色泽进行测定,每个样品测定3 次后取平均值,L*值表示亮度,a*值表示红度,b*值表示黄度,饱和度按照公式(1)计算。
蒸煮损失率的测定:取100 g左右的肉样记录煮前质量(m1/g),肉样中心插入温度计,放入85 ℃水浴锅中加热40 min,待肉样中心温度达到70 ℃后取出冷却至室温,擦干表面水分记录煮后质量(m2/g),蒸煮损失率按照公式(2)计算。
剪切力的测定:将测定蒸煮损失剩余肉样沿肌纤维方向切成3 cm×1 cm×1 cm的肉条,使用C-LM3B型嫩度仪测定6~8 次,以剪切力表征嫩度。
肌内脂肪质量分数的测定:根据GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》[10]中索氏抽提法测定样品中肌内脂肪质量分数,每块样品重复测定3 次。
1.3.4 脂肪酸组成测定
参照Floch等[11]与GB 5009.168—2016的方法制备脂肪酸甲酯,采用气相色谱仪分析,每个样品重复测定2 次。气相色谱条件:使用Rt-2560石英毛细管色谱柱(100 m×250 μm,0.20 μm),程序升温分3 步:温度由100 ℃升高至180 ℃,速率为10 ℃/min,稳定6 min后继续将温度提高至200 ℃,速率为1 ℃/min,稳定20 min后继续升温至230 ℃,速率为4 ℃/min,稳定20.5 min后结束升温。离子源温度和传输线温度分别为250 ℃和280 ℃。通过Sigma-Aldrich混合标准品保留时间确定各峰对应脂肪酸,根据峰面积对单个脂肪酸进行量化,并表示为总脂肪酸的相对含量。
1.3.5 脂肪酸代谢相关基因表达量的测定
参照王柏辉[12]的方法,称取约150 mg的肉样提取RNA。提取后的RNA样品测定吸光度及RNA浓度,用质量分数1%琼脂糖凝胶电泳检测总RNA质量,然后将RNA样品质量浓度稀释至500 ng/μL,采用反转录试剂盒反转录获得cDNA。采用SYBR染料法和LightCycler®480系统进行qPCR分析,每个基因重复测定2 次。相关引物的设计如表1所示,均由上海生工生物工程有限公司设计并合成,以β-actin为内参基因,基因相对表达量用2-ΔΔCt法计算。
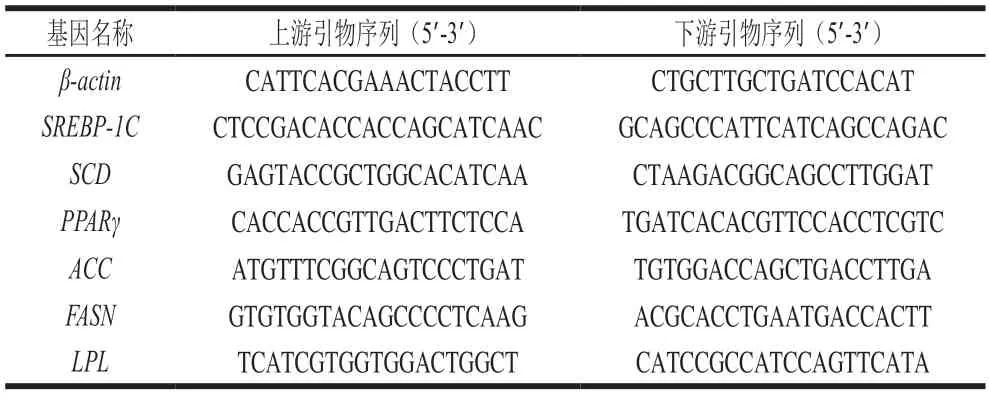
表1 qPCR引物序列Table 1 Primer sequences used for qPCR
1.3.6 瘤胃宏基因组测序分析
将采集好的瘤胃液样品取出,按照E.Z.N.A.DNA试剂盒说明书提取样品总DNA,选取样品DNA经过质量分数1%琼脂糖凝胶电泳后,选取条带较好、无明显降解、OD260nm/OD280nm在1.8~2.0之间的DNA送至北京诺禾致源科技股份有限公司进行Illumina PE150平台测序。
下机后的原始数据采用Readfq(version 8)软件(https://github.com/cjf!elds/readfq)进行预处理,得到Clean Data,参考文献进行基因组装[13]、开放阅读框预测[14]、去冗余基因[15]等信息处理,获得最终用于后续分析的Unigenes。将Unigenes与美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的NR数据库(version 2018-01-02)(https://www.ncbi.nlm.nih.gov/)进行比对,获得各个分类层级上的丰度信息表。
1.4 数据处理与分析
利用SPSS 26.0 软件进行独立样本t检验,以P<0.05表示差异显著,结果以平均值±标准差表示。使用R v3.6.3软件中Pearson相关系数法进行相关性分析,使用Prism 8.0软件作图。宏基因组原始数据已上传https://submit.ncbi.nlm.nih.gov/subs/sra/(查询号PRJNA882361)。
2 结果与分析
2.1 丁酸梭菌对小尾寒羊肉品质的影响
pH值是影响肉质的重要因素,畜禽屠宰后肌肉pH值下降会降低蛋白质在肌肉中的溶解度,对肉质产生不利影响。由表2可知,两组的初始pH值(pH45min)无显著差异(P>0.05),静置排酸24 h后,丁酸梭菌组的pH24h显著高于对照组(P<0.05),说明日粮添加丁酸梭菌能够显著减缓宰后肌肉的糖酵解进程,这与白艳苹等[16]的研究结果一致。肉色是确保消费者满意度的重要感官指标,饱和度越大表明肉的色泽越饱满。先前的研究表明日粮添加益生菌可以增强肌肉氧化稳定性,减缓组织内氧合肌红蛋白被氧化为高铁血红蛋白的速率,保持肉红度稳定[17]。本研究中,对照组的L*值、a*值和饱和度均显著低于丁酸梭菌组(P<0.05),说明丁酸梭菌对改善小尾寒羊肉色具有积极作用。Liu Yanhan等[18]也同样证实了日粮添加丁酸梭菌能显著提升鸭肉的红度。剪切力能客观反映嫩度,剪切力越小肉质越嫩。本实验中,对照组的剪切力显著高于丁酸梭菌组(P<0.05),这与董改香等[19]的研究结果一致,即用益生菌发酵饲粮可以显著降低绵羊肌肉的剪切力。研究表明,肌内脂肪沉积在肌束之间,与肌肉中的膜蛋白紧密结合,其含量与肉质多汁性、嫩度及风味呈显著正相关[20]。本实验中丁酸梭菌组的肌内脂肪质量分数显著高于对照组(P<0.05),说明丁酸梭菌的添加可促进脂肪在肌肉中的沉积,这也为益生菌改善羊肉嫩度提供了合理解释。
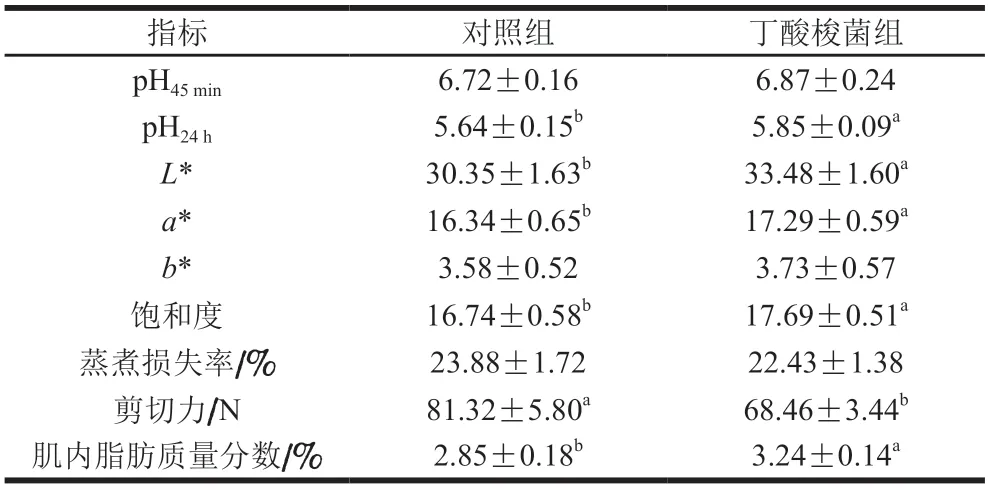
表2 丁酸梭菌对小尾寒羊肉品质的影响Table 2 Effect of Clostridium butyricum on meat quality of small-tailed Han sheep
2.2 丁酸梭菌对小尾寒羊脂肪酸组成的影响
肌肉中的脂肪酸组成可决定肌肉的氧化稳定性和硬度,进而影响其风味、嫩度和色泽[21]。反刍动物由于瘤胃中不饱和脂肪酸的高度生物氢化,导致肉类中饱和脂肪酸含量较高,而人体摄入过量的饱和脂肪酸则会增加血液胆固醇含量,从而危害身体健康[22]。丁酸梭菌对小尾寒羊饱和脂肪酸组成的影响如表3所示,对照组总饱和脂肪酸的相对含量显著高于丁酸梭菌组(P<0.05)。饱和脂肪酸中的硬脂酸是形成羊肉膻味的主要物质,其含量越高,膻味越大[23]。本研究中,丁酸梭菌组小尾寒羊背最长肌中硬脂酸的相对含量显著低于对照组(P<0.05),可能的原因是硬脂酸主要来源于不饱和C18脂肪酸的生物氢化,日粮添加丁酸梭菌产生的丁酸等代谢产物降低了瘤胃pH值,导致聚离子脂肪酸的生物加氢活性降低,进而减少C18:0脂肪酸的沉积[24]。与丁酸梭菌组相比,对照组棕榈酸的相对含量显著更高(P<0.05),而月桂酸和棕榈酸摄入过高容易引起血清低密度脂蛋白水平升高,增加患心血管疾病的风险[25]。
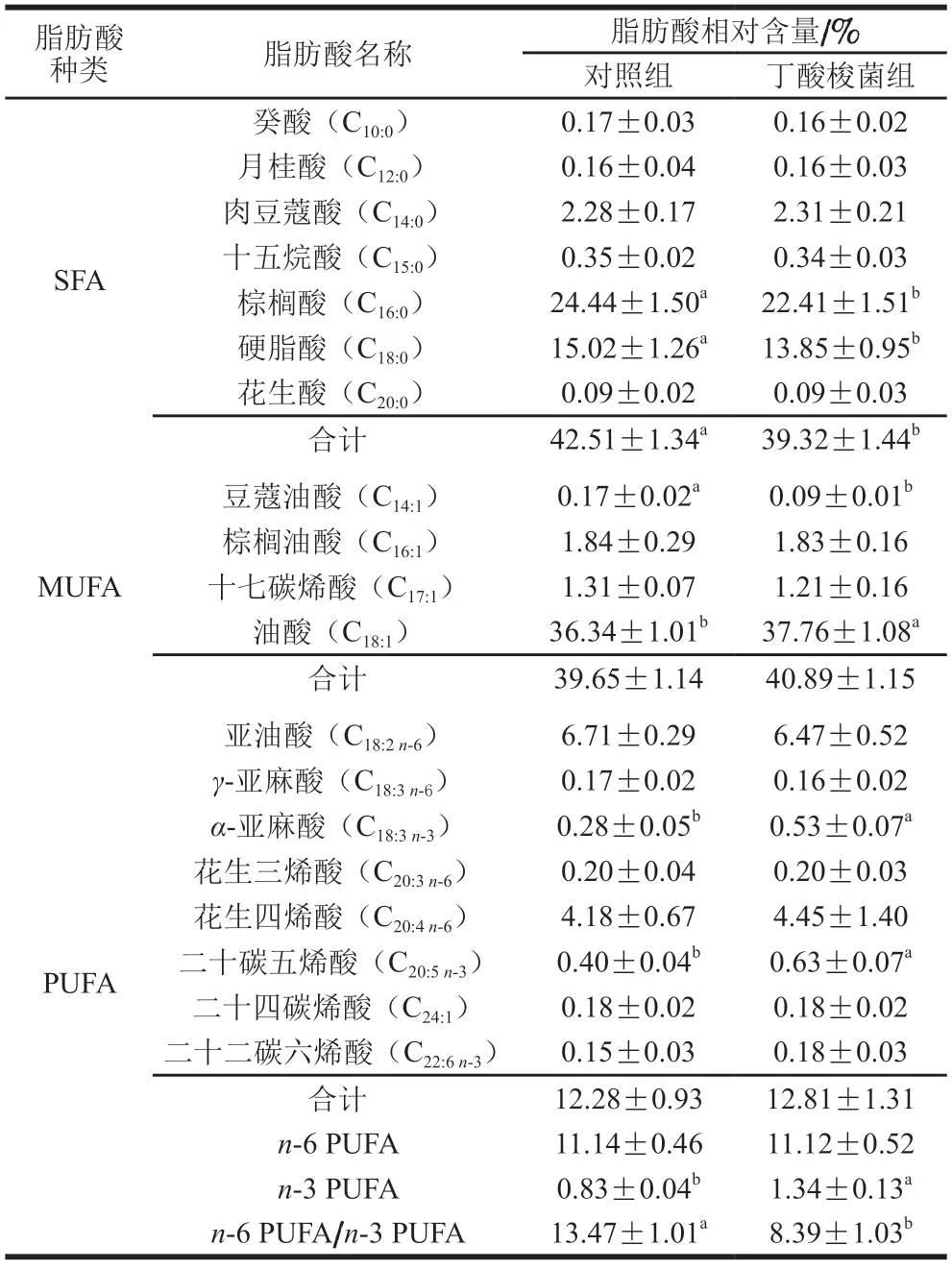
表3 丁酸梭菌对小尾寒羊背最长肌中脂肪酸的影响Table 3 Effect of Clostridium butyricum on fatty acid composition in Longissimus dorsi muscle of small-tailed Han sheep
油酸是羊肉中主要的不饱和脂肪酸,对降胆固醇和调节血脂有明显的改善作用[26]。本研究中丁酸梭菌组小尾寒羊背最长肌中油酸的相对含量显著高于对照组(P<0.05),这与Tang Xiaopeng等[27]的研究结果相一致。有研究表明益生菌的添加有利于增加肌肉组织中Δ9-去饱和酶活性,促进机体将硬脂酸内源性转化成油酸[28]。肉类中功能性脂肪酸多为不饱和脂肪酸,其中亚麻酸作为中长链脂肪酸合成的底物,对羊肉风味的形成起重要作用[29]。本研究发现,与对照组相比,丁酸梭菌组α-亚麻酸相对含量显著升高(P<0.05),亚油酸和γ-亚麻酸的相对含量降低,但差异不显著(P>0.05)。二十碳五烯酸和二十二碳六烯酸属于功能性长链脂肪酸,具有促进神经系统健康的作用,有利于抗衰老和维持认知功能[30]。本研究发现丁酸梭菌干预显著提高了小尾寒羊肌肉的二十碳五烯酸相对含量(P<0.05),进一步说明益生菌能提高小尾寒羊肉的保健功效。研究表明,当n-6多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)/n-3 PUFA的比值处于4~10时,更符合人们的食用健康标准[31],本实验中丁酸梭菌组n-6 PUFA/n-3 PUFA的比值显著低于对照组,更加符合推荐标准。
2.3 丁酸梭菌对小尾寒羊脂肪酸代谢相关基因表达量的影响
脂肪沉积是多种基因、蛋白以及多条信号通路共同作用调控的结果,相关基因表达可调控与脂肪代谢相关的物质,最终影响脂肪的沉积与降解。固醇调节元件结合蛋白1C(sterol regulatory element binding protein 1C,SREBP-1C)是细胞核内调控脂质代谢的重要转录因子,能够调控胆固醇和脂肪酸的合成。SREBP-1C通过激活SCD的表达来调控下游过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)基因[32]。PPARγ进一步调控乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、脂肪酸合成酶(fatty acid synthetase,FASN)和脂蛋白脂酶(lipoprotein lipase,LPL)来诱导骨骼肌中脂滴的积累,进而增加肌内脂肪的含量[33]。
由图1 可知,丁酸梭菌组小尾寒羊背最长肌的SREBP-1C、SCD、PPARγ和ACC基因表达量显著高于对照组(P<0.05)。Hsieh等[34]在对雄性大鼠的研究中发现罗伊氏乳杆菌能激活SREBP-1C,从而促进大鼠脂肪组织中脂肪的沉积。SCD能催化饱和脂肪酸脱氢生成单不饱和脂肪酸,如硬脂酸转化成油酸,并且与前体脂肪细胞分化密切相关[35]。本研究中丁酸梭菌组的SCD基因表达量显著高于对照组,并且丁酸梭菌组背最长肌中油酸的相对含量更高,可见日粮添加丁酸梭菌能够改变小尾寒羊背最长肌SCD基因表达水平,进而影响肌肉组织中脂肪酸的组成。基因可以调控脂肪酸代谢,而脂肪酸也会对基因产生影响,如油酸会促进PPARγ的表达[36]。PPARγ是核受体超家族成员之一,能促进机体内脂肪的分化和积累,在调节肌内脂肪代谢过程中起核心作用[37]。本研究中丁酸梭菌组小尾寒羊背最长肌的PPARγ基因表达量显著高于对照组(P<0.05),其原因可能与丁酸梭菌代谢产生的短链脂肪酸——丁酸有关,该脂肪酸通过调控PPARγ信号通路影响脂肪的生成[38]。Ma Jie等[39]在沙子岭猪的饲粮中补充约氏乳杆菌,发现沙子岭猪腹部脂肪组织中PPARγ基因表达量显著上调,促进了腹部脂肪的积累。ACC是催化长链脂肪酸合成的限速酶,还可催化乙酰辅酶A缩合为丙二酸单酰辅酶A,进而调控脂肪酸的氧化进程[40]。因此,本研究对该基因进行了测定,结果显示丁酸梭菌组ACC相对表达量(1.15)显著高于对照组(0.81)(P<0.05),ACC的高表达能增加丙二酸单酰辅酶A活性,促进小尾寒羊肌内脂肪的沉积。张月等[41]利用乳酸菌饲喂苏尼特羊发现,乳酸菌通过抑制腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)磷酸化,提高ACC基因的表达,进而促进脂肪酸沉积。

图1 丁酸梭菌对小尾寒羊脂肪酸代谢相关基因表达量的影响Fig.1 Effect of Clostridium butyricum on expression levels of genes associated with fatty acid metabolism in small-tailed Han sheep
2.4 脂肪酸相关调控基因表达量与脂肪酸组成相关性分析
动物脂肪代谢是脂肪合成和脂肪分解动态博弈的结果,受脂肪酸代谢相关基因的调控,因此对小尾寒羊背最长肌中脂肪酸代谢相关基因表达量与脂肪酸组成进行Person相关性分析。由图2可知,PPARγ基因相对表达量与α-亚麻酸和二十二碳六烯酸相对含量呈显著或极显著正相关(P<0.05或P<0.01),ACC和SREBP-1C基因相对表达量与α-亚麻酸和二十碳五烯酸相对含量呈显著或极显著正相关(P<0.05或P<0.01),推测PPARγ、SREBP-1C和ACC基因的高表达有利于不饱和脂肪酸的沉积。张秋旭[42]的研究表明n-3 PUFA能提高PPARγ基因的表达水平,活化的PPARγ通过调控LPL、ACC、SREBP-1C等靶基因,上调脂肪酸去饱和程度,从而促进肉中不饱和脂肪酸的沉积。SCD基因相对表达量与饱和脂肪酸相对含量呈极显著负相关(P<0.01),但与油酸、α-亚麻酸和二十碳五烯酸相对含量呈显著或极显著正相关(P<0.05或P<0.01),Li Changxi等[43]研究发现,SCD基因的高表达有助于不饱和脂肪酸的沉积以及调控棕榈酸和硬脂酸的去饱和化过程,这与本实验结果一致。
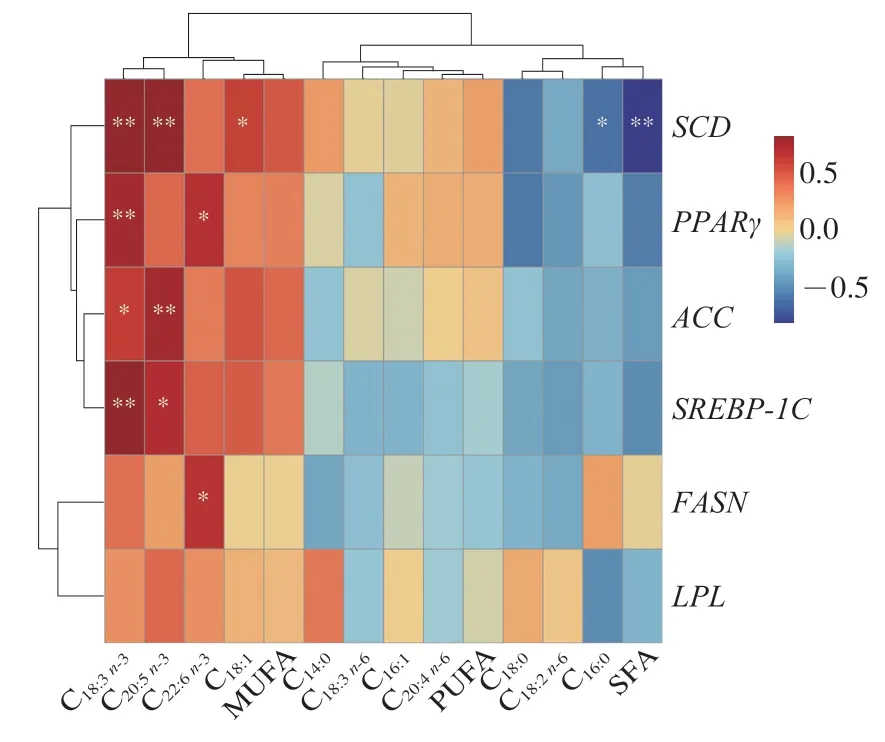
图2 脂肪酸代谢相关基因表达量与脂肪酸组成相关性热图Fig.2 Heatmap showing correlation between expression of fatty acid metabolism-related genes and fatty acid compositions
2.5 丁酸梭菌对小尾寒羊瘤胃微生物组成的影响
瘤胃微生物是“第二基因组”,在调控肌肉脂肪酸组成和风味物质变化中发挥重要作用。由表4门水平上相对丰度(排名前6的菌门)可知,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)是瘤胃样本中的优势菌门。其中丁酸梭菌组中厚壁菌门的相对丰度显著高于对照组(P<0.05),而拟杆菌门的相对丰度在两组间无显著差异(P>0.05)。刘宇阳[44]的研究也证实日粮添加复合益生菌能提高波尔山羊瘤胃中厚壁菌门的相对丰度。据报道,拟杆菌门和厚壁菌门均能调节宿主脂质代谢,提高能量效率,其中拟杆菌门能促进非纤维碳水化合物的消化,而厚壁菌门能促进纤维物质的分解[45]。本研究中,添加丁酸梭菌可以增加瘤胃中厚壁菌门的数量,对纤维物质的分解有益。变形菌门中的细菌包括多数致病菌,如大肠杆菌、沙门氏菌、幽门螺杆菌[46]。本实验中丁酸梭菌组瘤胃中变形菌门的相对丰度显著低于对照组(P<0.05),原因可能是丁酸梭菌能够合成和分泌短链脂肪酸和细菌素,破坏致病菌的细胞膜,从而杀死或抑制致病菌生长[47]。

表4 丁酸梭菌对小尾寒羊瘤胃微生物相对丰度的影响Table 4 Effect of Clostridium butyricum on the relative abundance of rumen microflora in small-tailed Han sheep %
从表4 中属水平相对丰度排名前10 的菌属可知,相对丰度最高的3 个菌属分别为普雷沃氏菌属(Prevotella)、拟杆菌属(Bacteroides)和梭菌属(Clostridium)。最新的研究表明梭菌属能够利用纤维素、细胞壁多糖、木质纤维素等原料,提高畜禽的纤维降解能力[48]。本研究中,丁酸梭菌组梭菌属的相对丰度显著高于对照组(P<0.05),说明丁酸梭菌成功定植于小尾寒羊瘤胃中,一定程度上提高了小尾寒羊瘤胃的纤维降解能力。纤维杆菌属(Fibrobacter)可代谢产生乙酸、丙酸等短链脂肪酸,通过三羧酸循环为宿主提供能量[49]。本研究中丁酸梭菌组纤维杆菌属的相对丰度显著高于对照组(P<0.05),与Miguel等[50]的研究结果一致,即在奶牛日粮中添加丁酸梭菌能显著增加瘤胃纤维杆菌的丰度。丁酸弧菌属(Butyrivibrio)是主要参与多不饱和脂肪酸生物氢化的瘤胃微生物,在共轭亚油酸和SFA合成过程中发挥重要作用[51]。本研究中丁酸梭菌组瘤胃中丁酸弧菌属相对丰度显著低于对照组(P<0.05),这可能有利于更多的多不饱和脂肪酸沉积在肉中。副拟杆菌属(Parabacteroides)是拟杆菌门中的一种革兰氏阴性细菌,代谢终产物主要是乙酸和琥珀酸,另外其代谢合成的主要脂肪酸为饱和直链脂肪酸和anteiso-甲基支链脂肪酸[52]。Young等[53]研究发现,甲基支链脂肪酸是造成羊肉中膻味的重要物质,本研究结果发现丁酸梭菌会显著降低副拟杆菌属的相对丰度(P<0.05),这可能对羊肉风味的形成具有积极作用。总体而言,日粮添加丁酸梭菌后瘤胃中厚壁菌门、梭菌属和纤维杆菌属的相对丰度显著提高,推测丁酸梭菌的添加可能会提高小尾寒羊对纤维素的分解效率,为肌肉脂肪酸合成提供更多的营养和能量,有利于肌内脂肪的沉积,但其具体作用机制还需进一步研究。
2.6 瘤胃优势菌群与脂肪酸组成的相关性分析
为了进一步探究瘤胃优势菌群与背最长肌中脂肪酸组成之间的关系,以属水平上相对丰度前10的优势菌群与11 种脂肪酸进行Pearson相关性分析。由图3可知,副拟杆菌属相对丰度与α-亚麻酸、二十碳五烯酸相对含量呈显著负相关(P<0.05),与饱和脂肪酸相对含量呈显著正相关(P<0.05)。瘤胃杆菌属相对丰度与硬脂酸、亚油酸和γ-亚麻酸相对含量呈显著负相关(P<0.05),与α-亚麻酸和二十二碳六烯酸相对含量呈显著正相关(P<0.05)。而普雷沃氏菌属相对丰度与二十碳五烯酸和单不饱和脂肪酸相对含量呈显著正相关(P<0.05),与硬脂酸饱和脂肪酸相对含量呈显著负相关(P<0.05)。瘤胃杆菌属和普雷沃氏菌属主要参与纤维素的降解,可产生大量的挥发性脂肪酸,挥发性脂肪酸被瘤胃壁吸收,转化生成脂肪酸,这可能是丁酸梭菌增加肌肉不饱和脂肪酸含量的内在机制[49]。丁酸弧菌属相对丰度与棕榈油酸和多不饱和脂肪酸相对含量呈显著负相关(P<0.05)。此外,乳酸杆菌属相对丰度与油酸、α-亚麻酸、二十碳五烯酸和单不饱和脂肪酸相对含量呈显著正相关(P<0.05),但与亚油酸和饱和脂肪酸呈显著负相关关系(P<0.05)。刘婷等[54]研究发现乳酸杆菌属的添加能显著提高苏尼特羊背最长肌中油酸的含量,显著降低亚油酸的含量,本研究结果与其相似。

图3 瘤胃优势菌群与脂肪酸组成相关性网络图Fig.3 Correlation network between predominant rumen flora and fatty acid composition
3 结论
本研究结果表明,日粮添加丁酸梭菌提高了小尾寒羊背最长肌中油酸、α-亚麻酸和二十碳五烯酸的相对含量,降低了棕榈酸和硬脂酸的相对含量,提升了肌肉的肌内脂肪含量、色泽和嫩度,延缓了宰后pH值的下降,对肉品质有明显的改善作用。通过脂肪代谢相关基因分析得出,丁酸梭菌组SREBP-1C、SCD、PPARγ和ACC基因表达水平显著上调,从分子水平证实了丁酸梭菌可以促进机体脂肪沉积。进一步研究瘤胃微生物对脂肪酸代谢的影响发现,饲喂丁酸梭菌提高了小尾寒羊瘤胃中厚壁菌门、梭菌属和纤维杆菌属的相对丰度,降低了变形菌门、丁酸弧菌属和副拟杆菌属的相对丰度。瘤胃微生物与脂肪酸的相关性分析中,瘤胃中瘤胃杆菌属、普雷沃氏菌属和乳酸杆菌属相对丰度与不饱和脂肪酸相对含量呈正相关。综上,通过饲喂益生菌调控反刍动物瘤胃微生物影响机体脂肪酸代谢或是将来改善羊肉品质的重要研究方向,可为微生物制剂改善肉质性状提供新的机理解释。
