补体应答基因32在小鼠部分肝切除后肝再生过程中的表达及意义
2023-11-06李兴元杨艳芳陈琰胡文慧赵小英唐俊明孔德营
李兴元, 杨艳芳, 陈琰, 胡文慧, 赵小英, 唐俊明, 孔德营
1 遵义医科大学基础医学院生理学教研室, 贵州 遵义 563000; 2 贵州省人民医院中心实验室, 贵阳 550002; 3 湖北医药学院基础医学院生理学教研室, 湖北 十堰 442000
部分肝切除(partial hepatectomy,PH)术是治疗肝肿瘤、肝内胆管结石等疾病的重要手段,但术后肝衰竭的发生严重影响患者预后,甚至导致患者短期内死亡,无法达到治疗疾病的目的[1]。PH术后的顺利恢复主要取决于剩余肝脏的迅速再生以及肝功能的迅速恢复[2],因此研究肝脏再生的过程及其调控机制十分重要。有研究[3]表明补体系统在调控两栖类动物肢体再生过程中发挥了重要作用,在一些有尾动物中,其肢体胚芽细胞的再生起始于C3组分的表达。补体应答基因32(response gene to complement 32,RGC32)是一种重要的补体激活基因,补体系统被激活后会促进其表达[4]。RGC32在肝脏再生过程中是否也发挥重要作用,目前尚不清楚。本研究旨在观察小鼠PH术后肝再生过程中肝脏的结构和功能变化,不同时期细胞增殖情况,以及不同时期RGC32的表达变化,分析PH术后肝再生过程中RGC32对细胞增殖的影响。
1 材料与方法
1.1 材料 10周龄雄性C57BL/6小鼠42只,由湖北医药学院实验动物中心提供,生产许可证号:SCXK(鄂)2019-0008,实验动物使用许可证号:SYXK(鄂)2019-0031。L02细胞来自于湖北省胚胎干细胞重点实验室。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(ab29)购自Abcam公司。RGC32(bs-9079R)购自北京博奥森生物技术有限公司。ALT、AST检测试剂盒购自南京建成生物工程研究所。实时荧光定量PCR(qRT-PCR)试剂购自Toyobo公司。油红O染色液(GP1067)、Ki67(GB121141)、脂肪固定液(G1119)、抗荧光淬灭封片剂(G1401)、柠檬酸修复缓冲液(G1201)、PBS缓冲液(G0002)购自武汉塞维尔生物有限公司。DAB免疫染色试剂(ZLI-9018)、苏木素染色液(ZLI-9610)购自北京中杉金桥。EdU(Cy3)染色试剂盒(K1075)购自Apexbio。
1.2 方法
1.2.1 小鼠PH模型的制备 42只10周龄雄性C57BL/6小鼠,随机分为对照组[切除小鼠完整的肝脏称重、拍照作为正常对照(sham组),进一步切除肝左叶和肝中叶后称重、拍照作为手术对照(0 d组),sham组和0 d组共用一组小鼠]、术后1天组(1 d)、术后2天组(2 d)、术后4天组(4 d)、术后6天组(6 d)、术后8天组(8 d)和术后10天组(10 d),每组6只。手术操作均在SPF级环境中完成。小鼠提前一天用脱毛膏脱去胸腹部的毛。实验当天称量小鼠体质量并记录。异氟烷吸入式气体麻醉,麻醉后仰卧于铺有37 ℃加热垫的操作案板上,用手术胶带固定其四肢。碘伏消毒,于上腹剑突处水平切开,打开腹腔,暴露小鼠肝脏,用6-0丝线结扎肝左叶并切除,再用6-0丝线结扎肝中叶并切除,用4-0外科缝线缝合关腹,碘伏消毒。分别于术后1、2、4、6、8、10天处死小鼠,收集血清和肝脏组织。
1.2.2 HE染色 5 μm厚的石蜡切片,经二甲苯脱蜡、梯度酒精脱水后,用苏木精和伊红染色,梯度酒精脱水,二甲苯透明,中性树胶封片。
1.2.3 油红O染色 肝脏用脂肪固定液固定24 h,蔗糖梯度脱水,OCT包埋,冰冻切片。室温晾干,饱和油红O液染色,60%异丙醇分化;苏木素对染细胞核,甘油明胶封片剂封片。
1.2.4 qRT-PCR Trizol法提取总RNA,反转录为cDNA,使用SYBR Green real-time PCR Master Mix(SYBR)(Toyobo公司)进行qRT-PCR反应。表达水平用GAPDH进行标准化,使用2-ΔΔCT方法分析基因表达。引物序列GAPDH-Forward:TTGCCATCAATGACCCCTTCA,GAPDH-Reverse:CGCCCCACTTGATTTTGGA;RGC32-Forward:AGCCTTCATTGCTGATCTTGA,RGC32-Reverse:GCAGGTCCTCGGAACTTCT。
1.2.5 免疫组化染色 5 μm厚的石蜡切片,经二甲苯脱蜡、梯度酒精复水、抗原修复、阻断内源性过氧化物酶后用正常羊血清室温下封闭1 h,加入一抗Ki67(1∶600)、PCNA(1∶2 000)、RGC32(1∶200),4 ℃湿盒内孵育过夜;PBS漂洗后加入相应的二抗,室温下孵育1 h;PBS漂洗后DAB显色,苏木素对染细胞核,中性树胶封片。
1.2.6 免疫荧光双染 操作步骤与免疫组化染色步骤大致相同,将二抗更换为对应的荧光二抗,DAPI染核,抗荧光淬灭剂封片。
1.2.7 EdU实验 L02细胞接板,次日无血清饥饿处理24 h,换成正常培养基,同时加入对应腺病毒,转染48 h后按EdU试剂盒操作说明进行EdU染色。
1.2.8 肝功能检测 不同时间点处死小鼠,收集血清,3 000 r/min离心5 min,用AST、ALT检测试剂盒,按操作说明检测血清AST、ALT水平。
1.3 统计学方法 采用image J 1.53 t软件测量图片平均光密度并进行量化比较;采用SPSS 22.0统计软件进行数据分析。计量资料采用表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验;两组间比较采用成组t检验。相关性分析采用Pearson相关分析法。P<0.05为差异具有统计学意义。采用GraphPad Prism 9.0软件绘制统计图。
2 结果
2.1 小鼠PH术后肝再生过程中肝脏大小变化 为观察小鼠PH术后肝再生过程中肝脏大小的变化,对术后不同时间点的肝脏拍照、称重,计算肝体比(肝脏质量/体质量)。如图1a所示,PH术后,剩余肝脏逐渐增大,第0天到第6天肝脏大小变化最为明显,第6天到第10天肝脏大小变化不明显。PH术后肝体比明显减小,第0天到第6天为肝体比上升的高峰期,术后第6天到第10天,肝体比无明显变化(图1b)。
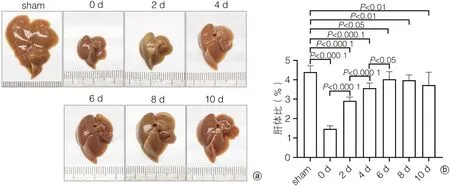
图1 小鼠PH术后肝再生过程中肝脏大小变化Figure 1 Changes in liver size during PH postoperative liver regeneration in mice
2.2 小鼠PH术后肝再生过程中组织结构和功能变化 为了观察肝再生过程中肝脏组织形态学变化,对小鼠PH术后不同时间点的肝脏标本进行HE染色。如图2a所示,sham组小鼠肝细胞着色均匀,排列规整;PH术后第2天肝细胞中出现许多小泡,胞质着色均匀,肝细胞紧密排列,细胞间缝隙最窄;PH术后第4天肝细胞中小泡消失,肝细胞胞质着色深,胞质着色存在区域性差异,门静脉(portal vein,PV)区相对中央静脉(central vein,CV)区胞质着色要深,肝细胞之间的缝隙变宽;PH术后第6天肝细胞胞质区域性着色差异愈加明显,CV区附近肝细胞出现少量小泡,与此同时细胞间的缝隙最宽;PH术后第8、10天CV区肝细胞小泡逐渐增多,而PV区肝细胞未见小泡。
为了验证PH术后肝组织中出现的小泡是脂滴,对PH术后不同时间点的小鼠肝脏标本进行冰冻切片油红O染色。结果显示,sham组小鼠PV区和CV区肝细胞中脂滴均匀分布;PH术后第2天,PV区和CV区肝细胞中脂滴变大,数量明显增多;PH术后第4天,PV区和CV区肝细胞中脂滴明显减少;PH术后第6、8、10天CV区肝细胞脂滴数量逐渐增多,而PV区肝细胞脂滴未见增加(图2b~d)。由此可见,脂滴的分布与HE染色中的小泡分布相一致,表明小鼠PH术后肝脏HE染色中出现的小泡为脂滴。以上结果表明,PH术后脂滴增多;随着肝再生的进行,脂滴减少,但PV区和CV区脂滴分布产生差异。
为了评估PH术后肝功能的变化,收集PH术后不同时间点的小鼠血清,用肝功能生化检测试剂盒检测血清ALT和AST水平。结果显示,与sham组相比,小鼠PH术后第1天血清ALT和AST水平明显升高,但呈现出较大的个体差异,随后逐渐降低,分别于术后第6天和术后第2天恢复至sham组水平(图2e、f)。以上结果表明,PH术后肝脏功能严重受损,随着肝脏再生的进行,肝功能逐渐恢复。
2.3 小鼠PH术后肝脏再生过程中细胞增殖变化为了研究肝脏再生过程中细胞增殖情况,通过免疫组化染色检测细胞增殖标志物PCNA。结果显示,sham组小鼠肝脏组织中仅有极少数散在分布的PCNA+肝实质细胞;PH术后第2天,PCNA+肝实质细胞数达到最大值(86±5),随后逐渐减少;术后第8天时PCNA+肝实质细胞数再次增多(24±3);术后第10天PCNA+肝实质细胞数趋于sham组(图3a、b)。而小鼠PH术后PCNA+非实质细胞数呈现逐渐增多的趋势;术后第6天,PCNA+非实质细胞数达到最大值(34±5),随后逐渐减少,最终小鼠肝脏组织中PCNA+非实质细胞数趋于sham组(图3a、c)。
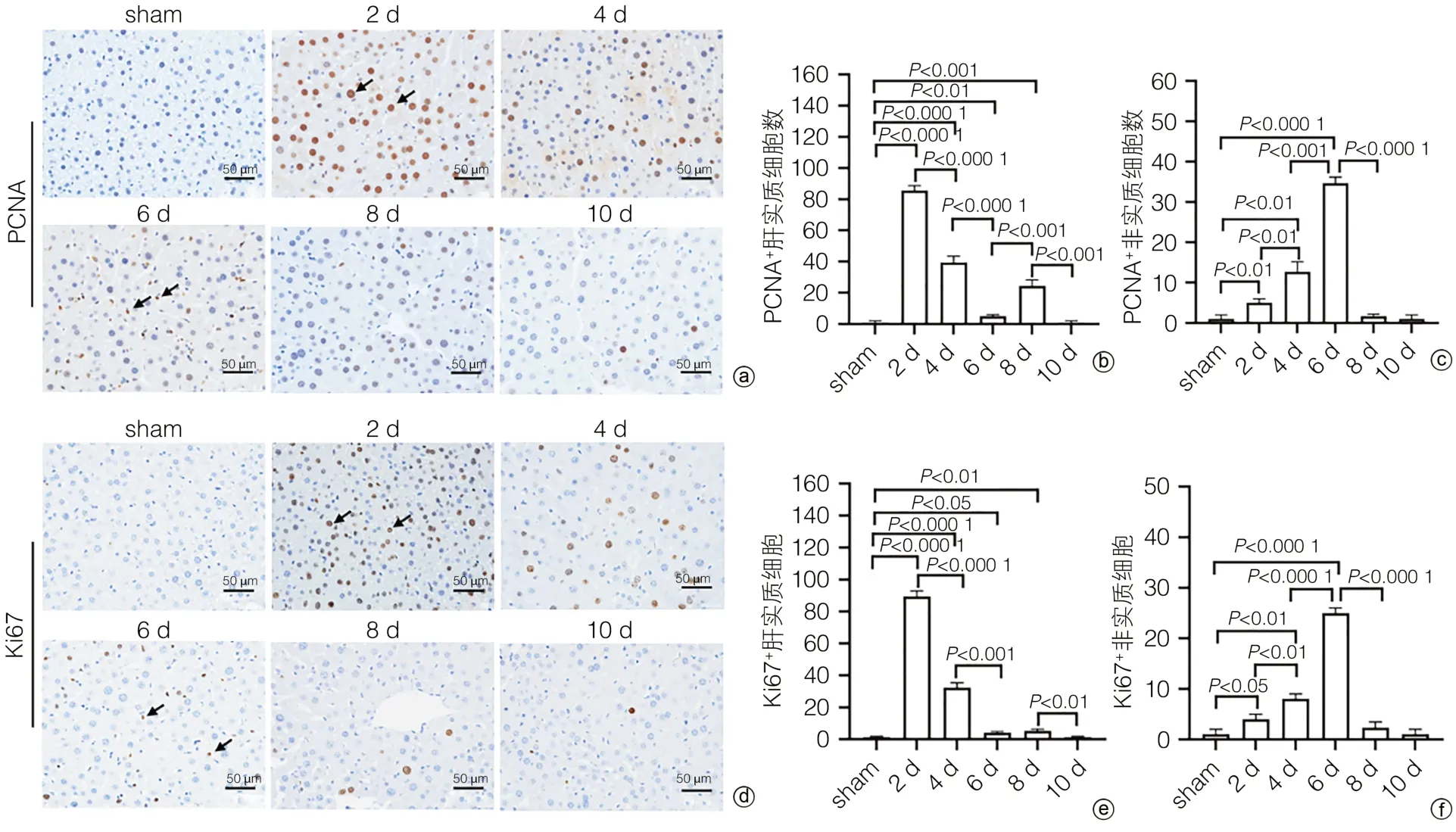
图3 小鼠PH术后肝再生过程中细胞增殖变化Figure 3 Cell proliferation changes during PH postoperative liver regeneration in mice
为了进一步验证以上结果的准确性,通过免疫组化染色检测了另一个细胞增殖标志物Ki67。结果显示,sham组小鼠肝脏Ki67+细胞数极少,散在分布;PH术后第2天,Ki67+肝实质细胞数达到最大值(89±5),随后逐渐减少,直至PH术后第10天,Ki67+肝实质细胞数趋于sham组(图3d、e)。而Ki67+非实质细胞数在PH术后逐渐增多;术后第6天,Ki67+非实质细胞数达到最大值(25±3),随后Ki67+非实质细胞数逐渐减少,直至趋于sham组(图3d、f)。Ki67+细胞数变化趋势与PCNA+细胞数的变化趋势大致相同。
2.4 小鼠PH术后肝再生过程中RGC32的表达及分布变化 为了研究小鼠PH术后肝再生过程中RGC32的表达是否发生变化,提取不同时间点的肝组织总RNA,进行qRT-PCR。如图4a所示,与sham组相比,PH术后第2天RGC32 mRNA相对表达增加,随后逐渐恢复正常表达水平。
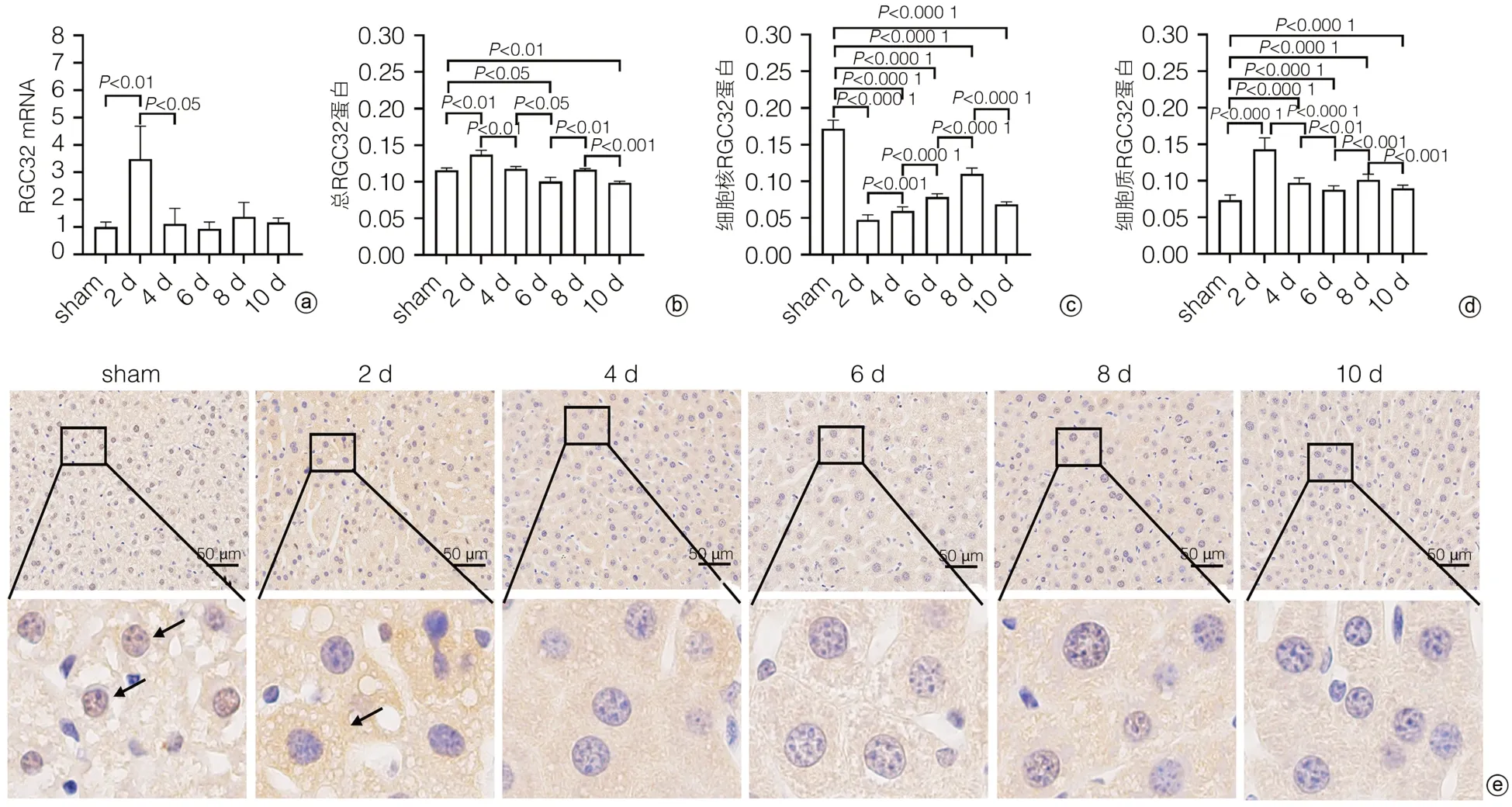
图4 小鼠PH术后肝再生过程中RGC32的表达及分布变化Figure 4 The expression and distribution of RGC32 during PH postoperative liver regeneration in mice
进一步从蛋白水平研究小鼠PH术后肝再生过程中RGC32的表达及分布变化,采用免疫组化对PH术后不同时间点的小鼠肝脏标本进行RGC32染色。结果显示,PH术后第2天,肝组织总的RGC32的表达量最高,随后逐渐降低(图4b、e),该结果与基因水平RGC32 mRNA的变化趋势相一致。
此外,研究发现正常肝细胞核中RGC32高表达,PH术后第2天降到最低(图4c、e);而正常肝细胞质中RGC32低表达,PH术后第2天,肝细胞质RGC32的表达升到最高(图4d、e)。表明PH术后第2天不仅RGC32的表达发生变化,RGC32的核质分布也发生了改变。
2.5 RGC32表达变化与肝实质细胞增殖变化相关性分析 本研究发现,小鼠PH术后不仅RGC32表达变化趋势与肝实质细胞增殖变化趋势相似,而且时间点也相同,都是在术后第2天变化最显著。分析肝实质细胞的增殖变化与RGC32的表达变化之间的相关性,结果显示,细胞核RGC32的表达与肝实质细胞的增殖呈负相关(R2=0.308 3,P<0.05)(图5a),细胞质RGC32的表达与肝实质细胞的增殖呈正相关(R2=0.808 6,P<0.001)(图5b)。
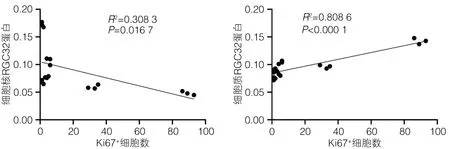
图5 RGC32的表达变化与肝实质细胞增殖变化的相关性分析Figure 5 Correlation analysis between expression of RGC32 and proliferation of hepatocellular parenchymal cells
2.6 RGC32的表达及分布对细胞增殖的影响 为进一步研究RGC32的表达及分布对肝细胞增殖的影响,首先研究小鼠肝脏中正常增殖的肝细胞RGC32的表达及分布。结果显示,正常小鼠肝组织中Ki67+肝细胞RGC32阴性,Ki67-肝细胞RGC32阳性,且定位于肝细胞核(图6a),进一步证实核RGC32的表达与细胞增殖呈负相关。
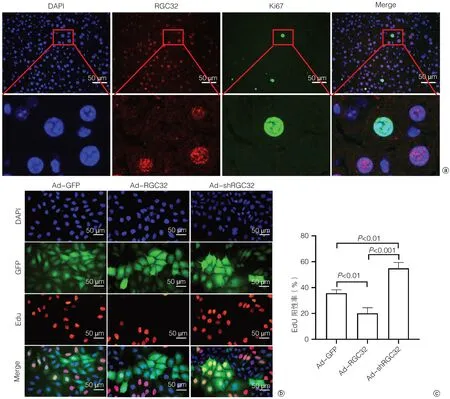
图6 RGC32核质分布对L02细胞增殖的影响Figure 6 Effect of RGC32 cytoplasmic distribution on proliferation of L02 cells
进一步从体外研究RGC32对细胞增殖的影响。用RGC32过表达(Ad-RGC32)和敲低(Ad-shRGC32)的腺病毒及对照腺病毒(Ad-GFP)分别转染肝细胞系L02,转染2天后通过EdU细胞增殖实验分析RGC32对肝细胞增殖的影响。EdU阳性率统计分析显示,RGC32过表达后EdU阳性率为20.1%,与对照组EdU阳性率35.7%相比,阳性率减少15.6%;而RGC32敲低后EdU阳性率为54.9%,与对照组相比EdU阳性率增加了19.2%(图6b、c)。
3 讨论
正常肝脏具备一定的代偿能力,少量肝切除,肝脏能够维持正常生理需求,不会引起肝脏再生。70%肝切除模型,能最大程度诱发肝再生潜能,受病理因素影响小,是研究肝再生常用的动物模型[5-6]。本研究显示,小鼠PH术后肝脏迅速启动再生,肝脏大小和功能逐渐恢复。研究发现,PH术后肝脏脂肪在第2天升到最高,术后第4天又降到最低,随后逐渐恢复,但CV区和PV区脂肪堆积产生差异化。这可能是肝切除早期,由于肝脏大部分丢失,肝功能严重受损,远超代偿范围,严重威胁生命安全,在这种情况下肝脏首选执行再生功能,其他功能如代谢功能受损,从而导致脂质在剩余肝脏中大量积累。随着肝再生的进行,肝功能得到部分恢复,肝脏再生的同时也开始执行代谢功能,将前期积累的脂质代谢,脂质堆积减少。
肝脏的基本结构和功能单位是肝小叶,肝再生不会改变剩余肝脏中肝小叶的数量,也不会改变PV、CV的数量,而是肝小叶的结构变大[1],因此肝再生完成后PV与CV之间的距离变长。笔者认为,再生后的肝脏中PV区和CV区脂肪分布产生差异,可能是由于PV与CV之间的距离变长,血液从PV流向CV,血液中的营养成分逐渐减少,流经CV区时血液中的营养成分缺乏,为了适应这种环境变化,不同区域的肝细胞功能发生了改变,还有待后续进一步研究。
肝再生是通过多种细胞因子和生长因子调节的复杂的细胞增殖过程,与一般组织由原始细胞或干细胞分化完成的再生过程不同,肝再生主要依赖于剩余肝组织分化成熟的肝细胞重新活化,获得增殖活性,启动后续的DNA复制、细胞分裂和细胞增殖[7-9]。本研究发现,在PH术后第2天肝实质细胞增殖最活跃,随后肝实质细胞增殖活性逐渐降低;而非实质细胞增殖活性在PH术后开始逐渐增强,在PH术后第6天才达到最高,随后逐渐恢复正常。肝实质细胞与非实质细胞的增殖存在先后关系,表明不同时间点不同的细胞发挥不同的作用[10-11]。
RGC32是由补体激活、生长因子和细胞因子诱导的基因,在多种正常组织及肿瘤中广泛表达,具有调控细胞周期、促进细胞分化、调节免疫等多种生物学功能[4,12-13]。例如RGC32的表达水平随着动脉粥样硬化的进展而增加,沉默RGC32表达可抑制C5b-9诱导的动脉内皮细胞增殖[14]。妊娠期胎盘中RGC32的表达降低,可抑制血管内皮生长因子诱导的内皮细胞增殖、迁移和血管形成,阻断胎盘血管生成而导致胎儿生长受限[15]。大鼠颈动脉球囊损伤诱导内膜新生的研究中,RGC32可促进平滑肌细胞的增殖和迁移,从而促进血管病变的形成[16]。这些研究提示RGC32对细胞增殖具有促进作用,但是这些研究仅聚焦于总的RGC32对细胞增殖的影响,并未对RGC32的分布进行研究。本研究显示,PH术后第2天,肝实质细胞大量增殖,总的RGC32的表达最高,这与其他学者[14-16]的研究结果相符,然而笔者发现此时细胞核RGC32的表达反而降到最低。由此可见,RGC32核质分布差异,可能发挥不同的作用,不能只从表达量研究其对细胞的影响。
由于PH术是人为损伤肝脏诱发肝细胞增殖,不可避免地会引起机体的免疫反应,这可能与正常小鼠肝脏中肝细胞增殖的情况不同[17-18]。本研究显示,正常小鼠处于静息态的肝细胞核表达RGC32,而增殖的肝细胞不表达RGC32;细胞实验研究显示,RGC32过表达抑制L02细胞增殖,敲低RGC32表达促进细胞增殖,两种实验结果相吻合。以上结果与Saigusa等[19]的研究相一致,过表达RGC32可能是由于诱导了G2/M停滞,抑制了胶质瘤细胞的生长。而与本研究动物实验PH术后第2天,细胞增殖最活跃,总RGC32表达升高的结果相矛盾。进一步分析发现,升高的是细胞质RGC32的表达,而细胞核RGC32的表达显著降低;结合细胞研究结果,笔者认为主要是细胞核RGC32调控细胞增殖。RGC32作为一种重要的补体应答基因,补体激活后能够促进其表达。因此笔者猜测,细胞核RGC32表达的升高是由于补体系统激活所导致,起到调节免疫作用,但需要后续进一步研究证实。
综上所述,本研究证实肝实质细胞和非实质细胞增殖不同步,共同参与了肝脏再生。肝切除再生过程中,RGC32表达存在核质分布差异,细胞核RGC32对肝细胞增殖具有抑制作用。
伦理学声明:本研究方案于2021年12月5日经由湖北医药学院实验动物伦理委员会审批,批号:2021-实071号,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:孔德营、唐俊明负责课题设计;李兴元、杨艳芳、陈琰、胡文慧参与动物模型的构建;李兴元、杨艳芳负责做实验、整理数据及撰写论文;赵小英负责对论文进行修改;李兴元和杨艳芳对本文贡献等同,同为第一作者。
