溶菌酶自组装纳米纤维膜的制备及性能
2023-11-06杨素华金临轩牛晨雨刘玲玲陈豪斌朱一星班兆军
杨素华,金临轩,牛晨雨,刘玲玲,陈豪斌,朱一星,班兆军
(浙江科技学院生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化制造协同创新中心,浙江杭州 310023)
目前使用的包装塑料主要来自化石原料,大部分普通塑料不能被生物降解,对地球生态系统造成破坏性的影响,因此迫切需要可替代的环境友好型和可生物降解的天然聚合物材料[1]。近年来,蛋白质因其安全、高效和易生物降解而引发极大的关注[2]。
在食品包装领域,溶菌酶(lysozyme,LYZ)因其安全、无毒副作用等特点而备受关注。溶菌酶是一种胞壁质酶,可水解细菌细胞壁中的β-1,4 糖苷键,从而破坏细胞膜的完整性,使细胞死亡而表现出一定的抑菌活性[3-4]。Zhang 等[5]设计的溶菌酶复合包装膜运用于巴氏杀菌牛奶包装,能对大肠杆菌和金黄色葡萄球菌起到有效的抗菌活性。鲁奇林等[6]制备了溶菌酶复合涂膜对鲜枣进行保鲜储存,结果显示复合涂膜可延缓果实的衰老和营养物质流失,能有效延长鲜枣的货架期。
溶菌酶的来源广泛,从苦瓜、萝卜、家禽蛋清、哺乳动物泪液、唾液以及细菌和真菌细胞壁中均可分离得到。鸡蛋清中的溶菌酶含量是自然界中最丰富的[7],蛋清溶菌酶的化学性质稳定,在酸性和高温条件下,仍然保持较高活性,这与其结构中的氢键、二硫键和疏水键有关。疏水相互作用在溶菌酶的折叠构象中起到相当重要的作用[8]。因此,蛋清溶菌酶被认为是一种硬蛋白,不能被还原为天然结构和未折叠的状态,可用作淀粉样纤维的形成和结构的理想模型。当外部环境改变时,蛋白质的空间构型会因此改变,由可溶的天然态转变为不溶的纤维态,该过程被称为蛋白质的淀粉样纤维化。因此通过改变pH、温度、离子浓度等外部诱导条件,溶菌酶可自我组装形成低聚物、聚集体或淀粉样纤维[9-12]。淀粉样纤维的结构非常稳定,难以分解,同时具有潜在的材料特性,如高硬度、极长径比和集体有序特征[13-14],因此在近年来,淀粉样原纤维在纳米材料领域显示出良好的前景。Zhou 等[15]利用溶菌酶淀粉样纤维作为固定化酶载体形成催化微凝胶,不仅保持了封装酶的完整性,同时显示出坚固的材料特性。France 等[16]制备的溶菌酶淀粉样纤维复合薄膜表现出优异的拉伸强度和韧性。
在本研究中,以溶菌酶为研究对象,通过在低pH 和高温条件下进行淀粉样纤维化蛋白自组装,同时加入增塑剂甘油以降低薄膜脆性,最终通过流延法制得均匀光滑的抗菌纤维薄膜。
1 材料与方法
1.1 材料与仪器
溶菌酶(蛋清,2 万U/mg)、甘油、胰蛋白胨、香兰素 上海源叶生物科技有限公司;冰醋酸 分析纯,上海泰坦化学有限公司;平板计数琼脂 生物级,北京索莱宝科技有限公司;酵母提取物(生物级)、磷酸二氢钠、磷酸氢二钠 上海麦克林生化科技有限公司;氯化钠 分析纯,天津市永大化学试剂有限公司;枯草芽孢杆菌(B. subtilis)、大肠杆菌(E. coli)均保存于生物与化学工程学院C2-413。
HCJ-4G 磁力搅拌水浴锅 常州朗越仪器制造有限公司;Zetasizer Nano 纳米粒度仪 英国Malvern 公司;Multimode SPM 原子力显微镜 美国Veeco 公司;Chirascan 圆二色谱仪 英国Apllied Photophysics 公司; F-4500 荧光分光光度计 日本Hitachi 公司;TA-XT2i 质构仪 北京超技仪器技术有限公司;生化培养箱 上海博讯实业有限公司医疗设备厂。
1.2 实验方法
1.2.1 溶菌酶淀粉样纤维溶液制备 称取5 g 溶菌酶溶于50 mL 醋酸溶液(40% v/v),调节溶液pH 至2.0。将配制好的溶液置于磁力搅拌水浴锅90 ℃加热5 h 得到溶菌酶淀粉样纤维(A-LYZ)溶液,静置备用。以天然溶菌酶(O-LYZ)溶液作为对照,溶解于去离子水中并搅拌2 h[2]。
1.2.2 溶菌酶薄膜制备 称取1.5 g 甘油分别溶于A-LYZ 溶液和O-LYZ 溶液中,搅拌均匀后采用流延法制备薄膜,取10 mL 样品溶液于聚四氟乙烯平皿,室温干燥,揭膜,得到A-LYZ 薄膜和O-LYZ 薄膜,置于RH=40%干燥器保存待用。
1.2.3 粒度测定 采用马尔文粒度分析仪测定溶菌酶的平均粒径和粒度分布。将A-LYZ 溶液用醋酸溶液(pH2.0)稀释至0.5 mg/mL。O-LYZ 溶液用0.01 mol/L 的PBS 缓冲溶液(pH7.0,由磷酸二氢钠、磷酸氢二钠配制)进行稀释[17]。
1.2.4 淀粉样纤维微观形态 溶菌酶经过纤维化前后的颗粒形貌通过原子力显微镜(AFM)观察得到。A-LYZ 溶液用醋酸溶液(pH2.0)稀释至25 μg/mL,O-LYZ 溶液用去离子水稀释。取20 μL 稀释后的溶液滴加在新鲜剥离的云母片表面,等待自然风干[18]。在轻敲模式下进行测量,AFM 观测到的图像用NanoScope Analysis 1.9 软件进行图像处理和分析。
1.2.5 二级结构测定 用去离子水将样品溶液稀释至0.2 mg/mL,并用透析袋去除醋酸减少对检测的干扰。使用圆二色谱仪在190~260 nm 之间进行扫描,扫描速度20 nm/min,带宽 1 nm[19]。二级结构含量的分析和计算根据在线网站http:// dichroweb.cryst.bbk.ac.uk 获得。
1.2.6 荧光猝灭 溶菌酶与香兰素之间的相互作用通过蛋白质内源荧光光谱分析。O-LYZ 溶液和ALYZ 溶液分别用0.01 mol/L 的PBS 缓冲溶液稀释至0.5 mg/L,香兰素溶解于热水中使其浓度达到2.5 mmol/L。在每根试管中分别加入5 mL 的样品溶液,同时加入一定量的香兰素溶液,使香兰素最终浓度分别为0~50 μmol/L。混合均匀后用日立F-4500荧光分光光度计测定,参数设定激发波长290 nm,发射波长300~450 nm,狭缝宽度5 nm,光电倍增管的电压设置为700 V[17]。
1.2.7 薄膜性能测定
1.2.7.1 机械性能 薄膜机械性能主要测定抗拉强度(TS)和断裂伸长率(E)。将薄膜裁剪成20 mm×60 mm 的规格,用夹具固定进行测量,初始夹距30 mm,拉伸速度50 mm/min[20]。
式中,TS-抗拉强度(MPa),F-最大拉力(N),a-试样的宽度(mm),b-试样的厚度(mm)。
式中,E-断裂伸长率(%),L0-试样的原始标线间的距离(mm),L-试样断裂时距离标线间的距离(mm)。
1.2.7.2 水蒸气透过率(WVP) 采用修正的ASTM法进行WVP 的测定[21]。干燥器内放入BaCl2饱和溶液使其湿度保持在90%。选择敞口玻璃容器作为透湿杯放入烘干至恒重的CaCl2并将裁剪的薄膜覆盖在玻璃容器表面,用矿脂密封后置于干燥器中,每隔一段时间称量玻璃容器的重量,并按下式计算薄膜的WVP。
式中,WVP-透湿系数(g·mm/m2·d·kPa), Δmt 时间内质量增量(g),X-膜的厚度(mm),A-透湿杯的有效测定面积(m2),t-时间间隔,h;ΔP-试样两侧水蒸气压差(kPa)。
1.2.7.3 水溶性 (WS) 将薄膜裁剪成20 mm×20 mm的规格,在105 ℃下干燥至恒重m1。加入50 mL去离子水在室温下溶解24 h,将水倒掉后干燥至恒重为m2,根据质量变化计算薄膜的WS[20]。
式中,WS-水溶性(%),m1-第一次干燥至恒重时薄膜的质量(g),m2-第二次干燥至恒重时薄膜的质量(g)。
1.2.8 抑菌性测定 采用培养基扩散法-抑菌圈法[22]测定样品薄膜对E. coli 和B. subtilis的抑菌效果。取100 μL 菌悬液(由胰蛋白胨、酵母提取物、氯化钠配制)接种到熔融的平板计数琼脂中,使细菌浓度达到1×104CFU/mL。将样品薄膜切割成20 mm×20 mm大小的薄膜并用紫外线灯消毒20 min 进行试验,将薄膜放置在培养基平板的中心,37 ℃培养24 h 后测定抑菌圈大小(除去薄膜所占面积)。
1.3 数据处理
所有样品重复测定三次,利用SPSS 软件对实验数据进行方差分析和显著性分析(P<0.05)。
2 结果与分析
2.1 溶菌酶淀粉样纤维溶液和薄膜的外观
如图1 所示,O-LYZ 溶液外观基本澄清,内部混有少许不溶性蛋白(图1A)。由此制备的薄膜透明度高,但表面粗糙,具有一定的粘性和蛋白析出的现象(图1C)。可能的原因是O-LYZ 溶解度较低且与甘油相互结合作用较弱,使得在薄膜干燥过程中附着在表面。而经过淀粉样纤维化处理后得到的A-LYZ溶液颜色明显加深、黏度增大,在室温条件下可凝固成凝胶状(图1B)。由此得到的薄膜表面光滑平整(图1D)。

图1 淀粉样纤维化处理前后溶菌酶溶液和薄膜的外观Fig.1 Lysozyme solution and appearance of films before and after amyloid fibrosis
2.2 溶菌酶淀粉样纤维溶液的粒度测定
O-LYZ 和A-LYZ 溶液的粒度分布和平均粒径如图2 所示。两个对比样品均呈现单峰形态,说明粒径的分布较为集中。O-LYZ 粒径主要分布在40~250 nm,峰值为106 nm,而A-LYZ 的粒度分布明显变宽(530~950 nm),峰值为752 nm(图2 A)。另外,图2 B 显示了淀粉样纤维化处理前后溶菌酶的平均粒径(Dz)。可以明显看到经过酸热诱导处理之后溶菌酶的Dz 显著增大,从174 nm 增大786 nm,这与Bolisetty 等[23]的发现一致。该研究指出溶菌酶在酸热处理后发生水解,使得蛋白质单体在疏水作用和静电斥力作用下转化成更大的纤维聚集体。
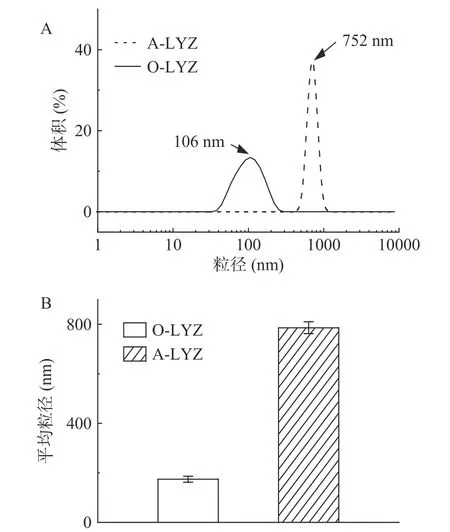
图2 淀粉样纤维化处理前后溶菌酶溶液的粒度分布(A)和平均粒径(B)Fig.2 Volume distribution (A) and Dz (B) of lysozyme before and after amyloid fibrosis
2.3 溶菌酶淀粉样纤维的微观形态
如图3 所示,在AFM 的轻敲模式下观察到除颗粒大小外,蛋白质颗粒的形态随酸热处理有较大变化。在天然状态下观察到粒径约为20~240 nm 的球形低聚物(图3A),分散良好,高度约为0.8~5.4 nm(图3B),与DLS 结果一致。在加热5 h 后,呈现典型的蛋白质纤维聚集体,长而细,无分支,但部分弯曲,呈蠕虫样的卷曲状,长度约为450~920 nm(图3C),高度0.7~3.6 nm(图3D)。Mishra 等[24]发现蛋清溶菌酶在低pH 和65 ℃下加热后发生水解最终形成成熟的淀粉样纤维。在Xiang 等[25]的研究中也发现了大豆分离蛋白进行纤维化处理后,出现了以扭曲的形式存在的蠕虫样原纤维,这与本文得到的结果一致。

图3 淀粉样纤维化处理前后溶菌酶溶液的原子力显微镜成像图Fig.3 Tapping mode AFM images of lysozyme before and after amyloid fibrosis treatment
2.4 溶菌酶淀粉样纤维的二级结构
蛋白质淀粉样纤维化过程通常伴随着分子构象的变化,尤其是高度有序的β-折叠二级结构的形成[26]。如图4 所示,O-LYZ 在206 nm 处具有明显的负平均残基椭圆率,表明其在天然状态下的二级结构以α-螺旋为主。经过酸热处理后,A-LYZ 的波长从206 nm 移到205 nm,同时最大负平均残基椭圆率增加,表明形成了更多的β-折叠结构。另外,利用BeStSel 软件计算得到二级结构相对含量如表1 所示,在纤维化处理过程中,α-螺旋和无规卷曲含量减少,β-折叠和β-转角逐渐增加。其中,α-螺旋含量由24.00%减少到21.70%,β-折叠含量由28.50%显著提高到35.60%(P<0.05),表明有淀粉样纤维的形成。
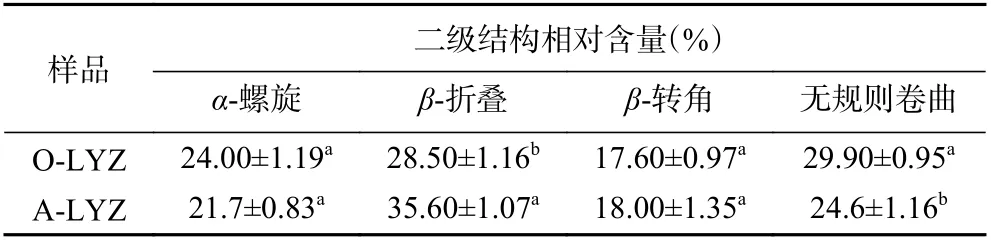
表1 淀粉样纤维化处理前后溶菌酶溶液的二级结构相对含量Table 1 Relative contents of secondary structures of lysozyme before and after amyloid fibrosis

图4 淀粉样纤维化处理前后溶菌酶溶液的远紫外光谱图Fig.4 Far-UV CD spectra of lysozyme before and after amyloid fibrosis
2.5 溶菌酶淀粉样纤维与香兰素相互作用
疏水氨基酸残基(Trp,Tyr 和Phe)是蛋白质的主要荧光基团,使其具有内源性荧光。通常认为,当蛋白质的色氨酸(Trp)发色团处于极性微环境中时,荧光发射最大值(λm)会发生转移或当发色团与溶剂中的猝灭剂相互作用时,荧光的量子产率会降低[27]。因此,可以通过蛋白质内源性荧光猝灭来研究蛋白质与疏水生物活性物质之间的相互作用[28]。
如图5A 所示,O-LYZ 的内源荧光光谱在338 nm处达到最大荧光强度,说明Trp 所处的微环境具有较高的疏水性。经过酸热诱导处理后发生了明显的红移(从338 nm 到343 nm),并且荧光强度下降,表明酸热处理后蛋白质结构发生变化,疏水基团转移到更极性的环境中,进一步证实了淀粉样纤维的形成。为了进一步验证A-LYZ 与香兰素络合作用的产生,图5B 显示了香兰素浓度(0~50 μmol/L)增加对蛋白本征荧光发射光谱的影响。可以观察到,随着香兰素浓度的增加,A-LYZ 的最大荧光强度逐渐降低并且λm 发生红移(343~347 nm),表明溶菌酶的固有荧光被香兰素络合猝灭。在Chen 等[29]的研究中,发现了大豆蛋白和姜黄素之间的荧光猝灭现象。孔爱荣[30]也在研究中发现,香兰素对溶菌酶内源荧光的影响,随着不同浓度的香兰素的加入,溶菌酶特征峰的荧光强度逐渐降低,推测两者结合形成了复合物。

图5 溶菌酶溶液的内源荧光光谱Fig.5 Endogenous fluorescence spectrum of lysozyme
2.6 薄膜性能分析
2.6.1 机械性能分析 抗拉强度用于反映薄膜的变形抗力,拉伸延长率用于描述薄膜的韧性。如表2所示,纤维化处理对溶菌酶薄膜的抗拉强度影响较为显著(P<0.05),A-LYZ 的抗拉强度为2.96±0.25 MPa,比O-LYZ 提高了一倍,但薄膜的拉伸延长率在处理前后没有太大的差异。主要的原因是在加热和酸处理过程中,蛋白质内部结构展开,巯基和疏水性基团暴露在分子表面。在随后的膜干燥阶段,新的疏水基团相互作用并形成新的氢键,从而形成坚固致密的网状结构,得到具有一定机械强度的薄膜[31]。
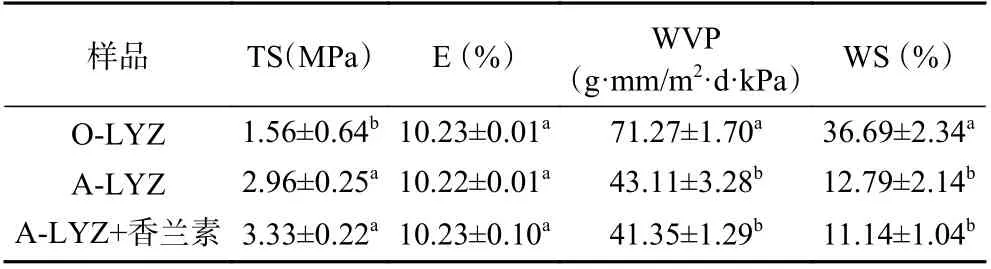
表2 淀粉样纤维化处理前后溶菌酶薄膜的机械性能、水蒸气透过率和水溶性Table 2 Mechanical properties, water vapor permeability and water stability of lysozyme films before and after amyloid fibrosis
2.6.2 阻隔性能 由于蛋白质固有的亲水性质,通常会表现出较差的水蒸气渗透性。本文对薄膜的WVP进行了连续7 d 的测试,结果如表2 所示。与O-LYZ薄膜相比,A-LYZ 薄膜的WVP 有明显的下降,从71.27±1.70 g·mm/m2·d·kPa 降为43.11±3.28 g·mm/m2·d·kPa,说明淀粉样纤维化后薄膜拥有更强的阻水性能。同样的,Peydayesh 等[2]将乳清蛋白进行淀粉样纤维化处理制备得到的薄膜也表现出比原始薄膜更低的WVP。
WS 在一定程度上反映了薄膜在水中的溶解度,如表2 所示,A-LYZ 薄膜的WS(12.79%)明显低于O-LYZ 薄膜的值(36.69%)。在被浸泡24 h 后,OLYZ 薄膜的溶胀显著,水分子不断渗透进蛋白膜内部,而淀粉样纤维化的过程改变了蛋白质的内部结构,亲水基团不断减少,同时疏水基团从分子内部大量暴露。因此变性后的蛋白质在疏水作用和静电斥力下不断靠近,发生了蛋白质的热聚集[32],由此能有效地隔绝水分。并且Peydayesh 等[2]在研究中证明了薄膜在水中释放的主要成分是增塑剂,干燥后的薄膜比浸水前的薄膜表现的更脆。
2.7 抑菌性
表3 显示了样品薄膜对大肠杆菌(E. coli)和枯草芽孢杆菌(B. subtilis)的抗菌活性测试结果。结果表明,O-LYZ 表现出良好的抑菌效果,抑制区域明显,但薄膜存在膨胀和融化的现象,这与天然蛋白质的亲水性有关。相比之下,A-LYZ 薄膜的完整性较好,但抑菌效果较天然状态下会变差,主要的原因是在酸热诱导处理下,酶活性降低使溶菌酶的抑菌效果变差[8]。在周钦育等[33]的研究中也发现,溶菌酶在过酸和过高的温度下会使其酶活性下降,抑菌效果减弱,同时温度越高,溶菌酶变性失活程度越高,失活速度越快。但是在孔爱荣[30]的研究中发现香兰素与溶菌酶可结合生成复合物,并且香兰素的加入可提高溶菌酶的酶活力,因此在含有香兰素的A-LYZ 薄膜表现出优异的抑菌效果,并且香兰素在较低pH 下抑菌效果也会增强[34]。
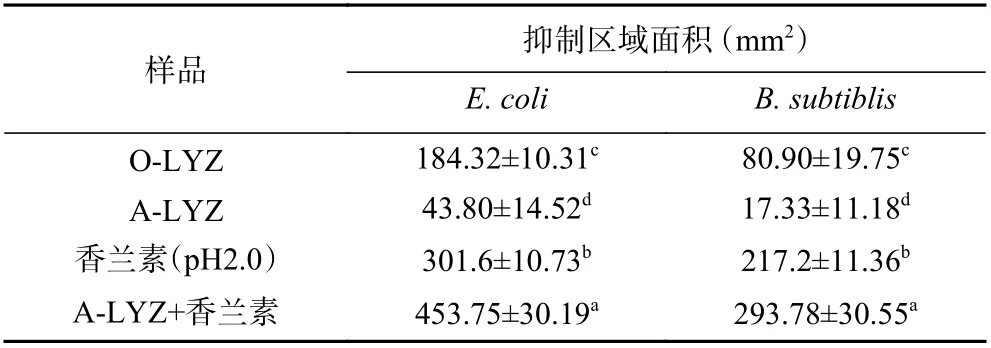
表3 淀粉样纤维化处理前后溶菌酶薄膜对试验微生物的抑菌活性测定Table 3 Bacteriostatic activity against test microorganisms of lysozyme films before and after amyloid fibrosis
3 结论
在本研究中,通过对溶菌酶进行淀粉样纤维化处理,以此作为开发高性能蛋白质的策略。AFM、CD 和荧光猝灭实验分析表明在酸热诱导处理下有淀粉样纤维的形成,并且由淀粉样纤维得到的薄膜外观均匀平整,没有裂纹和气泡。重要的是,纤维化处理改善了机械性能和阻隔性能。A-LYZ 薄膜表现出优异的WVP 和WS,同时TS 也有一定提高。溶菌酶在经过处理后对大肠杆菌和枯草芽孢杆菌仍能保持一定的抑菌效果,香兰素的加入提高了薄膜的协同抗菌性能。
