“以学生为中心”的物理化学教学
——以相平衡为例*
2023-11-03安庆锋
李 红,安庆锋
(1 聊城大学材料科学与工程学院,山东 聊城 252000;2 青岛理工大学(临沂),山东 临沂 273400)
教育部《关于加快建设高水平本科教育全面提高人才培养能力的意见》中指出:坚持以促进学生全面发展为中心,以成果为导向,既注重“教得好”,更注重“学得好”,激发学生学习兴趣和潜能,激励学生爱国、励志、求真、力行,增强学生的社会责任感、创新精神和实践能力。在教学中必须围绕学生、关照学生、服务学生,不断提高学生各方面的能力,促进学生全面发展。在全国高校思想政治工作会议的讲话上,习近平指出:要用好课堂教学这个主渠道,各门课要“守好一段渠、种好责任田”。可见课堂教学在实现价值塑造、知识传授和能力培养“三位一体”的人才培养目标中起着举足轻重的地位。
相图是表征多相系统所处的状态随温度、压力、浓度等强度性质变化而变化的图形。相平衡是热力学基本原理在相平衡领域的应用,在溶解、蒸馏、重结晶、萃取、提纯、无机非金属材料及金相分析中有重要的指导意义。本章主要研究相数、独立组分数和自由度等基本概念和单组份系统、二组分系统相图的基本类型及其应用。由于学生前期基础较少,内容多,图形比较抽象,目前教材[1-3]中只介绍了二组分系统相图的绘制,对于相图中的特殊点,教材中较少涉及,一些参考书给出的答案也不尽相同,使初学者理解有一定的难度。本文以思维导图总结了本章主要内容及相图的重要应用,根据多年的教学经验,讨论了本章在学习过程中学生感到困惑的几个知识点和容易出现的问题,教师在教学中只有注重从学生角度出发来收集学习过程的数据,才能在教学中真正做到有的放矢、因材施教,而“以学生为中心”才能落到实处[4],才能提高学生在学习过程中灵活应用所学知识解决问题的能力,从而达到举一反三的目的。
1 思维导图在相平衡中的应用
思维导图是由英国的东尼·博赞(Tony Buzan)于1970年提出的一种辅助思考工具。它的创作结果是一个从中央出发、有多个分支的放射性图形。思维导图具有重点突出、层次感强、联想和发散思维、个体独创性等特点,适用于自主学习和课堂教学。利用思维导图的特点,结合相平衡的具体内容,绘制如图1所示思维导图,提高学生的逻辑思维能力,在头脑中构建出本章完整的知识框架体系,让其更好地灵活掌握相平衡的知识点[5-6]。让学生变被动学习为主动学习,激发求知欲望,使学生成为学习的主体,提高学习效率,加速达到融会贯通的境界。
通过思维导图,对这一章的内容有了系统的把握。相平衡主要用相律来分析相图,在物理化学中,我们主要讨论单组分和二组分系统的相图。二组分系统相图的类型较多,其实主要可以分为液液二组分系统相图和固固二组分系统相图,每一类按互溶度又可分为完全互溶、部分互溶和不互溶。在思维导图的框架基础上,再去深化各部分内容,知识结构一目了然。
2 几个容易困惑的难点
2.1 相图中特殊点步冷曲线的绘制
步冷曲线是热分析法绘制相图的重要组成部分。首先将二组分固相系统加热熔化,记录冷却过程中温度随时间的变化曲线。根据在冷却过程中的相变化和相律,在步冷曲线上会出现转折点或水平线段,把转折点和水平线段所对应的组成和温度对应到二组分系统的T-x图上即可绘制出固-固二组分系统的相图。反之,在相图中给出一个特定的组成,根据冷却过程遇到的曲线或水平线段我们要能够绘制步冷曲线。对于不是水平线段的端点的组成,我们总结了一个规律:在冷却过程中遇到曲线的时候,步冷曲线上会出现转折点,遇到水平线段的时候,步冷曲线也出现水平线段。但当组成正好在水平线段的端点时,必须要根据冷却过程的相变化进行分析,绘制步冷曲线。图2给出了相图中几个特殊点步冷曲线的绘制,分析了学生在绘制过程中经常出现的问题,在平时授课过程中教师应该着重分析,帮助学生更好的理解利用相律来分析相图。通过这些特殊点步冷曲线的绘制,同学们应该掌握了这类相图中所有组成点的步冷曲线的绘制,从而达到举一反三的目的。
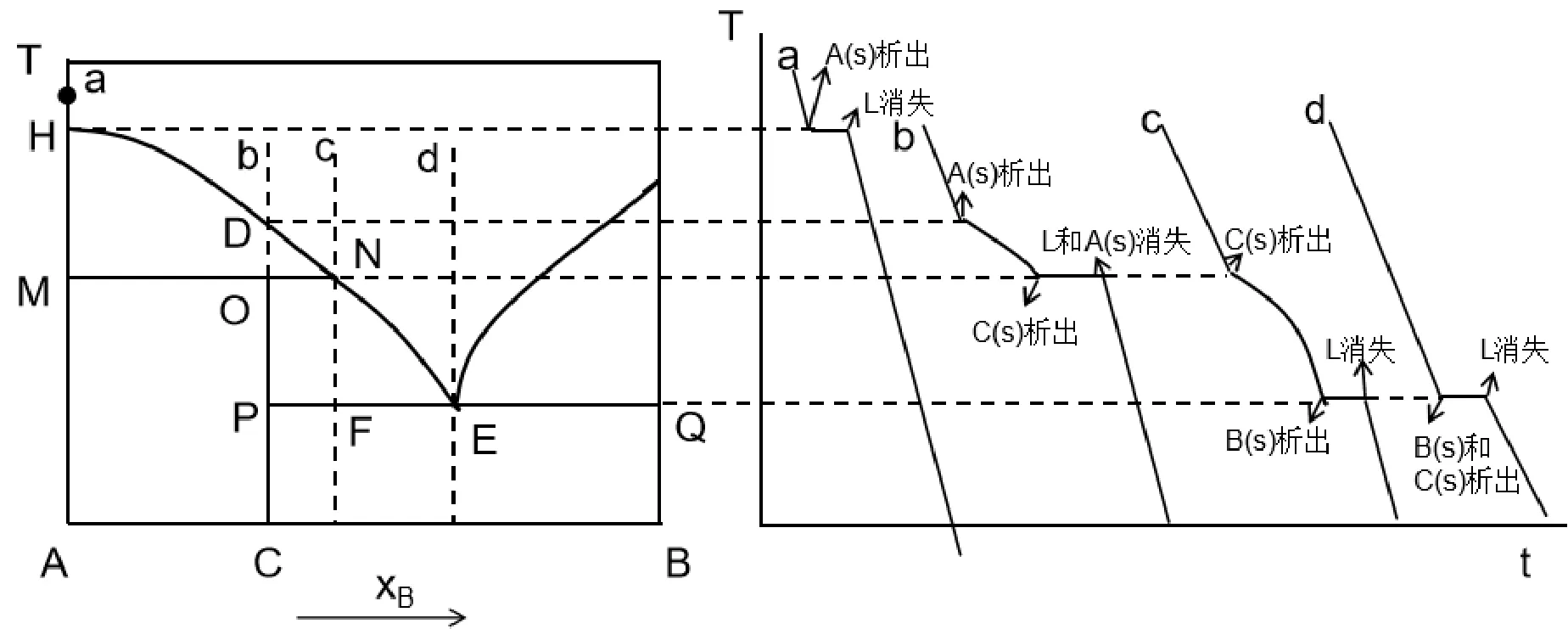
图2 特殊点的步冷曲线
该相图是具有不稳定化合物生成的固-固二组分系统相图,其中a、b、c、d四个点冷却过程相变化如表1~表4所示,步冷曲线如图2右侧所示。

表1 a点冷却过程相变化

表2 b点冷却过程相变化
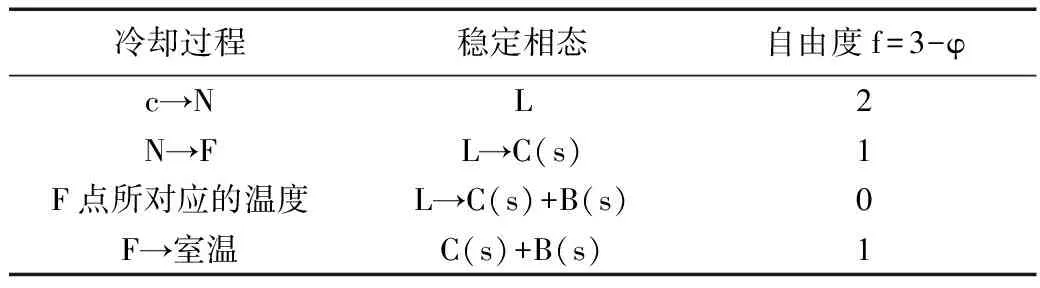
表3 c点冷却过程相变化

表4 d点冷却过程相变化
学生错误:该点同学们在绘制步冷曲线时最常见的错误是把步冷曲线画成如图3所示。

图3 点a常见错误形式
错误(1)学生分析:当冷却到H点时开始有固体的A析出,此时两相共存,根据相律,自由度为0,故步冷曲线出现水平线段,当液相消失时温度下降,到M点时,三相共存,自由度为0,故出现水平线段。
错误(2)学生分析:当冷却到H点时开始有固体的A析出,此时两项共存,自由度为1,步冷曲线出现转折,继续冷却到M点,三相共存,自由度为0,当一相消失,自由度不为0,温度继续下降。
其他同学讨论以上两位同学的分析是否正确,得出结论:错误(1)中,错误原因是遇到水平线段MN时,只有固相纯A一相,此时自由度为1,在步冷曲线上不出现转折点,温度继续下降。错误(2)在于H点的分析,此时自由度为0,应为水平线段。
教师总结:小组讨论得出的结果很好,产生以上错误的原因在于对纯物质冷却过程的相变化理解不透彻。以上错误(1)在降温过程中,虽然遇到了水平线段MN,但此时只有一相,根据相律f=2-φ得出自由度为1,所以在步冷曲线上不出现水平线段,温度继续下降。错误(2)除了错误(1)以外,还有对H点的分析,a点过纯A的组成轴,应用相律的形式为:f=2-φ而不是二组分系统的f=3-φ。H点是纯A的熔点,冷却到该点所对应的温度时液态的A凝固为固态的A,此时2相共存,f=0,步冷曲线出现水平线段,直到液相消失,全部凝结为固态的A,f=1,此时温度才可以继续降低,直到室温。
该点同学容易出现的错误和点a相似,当冷却到相图中的PQ所对应的温度,机械的认为,只要在这条水平线上就是三相共存,自由度为0。按照冷却过程中的相变化分析可知,相图中的P点位于化合物C的组成轴上,在该点时系统只有固体的C存在,此时f=2,温度可以下降,在步冷曲线上不会出现水平线断。
该点在冷却到相图中的N点时同学们容易出错,虽然N点在转熔线上,但此时系统只有L和C(s)两相共存,f=1,随着时间的延长温度可以继续下降。
在有不稳定化合物生成的相图中,如果学生对这几个特殊点的步冷曲线能够正确分析,则此类相图中所有点的步冷曲线及冷却过程中的相变化均能分析正确,做到在分析过程中以不变应万变。
2.2 溶液中物种数和独立组分数的确定
相律是相图中重要的规律,分析相图是以相律为指导进行分析的,相图上的点线区都不能违背相律。在应用相律进行分析时,我们要先确定系统的相数φ、独立组分数c,然后根据相律计算出自由度。相数的确定一般比较容易,而独立组分数c的确定从如下公式入手(不同教材符号略有区别):c=S-R-R′,S为物种数,R为独立的化学平衡的个数,R’为浓度限制条件。
例:NaCl的水溶液中的物种数和独立组分数的确定。
对于此类问题,很多同学迷茫,用不用考虑NaCl的电离?用不用考虑水的电离?下面我们对于不同的考虑方式分别讨论如下:
若不考虑任何物质的电离,则S=2(NaCl,H2O),没有化学平衡,没有浓度限制条件,c=2-0-0=2;
若考虑NaCl和水的电离平衡,S=6(Na+,Cl-,H2O,H+,OH-,NaCl);R=2,H2O → H++OH-,NaCl→Na++Cl-;R′=2,[H+]=[OH-],[Na+]=[Cl-];c=6-2-2=2;
若只考虑NaCl电离平衡,S=4(Na+,Cl-,H2O,NaCl);R=1,NaCl→ Na++Cl-;R′=1,[Na+]=[Cl-];c=4-1-1=2;
若考虑NaCl完全电离,S=3(Na+,Cl-,H2O);R=0;R′=1,[Na+]=[Cl-];c=3-0-1=2。
综上所述,在分析溶液中的独立组分数时,不管是否考虑电解质的电离,对我们确定独立组分数c是没有影响的,不同的考虑方式只影响我们对物种数S的确定。
例2:H2O、K+、Na+、Cl-、I-体系的独立组分数是多少?
此例中很多同学会考虑系统中的物质有NaCl、KCl、NaI、KI、H2O、K+、Na+、Cl-、I-(S=9)。存在NaCl→Na++Cl-,NaI→Na++I-,KCl→K++Cl-,KI→K++I-,这样c=9-4-1=4。实际上解决此类问题大家可以发现,每多一种物质就多了一个方程式,所以无论我们是否考虑溶液中是否存在NaCl、KCl、NaI、KI这些物质,对最后独立组分数c是没有影响的。最简单的考虑方法S=5,R=0,R′=1(电中性),c=5-0-1=4。
3 结 语
相平衡这一章的知识虽然是学生在大学期间第一次接触,但是通过思维导图的形式把知识结构呈现给学生,能激发学生学习的兴趣和学习效率。从学生的角度出发分析特殊点步冷曲线的绘制能加深学生对相律的理解和应用,更好的体会物理化学中的定律不是机械的照搬,在应用公式的过程中要具体问题具体分析,更要在学习中做到举一反三,以不变应万变。对于独立组分数c的经验总结提高了学生分析问题的能力,更重要的是能培养学生的思维方法,在其他课程的学习和独立工作中也是很好的借鉴。
