陆地棉GhNAC1基因的克隆及抗黄萎病功能分析
2023-11-02张曼张进张新雨王国宁王省芬张艳
张曼, 张进, 张新雨, 王国宁, 王省芬, 张艳
(河北农业大学农学院,华北作物改良与调控国家重点实验室,河北省作物种质资源重点实验室,河北保定 071000)
棉花作为重要的经济作物,不仅是纺织工业的关键原料,还是我国近亿棉农的主要经济来源。黄萎病(Verticillium wilt)是一种土传真菌维管束病害,主要由大丽轮枝菌(Verticillium dahliae)、黑白轮枝菌(Verticillium albo-atrum)侵染所致[1]。大丽轮枝菌依靠其微菌核结构可在土壤中存活数年,导致世界范围内多种作物产生严重维管束病害,引起植物叶片黄化、失水萎蔫甚至整株死亡的症状[2-3]。黄萎病自1935 年由美国传入我国后,在黄河流域、长江流域和西北内陆三大棉区不断发展,每年造成的棉花产量损失约占世界皮棉总产量的10%~30%[4]。20 世纪90 年代后,该病在全国范围内大暴发,年发生面积约300 万hm2,经济损失高达12亿元[5]。利用基因工程手段进行抗病防治是最为经济有效的措施,然而受限于栽培陆地棉遗传基础和抗源狭窄,生产上推广的棉花品种很少能够达到抗病水平。
病毒诱导的基因沉默(virus-induced gene silence,VIGS)是RNA 介导的转录后沉默(post transcriptional gene silencing,PTGS),据此发展出了适用于多种植物的VIGS 技术。与传统的转基因技术相比,VIGS 技术具有操作更加简便、周期更短、效果明显、适合高通量等优点,在植物功能基因组学领域表现出巨大的潜力。Gao 等[6]基于烟草脆裂病毒(tobacco rattle virus,TRV)载体体系,构建了适用范围更广、沉默效果更好的植物VIGS技术系统。基于TRV 载体体系的VIGS技术成功应用于棉花,使一些重要的棉花黄萎病抗性基因获得很好的功能分析,如GbRvd[7]、GhLAC15[8]、GhGPA[9]、GhnsLTP[10]等。虽然VIGS 技术难以保持长久稳定的沉默效果[11],但是考虑到棉花苗期黄萎病抗性鉴定可以在沉默的幼苗接菌后25~30 d完成,在此过程中,VIGS 完全可以保证稳定的沉默效果,因此利用VIGS 技术可以高效、快速地鉴定棉花抗黄萎病相关基因功能。
NAC(no apical meristem)转录因子是一种含有NAM/ATAF/CUC 保守结构域的植物特异性转录因子。NAC 转录因子于1997 年首次在矮牵牛中被报道,拟南芥ATAF1/2和CUC2基因编码蛋白的N 端[12]。研究表明,NAC 转录因子不仅在植物生长发育中发挥重要作用,而且也参与病原菌防御相关的次生壁形成、乙烯产生等过程[13-15]。如烟草NbNAC062属于NAC 类膜结合转录因子,被PVY(potato virus Y, PVY)侵染后其转移至细胞核,并可能通过调控UPR(unfolded protein response,UPR)相关基因BiP的表达促进细胞生存,抑制PVY 的早期侵染[16]。接种橡胶树白粉菌后,拟南芥NAC 家族转录因子ATAF2 上调,并与EDS1 发生互作进而正调控拟南芥对白粉菌的抗病性[17]。辣椒CaNAC1能够快速对细菌性斑点病菌、辣椒轻斑驳病毒的侵染和外源激素作出响应,表达量上调并激活抗病反应[18]。
本课题组培育的抗病高产品种农大601(ND601)2006年通过河北省品种委员会审定,多年多点田间病圃与培养室抗病性鉴定结果均显示,该品种黄萎病抗性稳定且达到抗病级别,能够将抗病与高产性状有效协调,保证其高产稳产。因此,以农大601 为材料,深入挖掘其含有的黄萎病抗性基因对于棉花抗病育种及解析抗病与产量之间的协调关系意义重大。本课题组前期从黄萎病菌胁迫处理后的抗病陆地棉农大601 转录组数据库中发现GhNAC1对大丽轮枝菌的侵染响应快速,推测其可能在早期防御反应中发挥作用。基于此,本研究从农大601 中克隆GhNAC1,利用生物信息学等手段分析该基因的特征,利用实时荧光PCR(real-time PCR,RT-PCR)明确GhNAC1在黄萎病菌处理后的表达模式,应用VIGS技术研究该基因的抗病功能,为进一步探索GhNAC1的抗病机制奠定基础。
1 材料与方法
1.1 试验材料
陆地棉抗黄萎病品种农大601 用于克隆GhNAC1,农大棉8 号因具有较高的沉默效果而用于VIGS试验,6个抗病品种(汤棉7401、慈棉9号、苏远04-3、鲁890)和6 个感病品种(奎屯系353、73-782、仁洞67-86、73-184、湖南麻阳洋棉花)用于分析不同种基因表达差异,均由本课题组提供。利用浓硫酸对棉花种子进行脱绒处理,清水中浸泡种子过夜,待种子露白后在湿润的毛巾上催芽,挑选发芽一致(约0.5 cm)的种子播种于装有蛭石的六棱钵中,于光照培养室中生长,培养条件为16 h 光照、8 h 黑暗,光强6 000~6 500 lx,昼温28 ℃、夜温22 ℃,相对湿度40%~50%。
供试大丽轮枝菌(Verticillium dahliae)为生产上强致病力菌系临西2-1[19],由本课题组分离鉴定,并继代保存于PDA(potato dextrose agar)培养基。
1.2 基因克隆
棉苗根组织用液氮研磨,使用EASYspi 植物RNA 快 速 提 取 试 剂 盒(AidLab,北 京)和EasyPure®植物DNA提取试剂盒(TransGen,北京)分别提取总RNA 和DNA,应用PrimeScript™ ⅡcDNA 合成试剂盒(Takara,大连)进行反转录。根据Cotton FGD database(https://cottonfgd.org/)中陆地棉TM-1 的同源序列设计引物(表1),并在农大601 中进行PCR 扩增。PCR 反应体系20 μL:1 μL DNA/cDNA 模板(< 100 ng),正反向引物(表1)各1 μL(10 μmol·L-1),10 μL 10 ×Ex TaqBuffer(Takara,大连)和7 μL 灭菌双蒸水。PCR 程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃ 10 min。PCR 产物经1%琼脂糖凝胶电泳进行检测,胶回收后克隆到pMD™18-T 载体(Takara,大连),转化大肠杆菌TOP10 后经菌落PCR筛选阳性克隆,送金为智公司进行测序。

表1 试验所用引物序列Table 1 Primers used in this experiment
1.3 生物信息学分析
利用Cotton FGD 数据库(https://cottonfgd.org/)进行Blast 比对,同时在NCBI 数据库(http://www.ncbi.nlm.nih.gov/)中分析目的基因编码蛋白的功能域。通过在线工具ProtParam(http://web.expasy.org/protparam)预测蛋白氨基酸组成(amino acid composition)、分子量(molecular weight)、理论等电点(theoretical pI)、不稳定指数(instability index)、脂肪指数(aliphatic index)和总平均亲水性(grand average of hydropathicity)等,利用在线软件SignalP 4.0(http://www. cbs. dtu. dk/services/SignalP)预测蛋白信号肽;利用TMpred 在线工具(http://www.ch.embnet.org/software/TMPRED_form.html)分析蛋白跨膜域;利用在线工具CELLO(http://cello.life.nctu.edu.tw/)进行亚细胞定位;利用NovoPro(https://www.novopro.cn/tools/)预测蛋白二级结构。
1.4 亚细胞定位
利用Premier 5.0 设计引物NAC1-G-F/R(表1),以抗病品种农大601 的cDNA 为模板,克隆基因并使用赛默飞世尔Gateway™ BP Clonase™Ⅱ Enzyme mix 试剂盒连接到pDONR207 入门载体,测序正确后,使用赛默飞世尔Gateway™ LR Clonase™ Ⅱ Enzyme mix 试剂盒,连接到pMDC43(含GFP)用于亚细胞定位。将构建好的亚细胞定位载体转化农杆菌GV3101,28 ℃培养2~3 d,将单克隆摇匀后加入到50 mL LB 液体培养基中,28 ℃摇 床150 r·min-1振 荡 培 养 至OD600为0.8~1.2。菌液以5 000 r·min-1离心10 min,弃上清并用无菌水重悬后混匀,离心10 min,参照Sparkes等[20]方法配置缓冲液重悬菌液,将沉淀用缓冲液进行重悬,静止15 min 后备用。使用1 mL 注射器在5~6 周的本氏烟草叶片下表皮上进行注射,23 ℃过夜避光培养,采用激光共聚焦显微镜(Fluo View FV1000, Olympus)观察荧光信号,GFP 激发光和发射光分别为488和550 nm。
1.5 黄萎病菌胁迫处理
将大丽轮枝菌LX2-1 接种到PDA 固体培养基上,25 ℃培养7 d,然后将菌块接种到PDB(potato dextrose broth)液体培养基[21]中,于25 ℃、150 r·min-1摇床中培养5~7 d。培养好的悬浮孢子液用双层纱布过滤后,再用灭菌蒸馏水将悬浮孢子液浓度调至1 × 107cfu·mL-1,备用。采用底部注射菌液定量接种法[22]接菌,每钵接种8 mL 菌液,接菌后的棉苗置于昼温25 ℃、夜温22 ℃,相对湿度65%~70%,光照不变的条件下继续培养[23],其间定期浇灌Hoagland 营养液[24]以补充养分。分别在接菌后6、12、24、36 和48 h 取棉苗根组织,保存在-80 ℃备用。每个样本取3 棵整齐一致的棉苗混样,每个时间点取3个生物学重复。以蒸馏水代替孢子悬浮液处理的棉苗作为对阴性照组。
1.6 RT-PCR
采用液氮研磨和EASYspi 植物RNA 快速提取试剂盒提取棉苗RNA。通过琼脂糖电泳和NanoDrop2 000 超微量分光光度计(Thermo Scientific)对RNA 的质量和含量进行检测。利用PrimeScript ™ RT reagent Kit with gDNA Eraser(TaKaRa)并参照说明书完成cDNA 的合成,并用于RT-PCR。RT-PCR 反应体系(20 μL):1 μL cDNA 模板(< 100 ng),10 μL SYBR®Premix Ex TaqTM(TaKaRa),正、反向引物(表1)各0.8 μL(10 μmol·L-1),7.4 μL 灭菌双蒸水。反应在CFX96 Real-Time PCR Detection System(Bio-Rad)中 进行,反应程序:95 ℃ 15 s;95 ℃ 10 s,58 ℃ 10 s,72 ℃ 15 s,40 个循环。以陆地棉UBQ14(Ghir_D1 0G001850)作为内参,每个反应设置3次生物学重复。采用2-ΔΔCt法[25]进行相对定量分析,并利用GraphPad Prism®6软件进行统计分析和作图。
1.7 病级统计
接种后25 d,采用5级分类法[20]对棉苗进行病级统计:0级,植株无病症;1级,子叶发病,真叶无病症;2 级,子叶以上的第一片真叶发病;3 级,两片及以上真叶发病,新叶无病症;4 级,植株生长点或整株枯死。病情指数(disease index, DI)的计算公式[26]如下。
1.8 棉花VIGS试验
设计引物NAC1-V-F/R(表1),在GhNAC1序列两端引入酶切位点EcoRⅠ和KpnⅠ,以含有GhNAC1ORF 的质粒为模板,进行PCR 扩增。PCR 产物经胶回收后克隆至pMD™18-T 载体,再经双酶切,将回收目的片段克隆至VIGS 载体(pTRV2)。采用冻融法将pTRV2 重组质粒转入农杆菌GV3101 感受态细胞[27]。参照Gao 等[28]的方法进行遗传转化,GhNAC1沉默效果通过RT-PCR检测,方法同1.4。
2 结果与分析
2.1 GhNAC1的克隆与生物信息学分析
从黄萎病菌胁迫处理后的陆地棉农大601 转录组数据库中,筛选到与棉花抗黄萎病相关的基因Ghir_A01G000170(GhM_A01G0037),该基因含有NAM 结构域,命名为GhNAC1。根据陆地棉TM-1 基因组中GhNAC1的序列信息,设计特异引物进行PCR 扩增,获得约800 bp 的目的片段。经测序,获得GhNAC1的ORF 全长序列840 bp,该基因编码279 个氨基酸残基。在NCBI 上BLAST 结果显示,GhNAC1属于NAM 超级家族,NAM 结构域在10~130 aa位置。
GhNAC1蛋白分子量32.4 kD,理论等电点pI为8.91,包括4 542 个原子,分子式C1456H2264N388O421S13。在组成GhNAC1 蛋白的20 种氨基酸中,赖氨酸(Lys)所占比例最高(9.3%),而半胱氨酸(Cys)所占的比例最低(1.1%)。GhNAC1 的不稳定指数47.78,属于不稳定蛋白;脂肪指数72.33;总平均亲水性-0.592。GhNAC1 没有信号肽和跨膜结构(图1A 和B),亚细胞定位预测结果显示GhNAC1定位在细胞核。蛋白二级结构分析显示,GhNAC1含有10个α螺旋和10个β折叠(图1C)。
2.2 GhNAC1的亚细胞定位分析
亚细胞定位预测结果显示GhNAC1定位于细胞核。为进一步确定GhNAC1 在细胞中的位置,将其与GFP 蛋白进行融合表达。在CaMV 35S 启动子的控制下,构建了GhNAC1 与GFP 的融合蛋白,并在烟草表皮细胞中瞬时表达。GhNAC1-GFP 融合蛋白侵染烟草表皮后,荧光成像显示定位在细胞核上(图2),与预测结果一致。

图2 GhNAC1亚细胞定位Fig. 2 Subcellular localization of GhNAC1

图2 GhNAC1蛋白结构分析Fig. 2 Structure analysis of GhNAC1 protein
2.3 GhNAC1的表达模式分析
在四叶期取棉苗不同组织进行表达检测,结果显示GhNAC1在叶中的表达显著高于根和茎(图3A)。对于抗黄萎病品种ND601,在检测的5个时间点中,GhNAC1的表达在6、12 和24 phi(hours post infection)均显著上调(图3B)。GhNAC1在6 个抗病和6 个感病品种的表达水平检测结果显示,GhNAC1在抗病品种的表达水平显著高于感病品种(图3C),进一步证明GhNAC1参与了棉花对黄萎病的抗病反应,且可能是参与棉花抗病反应的正调控因子。
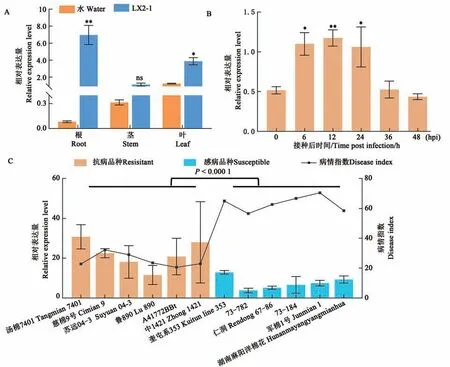
图3 GhNAC1的表达模式Fig. 3 Expression pattern of GhNAC1
2.4 GhNAC1正调控棉花黄萎病抗性
利用VIGS 处理农大棉8 号7 d 后,沉默CLA1基因的棉苗呈现出新生真叶白化现象(图4A),表明本研究成功建立了VIGS技术体系。此时,通过RT-PCR 检测GhNAC1的沉默效果,如图4B 所示,与对照(CK)棉苗相比,GhNAC1基因在沉默棉苗中的表达量显著下调,表明棉花内源GhNAC1得到有效沉默,这些沉默植株继续用于抗黄萎病功能分析。沉默植株与对照植株分别接种临西2-1,接菌20 d 后发现GhNAC1沉默植株较对照呈现出更加严重的叶片黄化、萎蔫等典型的黄萎病症状(图4C)。病情指数统计结果显示,沉默植株病指为44.1(感病),显著高于对照植株27.9(耐病)(图4D)。植株茎杆纵切观察显示,沉默植株的维管束褐化程度较对照植株更严重(图4E)。由此可见,抑制GhNAC1基因的表达可显著降低棉花对黄萎病的抗性,表明GhNAC1正调控棉花抗黄萎病反应。
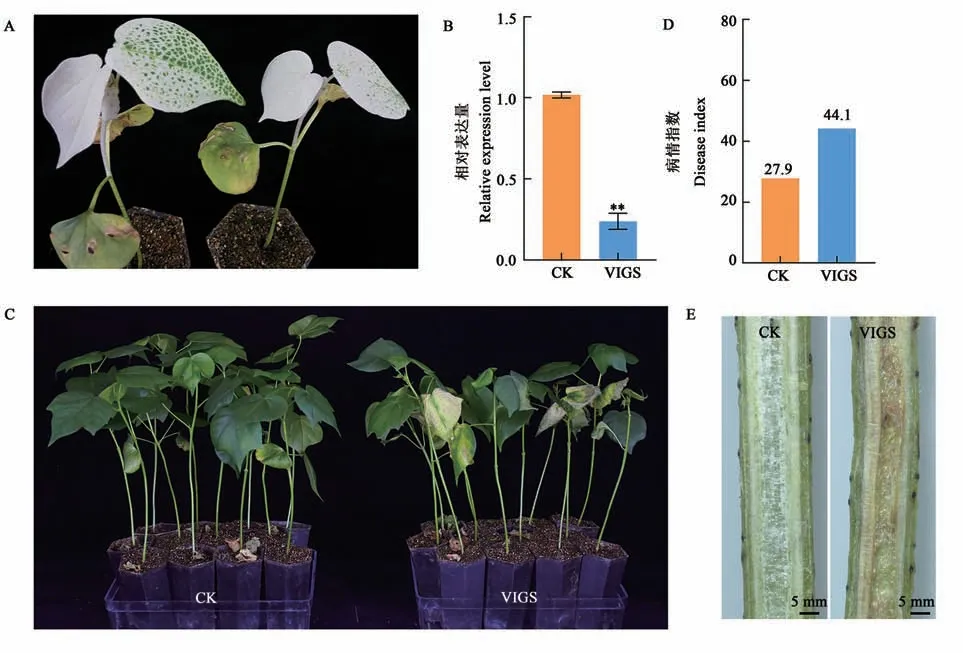
图4 沉默GhNAC1降低了棉花对大丽轮枝菌的抗性Fig. 4 Silencing GhNAC1 reduced the resistance to V. dahliae in cotton
2.5 沉默GhNAC1 后降低了水杨酸通路相关基因表达
水杨酸(salicylic acid,SA)能够诱导植物被病原菌侵染后相关蛋白的合成,从而提高植物的抗病性,SA 相关信号途径被认为是参与生物胁迫的重要抗病路径[29]。对GhNAC1沉默植株中SA 通路相关的基因进行了检测,发现沉默植株中SA通路主要标志基因(PAD4、NDR1、NPR1、和PR1)的表达水平显著下降(图5),推测GhNAC1 通过激活SA 信号通路增强棉花黄萎病抗性。
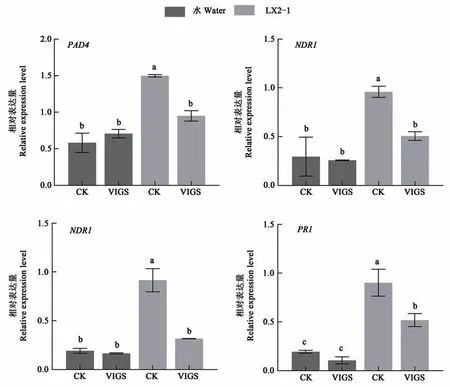
图5 GhNAC1沉默棉花接菌后水杨酸途径基因表达分析Fig. 5 Analysis of gene expression of salicylic acid pathway in GhNAC1 silenced cotton after inoculation
3 讨论
黄萎病是土传真菌病害,严重影响植物的生长发育,降低作物的品质和产量。黄萎病每年对棉花造成严重的产量损失与品质下降[4]。培育抗病品种是防治黄萎病最有效的途径,挖掘黄萎病抗性基因,阐明基因的抗病功能一直是棉花抗病育种的重要研究内容。近年来研究表明,NAC 转录因子在生长、发育、衰老和形态发生等多种生物过程中发挥重要作用,并广泛参与不同植物激素、多种非生物和生物胁迫响应的信号通路[30]。在模式植物和大田作物中,均有报道NAC基因响应病原菌的感染而诱导表达[31]。本研究在黄萎病菌胁迫处理的cDNA 文库中鉴定了GhNAC1基因,该基因定位在细胞核,能够在根部快速响应黄萎病菌诱导表达量显著升高,并在抗病品种的表达水平显著高于感病品种,表明GhNAC1基因参与了棉花对黄萎病的抗性,为棉花抗性育种提供新的候选基因。过表达或沉默NAC基因导致植株对病原菌的抗性增强或减弱[32-33],表明NAC 转录因子可以正向或负向地调节植物的抗病/防御反应。OsNAC6是参与水稻抗病的NAC 转录因子,过表达OsNAC6的转基因水稻对稻瘟病、缺水和高盐胁迫的耐受性都有提高[34]。在水稻中过表达OsNAC111、OsNAC58和OsONAC066可以提高水稻对稻瘟病的抗性[19,35];在小麦中,沉默TaNAC2可在条锈菌(Puccinia striiformis f.sp.Tritici,Pst)与小麦互作早期显著增加H2O2的合成,降低菌丝生长,从而增强植株对条锈病的抗性[36];沉默番茄SlSRN1(solanum lycopersicum stress-related NAC1)降低了番茄对灰葡萄球菌(Botrytis cinerea)的抗性,表明SlSRN1是番茄对灰葡萄球菌防御反应的正调控因子[37]。马铃薯中的StNACb4被证明能够增强对青枯病的抗性[38]。上述研究表明,NAC 转录因子参与了植株对多种病原菌的抗病反应。本研究对陆地棉GhNAC1基因进行沉默后发现,相较于TRV∶00植株,TRV∶GhNAC1沉默植株叶片褪绿更明显,整体表现为萎蔫,大多数沉默植株表现出较高的病害等级(2、3、4),茎秆被真菌侵染力度更大。因此,沉默GhNAC1显著降低了棉花对黄萎病的抗性,表明GhNAC1正向调控棉花黄萎病抗性,进一步扩充了NAC 转录因子调节植物防御反应的内容。
SA 是重要的信号分子,在许多植物病原体相互作用中激活防御反应,特别是针对生物营养体和半生物营养体[39-40]。SA的生物合成途径有2种,分别是异分支酸途径(isochorismate synthase,ICS)和苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)途径,它们都是从分支酸盐开始的[41],SA合成主要通过ICS途径,发生在叶绿体中,约占SA合成的90%[42]。此外,染色质免疫沉淀(ChIP)试验表明,在ICS1和SAGT1启动子中均含有NAC 核心结合位点,且被ANAC019沉淀富集。 因此,ANAC019、ANAC055、ANAC072可能分别通过抑制ICS1和诱导SAGT降低拟南芥SA 的合成,增强SA的代谢,成为SA 积累的负转录调控因子[43]。本研究对沉默植株SA 信号通路相关基因(PAD4、NDR1、NPR1和PR1)的表达进行了检测,发现它们在沉默植株中明显受到抑制,表明GhNAC1参与了SA 介导的抗病信号通路。上述结果为深入研究GhNAC1的抗病机制及分子调控网络奠定了基础。
本研究克隆了GhNAC1,并验证了其在黄萎病抗性中的作用。GhNAC1是棉花黄萎病抗性的正调控基因,可能通过参与SA信号途径增强棉花对黄萎病抗性,为棉花抗病育种提供新的候选基因。
