MDEA/正丁醇/水相变吸收剂的CO2吸收性能及动力学特性
2023-11-01唐建峰许义飞孙培源
唐建峰,陈 洁,桑 伟,许义飞,孙培源,王 铭
(1.中国石油大学(华东) 储运与建筑工程学院,山东 青岛 266580;2.中国石油大学(华东) 山东省油气储运安全省级重点实验室,山东 青岛 266580)
人为排放化石燃料燃烧产生的大量二氧化碳(CO2)加剧了全球变暖[1]。有机胺化学吸收法被认为是一种有效的燃烧后CO2捕集方法,可减少CO2排放量[2]。然而,常见的有机胺吸收剂的再生能耗高,溶剂再生时所需要的能量会导致电力成本增加约60%[3]。为了减少CO2捕集过程中的能量损失,开发出新型相变吸收剂——吸收CO2后可以自行形成或加热至某一温度后形成具有明显特征的两相的吸收剂,其仅需将CO2富相送至再生塔加热,明显减少了溶液的循环量,具有大幅降低再生能耗的潜力[4-5]。
近年来,物理溶剂型相变吸收剂由于具备成本低廉、相变产物黏度较低、溶液体系稳定[6]和分相后富相溶液体积分数低等优点,逐渐成为研究热点。物理溶剂型相变吸收剂中,物理溶剂的加入会对溶液的吸收性能产生一定的影响,且溶液在吸收过程中发生分相,分相后的溶液中贫、富相间物质的转移也会对其动力学性能产生一定的影响。目前,较多学者对其动力学展开研究,如田志杰[7]利用湿壁塔研究了实验工况对乙醇胺(MEA)/环丁砜/水相变吸收剂CO2吸收速率的影响,并建立了反应动力学模型,研究温度和CO2负载对动力学的影响。结果表明,CO2吸收速率随温度的升高而增大,随CO2负载的增大而减小。于松华[8]建立了二乙烯三胺(DETA)/环丁砜/水相变吸收剂的动力学模型,并结合实验结果进行了分析,认为随着CO2吸收量的增加,传质阻力由气膜一侧转移到液膜一侧。张艺峰[9]建立了气液反应动力学模型,对比了几种相变吸收剂的CO2吸收速率,并研究了温度和CO2负荷对传质系数的影响。WANG 等[10]研究了N,N-二甲基丁胺(DMBA)/二乙氨基乙醇(DEEA)/水相变吸收剂吸收CO2的反应动力学,发现4 mol/L DMBA + 2 mol/L DEEA具有较高的吸收率和反应稳定性,CO2吸收主要受液膜扩散过程的影响。沈丽[11]对氨乙基哌嗪(AEP)/正丙醇/水相变吸收剂吸收CO2的动力学性能进行研究,发现其反应速率常数随着温度的升高而升高,随着CO2吸收负荷的升高而降低,并拟合得到阿伦尼乌斯公式,可实现对反应速率较为精准的预测。
综上,虽然学者们已对物理溶剂型相变吸收剂的反应动力学进行了相关研究,但是对相变吸收剂吸收CO2过程的动力学研究只局限于自身,未与非相变体系进行对比分析,通过对比两种体系下溶液物性参数及动力学参数,有助于进一步了解相变吸收剂的传质反应机理。因此,本文在前期研究的基础上,选取性能较优的N-甲基二乙醇胺(MDEA)/正丁醇/水相变吸收剂作为研究对象[12],研究物理溶剂正丁醇的加入对MDEA 水溶液吸收性能的影响。同时,为了探究物理溶剂正丁醇的内在作用机制,使用13C NMR 表征手段测试吸收过程中MDEA/正丁醇/水相变吸收剂的物质组成变化情况,分析MDEA/正丁醇/水相变吸收剂的反应机理及上下相的物质转移过程;在此基础上进行动力学实验获取其动力学参数并与MDEA 水溶液吸收CO2动力学参数相对比,深入了解MDEA/正丁醇/水相变吸收剂吸收CO2过程中的动力学特性。
1 实验部分
1.1 实验气体与试剂
原料气:混合气(35%CO2+ 65%N2,体积分数),青岛天源特种气体厂;试剂:MDEA(C5H13NO2),分析纯,上海展云化工有限公司;正丁醇(C4H10O),分析纯,国药集团化学试剂有限公司;硫酸(H2SO4),纯度为98%(质量分数),国药集团化学试剂有限公司;蒸馏水,实验室自制。
1.2 实验装置及方法
1.2.1 CO2吸收实验
CO2吸收实验装置见图1,主要由反应釜、进气预热调压系统、磁力搅拌系统、电加热系统、抽真空系统、数据采集系统和控制系统组成。本文在反应釜中放入配制好的定量为100 mL吸收液,随后向反应釜中通入CO2和N2混合气体进行充分反应,通过传感器监测实验中温度和压力的变化并对吸收剂的吸收性能指标进行测算[12]。
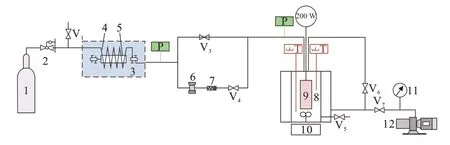
1—高压气瓶;2—减压阀;3—恒温水浴;4—预热盘管;5—调压阀;6—调压阀;7—单向阀;8—绝热釜;9—定功率加热棒;10—磁力搅拌器;11—真空表;12—真空泵;Vi—阀门;P—压力表;T—温度计。
1.2.2 分相实验
本文采用恒温水浴箱、量筒、分液漏斗和酸解实验装置[13]等实验器材对分相性能指标进行测算。首先,将反应后的溶液倒入量筒后置于恒温水浴箱中,待两相分界面稳定时,记录此时溶液总体积与富相溶液体积。随后,利用分液漏斗将贫富相溶液分开,并分别对贫富相溶液取样,采用酸解法测量其CO2负荷[12]。
1.2.3 动力学实验
本文利用双搅拌釜进行动力学实验,实验装置见图2。该实验装置主要由搅拌釜、配气部分、循环水浴和数据采集等部分组成。具体实验步骤如下:(1)配制实验所需的溶液:MDEA水溶液、MDEA/正丁醇/水溶液;(2)关闭除连接真空泵外的其他阀门,打开真空泵对真空腔与反应釜内部进行真空处理;(3)将待反应溶液充入反应釜,并加热至实验所需温度(303.15~343.15 K);(4)充入气体,开始实验,记录压力随时间的变化;(5)取出反应后的溶液;(6)整理与清洗实验装置。
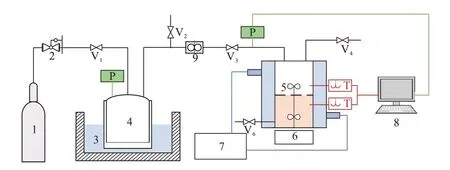
图2 双搅拌釜实验装置示意Fig.2 Schematic diagram of double stirred tank experimental device
1.3 实验指标
选取CO2吸收速率和CO2吸收负荷作为CO2吸收性能的评价指标,富相比例和富相CO2含量比例作为分相性能的评价指标,传质速率作为动力学性能的评价指标,根据各性能指标实验结果对相变吸收剂性能进行分析。
1.3.1 CO2吸收速率与CO2吸收负荷
CO2吸收负荷是指单位体积的溶液吸收的CO2的物质的量,其计算公式见式(1)。
式中,L为胺液的CO2吸收负荷,mol/L;ΔCb为气相中CO2的浓度变化,mol/L;Vg为反应釜气相容积,L;Vl为反应釜液相容积,L。
CO2吸收速率是指单位时间内单位体积溶液吸收CO2的物质的量,其计算公式见式(2)。
式中,c为胺液的CO2吸收速率,mol/(L·min);Δτ为吸收时间,min。
1.3.2 富相比例与富相CO2含量比例
富相比例(φ,%)为吸收后富相溶液的体积与溶液总体积的比值,其计算公式见式(3)。
式中,Vrich为富相溶液体积,mL;V为溶液总体积,mL。
富相CO2含量比例(ϕ,%)为富相中含有的CO2的物质的量与溶液总共含有CO2的物质的量的比值,其计算公式见式(4)。
式中,nlean为贫相中CO2的物质的量,mol;nrich为富相中CO2的物质的量,mol。
1.3.3 传质速率
双搅拌釜中CO2的传质速率的计算公式见式(5)。
式中,N为传质速率,kmol/m2·s;VG为反应釜中气相的体积,m3;T为温度,K、t为时间,s;R为气体常数,本文取值为8.314 J/(mol·K);A为双搅拌釜的横截面积,m2;pCO2为CO2分压,kPa。
1.4 物性参数的测定与表征方法
1.4.1 物性参数的测定
溶液黏度的测定:实验使用安东帕MCR-2旋转流变仪完成,该旋转流变仪主要由黏度测试主机、水浴降温系统和空气压缩机组成。温度测试范围为-20~100 ℃,黏度测试范围为0.1~109.0 mPa·s,测试精度为0.01 mPa·s。
CO2的亨利常数与扩散系数的测定:由于CO2会与MDEA 发生反应,CO2在胺溶液中的物理亨利常数不能直接通过实验测得。考虑到N2O与CO2有相似的结构,且N2O 不会与MDEA 发生化学反应,可先使用实验装置测得N2O在MDEA/正丁醇/水溶液中的亨利常数,再使用N2O 类比法得到CO2在有机胺溶液中的亨利常数,见式(6)。
式中,HCO2,solution为CO2在有机胺溶液中的亨利常数,kPa/(m3·kmol);HN2O,solution为NO2在有机胺溶液中的亨利常数,kPa/(m3·kmol);HCO2,H2O为CO2在水中的亨利常数,kPa/(m3·kmol);HN2O,H2O为N2O在水中的亨利常数,kPa/(m3·kmol),CO2和N2O 在水中的亨利常数的计算公式分别见式(7)和式(8)[14]。
CO2在溶液中的扩散系数(DCO2,solution,m2/s),可以使用Stokes-Einstein方程[15]估算,见式(9)。
式中,μH2O为水的黏度,mPa·s;μsolution为溶液的黏度,mPa·s;DCO2,H2O为CO2在水中的扩散系数,m2/s,计算公式见式(10)[16]。
1.4.213C NMR表征
采用核磁共振碳谱分析MDEA/正丁醇/水相变吸收剂吸收CO2过程中溶液中的物质分布情况,根据物质在两相中的分布情况来研究其反应机理。实验步骤主要为:(1)分别对不同CO2吸收负荷下的吸收剂进行取样,采用重水(D2O)作为溶剂配制测试样品。(2)利用核磁共振波谱仪(AscendTM 400,德国Bruker)对样品进行测试,测试结果利用MestReNova 软件进行分析,得到溶液中各物质碳原子对应的化学位移,借此确定溶液中的反应产物。
2 结果与讨论
2.1 MDEA/正丁醇/水相变吸收剂的CO2 吸收性能研究
2.1.1m(正丁醇):m(水)的影响
为探究m(正丁醇):m(水)对MDEA 水溶液吸收性能的影响,利用绝热吸收实验装置进行吸收实验。采用65%N2+ 35%CO2混合气,在吸收压力为3.1 MPa、吸收温度为313.15 K 的条件下,固定MDEA的质量分数为30%,调节m(正丁醇):m(水)进行CO2吸收实验。溶液的CO2吸收速率实验结果见图3(a),溶液的CO2吸收负荷实验结果见图3(b),溶液的分相情况和性质见表1。
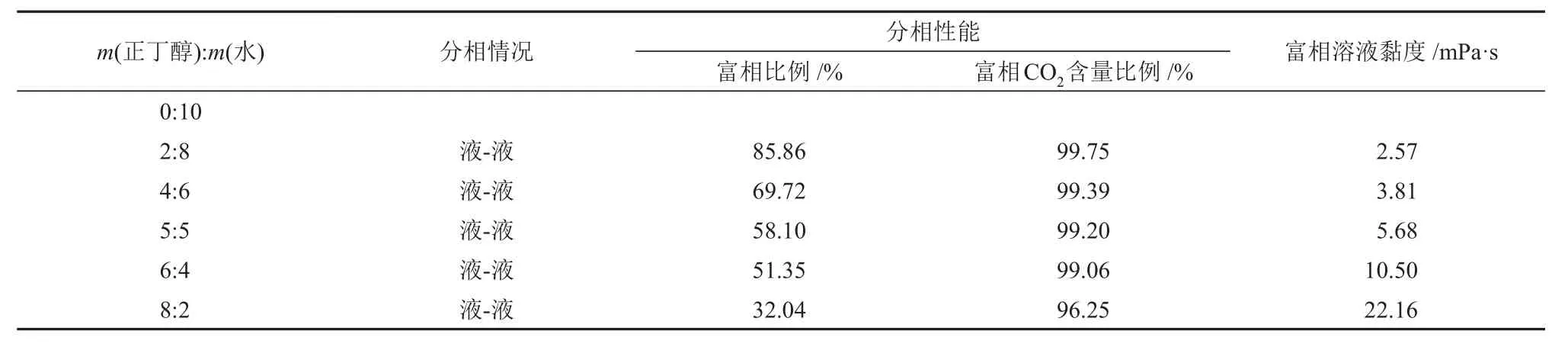
表1 不同m(正丁醇):m(水)下MDEA/正丁醇/水相变吸收剂吸收CO2后溶液的分相行为Table 1 Phase separation behavior of solution after CO2 absorption by MDEA/n-butanol/water phase change absorbent with different m(n-butanol):m(water)
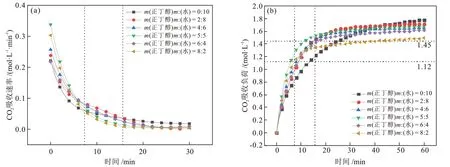
图3 m(正丁醇):m(水)对CO2吸收性能的影响Fig.3 Effect of m(n-butanol):m(water) on CO2 absorption performance
由图3 和表1 可知,正丁醇的含量对MDEA/正丁醇/水相变吸收剂的CO2吸收性能和分相性能有较大影响。溶液中加入正丁醇后,在前9 min左右溶液的CO2吸收速率都出现了不同程度的提高,吸收实验结束时最终的CO2吸收负荷都出现不同程度的降低;且富相比例和富相CO2含量比例与正丁醇的含量呈负相关,溶液黏度与正丁醇的含量呈正相关。分析认为,在CO2吸收负荷较低(小于1.12 mol/L)时,溶液CO2吸收速率的提升是由于正丁醇对CO2的溶解性增加,减小了CO2在气液间的传质阻力,给有机胺提供了较高浓度CO2的反应环境,因此MDEA 的CO2吸收速率得到一定的提升。在CO2吸收负荷较高(大于1.45 mol/L)时,溶液CO2吸收负荷的下降是由于正丁醇取代了原有机胺溶液中的部分水,且一部分水用来溶解反应产物,使得用于反应的水的物质的量减少;并且富相溶液黏度较大,使得液相传质阻力较大,导致溶液的CO2吸收负荷降低。
当溶液中m(正丁醇):m(水)较小时,正丁醇的含量较少,正丁醇对CO2吸收过程的促进作用较小,因此CO2吸收速率相对较低一些;但是由于其水含量较多,使其有充足的水参与反应,并且富相黏度较小,使其在CO2吸收反应后半段液相传质阻力较小,因此CO2吸收负荷相对较高。当溶液中m(正丁醇):m(水)较大时,正丁醇含量较多,其CO2吸收速率较高,但是水含量较少,使得CO2吸收负荷大幅降低,并且分相后富相体积较小,导致富相黏度升高。此外,富相CO2含量比例也出现降低趋势,说明较高的富相黏度也对溶液的分相性能产生了影响[17]。提高正丁醇在溶液中的含量能够有效降低富相体积,这对于降低再生能耗是有利的,但是过高的含量也会导致分相性能变差、富相溶液黏度升高等问题,同时富相溶液黏度的升高也会影响再生性能。当m(正丁醇):m(水)为5:5 时,其CO2吸收性能较好,并且拥有较低的富相比例和溶液黏度,分别为58.10%和5.68 mPa·s。因此,认为MDEA/正丁醇/水相变吸收剂中m(正丁醇):m(水)为5:5时整体性能最优。
2.1.2 MDEA含量的影响
采用65%N2+ 35%CO2混合气,在吸收压力为3.1 MPa,吸收温度为313.15 K 的条件下,固定m(正丁醇):m(水)为5:5,选取不同含量(质量分数,分别为30%、40%和50%)的MDEA溶液进行CO2吸收实验,溶液的CO2吸收速率实验结果见图4(a),溶液CO2吸收负荷实验结果见图4(b),溶液的分相情况和性质见表2。
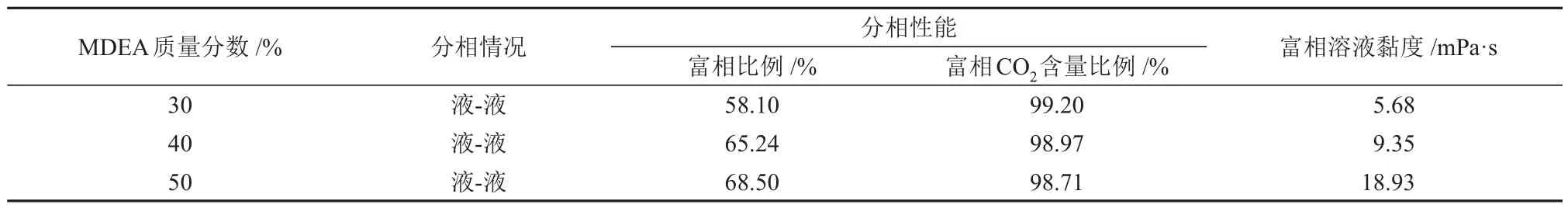
表2 不同MDEA含量下MDEA/正丁醇/水相变吸收剂吸收CO2后溶液的分相行为Table 2 Phase separation behavior of solution after CO2 absorption by MDEA/n-butanol/water phase change absorbent with different MDEA contents
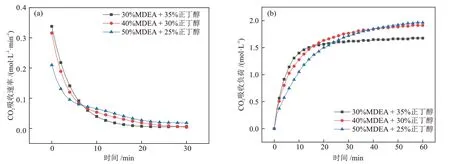
图4 MDEA含量对CO2吸收性能的影响Fig.4 Effect of MDEA content on CO2 absorption performance
由图4和表2可知,MDEA的含量对溶液的CO2吸收性能和分相性能有一定的影响。随着MDEA含量从30%升高至50%,溶液的CO2吸收速率在前8 min左右呈现下降的趋势,且下降幅度逐渐变大;溶液的CO2吸收负荷呈现上升趋势,且上升幅度减小;富相比例和溶液黏度与MDEA 含量呈正相关,富相CO2含量比例与MDEA 含量呈负相关。分析认为,当MDEA 含量较低时,溶液中正丁醇的含量较高,使得溶液的CO2吸收速率提升,但溶液很快就达到CO2吸收饱和。当MDEA含量较高时,溶液中正丁醇的含量较低,故CO2吸收速率降低,并且溶液中水含量的减少也会对CO2吸收速率有一定的影响。但MDEA 含量的升高,增强了其助溶性能,使溶液能够在较大的CO2吸收负荷范围内不发生分相,保证有充足的水参与反应,从而增加了溶液的CO2吸收负荷。但是MDEA 含量过高,富相溶液黏度过大,使液相传质阻力增大,CO2吸收负荷提升幅度降低。综上所述,MDEA含量的升高会提高溶液的CO2吸收负荷,但会降低溶液中正丁醇的含量,从而降低CO2吸收速率。当MDEA含量为40%时,此时溶液的CO2吸收性能较好,且溶液富相黏度较低为9.35 mPa·s,因此,认为MDEA含量为40%时溶液的综合性能较优。
2.1.3 正丁醇对MDEA 水溶液亨利常数和扩散系数的影响
为探究正丁醇取代部分水后对MDEA 水溶液亨利常数和扩散系数的影响,分别测量了MDEA/正丁醇/水(40%MDEA + 30%正丁醇+ 30%H2O)相变吸收剂和MDEA水溶液(40%MDEA + 60%H2O)在温度为303.15~343.15 K 内、CO2负荷为0~0.9 mol/mol(1 mol MDEA 中的CO2物质的量,下同)内溶液的亨利常数和扩散系数。亨利系数的测量结果见表3和表4,扩散系数的测量结果见表5、表6和表7。
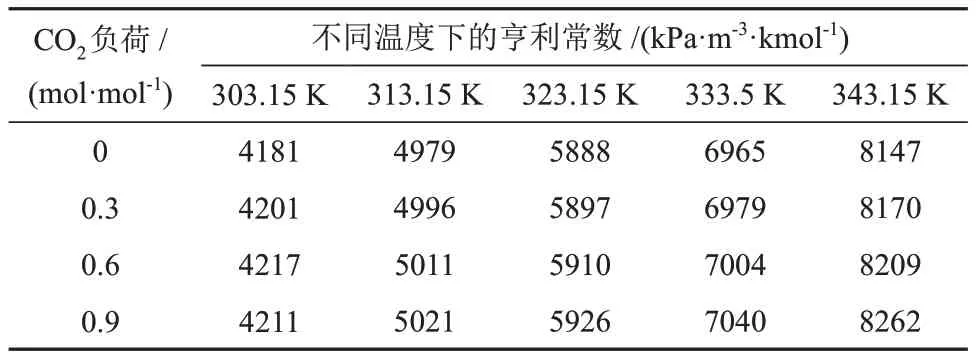
表3 不同温度和CO2负荷下CO2在MDEA水溶液中的亨利常数Table 3 Henry constants of CO2 in MDEA aqueous solution at different temperatures and CO2 loads
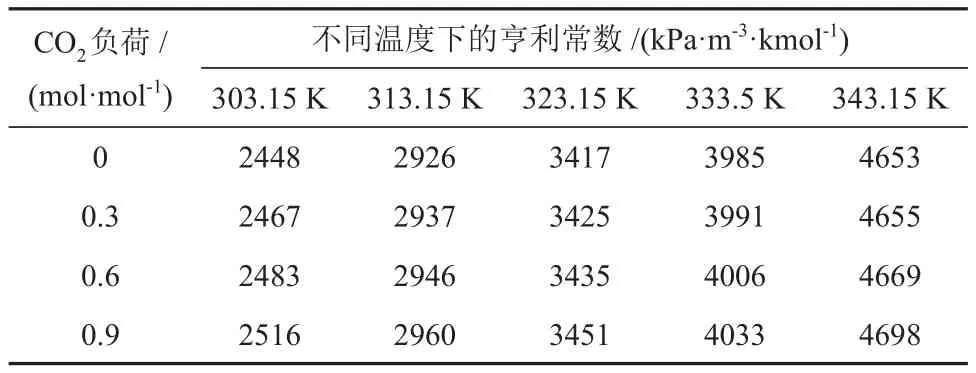
表4 不同温度和CO2负荷下CO2在MDEA/正丁醇/水相变吸收剂中的亨利常数Table 4 Henry constants of CO2 in MDEA/n-butanol/water phase transition absorbent at different temperatures and CO2 loads
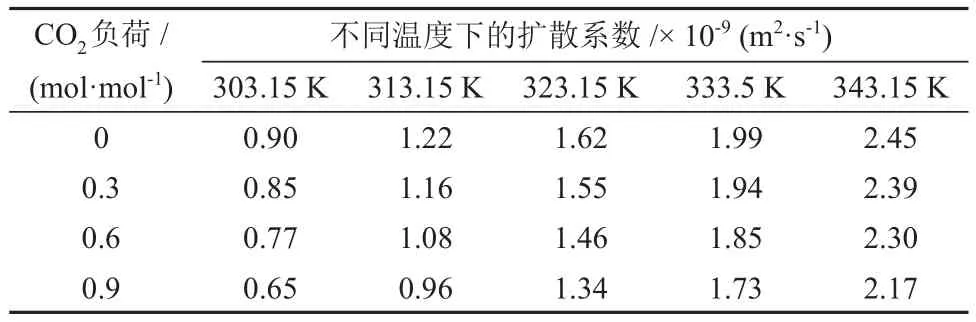
表5 不同温度和CO2负荷下CO2在MDEA水溶液中的扩散系数Table 5 Diffusion coefficients of CO2 in MDEA aqueous solution under different temperatures and CO2 loads
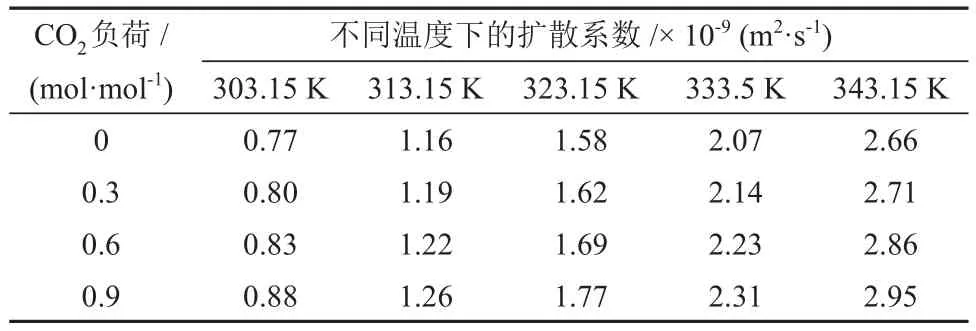
表6 不同温度和CO2负荷下CO2在MDEA/正丁醇/水贫相溶液中的扩散系数Table 6 Diffusion coefficients of CO2 in MDEA/n-butanol/water lean phase solution at different temperatures and CO2 loads
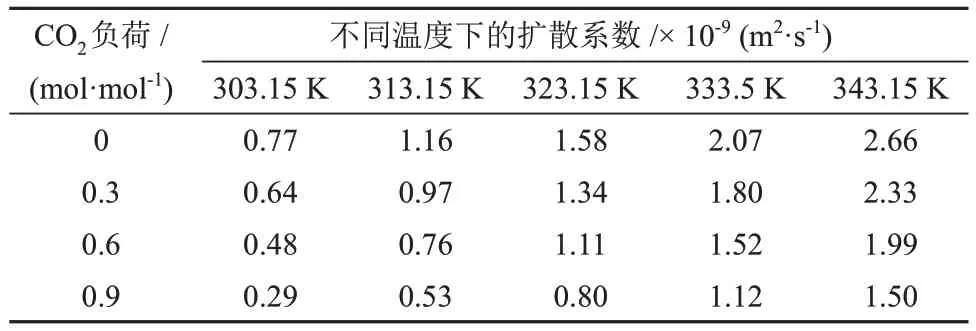
表7 不同温度和CO2负荷下CO2在MDEA/正丁醇/水富相溶液中的扩散系数Table 7 Diffusion coefficients of CO2 in MDEA/n-butanol/water rich phase solution at different temperatures and CO2 loads
由表3和表4可知,CO2在两种溶液的亨利常数均随着温度和CO2负荷的升高而增大,但受CO2负荷的影响幅度较小。不同的是,CO2在MDEA/正丁醇/水相变吸收剂中的亨利常数比在MDEA 水溶液中的小,且随着温度的升高变化幅度较小,说明正丁醇提高了CO2在溶液的物理溶解度,这与2.1.1节得出的结果是一致的。
由表5、表6和表7可知,CO2在各溶液中的扩散系数随温度的升高而升高。不同的是,CO2在MDEA/正丁醇/水富相溶液和MDEA水溶液中的扩散系数随溶液中CO2负荷的升高而降低,而在MDEA/正丁醇/水贫相溶液中的扩散系数出现小幅增加。分析认为,这是由于随着反应过程的进行,贫相中的MDEA含量逐渐减少,使得贫相溶液的黏度降低,从而使CO2在贫相溶液的扩散系数升高。CO2在MDEA/正丁醇/水富相溶液中的扩散系数较MDEA 水溶液低且随CO2负荷的升高差距逐渐增大,分析认为,这是由于分相作用使得富相溶液在相同的CO2负荷下黏度更大,从而增加了CO2在溶液中的扩散阻力。
2.2 MDEA/正丁醇/水相变吸收剂吸收CO2机理分析
2.2.113C NMR表征分析
为探究MDEA/正丁醇/水相变吸收剂吸收CO2机理,以及随着反应过程的进行各物质在贫、富相中的分布情况,利用核磁共振碳谱对MDEA/正丁醇/水(40%MDEA + 30%正丁醇+ 30%H2O)相变吸收剂在CO2负荷分别为0、0.3 mol/mol 和0.6 mol/mol 下的溶液进行表征,MDEA/正丁醇/水相变吸收剂的13C NMR 谱图见图5,反应过程中各物质对应的化学位移见表8。
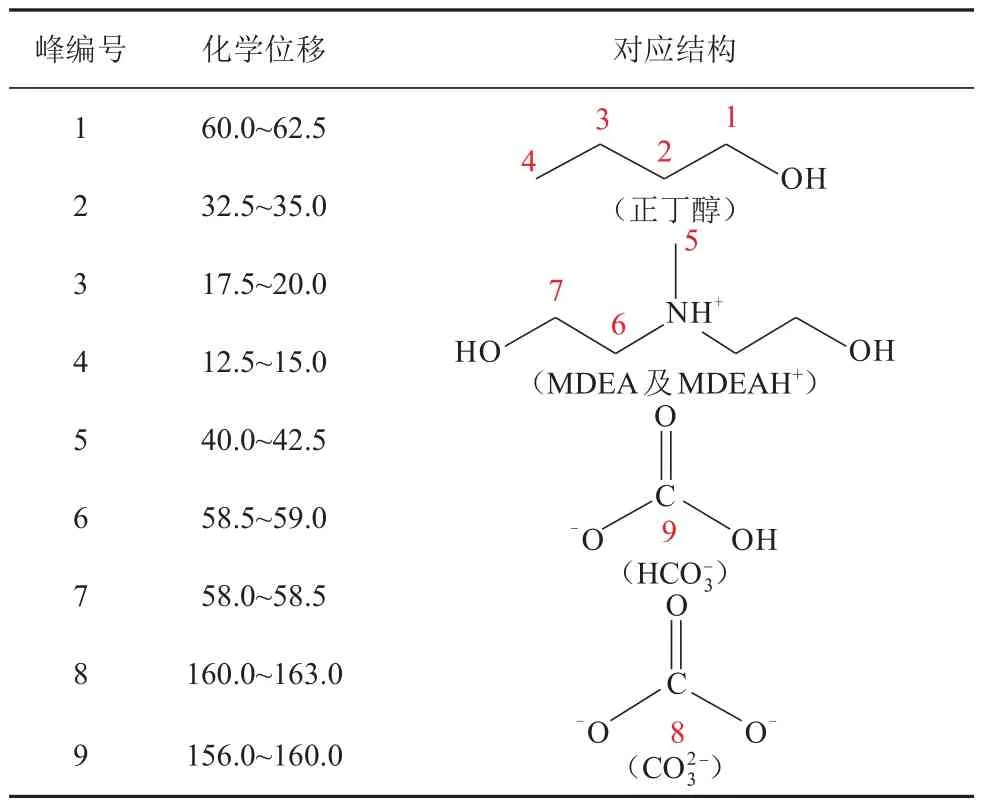
表8 MDEA/正丁醇/水相变吸收剂中各物质对应的化学位移Table 8 Corresponding chemical shifts of each substance in MDEA/n-butanol/water phase change absorbent
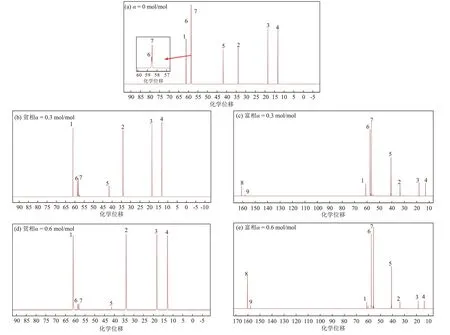
图5 不同CO2负荷下MDEA/正丁醇/水相变吸收剂的13C NMR谱图Fig.5 13C NMR spectra of MDEA/n-butanol/water phase change absorbent under different CO2 loads
由图5可知,当CO2负荷(图中α)为0时,谱图中共有7个峰,其中峰1~峰4来自于正丁醇,峰5~峰7来自MDEA。当CO2负荷为0.3 mol/mol时,贫相中峰5~峰7的高度下降,而富相中峰1~峰4的高度下降,化学位移在160~163 和156~160 处出现新的峰8 和峰9,峰8和峰9分别代表碳酸氢根和碳酸根,表明MDEA中的叔氨基与水发生碱催化效应[18],且峰8和峰9只出现在富相中,表明碳酸氢根和碳酸根难溶于正丁醇。当CO2负荷为0.6 mol/mol时,贫相中峰1~峰4的强度进一步增大,峰5~峰7 的强度进一步减小,富相中峰1~峰4的强度进一步减小,峰5~峰9的强度进一步增大。这表明随着吸收过程的进行,MDEA的反应产物逐渐向富相转移,正丁醇逐渐向贫相转移。
2.2.2 CO2吸收机理分析
根据13C NMR 的测试结果可知,MDEA/正丁醇/水相变吸收剂在吸收反应过程中,正丁醇并未参与反应,MDEA与CO2的反应遵循碱催化水合机理。碱催化水合机理认为叔胺在反应中仅起到催化水分子解离的作用,当水分子失去氢离子的同时可与CO2发生反应,具体反应过程见式(11)~式(14),其中MDEA以R'R''R'''N表示,R' = R'' = —C2H4OH,R''' = —CH3。
图6 为MDEA/正丁醇/水相变吸收剂吸收CO2机理。
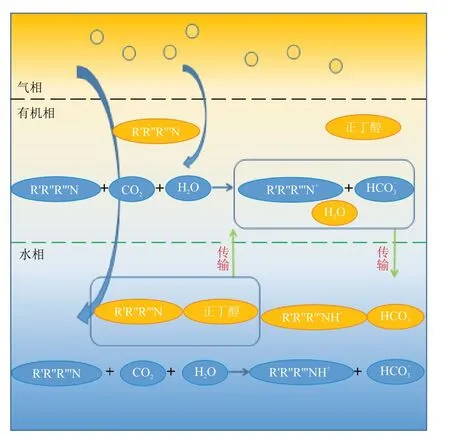
图6 MDEA/正丁醇/水相变吸收剂吸收CO2机理示意Fig.6 Schematic diagram of mechanism of CO2 absorption by MDEA/n-butanol/water phase change absorbent
溶液开始与CO2反应后,溶液中MDEA 的含量减少,MDEA 助溶性能下降,但此时CO2负荷较小,溶液中MDEA的助溶作用仍能使正丁醇溶于水相,溶液保持均相。生成的反应产物碳酸氢根和碳酸根等易溶于水,不溶于正丁醇。当溶液中CO2负荷上升到一定程度,即溶液中MDEA含量减少到临界点时,溶液开始出现分相,此时富相溶液成分为:MDEA、MDEAH+、碳酸氢根和碳酸根等反应产物以及少量溶于水的正丁醇;贫相的组分为:MDEA、正丁醇以及溶解着少量MDEAH+、碳酸氢根和碳酸根等反应产物的水。贫相中MDEA 的助溶作用使贫相中的正丁醇和水互溶。随着溶液中CO2负荷继续升高,贫相中MDEA 不断反应,反应后的产物逐渐向富相转移,并且MDEA含量的减少使其助溶性能变差,贫相中的水也向富相转移,使得MDEA/正丁醇/水相变吸收剂的富相比例不断上升。富相中反应产物的增加使得水对正丁醇的溶解能力下降,少量正丁醇转移至贫相,同时由于富相反应产物增多,水的溶解能力有限,部分溶于水的MDEA 被挤入贫相继续反应。当溶液中CO2负荷达到一定程度时,贫相中MDEA含量较少,助溶性能很差,贫相中几乎无水,MDEA无法继续反应。而由于富相溶液黏度较大、MDEA 浓度低和反应产物MDEAH+、碳酸氢根和碳酸根含量高等原因,反应速率也几乎为零,溶液分相达到一个稳定的状态。综上所述,MDEA/正丁醇/水相变吸收剂的吸收分相过程类似于亲酯性胺相变吸收剂再生过程的“自萃取作用”[19-20],MDEA 在贫相反应后,产物自主向富相转移,促进反应过程的进行。
2.3 MDEA/正丁醇/水相变吸收剂吸收CO2动力学性质分析
2.3.1 传质理论分析
目前较为成熟的传质理论有:渗透理论[21]、表面更新理论[22]和双膜理论[23],其中双膜理论的应用最为广泛,本文采用双膜理论来分析搅拌釜内的传质动力学过程。在搅拌釜中,CO2从气相主体进入气膜,再通过气-液界面,然后进入液膜,传质速率方程为:
式中,N为CO2传质通量,kmol/(m2·s);pCO2,G为气相主体中CO2的分压,kPa;pCO2,i为气液界面处的CO2分压,kPa;kG为气相 传 质系 数,kmol/(m2·s·kPa);CCO2,i为气液界面处CO2的浓度,kmol/m3;CCO2,L为液相主体中CO2的浓度,kmol/m3;kL、k0L分别为伴有化学反应和无化学反应时液相传质系数,m/s;E为化学反应增强因子。
气液相界面间的CO2浓度可由式(18)计算:
式中,HCO2为CO2在MDEA/正丁醇/水溶液或MDEA水溶液中的亨利常数,kPa/(m3·kmol)。由于胺与CO2的反应速度较快,因此液相主体中CO2的浓度很小,可忽略不计。因此传质速率可由式(19)计算:
沈丽[11]通过研究发现,气相传质阻力远小于液相传质阻力,因此可忽略不计,可以简化为式(20):
对于快速拟一级反应,增强因子(E)与哈雷常数(Ha)相等,其可通过式(21)计算:
式中,kOV为总反应速率常数,kmol/( m2·s·kPa);DCO2为CO2在MDEA/正丁醇/水溶液或MDEA水溶液中的扩散系数,m2/s。此时Ha需满足以下条件:
瞬时增强因子(E∞)可由式(23)计算得到:
式中,CAmine为胺液浓度,kmol/m3;DAmine为有机胺(MDEA)在MDEA/正丁醇/水溶液或MDEA水溶液中的扩散系数,m2/s;νCO2为CO2的黏度,mPa·s。根据式(20)和式(21),溶液吸收CO2的传质速率可表示为:
由此可得,溶液吸收CO2的总反应速率常数可由式(25)计算得到:
2.3.2 动力学特性分析
利用双搅拌釜实验装置测定温度在303.15~343.15 K内、CO2负荷在0~0.9 mol/mol 内的MDEA/正丁醇/水(40%MDEA + 30%正丁醇+ 30%H2O)相变吸收剂和MDEA 水溶液(40%MDEA + 60%H2O)的传质速率,然后根据2.3.1 节相关公式进行计算,得到两种溶液传质速率、总反应速率常数、增强因子的对比结果见图7、图8和图9。
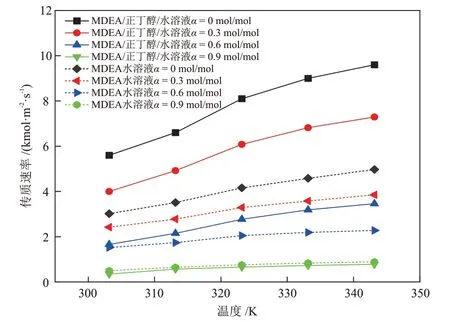
图7 不同温度下MDEA/正丁醇/水相变吸收剂与MDEA 水溶液传质速率的对比Fig.7 Comparison of mass transfer rates between MDEA/n-butanol/water phase change absorbent and MDEA aqueous solutions at different temperatures
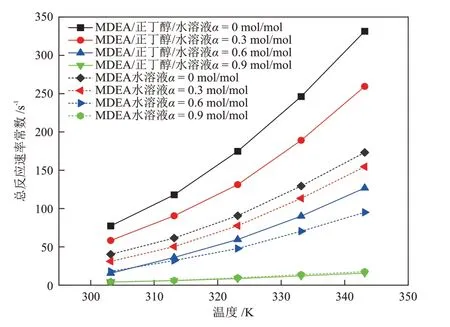
图8 不同温度下MDEA/正丁醇/水相变吸收剂与MDEA 水溶液总反应速率常数的对比Fig.8 Comparison of total reaction rate constants of MDEA/n-butanol/water phase change absorbent and MDEA aqueous solution at different temperatures
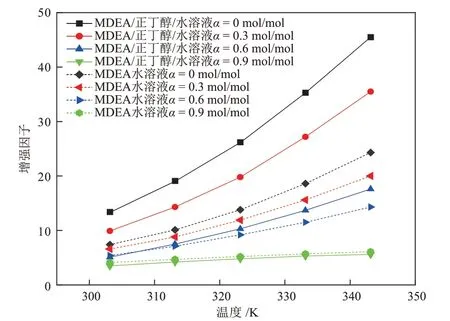
图9 不同温度下MDEA/正丁醇/水相变吸收剂与MDEA 水溶液增强因子的对比Fig.9 Comparison of enhancement factors of MDEA/n-butanol/water phase change absorbent and MDEA aqueous solution at different temperatures
由图7、图8和图9可知,两种溶液的传质速率、总反应速率常数、增强因子都随着温度的升高而升高,随溶液中CO2负荷(图中α)的升高而降低,并且CO2负荷的升高会降低温度对各动力学性能的促进作用。图7~图9 中MDEA 水溶液的各项动力学参数在不同的条件下都处于较低的范围内,表明MDEA水溶液与CO2的反应过程进行的较慢。
通过2.1.3 节的研究发现,CO2在MDEA/正丁醇/水溶液中具有较高的物理溶解度,并且分相后,CO2在贫相的扩散系数增大。因此,在MDEA/正丁醇/水贫相溶液中,CO2浓度较高,使贫相中的MDEA 得以快速反应。而MDEA 与CO2的快速反应会使贫相中的CO2含量快速降低,从而又促进了气相CO2的溶解,于是,溶解与反应过程相互促进,使吸收速率大幅提升。当CO2负荷很高时,溶液的分相程度已经接近理想分相状态,贫相中含水量很低,富相中MDEA含量低,反应产物含量高,使得溶液与CO2的反应速率降低,总反应速率常数和增强因子下降,进而使得溶液的传质速率下降。
3 结论
本文研究了MDEA/正丁醇/水相变吸收剂中不同组分配比对其吸收性能的影响;使用13C NMR 对不同CO2吸收负荷下的MDEA/正丁醇/水相变吸收剂进行表征,探究了其反应机理及物质转移过程;并利用双搅拌釜测量计算了MDEA/正丁醇/水相变吸收剂和MDEA水溶液的动力学参数,深入分析了相变吸收剂的动力学特性,得到以下主要结论。
(1)随着正丁醇含量的升高,溶液的CO2吸收速率出现先增高后降低的趋势,CO2吸收负荷逐渐降低,富相比例逐渐减小,富相CO2含量比例先保持不变后出现下降;随着MDEA 含量的升高,溶液CO2吸收速率逐渐降低,溶液CO2吸收负荷逐渐提高,富相比例逐渐增大,富相CO2含量比例逐渐降低。
(2)MDEA/正丁醇/水相变吸收剂吸收CO2过程中,正丁醇不参与反应,MDEA与CO2反应遵循碱催化水和反应机理;溶液分相后,贫相主要为MDEA、正丁醇和水的混合溶液,富相主要为MDEA 与CO2反应产物的水溶液。相比于MDEA水溶液,MDEA/正丁醇/水相变吸收剂对CO2的物理溶解度更高,并且受温度影响更小;随着溶液中CO2负荷的升高,分相过程使得CO2在贫、富相溶液中的扩散系数出现相反的变化趋势:在贫相溶液中的扩散系数增加,在富相溶液中的扩散系数降低。
(3)动力学研究表明,当溶液CO2负荷较低时,MDEA/正丁醇/水相变吸收剂的传质速率、总反应速率常数和增强因子均高于MDEA 水溶液。溶液中CO2物理溶解度的增加促进了贫相中MDEA 的快速反应,继而又促进气相CO2的溶解,这种溶解促进反应、反应促进溶解的过程,使得MDEA/正丁醇/水相变吸收剂在CO2负荷较低时吸收速率高于MDEA水溶液;当溶液CO2负荷较高时,溶液的分相程度已经接近理想分相状态,贫相中含水量很低,富相中MDEA 含量低,反应产物浓度高,使得溶液与CO2的反应速率降低,总反应速率常数和增强因子下降,进而使得溶液的传质速率下降。
