外源激素对仙茅未成熟种子愈伤组织诱导不定芽分化的影响
2023-11-01杨宝明杨超振李永平李迅东尹可锁
苏 艳,杨宝明,杨超振,李永平,李迅东,尹可锁
1.云南省农业科学院花卉研究所/农业农村部花卉产品质量监督检验测试中心(昆明)/国家观赏园艺工程技术研究中心/云南云科花卉有限公司,云南昆明 650100;2.云南省农业科学院农业环境资源研究所/云南省农业跨境有害生物绿色防控重点实验室,云南昆明 650205;3.云南省农业科学院热区生态农业研究所,云南元谋 651300)
仙茅(CurculigoorchioidesGaertn.)为石蒜科(Amaryllidacean)仙茅属(CurculigoGaertn.)多年生草本植物,野生资源主要分布于四川、贵州、云南、广西、广东等省区[1-2]。仙茅以根茎入药,药用历史悠久,为我国传统中药材,具有药用和开发利用价值[3-5]。近年来,随着对仙茅药用价值的深入了解及开发利用的增加,市场需求量逐渐加大。然而,仙茅尚未形成规模化人工种植,主要依赖挖掘野生资源,导致野生资源遭到严重破坏,濒临枯竭。开展仙茅组织培养技术研究,既可保护野生自然资源,又可为大规模人工种植提供优良种苗,实现野生资源的合理开发利用。
关于仙茅的组织培养研究较少,张萍等[5-6]用茎段,张虹等[7-9]、罗春梅等[10-11]、邹璐等[12-13]、王任翔等[14]、彭海峰等[15]和吴果团[16]都是用幼叶,在外植体的选择上主要集中在叶片和茎方面。利用细胞全能性在控制严格的条件下培育出来的新个体,对技术和环境设备要求较高,而种子作为外植体具有易获得数量较多的外植体、耐消毒、操作简单等优势,但有关种子作为外植体方面的组织培养研究尚未见报道。笔者以仙茅未成熟种子为外植体,通过愈伤组织诱导、不定芽分化实现植株再生,以期为仙茅组培快繁技术提供了一种新方法。
1 材料与方法
1.1 材料仙茅采自云南玉溪市易门县浦贝彝族乡草箐村。
1.2 方法
1.2.1外植体选择。晴天,选择生长健壮、长势良好无病虫害植株未成熟种子。
1.2.2外植体灭菌。自来水下将种子表面冲洗干净,然后在无菌工作台内,先用75%乙醇溶液浸种子30 s,再用0.1%的氯化汞溶液灭菌6~8 min,用无菌水冲洗3~4次,无菌滤纸吸干表面水分备用。然后用手术刀去除种皮。
1.2.3培养基及培养条件。分为A组(愈伤组织诱导培养基)和B组(不定芽分化培养基)(表1)。A1,MS+6-BA 1.0 mg/L+NAA 0.2 mg/L;A2,MS+6-BA 2.0 mg/L+NAA 0.2 mg/L;A3,MS+6-BA 3.0 mg/L+NAA 0.2 mg/L;A4,MS+6-BA 1.0 mg/L+NAA 0.5 mg/L;A5,MS+6-BA 2.0 mg/L+NAA 0.5 mg/L;A6,MS+6-BA 3.0 mg/L+NAA 0.5 mg/L;A7,MS+6-BA 3.5 mg/L+NAA 0.5 mg/L;B1,MS+6-BA 1.0 mg/L+NAA 0.2 mg/L;B2,MS+6-BA 1.5 mg/L+NAA 0.2 mg/L;B3,MS+6-BA 2.0 mg/L+NAA 0.2 mg/L;B4,MS+6-BA 2.5 mg/L+NAA 0.2 mg/L;B5,MS+6-BA 3.0 mg/L+NAA 0.2 mg/L;B6,MS+KT 1.5 mg/L+NAA 0.2 mg/L;B7,MS+KT 2.0 mg/L+NAA 0.2 mg/L;B8,MS+KT 3.0 mg/L+NAA 0.2 mg/L。
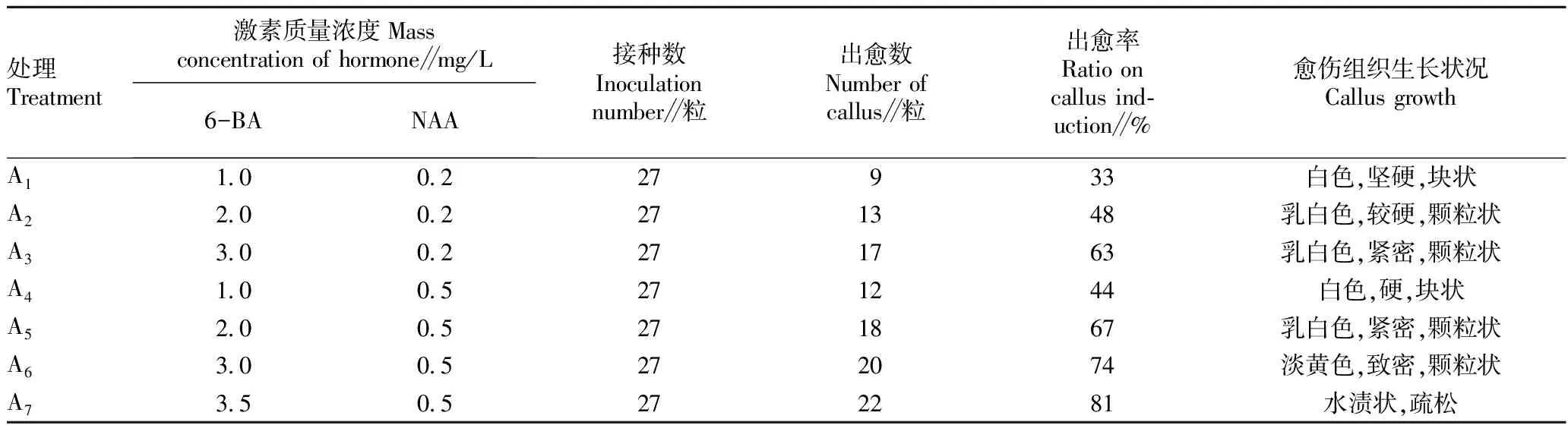
表1 不同处理对愈伤组织的影响
以上培养基均为MS+蔗糖30 g/L+琼脂5 g/L;培养基pH 5.8~6.0;培养室温度(25±2)℃;光照时间12 h/d;光照强度1 600~2 000 lx。
1.2.4愈伤组织诱导。用手术刀去除种皮,接种到A组培养表面,每处理接种3瓶,每瓶接种3粒种子,3次重复。接种10 d后,每隔10 d观察一次生长情况,40 d后统计出愈率。
1.2.5不定芽分化。将培养得到的愈伤组织切割成0.5 cm2左右的小块,接种到B组培养基中,每处理接种3瓶,每瓶接种1块,3次重复。每隔10 d观察一次生长情况,30 d后统计不定芽分化率。
1.3 数据分析利用Excel对试验数据进行差异显著性分析。出愈率=分化成愈伤组织的外植体数/外植体接种数×100%;增殖系数=愈伤组织产生的不定芽数/接种愈伤组织数。
2 结果与分析
2.1 愈伤组织的诱导及生长情况从表1可以看出,A组7种不同浓度的6-BA和NAA愈伤组织的诱导培养基,经差异性分析P=1.976 95E-06<0.05,达显著水平,说明A组7种诱导培养基对愈伤组织的诱导及生长情况存在显著差异。7种不同浓度的6-BA和NAA配合使用,可以影响愈伤组织的诱导及愈伤组织的质量。6-BA和NAA 7个浓度诱导培养基与出愈率之间的相关系数达0.953 432 844,说明6-BA和NAA浓度与出愈率之间呈良好的正相关,由此可知,6-BA和NAA浓度的增加,愈伤组织诱导率也随之提高,出愈时间缩短,出愈量加大。高浓度的6-BA和NAA配合施用,更有利于愈伤组织的诱导。在相同6-BA浓度下,NAA 0.5 mg/L(平均出愈率62%)的诱导效果明显优于NAA 0.2 mg/L(平均出愈率48%)。当6-BA浓度为3.5 mg/L、NAA浓度为0.5 mg/L时,出愈量最大,出愈率最高,达81%,但存在愈伤组织水渍状、质地松散等问题,不利于不定芽的分化。因此,愈伤组织诱导培养基以A6(MS+6-BA 3.0 mg/L+NAA 0.5 mg/L)较好。
2.2 6-BA和KT对不定芽分化及增殖的影响对B组8种不同浓度的6-BA、KT和0.2 mg/L NAA不定芽分化培养基进行处理,经差异性分析P= 0.001 308 535(<0.05),达显著水平,说明B组8种培养基对不定芽分化及增殖的影响存在显著差异。表明不同浓度6-BA、KT与0.2 mg/L NAA配合施用,均能使愈伤组织分化出不定芽。不定芽分化数量和时间,随着6-BA和KT浓度的增加而提高。当6-BA浓度达2.5 mg/L时,不定芽的分化数量降低,说明高浓度的6-BA对不定芽的分化和形成有抑制作用。另外,6-BA对不定芽的分化和形成的促进作用优于KT,不定芽分化早,生长快,增殖系数高,提早3~5 d分化出苗,其中以MS+6-BA 2.0 mg/L+NAA 0.2 mg/L的培养基,不定芽分化最早,增殖系数达11.7%(表2)。其增殖培养效果见图1。

图1 仙茅增殖培养效果Fig.1 Proliferation culture effect of Curculigo orchioides Gaertn.
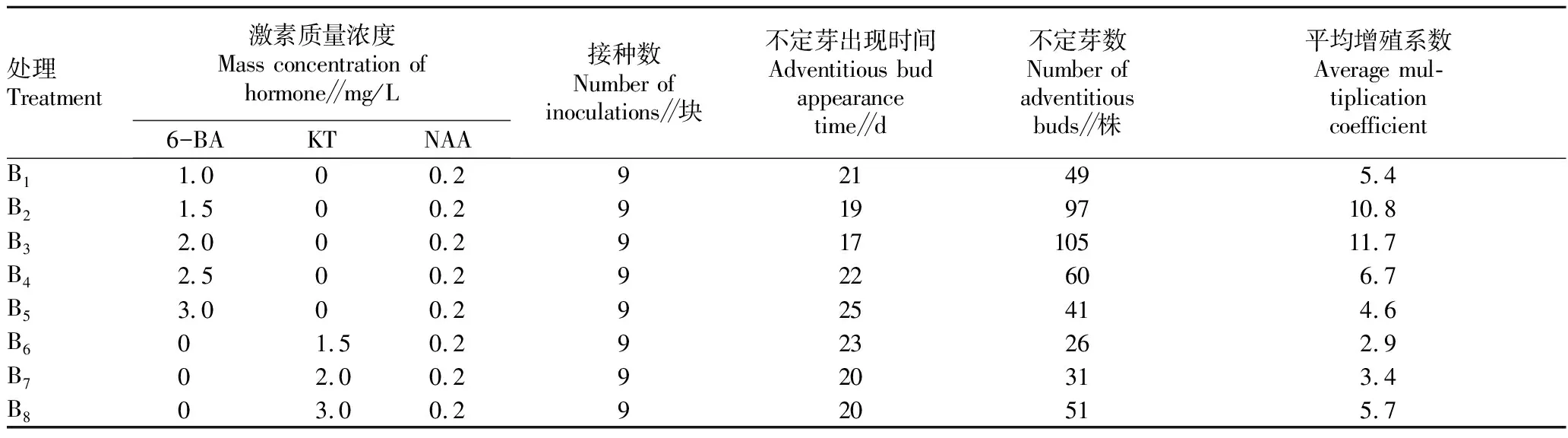
表2 不同处理对不定芽分化及增殖的影响
3 讨论
诱导愈伤组织成败的关键是所使用激素成分和浓度。生长素和细胞分裂素对诱导愈伤组织的产生及促进迅速生长是必需的[17]。在愈伤组织诱导中,当6-BA和NAA浓度配比发生变化时,诱导出的愈伤组织数量和质量也随之改变。愈伤组织的数量和质量,随着6-BA和NAA浓度的增加而提高。当6-BA浓度为3.5 mg/L、NAA浓度为0.5 mg/L时,出愈率最高,达81%,但愈伤组织呈水渍状,质地松散,说明激素浓度偏高;在不定芽的分化培养中,在相同浓度情况下,添加6-BA的处理较KT的处理,平均提早3~5 d分化出不定芽,增殖系数高,最高增殖系数达11.7,说明6-BA的促进作用大于KT。当6-BA浓度达2.5 mg/L时,不定芽的分化数量降低,说明6-BA浓度偏高,抑制了不定芽的分化和形成,导致高频率的变异[18-21]。
外源激素的种类和浓度对植物器官的脱分化和再分化起决定性的作用。激素的种类、浓度和组合配比,是直接影响愈伤组织诱导、愈伤组织的形态结构以及不定芽分化的关键因素。不同的愈伤组织类型,其分化能力均不相同,只有质地致密的愈伤组织才具有较强的分化能力[22]。
在仙茅的组织培养及快繁体系构建中,褐变现象是一个主要问题,影响褐变现象的因素很多,但酚污染是主要原因之一,在组织培养过程中,损伤细胞中酚类物质被氧化成醌,变成棕褐色或暗褐色而发生褐变[23]。此外,黑暗培养有利于减轻仙茅外植体的酚污程度[24-25]。下一步将进一步研究不同方法对仙茅未成熟种子愈伤组织诱导组培褐变的影响,更有效地减轻外植体的褐变现象。
4 结论
该试验结果表明,仙茅未成熟种子的最佳愈伤组织诱导培养基为MS+6-BA 3.0 mg/L+NAA 0.5 mg/L,出愈率为74%;最佳不定芽分化培养基为MS+6-BA 2.0 mg/L+NAA 0.2 mg/L,平均增殖系数达11.7。
