替拉扎明对多重耐药沙门菌抗菌增敏活性分析
2023-10-29武周慧王之文武金亮
武周慧,王 瑜,杜 衡,王之文,肖 爽,武金亮,王 真
(北京农学院动物科学技术学院,兽医学(中兽医)北京市重点实验室,北京 102206)
沙门菌(Salmonella)作为食源性腹泻中肠杆菌科重要的病原菌之一,主要通过食品和水引起人和动物的沙门菌病[1],引起人畜共患沙门菌病的两大血清型是肠道沙门菌亚种的鼠伤寒沙门菌(SalmonellaTyphimurium)和肠炎沙门菌(SalmonellaEnteritidis)[2-3]。沙门菌广泛存在于自然环境中,因其极强的致病性,可在宿主内定殖,导致人类宿主持续性感染[4],引发食物中毒类突发公共卫生事件[5]。在全球范围内,每年约有1亿人患腹泻,9 715人死亡,死亡人数中有41%因感染沙门菌腹泻病而死亡[6-7]。沙门菌携带的耐药基因种类越来越多,多重耐药性不断增高,耐药基因的转移和传播对公共卫生和食品安全产生了严重危害[8]。
大多数抗生素是从天然产物和合成物的库中发现的具有抑制细菌生长的化合物[9],随着抗生素的滥用,迫切需要寻求新的抗菌剂来解决抗生素的耐药问题。小分子抑制剂是一类能够靶向作用于蛋白,降低蛋白活性或者阻碍生化反应、分子量小于1 000 u的有机化合物分子[10]。小分子抑制剂在精细调控细胞生命和功能方面具有显著优势,被广泛应用,使其成为近年来生命科学研究中重要的工具药。
替拉扎明(tirapazamine, TPZ)是一种缺氧细胞毒素和缺氧选择性生物还原剂[11],也是一种小分子抑制剂,在缺氧条件下导致DNA双链断裂和染色体断裂[12]。2013年,Shah等[13]报道在厌氧条件下,替拉扎明对大肠杆菌、金黄色葡萄球菌和艰难梭菌具有不同程度的杀菌活性。近期研究表明,负载替拉扎明的微球有协同抗肿瘤作用[14]。金纳米颗粒与替拉扎明结合增强了肿瘤靶向性[15]。本实验室前期以肠杆菌RNA聚合酶结合转录因子DksA为靶标,通过计算机虚拟筛选技术基于DksA蛋白进行靶向药物小分子抑制剂的筛选,结果显示,替拉扎明是具有显著活性,与靶标蛋白DksA具有高亲和力的小分子化合物之一。
为了探明替拉扎明对沙门菌的杀菌机制,本研究通过替拉扎明对多重耐药沙门菌的最小抑菌浓度(minimum inhibitory concentration, MIC)和最小杀菌浓度(minimum bactericidal concentration, MBC)试验、抗菌活性研究、时间杀菌曲线及生物被膜形成能力测定,研究了替拉扎明对多重耐药沙门菌的抗菌活性,为耐药性沙门菌病的防治提供新的治疗方案和潜在候选药物。
1 材料与方法
1.1 材料
鼠伤寒沙门菌S.Typhimurium(ATCC 14028)和沙门菌临床分离株(ST-1、ST-3、ST-6、ST-7、ST-71和ST-477)均由本实验室保存。
LB培养基、MH培养基和药敏纸片购自北京索莱宝有限公司,10 g·L-1结晶紫和二甲基亚砜(DMSO)购自国药化学试剂有限公司,替拉扎明和诺氟沙星购自上海陶术生物科技有限公司。
1.2 方法
1.2.1 细菌培养 取-80 ℃保存的沙门菌进行复苏,在生物安全柜中无菌划线接种于LB(luria-bertani)固体培养基,倒置于37 ℃恒温培养箱培养12~16 h,挑取单菌落接种于3 mL LB液体培养基中,37 ℃ 180 r·min-1摇床培养12~16 h,菌液在LB液体培养基1∶100扩大培养至OD630 nm为0.4~0.5,稀释计数后调整菌液浓度为作用浓度。
1.2.2 沙门菌耐药性分析 根据临床和实验室标准化委员会(CLSI)推荐的操作,采用K-B(Kirby-Bauer)药敏纸片扩散法[16],用24种临床常用抗菌药物对鼠伤寒沙门菌S.Typhimurium ATCC 14028(ST)和沙门菌临床分离株(ST-1、ST-3、ST-6、ST-7、ST-71和ST-477)使用MH培养基(Mueller-Hinton)进行药物敏感试验。依据CLSI中肠杆菌科抑菌直径解释标准进行敏感、中介和耐药的判读。抗菌药物包括β-内酰胺类、大环内酯类、氨基糖苷类、四环素类、喹诺酮类、林可霉素类、多肽类、酰胺醇类、磺胺类和利福霉素类。
1.2.3 替拉扎明对沙门菌最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定 根据替拉扎明和对照药物诺氟沙星(norfloxacin)最大溶解度,使用DMSO进行溶解,储存于4 ℃,使用前用MH培养基稀释成浓度为800 μmol·L-1的母液,DMSO浓度<0.1%(已经试验证实该浓度不影响沙门菌的正常生长,见OSID相关材料中图S1)。选择临床和实验室标准研究所推荐的肉汤微量稀释法测定替拉扎明的MIC[17]。在96孔培养板中,用MH培养基将初始浓度为800 μmol·L-1的替拉扎明进行2倍倍比稀释,稀释后浓度分别为400、200、100、50、25、12.5、6.25和3.125 μmol·L-1,再分别加入等体积100 μL 1×106CFU·mL-1沙门菌悬液,以MH培养基为空白对照,以沙门菌悬液为阳性对照,以诺氟沙星为对照药物,每组重复3个复孔。将96孔板置37 ℃恒温培养箱培养24 h,使用酶标仪测定OD630 nm,记录试验结果,MIC为抑制细菌生长的药物最小浓度。
选择96孔板上比MIC值大的各孔内培养物100 μL,均匀涂布到MH培养基上,在37 ℃温箱中培养16~18 h,观察培养基上菌落生长状况,记录菌落数量,通过杀灭99.9%初始细菌种群的最低浓度确定最小杀菌浓度,即MBC值[18]。MBC值测定独立进行3次。
1.2.4 替拉扎明对沙门菌时间杀菌曲线的绘制 将1×106CFU·mL-1的沙门菌悬液与不同浓度的替拉扎明等体积加到EP管中,用移液枪吹打混匀,替拉扎明的终浓度为1/2 MIC、MIC、2 MIC、4 MIC和8 MIC。替拉扎明在沙门菌ST的作用终浓度分别为6.25、12.5、25、50和100 μmol·L-1,替拉扎明在沙门菌ST-6和沙门菌ST-7的作用终浓度均为12.5、25、50、100和200 μmol·L-1,置于37 ℃ 180 r·min-1恒温摇床培养24 h。分别在培养后0、4、8、12、16、20和24 h取100 μL菌液用稀释平板计数法进行活菌计数,绘制时间杀菌曲线。以添加0.1%DMSO的沙门菌悬液为阳性对照。
1.2.5 替拉扎明对沙门菌耐药表型的影响 选择24种抗生素药敏片进行药敏试验,将100 μL浓度为1×106CFU·mL-1的菌悬液加到96孔板中,然后加入100 μL浓度为MIC的替拉扎明,替拉扎明的作用终浓度为1/2 MIC,重复3个复孔。置于37 ℃温箱培养12 h,吸取每孔共培养物100 μL滴在MH培养基上,用灭菌玻璃棒在平皿上均匀涂抹琼脂表面,用无菌镊子夹取药敏纸片贴于平皿表面,置37 ℃温箱中培养16~18 h,量取抑菌圈直径。
1.2.6 替拉扎明对沙门菌生物被膜形成的影响 结晶紫(crystal violet, CV)染色是测定生物膜广泛使用的方法[19]。使用10 g·L-1结晶紫测定替拉扎明抗生物被膜的能力,取1×106CFU·mL-1的菌液100 μL接种到96孔培养板上,分别加入等体积浓度为MIC的替拉扎明和对照药物诺氟沙星,替拉扎明的作用终浓度为1/2 MIC,以LB培养基为空白对照,以含0.1%DMSO菌悬液为阳性对照,重复3个复孔,置37 ℃温箱培养36 h。培养结束后,弃去培养基,为洗去杂质和浮游菌,用1×磷酸盐缓冲溶液(phosphate-buffered saline,PBS)冲洗3次,60 ℃加热固定生物被膜1 h,加入200 μL 10 g·L-1结晶紫染色30 min,洗去多余染液,每孔加入200 μL 95%甲醇,使用酶标仪测定OD630nm。依据临界ODc值(ODc等于空白孔的平均值加上其3倍的标准差而得到的OD值)可对生物被膜分类:OD≤ODc为不黏附(0),ODc

1.3 数据统计分析
使用MicrosoftExcel 2021进行数据整理和作图,SPSS 28.0对数据进行方差统计分析,多组数据经方差分析后进行两两比较,试验数据均值比较采用单因素方差分析,统计差异在P<0.05判定为有统计学意义,*.P<0.05表示差异显著,**.P<0.01表示差异极显著,***.P<0.001表示差异极显著,****.P<0.001表示差异极显著,所有试验数据均代表3个独立试验。
2 结 果
2.1 沙门菌的耐药性分析
选择24种常用药物对沙门菌进行药敏试验,沙门菌耐药表型检测结果见表1,7株沙门菌的耐药谱存在差异,但均为多重耐药菌株,其中沙门菌ST对11种抗生素耐药,包括6类抗生素,主要有β-内酰胺类(氨苄西林、羧苄西林、头孢克肟和亚胺培南)、大环内酯类(红霉素、阿奇霉素)、氨基糖苷类(链霉素、新霉素)、四环素类(强力霉素)、多肽类(万古霉素)和利福霉素类(利福平);沙门菌ST-1对10种抗生素耐药,包括6类抗生素,与沙门菌ST的耐药谱相比,耐药抗生素不包括β-内酰胺类(氨苄西林、亚胺培南)和四环素类(强力霉素),但增加了氨基糖苷类(阿米卡星)和四环素类(米诺环素);沙门菌ST-3对11种抗生素耐药,包括6类抗生素,耐药抗生素和沙门菌ST-1基本相同,但增加了亚胺培南;沙门菌ST-6对13种抗生素耐药,包括7类抗生素,与沙门菌ST相比,耐药谱不包括氨基糖苷类(链霉素),但增加了氨基糖苷类(卡那霉素)、四环素类(米诺环素)和喹诺酮类(诺氟沙星);沙门菌ST-7对12种抗生素耐药,包括6类抗生素,和沙门菌ST-6的耐药谱基本相同(不包括诺氟沙星);沙门菌ST-71对11种抗生素耐药,包括6类抗生素,与沙门菌ST相比,耐药谱不包括氨基糖苷类(链霉素)和四环素类(强力霉素),但增加了氨基糖苷类(卡那霉素)和四环素类(米诺环素);沙门菌ST-477对10种抗生素耐药,包括6类抗生素,和沙门菌ST耐药谱基本相同(不包括链霉素和强力霉素),但增加了四环素类(米诺环素)。根据各沙门菌耐药谱,选择耐药抗生素数目多和抗生素种类多的沙门菌ST、ST-6和ST-7进行体外抑菌试验。
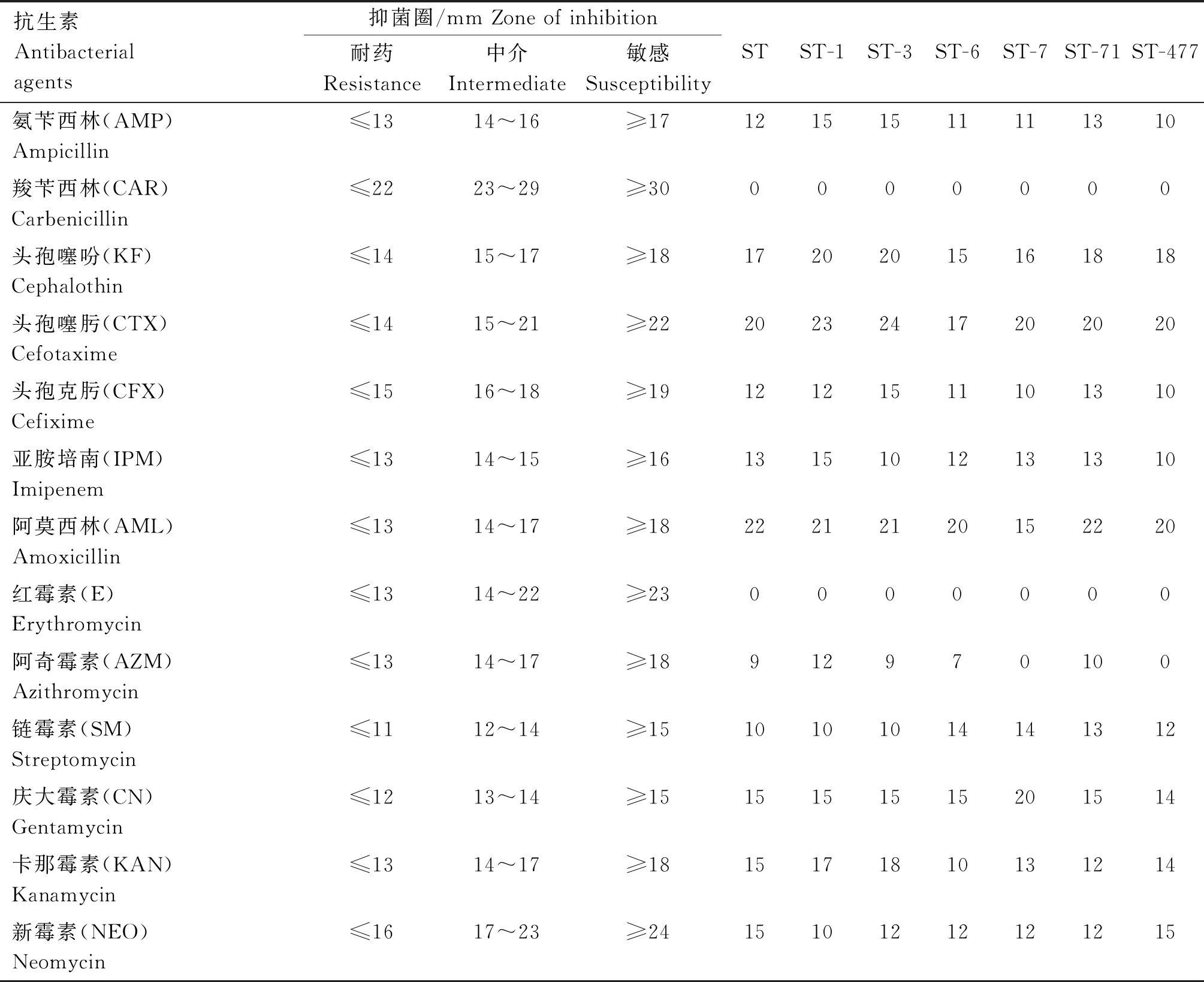
表1 沙门菌菌株的药敏性分析结果
2.2 替拉扎明对多重耐药沙门菌的抗菌活性
MIC和MBC测定结果如表2所示,替拉扎明对沙门菌ST、ST-6和ST-7的MIC值分别为12.5、25和25 μmol·L-1,MBC值均为50 μmol·L-1;对照药物诺氟沙星对沙门菌ST、ST-6和ST-7的MIC分别为25、50和50 μmol·L-1,MBC值均为50 μmol·L-1。通过比较MIC值,发现替拉扎明对沙门菌的MIC值比诺氟沙星小。结果表明,替拉扎明对沙门菌具有较强的抗菌活性,且抗菌效果优于诺氟沙星。
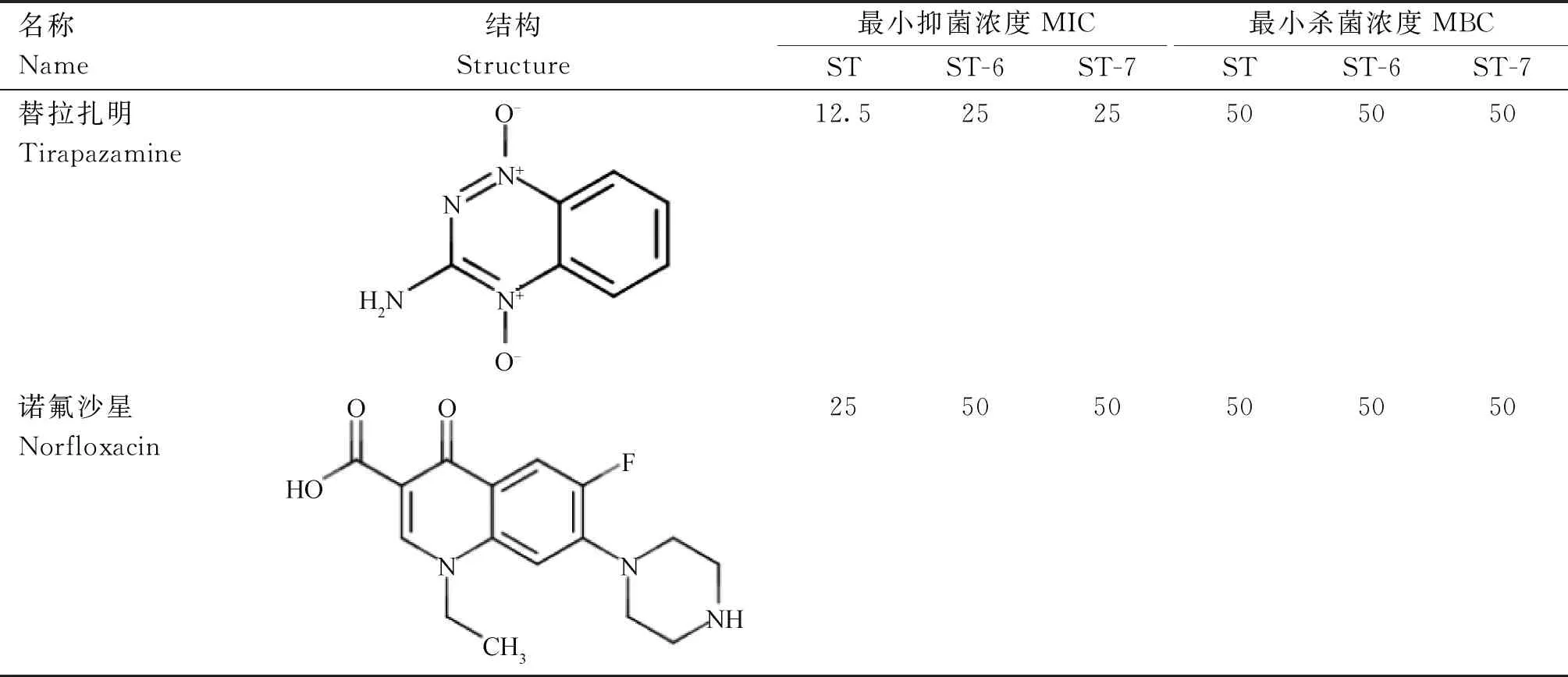
表2 替拉扎明和诺氟沙星对多重耐药沙门菌的MIC和MBC测定结果
沙门菌和替拉扎明动态接触的细菌活菌数随时间的生长曲线如图1所示,在替拉扎明浓度为12.5 μmol·L-1时,能抑制沙门菌ST、ST-6和ST-7的生长,培养24 h后的细菌活菌数与阳性对照组(0.1% DMSO)的活菌数基本相同。替拉扎明浓度为25 μmol·L-1时,培养4 h后,沙门菌ST-6和ST-7细菌活菌数有轻微浮动,但基本保持不变,表明在该浓度下,替拉扎明不能完全杀死沙门菌,但对于沙门菌的繁殖起到一定的抑制作用。替拉扎明浓度大于50 μmol·L-1,对沙门菌起到明显杀菌效果,细菌活菌数与阳性对照组相比出现急剧下降趋势直至活菌数为0。时间杀菌曲线结果表明,替拉扎明对多重耐药沙门菌的抑制作用具有浓度和时间依赖性。

a.沙门菌ST;b.沙门菌ST-6;c.沙门菌ST-7a. Salmonella ST; b. Salmonella ST-6;c. Salmonella ST-7图1 替拉扎明对沙门菌ST、ST-6和ST-7的时间杀菌曲线Fig.1 Time bactericidal curve of Tirapazamine against Salmonella strains (ST, ST-6 and ST-7)
2.3 替拉扎明显著逆转多重耐药沙门菌的耐药表型
替拉扎明对沙门菌的耐药性产生很大影响,如表3所示。替拉扎明作用后,沙门菌ST对10种抗生素(头孢噻肟、亚胺培南、链霉素、卡那霉素、新霉素、四环素、强力霉素、诺氟沙星、环丙沙星和复方新诺明)的耐药表型从耐药或中介转变为敏感,沙门菌ST-6对11种抗生素(头孢噻吩、头孢噻肟、亚胺培南、新霉素、阿米卡星、四环素、强力霉素、米诺环素、卡那霉素、诺氟沙星和环丙沙星)的耐药表型从耐药或中介转变为敏感,沙门菌ST-7对11种抗生素(头孢噻吩、头孢噻肟、头孢克肟、亚胺培南、链霉素、卡那霉素、新霉素、四环素、强力霉素、米诺环素和利福平)的耐药表型从耐药或中介转变为敏感,其中在替拉扎明的作用下,3株沙门菌对头孢噻肟、亚胺培南、强力霉素、新霉素和四环素的敏感性均明显增加,诺氟沙星显示出与替拉扎明相似的效果。由此表明,替拉扎明对沙门菌的耐药表型具有积极的逆转作用,以期在耐药性细菌感染的临床治疗中发挥辅助作用。

表3 替拉扎明和诺氟沙星对多重耐药沙门菌耐药性的影响
2.4 替拉扎明影响沙门菌生物被膜的形成能力
使用结晶紫法测定了替拉扎明对沙门菌生物被膜形成的影响。结果如图2所示,与未处理的对照组(0.1% DMSO)相比,替拉扎明处理后沙门菌的生物被膜形成能力显著下降,生物被膜形成率降低至<10%(P<0.000 1)。由此表明,替拉扎明对沙门菌具有强大的抗生物被膜形成能力,提示替拉扎明对沙门菌耐药表型具有逆转作用。

a.沙门菌生物被膜形成OD630 nm值;b.结晶紫染色结果。*.P<0.05,**.P<0.01,***.P<0.001,****.P<0.000 1a. OD630 nm value of Salmonella biofilm formation;b. Crystal violet staining results *.P<0.05,**.P<0.01,***.P<0.001,****.P<0.000 1图2 替拉扎明对多重耐药菌沙门菌生物被膜染色的OD630 nm值和染色图Fig.2 OD630 nm value and crystal violet staining diagram of Tirapazamine on multi-drug resistant Salmonella biofilm
3 讨 论
沙门菌是一种革兰阴性菌,目前具有2 600多种血清型,是全世界重要的人畜共患病原体,人类食用受沙门菌污染的产品会导致腹泻和肠道炎症,甚至菌血症[21-22]。近几十年来,抗菌剂在畜牧业中被频繁使用,不仅用于治疗与控制沙门菌和其他病原体,还作为预防和促生长剂使用[23],造成畜禽养殖场中沙门菌耐药性越来越严重[24]。中国是世界上最大的抗微生物药物生产国和消费国之一[25],从2000—2015年,中国的抗微生物消费量从2.3亿增加到4.2亿限定日剂量(defined daily dose, DDD),增幅为79%,预计2015—2030年,全球抗生素总消费量将增长202%,达到1 280亿DDD[26]。抗生素耐药性的增加令人担忧,预计到2050年,将会出现1 000万人死于耐药性细菌感染[27]。动物源性抗生素耐药性已经被证明对抗微生物药物耐药性有重大影响,需要采取行动和寻找有效的替代药物如小分子抑制剂来应对这个问题。
本研究表明替拉扎明是一种有效的抗沙门菌的小分子抑制剂,目前对于替拉扎明及其衍生物的研究主要集中在抗癌作用和抗结核作用。本研究通过体外抑菌试验验证了替拉扎明对多重耐药沙门菌的抗菌活性。研究表明,替拉扎明在需氧和厌氧条件下具有一定的杀菌作用,可以抑制大肠杆菌、金黄色葡萄球菌和艰难梭菌的生长[13],与本研究结果一致。此外,50 μmol·L-1替拉扎明可以对沙门菌起到100% 的杀菌作用。由于沙门菌对人和动物构成严重威胁,鉴于替拉扎明是一种已经批准的临床药物,本研究结果有望为控制沙门菌感染提供一种新的策略。
生物被膜是由微生物细胞及胞外多聚物形成的复杂群落,可附着在生物或非生物表面上的复杂微生物群落,或在不附着表面的情况下形成聚集体[28],如沙门菌、铜绿假单胞菌、金黄色葡萄球菌、大肠杆菌等细菌[29-30],并牢固地埋在细胞外基质中。在极端条件下生存的每种微生物都表现出特定的抵抗机制,其中生物膜的作用至关重要[31]。生物被膜的形成已被证明可以降低抗生素对细菌细胞的敏感性,对抗菌药物的耐药性会提高10倍~1 000倍[32]。由于抗生素耐药性的增加,越来越多的研究人员转向天然产品和小分子抑制剂的研究。本研究发现12.5~25 μmol·L-1的替拉扎明在很大程度上消除了沙门菌的生物被膜形成能力,导致生物被膜产生量减少90%。这些结果表明,替拉扎明作为一种能够有效减少和消除生物被膜相关感染的小分子具有广阔前景。
4 结 论
在本研究中,替拉扎明增加了沙门菌对多种抗生素的敏感性,替拉扎明对沙门菌的耐药表型具有逆转作用,有望在耐药细菌感染的临床治疗中发挥辅助作用。综上所述,替拉扎明对沙门菌的抗菌活性可能是通过逆转耐药表型和减少生物被膜的形成而实现,替拉扎明可以作为一种潜在的多重耐药菌感染治疗用候选药物,但替拉扎明是否是一种安全的抗菌剂仍需证明。并需要进一步探究替拉扎明的抗菌作用机制,确认其能否对其他耐药菌产生抗菌作用。
