适合早期诊断的非洲猪瘟sIgA抗体量子点免疫层析检测方法建立
2023-10-29谢青云易玮婕李嘉豪冯余凡赵东明步志高冯志新
谢青云,易玮婕,李嘉豪,白 昀,谢 星,袁 厅,张 越,冯余凡,赵东明,步志高,刘 斐*,冯志新*
(1.江苏省农业科学院兽医研究所,农业农村部兽用生物制品工程重点实验室,南京 210014;2.南京农业大学动物医学院单分子纳米生物学实验室,南京 210095;3.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,哈尔滨 150069;4.兽用生物制品(泰州)国泰技术创新中心,泰州 225300)
非洲猪瘟是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起猪的一种急性、热性和高度致死性传染病[1],急性病死率高达100%[2],为世界动物卫生组织 (OIE) 规定必须通报的动物传染病,也是我国的一类动物传染病和优先防范的重要外来疫病[3]。ASF进入亚洲给全球养猪产业造成了巨大经济损失[4]。ASFV感染包括急性、亚急性、慢性和无症状的病毒携带这四种类型,临床特征多表现为高热、出血和皮肤紫绀等,剖检可见以脾为主的、累及多器官的充血、肿大和出血等。但这些症状与猪瘟(classical swine fever,CSF)、猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)极为相似,所以需要借助灵敏有效的检测手段加以确诊[5]。此外,目前尚无安全有效的疫苗来预防ASF。因此,借助快速敏感的早期检测技术,在感染现场第一时间作出准确诊断是ASF防控的关键。
近几年,一些适合现场快速检测的高新技术,如等温扩增、免疫层析技术和微流控芯片等已用于ASFV 的检测研究[6-7]。哈登楚日亚等[8]利用重组酶聚合酶扩增技术, 针对ASFVB646 L/P72基因建立了实时荧光重组酶聚合扩增方法。吴海涛等[9]基于胶体金免疫层析技术制备了ASFV抗原蛋白检测胶体金试纸条。上海速芯生物科技有限公司研发出一款可准确、快速检测ASFV的微流控芯片快速检测试剂盒[10]。本研究团队利用重组酶聚合酶扩增技术结合侧向层析技术开发了ASFV核酸检测量子点试纸条[11]。此外,由中国动物卫生与流行病学中心等单位研制的ASFV荧光微球检测试纸条(二类)和北京森康生物技术开发有限公司等单位研制的ASFV荧光等温扩增检测试剂盒(三类)已获批新兽药。上述方法很好地实现了ASFV分子或抗原的敏感检测,但由于目前临床上常需要对ASFV进行抗原和抗体同步检测来确认感染。因此,建立新型血清学诊断方法用以满足ASF现场早期、灵敏、快速诊断的要求成为急需。
猪感染ASFV后血清抗体最早在8~12 d才开始转阳[12],无法完全满足ASFV感染的早期诊断。由口鼻上皮和相关固有层组成的保护性黏膜被认为是宿主对抗ASFV的第一道防线,可引起黏膜免疫反应[13-14]。与普通抗体相比,分泌型免疫球蛋白A(sIgA)作为参与黏膜免疫最主要的效应因子,具有亲和力更高、稳定性更好、在机体外分泌道中分泌时间更早等特点,因此具备成为ASFV早期诊断靶标的潜力。量子点免疫试纸条技术基于抗原抗体的特异性反应,结合量子点荧光强度强、生物相容性好、荧光寿命长等优良特性,在病原菌现场诊断中显示出了广阔的应用前景。本研究筛选ASF早期抗原p30蛋白作为检测工具,以口腔液中的ASFV sIgA抗体作为检测靶标,开发ASFV sIgA抗体量子点免疫荧光检测试纸条。该检测方法灵敏度高、稳定性好、反应时间短、检出时间早、操作简单,可以为ASF的防控提供技术参考。
1 材料与方法
1.1 试验材料
1.1.1 生物样本来源 100份ASFV阴性口腔液临床样本为江苏省农业科学院兽医研究所2018年以前采集保存的猪口腔液样本。16份采自4头ASFV人工感染猪(肌注105HAD50HLJ/18)接种后第20、22、24和26天的灭活阳性口腔液样本和灭活的血清样本。经商品化血清抗体ELISA检测试剂盒(金诺百泰生物技术有限公司,批号:20210646)检测为阳性(见OSID补充材料)。12份采自ASFV人工感染猪(口鼻接种104HAD50HLJ/18)的不同时间点的灭活口腔液样本和灭活的血清样本。2份采自2头ASFV同居感染猪感染后第22天的灭活阳性口腔液样本,同居感染通过与4头肌注106TCID50SD/DY-I/21或HLJ/HRB1/20于接种第1天共饲养实现。上述样本均由哈尔滨兽医研究所提供。用于特异性鉴定试验的伪狂犬病病毒(pseudorabies virus,PRV)、CSFV和PRRSV阳性口腔液标准品由江苏省农业科学院兽医研究所保藏。
1.1.2 主要仪器与试剂 荧光免疫分析仪(杭州中翰盛泰生物技术股份有限公司),肠激酶(北京碧云天生物技术有限公司)亲水性CdSe/ZnS QDMs(武汉珈源量子点技术开发有限公司),1-乙基-3-(3-二甲氨基丙基)氯化碳二酰亚胺(EDC)和蔗糖(美国Sigma-Aldrich),N-羟基琥珀酰亚胺(NHS)和牛血清白蛋白(BSA)(上海阿拉丁生化科技股份有限公司),鼠抗猪IgA-Sc片段抗体、兔抗鸡IgY和鸡IgY蛋白(美国Bethyl),硝化棉(NC)膜、吸收垫和样品垫(英国Whatman)。
1.2 试验方法
1.2.1 p30重组蛋白制备 1)利用无缝克隆技术构建pET32a-p30重组载体;2)利用原核表达系统在大肠杆菌BL21中以0.4 mmol·L-1IPTG诱导p30重组蛋白表达,16 ℃培养18 h;3)利用Ni亲和层析柱纯化带有His标签的p30重组蛋白;4)利用肠激酶切除经pET32a载体重组表达自带的Trx-tag、His-tag和S-tag标签,并再次利用Ni亲和层析柱纯化酶切后p30重组蛋白;5)经PBS透析和超滤浓缩管浓缩获得无标签的p30重组蛋白;6)利用Western blot验证制备的p30重组蛋白的免疫原性。
1.2.2 QDM-p30和QDM-兔抗鸡IgY探针制备 参照实验室已建立的QDM与蛋白质的偶联条件制备量子点荧光探针[15]。首先,100 μL的羧基修饰的QDMs 被添加至含20 mg·mL-1EDC和20 mg·mL-1NHS的20 mmol·L-1MES缓冲液(2-[N-morpholino] ethanesulfonic acid,pH 6)中,于37 ℃孵育15 min。接着以10 000g离心活化后的羧基修饰QDMs 20 min,再以100 mL MES缓冲液(0.02 mol·L-1,pH 8.00)重悬。分别加入14 μg p30重组蛋白和10 μg兔抗鸡IgY,在37 ℃下孵育2 h,加入4 mL 10% BSA溶液封闭微球表面未结合的羧基。以10 000g离心10 min后,用200 mL PB(磷酸盐缓冲液,0.02 mol·L-1,pH 7)缓冲液重悬QDM-p30和QDM-兔抗鸡IgY探针,4 ℃避光保存备用。
1.2.3 量子点免疫试纸条制备与检测体系建立 1)制备检测线(T线)为鼠抗猪IgA-Sc片段抗体,质控线(C线)为鸡IgY蛋白的侧向流免疫试纸条,并将QDM-兔抗鸡IgY质控探针均匀的喷于NC膜上,免疫试纸条干燥后于室温下保存备用;2)取7 μL待检口腔液样本与1 μL QDM-p30检测探针经62 μL样本稀释液(含1%脱脂乳的PBS,pH 7.4)混合后,全部加至试纸条的样品垫上,室温下静置反应15 min后,待检样品中经QDM-p30捕获的ASF sIgA抗体被固定于T线上的鼠抗猪IgA-Sc片段抗体再次捕获(图1),通过检测量子点荧光信号实现样本中抗体水平的定性及定量检测。检测结果可通过微型手持紫外灯定性观察,也可利用荧光免疫分析仪定量分析。

QDM.量子点微球QDM. Quantum dot microsphere图1 ASFV sIgA抗体量子点免疫试纸条检测原理Fig.1 Schematic diagram of QDM-based immunostrip for ASFV sIgA antibody detection
1.2.4 Cutoff值确定 利用建立的方法检测本实验室保藏的100份ASFV阴性口腔液临床样本,计算所有样本的T线荧光平均值和标准差值,再通过公式cutoff值=平均值+3×标准差确立该方法的Cutoff值。此外,使用于37 ℃加速老化1个月的试纸条检测100份ASFV阴性口腔液临床样本,计算所有样本的C线荧光平均值和标准差值,以把最小C值包含在内的计算值作为试纸条检测成立值。将T线位置观测到显著条带且T值大于等于cutoff值,C线位置观测到显著条带且值大于等于成立值作为阳性判定标准。
1.2.5 灵敏度检测 将热灭活ASFV阳性口腔液进行2倍梯度稀释至1/2、1/4、1/8、1/16、1/32、1/64和1/128,利用建立的方法进行3次重复检测,确定该方法敏感性。热灭活ASFV阳性口腔液采自ASFV人工感染猪(口鼻接种104HAD50HLJ/18)接种后第22天(DPI22)的口腔液样本,由哈尔滨兽医研究所提供。经OIE颁布的qPCR方法(Ct值为27.042)和商品化血清抗体ELISA检测试剂盒(金诺百泰生物技术有限公司,批号:20210646)检测均为阳性(见OSID补充材料)。
1.2.6 特异性验证 利用建立的方法重复三次检测PRV、CSFV、PRRV标准阳性口腔液,验证该方法的检测特异性。PBS作为空白对照,热灭活ASFV阳性口腔液(口鼻接种104HAD50HLJ/18,DPI 22)作为阳性对照。此外,检测热灭活ASFV Ⅰ型天然弱毒株SD/DY-I/21感染阳性口腔液和热灭活ASFV Ⅱ型天然弱毒株HLJ/HRB1/20感染阳性口腔液鉴定本研究方法对ASFV天然弱毒株的特异性。
1.2.7 临床样本检测效能评价 利用建立的方法检测16份人工感染ASFV HLJ/18猪的热灭活ASFV阳性口腔液临床样本和20份ASFV阴性口腔液临床样本。另外,分别利用建立的方法和商品化血清抗体ELISA检测试剂盒(金诺百泰生物技术有限公司,批号:20210646)检测人工感染ASFV后不同时间点的口腔液样本和血清样本,比较病毒最早检出时间。
2 结 果
2.1 ASFV p30抗原蛋白的制备
利用原核表达系统在大肠杆菌BL21中诱导pET32a-p30表达,再经Ni柱亲和层析纯化带有Trx、S和His标签的p30重组蛋白,蛋白相对分子质量约为50 ku。结果如图2A所示,重组蛋白被含250 mmol·L-1咪唑的洗脱液(PBS,pH 7.9)集中洗脱。经PBS透析去除咪唑后,再利用肠激酶切除经pET32a载体重组表达自带的标签蛋白(Trx、S和His标签,约14 ku)。酶切产物经Ni柱纯化,含有His的标签蛋白被结合在层析柱上。结果如图2B所示,酶切后p30重组蛋白(约36 ku)蛋白被含50 mmol·L-1咪唑的洗脱液集中洗脱。利用Western blot验证制备的p30重组蛋白的免疫原性,结果如图2C所示:由于切除了载体标签,制备获得的p30重组蛋白不能与His单抗反应;制备获得的p30重组蛋白能够与p30单抗和热灭活ASFV阳性口腔液产生单一反应条带,具备良好的免疫原性。
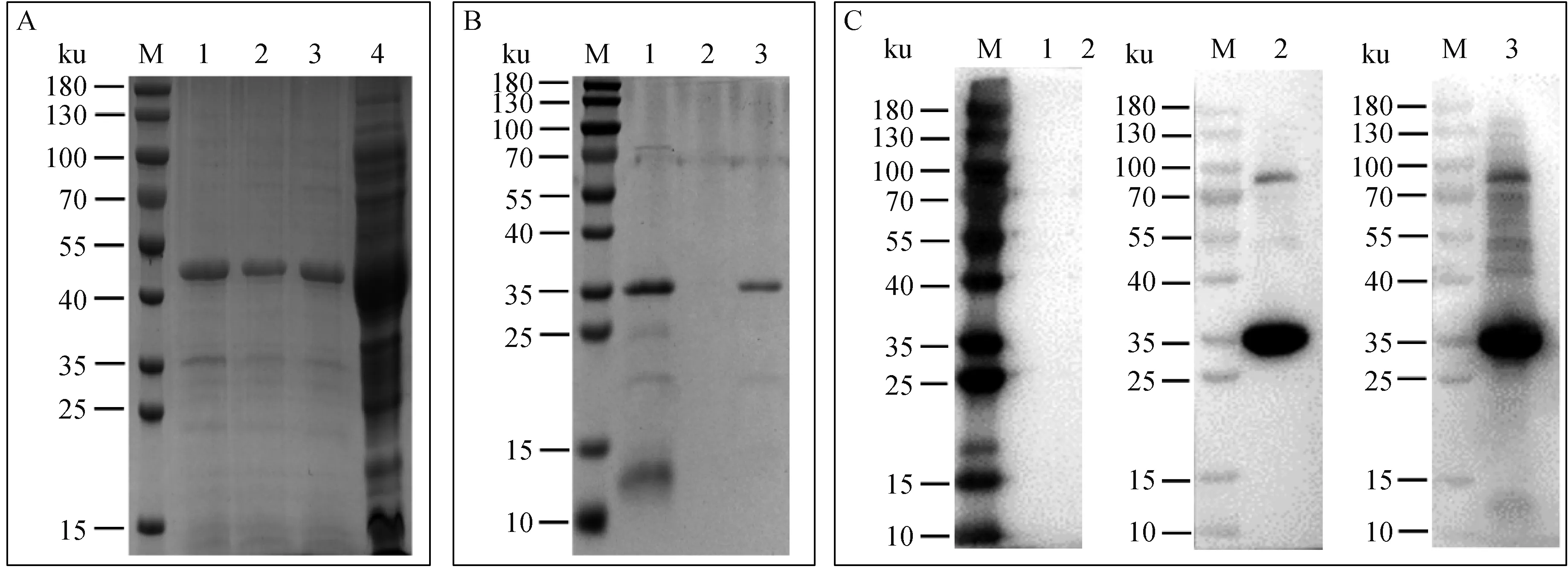
A. pET32a-p30重组蛋白的纯化SDS-PAGE结果(M.180 ku蛋白质相对分子质量标准;1~3. 含250 mmol·L-1咪唑的洗脱液洗脱产物;4. 流穿液);B. pET32a-p30重组蛋白的标签酶切与纯化SDS-PAGE结果(M.180 ku蛋白质相对分子质量标准;1. pET32a-p30重组蛋白经肠激酶酶切后产物;2. 肠激酶酶切产物流穿液;3. 含50 mmol·L-1咪唑的洗脱液洗脱产物);C. 肠激酶酶切纯化后p30重组蛋白Western blot结果(M. 180 ku蛋白质相对分子质量标准;1. 兔抗鼠His单抗为一抗;2. 兔抗鼠p30单抗为一抗;3. 热灭活ASFV阳性口腔液为一抗)A. SDS-PAGE results of purified pET32a-p30 recombinant protein (M.180 ku protein marker; 1-3. Elution products containing 250 mmol·L-1 imidazole; 4. Flow through liquid); B. SDS-PAGE results of label digested and purified pET32a p30 recombinant protein (M.180 ku protein marker; 1. The product of pET32a p30 recombinant protein after enterokinase digestion; 2. Enterokinase digestion and logistics penetration; 3. Elution products containing 50 mmol·L-1 imidazole elution solution); C. Western blot results of p30 recombinant protein purified by enterokinase digestion (M. 180 ku protein marker; 1. Rabbit anti mouse His monoclonal antibody as primary antibody; 2. Rabbit anti mouse p30 monoclonal antibody as primary antibody; 3. Heat inactivated ASFV positive oral fluid as primary antibody)图2 ASFV p30抗原蛋白制备Fig.2 Preparation of recombinant protein ASFV p30
2.2 Cutoff值的确定
利用开发的ASFV sIgA抗体量子点免疫荧光试纸条检测本实验室保藏的100份ASFV阴性口腔液临床样本。如图3所示,100份ASFV阴性口腔液临床样本的T均值为552.4,标准差为258.3,cutoff值为1 327。C均值为9 120,标准差为2 517,其中最小C值为4 598,当C均值减去2倍标准差时(4 086),最小C值包含在内,因此设定当C值大于等于4 086时试验成立。

A. 100份临床阴性样本检测T值;B. 100份临床阴性样本检测C值A. T values of 100 clinical negative samples; B. C value of 100 clinical negative samples图3 100份ASFV临床阴性口腔液样本检测结果Fig.3 Detection results of 100 clinical ASFV-negative oral fluid samples
2.3 灵敏度检测
利用开发的ASFV sIgA抗体量子点免疫荧光试纸条检测梯度稀释的ASFV阳性口腔液。如图4所示,本研究建立的检测方法可实现口腔液中ASFV黏膜抗体sIgA的高灵敏性检测,最低检测限为1∶64。此时T线的平均值为2 037,高于cutoff值为1 327的阳性判定标准。所有样品的C线值均位于大于4 086。
2.4 特异性验证
利用开发的ASFV sIgA抗体量子点免疫荧光试纸条检测PRV、CSFV、PRRSV阳性口腔液标准品,ASFV强毒株HLJ/18感染口腔液,ASFV弱毒株SD/DY-I/21感染口腔液,以及ASFV弱毒株HLJ/HRB1/20感染口腔液鉴定特异性。PBS作为空白对照。结果如图5所示,本研究建立的检测方法与PRV、PRRSV和CSFV不存在交叉反应,该方法能够特异性检测不同亚型、不同毒力的ASFV sIgA抗体。
2.5 临床样本检测效能评价
利用开发的ASFV sIgA抗体量子点免疫荧光试纸条检测本实验室保藏的20份ASFV阴性口腔液临床样本和16份ASFV阳性口腔液样本。如图6A所示,本研究建立的检测方法能够实现口腔液中ASFV sIgA抗体的特异性检测。此外,分别利用本研究建立的方法和商品化血清抗体ELISA检测试剂盒检测人工感染ASFV不同时间点的口腔液样本和血清样本,发现本研究建立方法最早可于感染后第6天检出,显著早于商品化试剂盒第16天的最早转阳时间(图6B)。
3 讨 论
目前,ASFV流行形式复杂。表现为亚急性、长潜伏或持续性感染的ASFV Ⅰ型和Ⅱ型天然弱毒株对ASFV防控构成了严重威胁。在感染现场第一时间作出准确诊断仍是ASF防控的首要关键。血清学诊断无需核酸提取和扩增、假阳性率、操作便捷,较病毒核酸检测更适应现场即时检验的需求。因此,开发敏感、快速、高效的ASFV抗体即时检测方案对助益ASF防控十分必要。
基于全病毒抗原或重组表达抗原(如p72、p54、p30等)的ELISA方法是世界动物卫生组织(OIE)推荐的ASF抗体检测方法。Gimenez-Lirola等[12]在ASFV早期抗体检测中利用免疫荧光珠分析(multiple fluorescent beads immunoassay,FMIA)比较了三种ASFV抗原蛋白p30、p54和p72,发现当以p30作为包被抗原时可在接种后8~12 d感染猪的血清和口腔液中检测到特异性抗体。袁芳峰等[16]基于p30蛋白建立一种敏感性好、重复性强的ASFV抗体检测阻断ELISA方法。ELISA是目前实验室最常用的ASFV血清抗体检测方法,由于其操作繁琐,耗时长,依赖仪器等限制,在缺乏实验室条件的猪场中应用受限。基于胶体金、乳胶微球和时间分辨率荧光微球(time-resolved fluorescent microspheres)的侧向流免疫层析技术被越来越多地应用于猪场ASFV抗体的POCT检测。万英等[17]和张欣雨等[18]开发了ASFV胶体金免疫检测试纸条。Sastre等[19]开发了基于衣壳蛋白VP72的乳胶微球免疫层析试纸条用于ASFV和CSFV的血清抗体检测。李成飞等[20]以截短的p54作为靶标抗原,开发了ASFV血清抗体荧光微球免疫试纸条。但是,上述试纸条方法的敏感性以及对于ASFV临床早期诊断仍待进一步提高。
与石墨烯、增频纳米粒子和荧光染料相比,量子点具有激发宽、发射窄、量子产率高、光化学稳定性和生物相容性好等优点,在提高生物制品检测敏感性方面展现出了巨大的应用潜力[21-23]。此外,与离散的量子点相比,量子点聚合微球(QDMs)往往具有更高的荧光信号、较强的反光子漂白性能和光化学稳定性。sIgA抗体是宿主黏膜部分应对感染首先产生的免疫抗体。本团队靶向黏膜抗体成功研制了国际首个猪肺炎支原体sIgA-ELISA抗体检测试剂盒(新兽药证字4号,2018)。该试剂盒不仅实现了猪肺炎支原体的早期诊断,还解决了猪气喘病活疫苗与灭活疫苗缺乏临床快速评估手段的问题[24]。此外,黏膜抗体IgA作为猪流行性腹泻病毒抗体检测靶标的ELISA试剂盒也于近期获得了批准文号(新兽药证字04号,2023)。可见,针对黏膜抗体IgA的检测具有良好的应用前景和商业化潜能。本研究将侧向流免疫层析技术的高特异性,与QDMs的超敏感性以及黏膜sIgA抗体的早期性相结合,开发了一种靶向ASFV黏膜抗体sIgA检测的量子点荧光试纸条(图1)。经检测,该方法对ASFV sIgA抗体检测灵敏度高、特异性好,对ASFV阳性口腔液的最低检出稀释度可达1∶64(图4),且适用于不同亚型、不同毒力的ASFV sIgA抗体检测(图5)。相较于市场上普遍使用的血清IgG抗体检测,口腔液sIgA检测无需侵入式样本采集,耗时更短,能在室温条件下、约20 min内完成目标样本的检测,可满足亚急性感染、慢性感染和临床健康ASF康复猪场的“拔牙清除”需求。此外,利用本研究方法检测ASFV人工感染猪口腔液中sIgA抗体时,最早于感染后第6天出现转阳,继抗体水平短暂下降后,再于感染后第12天起检测到稳定的阳性结果(图6B)。这可能是由于口腔液中黏膜抗体均一性较差,或动物饮水、饮食等行为稀释了口腔液样本抗体含量导致的。值得注意的是,考虑到此次检测样本数量有限,该方法的最早检出时间仍需进一步的检验。
4 结 论
本研究基于QDMs-p30检测探针开发了量子点免疫试纸条,实现了口腔液中ASFV sIgA抗体灵敏且特异的POCT诊断,填补了市场上ASFV黏膜抗体检测方法空白。与商品化ASFV抗体检测ELISA试剂盒相比,应用该方法检测不同时间点的口腔液样本,最早可于人工感染后第6天检出阳性,显著早于血清抗体ELISA检测试剂盒第16天的最早检出时间。考虑到其灵敏度高、特异性好、操作便捷、处理速度快(整个过程约20 min)、检出时间早和能现场即时检验等优点,本研究开发的口腔液中ASFV sIgA抗体量子点荧光检测试纸条是猪场ASF现场筛查的一种潜在工具。
