认知行为疗法和虚拟现实疗法干预神经性疼痛的作用及机制*
2023-10-27阮婷婷翁明奇鲍晓明牛艳芳徐淑君
阮婷婷 翁明奇 吴 璨 鲍晓明 牛艳芳 徐淑君**
(1)宁波大学医学部,浙江省病理生理学重点实验室,宁波 315211;2)宁波市海曙区横街镇卫生院,宁波 315181;3)宁波市第二医院心内科,宁波 315010;4)宁波大学附属第一医院神经内科,宁波 315020)
神经性疼痛(neuropathic pain,NP)是由外周或中枢躯体感觉系统的损伤或疾病导致的疼痛,以神经分布区域的烧灼感、异常性疼痛、感觉过敏、麻木和刺痛为典型症状[1-2]。神经系统疾病或中枢神经系统获得性损伤,如多发性硬化症(multiple sclerosis,MS)、脊髓损伤(spinal cord injury,SCI)、带状疱疹(herpes zoster,HZ)等都会表现出持续性或间歇性的神经疼痛症状,并伴有一定程度的功能丧失和认知障碍[3-5]。神经性疼痛的全球发病率约为7%~8%,给患者带来巨大的经济或社会负担[6-7]。针对神经性疼痛,临床上目前主要采取药物治疗,三环类抗抑郁药、加巴喷丁、普瑞巴林和5-羟色胺去甲肾上腺素再摄取抑制剂被推荐为一线药物[8]。但是过量药物治疗往往会引起严重的副作用,或在可耐受剂量下仅提供了部分的疼痛缓 解[9]。认知行为疗法(cognitive-behavioral therapy,CBT)、虚拟现实(virtual reality,VR)疗法等干预由于其无创、伤害小等特点越来越受到重视,逐渐成为疼痛治疗的替代疗法或补充疗法[10-11]。研究表明,通过CBT和VR疗法可以降低患者的疼痛分值,减少因为疼痛引起的康复抵抗,从而促进机体功能的恢复,提高患者生活质量[12-14]。本文综述了神经性疼痛的发病机制,以及CBT和VR疗法在慢性神经性疼痛治疗中的应用及相关机制,从而为临床疼痛治疗提供新的见解和指导(图1)。
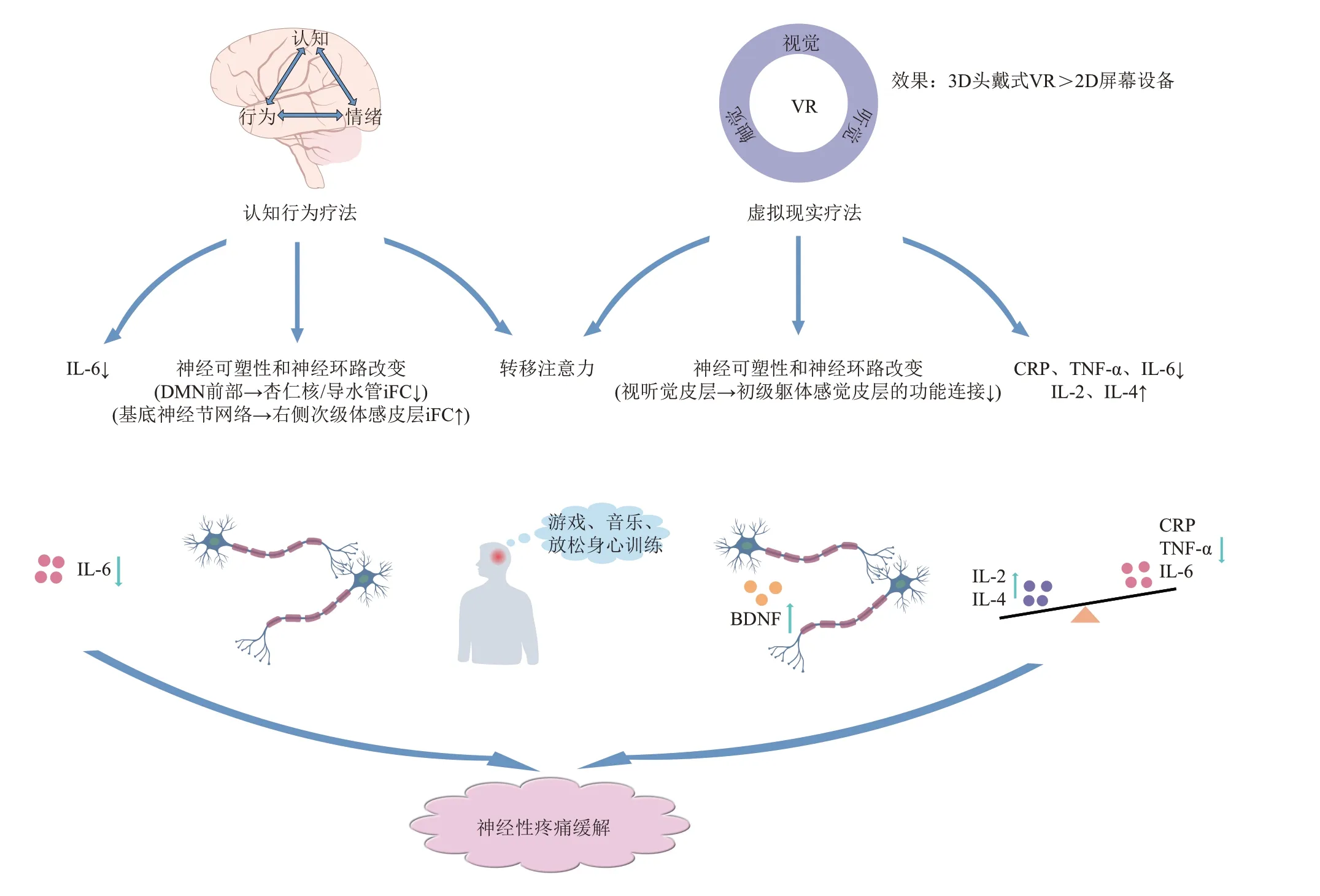
Fig.1 Mechanism of cognitive-behavioral therapy and virtual reality therapy in neuropathic pain图1 认知行为疗法和虚拟现实疗法调控神经性疼痛机制
1 神经性疼痛的机制
多种机制参与神经性疼痛的发生发展。离子通道异常、促炎和抗炎因子表达失衡、神经可塑性和神经环路的改变等导致神经纤维异常活动、外周和中枢致敏,从而引起疼痛[15-18]。
1.1 离子通道异常
周围神经元上电压门控钠通道(voltage-gated sodium channel,Nav)的失调与神经性疼痛的发生有关,其中Nav1.7、Nav1.8 和Nav1.9 几乎只在伤害性感受器上表达[19]。沉默调节蛋白1(sirtuin 1,SIRT1)是保守的组蛋白去乙酰化酶,其表达减少可以通过调节Nav1.7 启动子区域组蛋白H3 乙酰化水平,使背根神经节(dorsal root ganglion,DRG)中Nav1.7 表达上调,从而介导DRG 神经元的高兴奋性以及大鼠神经性疼痛的发生[20]。目前已发现多种Nav1.7 的选择性抑制剂,如ST-2530,可以逆转小鼠坐骨神经分支选择损伤(spared nerve injury,SNI)引起的机械性异常痛[21]。
除了Na+通道异常外,Ca2+通道异常在神经性疼痛的发生中也至关重要。研究发现,Cav3.1 T型钙通道的突变会使通道活性、电流密度和神经兴奋性增加,从而影响神经系统的疼痛传递[22]。前顶盖(anterior pretectum,APT)作为参与疼痛感知的躯体感觉系统的连接枢纽,Cav3.2 T型钙通道在小清蛋白(parvalbumin,PV)阳性的γ 氨基丁酸(γ-aminobutyric acid,GABA)能神经元亚群中特异性表达,且该通道已被证明可以与去泛素酶USP5相互作用介导神经性疼痛的发生[16,23]。
此外,血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)可以通过调控Na+和Ca2+通道调节疼痛信号传导,其与神经纤毛蛋白1(neuropilin 1,NRP1)结合可增强DRG中Nav1.7和Cav2.2通道电流和膜表达,而阻断两者的相互作用可以降低VEGF-A介导的脊髓背角自发兴奋性突触后电流频率和振幅,继而逆转大鼠的机械性异常痛和热痛觉过敏[24-25]。
1.2 神经可塑性和神经环路的改变
脊髓背角突触可塑性导致的中枢敏化被认为是多种神经病理性疼痛的共同病理基础[18]。在神经性疼痛的中枢神经系统中,突触可塑性表现为兴奋性突触和抑制性突触之间的不平衡[5]。多种信号通路参与调控神经可塑性。脊髓背角兴奋性神经元中的T 淋巴瘤侵袭转移诱导因子1(T lymphoma invasion and metastasis inducing factor 1,Tiam1)-Ras 相关的C3 肉毒素底物1(ras-related C3 botulinum toxin substrate 1,Rac1)信号轴,通过肌动蛋白细胞骨架重组和增强突触N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)活性稳定协调脊背角中的突触可塑性,参与神经病理性疼痛的发生、转化和维持[18]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是大脑中重要的信号分子家族,已被证明在轴突靶向运输、神经元生长、突触成熟和突触可塑性方面发挥重要作用[26]。研究发现,在臂丛神经撕脱伤(brachial plexus avulsion,BPA)小鼠和BPA 患者中,都存在BDNF的过表达模式和交感神经的过度兴奋状态,在外周,异常的BDNF信号参与调控交感神经纤维与感觉神经元的相互作用是NP 中外周致敏形成的重要机制[27]。在SNI 小鼠中的研究显示,抑制共济失调毛细血管扩张突变基因(ataxia telangiectasia mutated,ATM),从而下调组蛋白变体γ-H2AX,上调细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)磷酸化水平,增强DRG 感觉神经元的兴奋性,显著诱导机械性异常痛和热痛觉过敏[28]。小胶质细胞在突触重塑方面也发挥作用。小胶质细胞表达的瞬时感受器电位香草素受体4(transient receptor potential vanilloid type 4,TRPV4)通过脂质运载蛋白2(lipocalin-2,LCN2)的释放可以促进脊髓神经可塑性,介导神经元兴奋性和树突状脊柱重构[29]。
神经性疼痛还会影响前额叶皮层(prefrontal cortex,PFC)-伏隔核(nucleus accumbens,NAc)和外侧内嗅皮层(lateral entorhinal cortex,LEC)-齿状回(dentate gyrus,DG)的突触可塑性传递[30]。其中皮质边缘结构(前额叶皮层、伏隔核)发生的可塑性变化已被证明与疼痛刺激的情感行为相关联,内嗅皮层-齿状回通路的功能与认知行为相关联[31-33]。内侧隔核(medial septum,MS)的谷氨酸能神经元到外侧下丘脑(lateral hypothalamus,LH)的投射回路也参与疼痛的加工和调节,会显著降低小鼠的痛觉阈值[34]。
1.3 促炎和抗炎因子表达失衡
小胶质细胞的激活、促炎和抗炎因子的失衡在慢性神经性疼痛的发生和维持中起着重要作用[29,35-36]。与健康对照组相比,患有神经性疼痛的患者白细胞中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和 白介 素-1β(interleukin-1β,IL-1β)基因表达升高,而抗炎因子IL-10 表达降低[17]。小胶质细胞中的Orai1蛋白参与钙释放激活钙通道(calcium release-activated calcium,CRAC)的组成,Ca2+进入该通道可以激活钙调神经磷酸酶,进而促进炎症介质的合成和释放[37]。Orai1敲除会减弱脊髓小胶质细胞增殖,降低促炎因子水平和脊髓背角的兴奋性神经传递,从而减少雄性小鼠周围神经损伤后的机械超敏反应[38]。研究发现,小胶质细胞中还存在一种体积调节性阴离子通道(volume-regulated anion channel,VRAC),在炎症介质鞘氨醇-1-磷酸的刺激下使脊髓细胞外腺苷三磷酸(adenosine triphosphate,ATP)含量增加[39]。ATP通过刺激嘌呤能受体包括P2X和P2Y受体家族打开小胶质细胞中的p38 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子кB(nuclear factor-кB,NF-кB)通路,触发多种促炎因子的合成和释放,包括IL-6、TNF-α 和IL-1β,从而增强脊髓背角的兴奋性突触传递并重塑与神经性疼痛有关的脊髓回路[38]。
除了以上机制外,表观遗传调控也可能是神经性疼痛治疗策略的潜在新靶点。脊髓背角神经元中N6-甲基腺嘌呤(N6-methyladenine,m6A)特异性的DNA 甲基转移酶1 的下调,导致基因启动子处的m6A 损失,提高内向整流钾通道亚家族J 成员16(potassium inwardly rectifying channel subfamily J member 16,Kcnj16)表达,并导致小鼠神经性疼痛样行为[40]。
2 认知行为疗法在神经性疼痛干预中的作用及机制
近年来,生物-心理-社会干预模式越来越受到重视,认知行为疗法被认为是治疗疼痛最常用的心理学方法[41]。疼痛、情绪、认知、行为,以及社会环境之间是存在动态相互作用的[42]。一方面,神经性疼痛不仅会引起感觉症状,还会引起认知和情感功能障碍[5]。另一方面,认知行为干预又可以调控疼痛评分[12]。认知行为疗法通过学习各种自我管理技能建立对疼痛的正确认知,通过放松训练或注意力转移训练来减少疼痛感知,从而改善慢性疼痛及相关的心理并发症[43-44]。疼痛患者往往会表现出疼痛灾难化,即增强对疼痛的消极认知[45]。疼痛灾难化程度常被用以预测疼痛结果,CBT 正是通过改善这种对当下和未来的消极思想和负面情绪,进而影响疾病进展和预后[46]。研究发现,术前高水平的疼痛灾难化思想与术后疼痛强度成正相关[47]。
认知行为疗法的预期目的是放松个体以减少自主神经输出(即心率变异性、呼吸频率等)以及分散注意力,并改善对疼痛的不良情绪反应[48]。其中注意力转移是认知疗法中的常见疼痛应对技能,Feldmann 等[49]对临床1 440 例慢性疼痛患者的资料进行分析,发现分散注意力技能的使用会显著降低疼痛相关残疾和抑郁程度。研究对持续11 周CBT 干预以及仅接受教育材料的慢性疼痛患者进行神经影像学检查,与对照患者相比,CBT 干预使患者默认模式网络(default mode network,DMN)前部和杏仁核/导水管周围灰质之间的内在功能连通性(intrinsic functional connectivity,iFC)降低,并且这种变化与CBT 相关的情绪调节改善(例如更好的心理综合评分)相关,同时基底神经节网络和右侧次级体感皮层之间的iFC增加,这与患者疼痛管理自我效能改善相一致[50]。因此,CBT 可能通过情绪和认知管理调节脑区的神经环路改变,从而起到缓解认知功能障碍和减轻疼痛的效果。有证据表明,神经性疼痛患者脑中灰质体积会显著减少,其减少被认为是由于突触相关基因表达减少导致树突棘、树突和突触的丢失[51-52]。而CBT 干预已被证明可以减缓疼痛患者的灰质萎缩[53]。
除了影响突触功能外,CBT 还被证明可以抑制炎症因子的表达来缓解神经性疼痛。在慢性神经性疼痛时炎症因子IL-6 表达增加,并通过Erk/Mnk1/eIF4E 通路影响DRG 和三叉神经节(trigeminal ganglia,TG)神经元中的翻译调控,导致初级传入神经元的持续性疼痛超敏反应[54-55]。对40例带状疱疹后神经痛(post-herpetic neuralgia,PHN)患者进行为期12 周的治疗,与普瑞巴林单药治疗相比,CBT 联合普瑞巴林治疗后发现患者血中IL-6 的mRNA 表达显著下调,并观察到疼痛强度、灼烧、异常性疼痛和疼痛相关灾难化的评分显著下降[43]。CBT 调节体内炎症因子的含量有可能通过调控迷走或交感神经。研究表明,驱动迷走-肾上腺轴可以使TNF和IL-6产生减少50%[56]。
3 虚拟现实疗法在神经性疼痛干预中的作用及机制
3.1 虚拟现实疗法在神经性疼痛干预中的作用
VR 是一种基于交互性计算机的模拟技术,通过增强对用户视觉、听觉、触觉的反馈,使用户在虚拟环境(virtual environment,VE)中获得沉浸感和存在感[57]。该技术包括两大类:沉浸式和非沉浸式。沉浸式VR 通常由头戴式显示器和3D 输入设备组成,用户完全沉浸在与之交互的虚拟环境中。相反,非沉浸式VR使用户与真实世界环境保持某种感官联系[58]。VR将患者完全沉浸于虚拟的3D 空间中,有助于减轻患者的焦虑、压力、恐惧和痛苦,从而帮助患者康复[59]。VR在治疗神经性疼痛中的应用近年来显著增加,并显示出良好的效果[60-61]。最新一项对青少年严重神经性疼痛治疗的病例报告,暴露于虚拟环境可以显著降低患者的疼痛数字评定量表(numeric rating scale,NRS)分值[13]。
VR 疗法包括虚拟行走、虚拟增强训练、虚拟错觉和虚拟催眠等,其中虚拟行走和经颅直流电刺激(transcranial direct current stimulation,tDCS)联合治疗被证明在缓解脊髓损伤相关的神经性疼痛中效果最明显[62]。VR 疗法也可以根据用户类型,制定个性化的VR 程序,如给予目标导向型训练,或者时间标记训练模式[63]。虚拟环境中的认知操作任务不仅对改善注意力和记忆有积极影响,也能够很好地恢复患者的运动功能,促进康复[64-65]。此外,VR的沉浸程度与镇痛的效果存在相关性。VR硬件的快速发展使头戴式显示器产生越来越高的图形分辨率以及更强的交互性,从而带来更大的沉浸感。因此,与使用2D屏幕(非沉浸式)设备相比,3D头戴式VR(沉浸式)设备在降低患者疼痛评分方面效果更好[66]。对16名患有脊髓损伤和慢性神经性疼痛的男性进行一项随机交叉试验,结果称使用3D 头戴式VR 干预期间患者的平均疼痛减少65%以上,而使用2D 屏幕应用的平均疼痛仅降低35%[67]。沉浸式VR还强调了提高自身身体的感知与疼痛感下降之间关系的重要性,使患者处于完全感官沉浸的状态,从而减轻疼痛程度,也提高了患者对治疗的依从性,为疼痛治疗提供了一种宝贵的思路[68]。
3.2 虚拟现实疗法干预神经性疼痛机制
分散注意力是慢性疼痛患者的积极应对策略[69]。注意力被认为是疼痛感知中的一个调节因素,将注意力转移到身体之外,从而产生对疼痛的“遗忘”效应[68]。VR 可以将注意力从疼痛到另一种刺激的短期转移,通过“劫持”注意力、情绪和记忆来影响疼痛感知[67]。目前有证据表明,VR有助于减轻慢性和术后疼痛[70]。3D头戴式VR比2D屏幕应用降低疼痛效果更好的可能原因是3D 头戴式VR更能引起注意力转移[67]。
神经可塑性和神经环路及脑电的改变也是虚拟现实疗法干预神经性疼痛的重要机制。通过功能性近红外光谱技术(functional near-infrared spectroscopy,fNIRS)测量参与者的皮质连接和激活,发现VR的使用增强了视觉-听觉皮层激活,减少了与初级躯体感觉皮层(primary somatosensory cortex,S1)的功能连接,从而削弱了S1的疼痛处理功能,提高疼痛阈值[71]。此外,神经性疼痛患者在睁眼的静息状态下,α波活动增加,θ波和γ波活动降低[72]。VR干预使脊髓损伤患者额叶区域的δ 波和顶叶区域的低γ 波活动增加,额叶区域的α波活动减少,且患者自我报告疼痛强度评分降低[73]。神经影像学研究表明,VR干预可以激活患者对侧的运动皮层、小脑皮层和额叶白质区,有效促进皮层回路的轴突重塑和皮层映射的重排[74]。对慢性脑卒中患者进行基于沉浸式VR的运动控制训练干预,16 周后血清IL-6 水平下降17.96%,BDNF 浓度升高,这表明VR 通过抑制炎症因子和神经可塑性等机制发挥作用[75]。同样,Nambi等[76]对慢性非特异性腰痛(chronic non-specific low back pain,CNLBP)的运动员进行连续4 周的VR运动干预后,与等速运动和传统运动相比,不仅报告疼痛强度水平有显著改善,检测其炎症生物标志物C 反应蛋白(C-reactive protein,CRP)、TNF-α、IL-6都明显下降,IL-2和IL-4升高。
4 总结与展望
非药物的疼痛干预策略研究是当前疼痛研究者的关注热点,非药物的疼痛干预包括CBT、VR、非侵入性的神经调控策略、积极干预疗法、运动干预等[77-79]。神经性疼痛往往伴随着其他的躯体功能障碍,比如上下肢的关节损伤等,疼痛是阻碍患者康复训练的一个主要原因。CBT和VR疗法具有适用范围广,认知和行为相结合,受躯体功能障碍限制少的特点,两者联合使用或与药物治疗、其他非药物治疗联合使用可以作为新的有潜力的疼痛缓解方式[57,80]。例如,VR和非侵入性脑刺激(noninvasive brain stimulation,NIBS)联合使用对脊髓损伤患者神经性疼痛有积极作用[57]。最近,Aurucci 等[81]自主设计出了脑机接 口(braincomputer interface,BCI),通过实时监测脑电图结合皮肤电导的神经生理特征,实时触发经皮神经电刺 激(transcutaneous electrical nerve stimulation,TENS)和VR 的多感官干预,使患者神经性疼痛症状量表(neuropathic pain symptom inventory,NPSI)评分降低50%,显示出极大的潜能。
尽管研究发现CBT和VR疗法在认知和神经性疼痛管理方面有着很好的应用,但当前的研究仍然存在一些不足,许多问题值得在未来研究中继续探索。首先,目前的疼痛效果评价方法存在局限性,普遍使用自我报告的数字评定表,由于个体差异对疼痛的评级显然存在主观性,采用更先进的生理监测技术客观评价疼痛程度可能会使研究结果更有可信度。CBT 和VR 疗法的适用人群存在一定的差异,VR 的适用性相较于CBT 更加广泛[10]。目前尚没有对其镇痛效果进行系统比较的结论,需要研究人员进行更大规模的人群研究来解决这一问题。其次,CBT和VR对神经病理痛的治疗作用机制方面目前研究尚不够深入,能否调节离子通道或表观遗传修饰进而缓解疼痛还没有相关报道,应鼓励基础研究者投身其中探索更多作用机制,为疼痛患者减轻痛苦。此外,应该基于VR提供更加个性化的治疗方案,针对性别、年龄和兴趣爱好等因素设计不同的VR 内容类型,量身定制VR 参数,以实现更好的沉浸效果和最大程度的疼痛缓解,也可以在VR 中加入低信噪比(5 dB)的声音,最新研究发现,低信噪比(5 dB)的声音可以通过皮质丘脑回路诱导小鼠产生镇痛作用,并且在声音停止刺激后,这种积极影响至少可以维持两天[82]。因此,神经性疼痛管理仍然是一个有待解决的重要课题,应该实施基于药物治疗和非药物治疗的多学科、多模式管理策略。不仅要解决镇痛问题,还要解决影响患者疼痛体验以及对生活质量和功能产生不利影响的心理社会因素。
