化学和物理干预治疗阿尔茨海默病的机制*
2023-10-27潘召韬马宇涛林苏扬高君妍单江晖储超扬沈李丽萍
潘召韬 马宇涛 肖 彪 林苏扬 高君妍 单江晖 储超扬沈 巍 谢 凯** 李丽萍**
(1)宁波大学医学院附属医院康复科,宁波 315211;2)宁波大学医学院生理与药理学科,宁波 315211)
根据世界卫生组织的定义,痴呆症是一种慢性或进行性综合征,通常是认知功能出现严重衰退超过正常年老的过程,它影响记忆、思考、定向、理解、计算、学习、语言和判断能力。认知能力损伤通常伴有情感控制能力、社会行为和动机衰退,或晚于上述几种状况出现。目前全世界有5 000 万人患有痴呆症,随着人口老龄化,预计到2050 年将增加两倍多,而阿尔茨海默病(Alzheimer’s disease,AD)是痴呆的主要类型,占所有痴呆病例的50%~75%,主要发病人群是60 岁以上老年人,而65岁后老年人发病率每5年大约翻一番[1]。AD 患者在临床上表现为记忆力下降、认知障碍、语言障碍、学习能力下降等特点。AD的主要病理特征是β 淀粉样蛋白(amyloid β,Aβ)寡聚体在细胞外沉积形成的老年斑和Tau蛋白被过度磷酸化并在细胞内积累形成的神经原纤维缠结[2]。根据既往研究,AD 的发病机制主要包括突触丢失[3]、胆碱能神经元损伤[4]、Aβ 积累和Tau 蛋白磷酸化[5]、神经血管和前庭丢失等假说[6]。目前临床上针对AD的药物治疗选择非常有限,而且药物干预仅暂时性缓解病症,不能逆转AD的病理,并且对老年人有很大的副作用[7]。因此,近年来非药物的物理干预用于缓解和改善AD的研究越来越受到重视。本文就嗅觉干预、光疗法、声光刺激、脑电刺激、温度干预5个方面进行综述,为物理干预作为预防和延缓AD提供新的思路。
1 嗅觉干预
嗅觉系统是通往大脑的主要感官通道之一。研究表明,AD患者的嗅觉功能在早期阶段就发生恶化,嗅觉功能异常是最可能预示AD发生的早期预警标记[8]。嗅觉功能恶化可能与病理性Aβ 和高度磷酸化Tau 蛋白在嗅觉上皮(olfactory epithelium,OE)和内嗅皮层(entorhinal cortex,EC)等区域积累有关[9]。嗅觉系统存在神经发生,鼻嗅觉受体神经元可终生再生,OE 存在嗅觉感受器表达、神经发生和神经退化,嗅球(olfactory bulb,OB)也存在突触发生和神经发生[10]。鼻和OB中的嗅觉神经元可能为研究神经退行性疾病的发病机制提供了一个窗口。因此,针对嗅觉系统的康复治疗也可能成为防治AD的有效手段之一。
在嗅觉刺激中,气味信号转导发生在嗅纤毛中,它始于气味分子与嗅觉感受器的结合,引发了由腺苷酸环化酶III(adenylate cyclase III,AC3)产生的第二信使cAMP介导的一系列分子事件[11]。气味诱导的纤毛cAMP 增加,产生了一个由Na+和Ca2+携带的转导电流,正电荷电流通过环状核苷酸门控通道进入细胞内,随后负电荷Cl-通过由Ca2+激活的氯离子通道流出细胞外,最终细胞内因去极化产生动作电位,兴奋传递到OB,使OB 神经元兴奋性增强,这种增强是由钙依赖性电导的降低而导致[10]。同时,OE中包含的微绒毛支持细胞在其中也发挥了一系列作用,它们产生了神经营养和神经调节分子(如内源性大麻素、胰岛素和ATP),从而参与神经保护和神经发生[12]。一项研究将36 只Sprague-Dawley 大鼠随机分为训练组、伪训练组和空白对照组,在四臂径向迷宫中训练组的大鼠必须在每次同时呈现的两种气味(分别代表正面和负面提示)之间进行选择,只有选择了代表正面提示的气味后,才能获得水奖励,进行嗅觉辨别训练(20 次/d),持续3 d,每天持续到10 次试验后,训练组的大鼠至少有80%选择了代表正面提示的气味,结果表明大部分训练组的大鼠学会了对本次气味的辨别。研究还发现,嗅觉辨别训练诱导了内源性神经营养因子尤其是脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的产生,并激活额叶皮层神经营养因子的信号转导[13]。同样的,另一项研究也选用Sprague-Dawley大鼠进行了与上述相同的实验,结果表明嗅觉辨别训练诱导大鼠嗅觉梨状皮质锥体神经元兴奋性增加和突触传递增加,后超极化和成对脉冲减少,增强了大鼠的学习和记忆能力[14]。嗅觉辨别训练也会导致大鼠梨状皮质锥体神经元顶端树突棘密度增加[15]。其次,一项研究以C57BL/6J 小鼠为研究对象进行了嗅觉辨别学习训练,小鼠随机分为训练组、伪训练组和空白对照组,每组6 只,每天接触一对气味剂,试验200 次/d,持续14 d,训练组在选中代表奖励的气味后给予水奖励,伪训练组则随机给予水奖励,空白对照组仅暴露在净化空气中,结果发现嗅觉辨别学习训练能提高脑部成熟新生颗粒细胞(granule cells,GCs)的树突棘密度,利用光遗传标记显示嗅觉训练加强了嗅觉皮层(olfactory cortex,OC)到海马区新生GCs 之间的突触连接,增强了兴奋性信号的输入[16]。另一项研究将注射Aβ1-42寡聚体造模的急性AD大鼠暴露在黑松精油蒸汽中,15 min/d,持续21 d,发现黑松精油的刺激可降低Aβ对大脑的毒性作用和氧化应激。用径向臂迷宫和 Y 迷宫进行行为测试后发现黑松精油刺激减轻了Aβ 诱导的记忆障碍,表明芳香精油疗法在治疗AD 上具有神经保护和促智作用[17]。此外,临床试验研究数据表明熟悉或特定的气味可唤起过往的记忆,使AD患者表现出更快的记忆诱导、更短的记忆检索时间、更好的心理时间旅行和更具体的情感体验,提示气味可以作为AD患者唤起记忆的线索[18]。芳香疗法对AD患者睡眠障碍有积极作用,还能通过抑制乙酰胆碱酯酶的作用和降低海马区氧化损伤,从而改善记忆障碍[19]。以非侵入性方式在皮肤表面放置6种潜在的刺激电极,通过产生小的电子脉冲进入大脑嗅觉神经元区域,刺激嗅觉神经元兴奋,可以缓解并阻止AD患者症状的进一步恶化,表明嗅觉区域非侵入性电刺激疗法也是治疗AD策略之一[20]。
综上,通过对嗅觉的气味辨别训练或对嗅觉区域进行非侵入性电刺激,均可以诱导并增强嗅觉神经元的兴奋性,从而改善AD 的症状(图1)。因此,对嗅觉系统的干预也成为研究治疗AD症状的重要干预策略之一。

Fig.1 The mechanism of olfactory intervention in the treatment of Alzheimer’s disease图1 嗅觉干预治疗阿尔茨海默病的作用机制
2 光疗法
2.1 光生物调节
光生物调节(photobiomodulation,PBM)主要指利用低能量的光照射组织细胞,使组织细胞中线粒体的光受体吸收红色光至近红外光(620~1 100 nm)光子,从而产生有益的作用[21]。细胞色素c 氧化酶(cytochrome c oxidase,CCO)是PBM 发挥作用的基本分子,CCO 是线粒体呼吸电子传递链的第4个酶复合物,发挥催化氧气还原为水的作用,意味着CCO 和所有需氧细胞中代谢能量的产生密切相关,且CCO具有两个血红素(a和a3)和两个铜中心(CuA 和CuB),具有红色光(620~680 nm)和红外光(760~825 nm)的光谱吸收峰[22]。此外,作为细胞内主要的光感受器,CCO 对光的吸收并不局限于波长620~680 nm 和760~825 nm,对更长的近红外光如波长1 064 nm、1 068nm 和1 072nm 也具有吸收峰。而近红外光对患神经认知障碍的大脑产生有益的作用[21]。
脑血流量障碍、神经血管功能障碍和脑氧合降低已被认为是AD 的一个重要特征[23]。在PBM 的应用中,CCO 吸收光子并发生光氧化后,诱发CCO 上调,增加耗氧量和ATP 产生,从而改善代谢功能,并促进一氧化氮释放和线粒体膜电位增加[24]。同时,在CCO吸收光子并增加线粒体膜的通透性后,活性氧会短暂增加,从而激活与神经保护和细胞存活相关的线粒体信号通路[25]。此外,PBM 治疗促进一氧化氮释放,导致血管舒张、血液循环加快和脑血流量增加[26]。相关研究表明,作为一种非侵入性的脑PBM 形式,经颅近红外激光刺激会导致人脑中CCO 的光氧化,引起氧化CCO 上调,并触发血流动力学改变,诱导人前额的CCO、氧合血红蛋白浓度(oxyhemoglobin,HbO2)和总血红蛋白浓度(total hemoglobin concentration,HbT)等血流动力学参数显著增加[27]。PBM 通过影响人的脑电生理活动,增强老年人的神经认知功能,从而对抗与衰老或血管疾病相关的认知衰退[28]。PBM 通过激活蛋白激酶B 上Ser9 残基磷酸化,然后与糖原合酶激酶3β(glycogen synthase kinase-3β,GSK3β)的N端位点结合,抑制GSK3β 活性,从而保护细胞免受损伤和凋亡,发挥神经保护作用[29]。PBM 还通过抑制环加氧酶2(cyclooxygenase 2,COX-2)和调节核因子-κB(nuclear factor-κB,NF-κB)信号通路,发挥抗炎作用[30]。PBM 通过细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)-cAMP反应元件结合蛋白(cyclic AMP response element binding protein,CREB)通路,上调BDNF 水平,促进树突结构和突触发生,改善神经元连接和突触传递[31]。一项动物研究使用年轻(4月龄)和老年(20 月龄)雄性Wistar 大鼠进行激光二极管(波长为810 nm、功率100 mW)的慢性经颅治疗,随机分为年轻激光组(n=7)、年轻对照组(n=8)、老年激光组(n=8)和老年对照组(n=7)四组。年轻/老年激光组连续58 d接受经颅近红外激光治疗,每日激光治疗总能量为15 J,照射时间为150 s,通量为535.7 J/cm2,年轻/老年对照组则关闭激光接受安慰剂治疗,结果表明慢性经颅PBM 显著增强了年轻大鼠大脑皮层的代谢途径,尤其是兴奋性神经传递和氧化代谢,而且老年大鼠代谢途径可以恢复至年轻大鼠水平[32]。D-半乳糖(D-galactose,DG)的慢性给药已被用于诱导大脑氧化应激和认知功能障碍,以模拟啮齿类动物的自然衰老[33]。因此,一项研究将成年雄性BALB/c小鼠随机分为对照组(注射生理盐水,n=12)和衰老诱导组(注射500 mg/kg DG,n=60),探索经颅低水平激光治疗对DG诱导的小鼠线粒体功能障碍、细胞凋亡和认知障碍的影响。注射DG诱导的衰老小鼠分别给予4 J/cm2或8 J/cm2、2次/d、3 d/周、持续6周的红色光(波长660 nm)和近红外光(波长810 nm)激光治疗(最大输出功率200 mW、功率密度 4.75 W/cm2和10 Hz 脉冲波),发现4 J/cm2和8 J/cm2的红光和近红外光治疗均可改善衰老引起的线粒体功能障碍和细胞凋亡,通过巴恩斯迷宫和What-Where-Which 任务进行评估发现8 J/cm2红光和近红外光治疗显著缩短DG小鼠的潜伏期,而相同波长4 J/cm2对DG小鼠的行为无显著性影响,提示8 J/cm2的红光和近红外光治疗明显改善DG小鼠空间记忆和情景记忆[34]。此外,PBM 还具有抗炎作用。为了评估低水平激光照射(low-level laser irradiation,LLI)对Aβ 诱导的大鼠海马神经毒性的治疗作用,对Aβ 寡聚体诱导的成年雄性Sprague-Dawley大鼠进行LLI治疗,使用808 nm连续波的二极管激光器,大脑皮层组织水平接受剂量为15 J/cm2,海马水平约为5.0 J/cm2,2 min/d,持续5 d,结果显示LLI治疗缓解Aβ诱导的线粒体自噬,降低氧化损伤,抑制反应性胶质细胞增生、促炎因子产生和Tau过度磷酸化等神经变性,从而减轻了Aβ 诱导的行为缺陷[35]。PBM 还可以治疗老年大鼠的空间记忆和神经炎症。年轻(4月龄)和老年(20月龄)雄性Wistar大鼠每天接受激光二极管经颅照射治疗(波长810 nm、功率100 mW),颅部照射5 个点(30 s/点,总计15 J 能量、时长150 s),持续58 d,结果显示老年PBM组大鼠的空间记忆恢复至年轻对照组大鼠水平,同时PBM 降低了老年大鼠单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-5(interleukin-5,IL-5)水平,提示接受PBM治疗明显改善的老年大鼠的空间记忆和神经炎症[36]。
临床研究发现,PBM 对脑血流量(cerebral blood flow,CBF)和CCO 有积极的影响[28,37-38]。对平均年龄为72 岁健康老年妇女(25 名)进行经颅发光二极管(large electronic display,LED)治疗(波长627 nm、功率密度70 mW/cm2、能量密度10 J/cm2),额顶区4 个点,30 s/点,每周2 次,连续4周,结果显示,LED治疗后试验者左侧大脑中动脉收缩期速度增加25%、舒张期速度增加30%、基底动脉收缩期速度增加17%、舒张期速度增加25%,三侧大脑动脉搏动指数和阻力指数下降,提示LED 治疗改善了健康老年妇女大脑和基底动脉的血液流量[37]。另一项对年龄在49~90 岁患认知下降风险和主观记忆抱怨参与者(21 名)给予颅红外光刺激(transcranial infrared laser stimulation,TILS)治疗(功率3.4 W、功率密度250 mW/cm2、积能量密度60 J/cm2、照射面 积13.6 cm2),4 min/次,1 次/周,持续5 周,采用持续注意精神运动警戒任务(psychomotor vigilance task,PVT)、工作记忆使用延迟匹配样本(delayed matching-tosample,DMS)记忆检索任务测量、脑电图(electroencephalogram,EEG)和功能磁共振成像(functional magnetic resonance imaging,fMRI)评估TILS对认知的影响,结果显示,TILS可增加静息状态脑电图的α、β和γ功率,并促进了前额叶血氧水平依赖性fMRI反应,所有参与者的反应时间、正确试验次数和失误次数都有所改善,且老年者在DMS 和PVT 任务中测出认知改善中的效果比年轻者更明显,治疗期间没有出现不良反应,提示非侵入性TILS 方法可能增强老年人的神经认知功能[28]。年龄在18~85岁健康的成年参与者(68名)接受近红外光谱刺激右前额叶皮层激光治疗(波长1 064 nm、功率3.4 W、功率密度250 mW/cm2、能量密度120 J/cm2、面积13.6 cm2)8次,1 min/次,结果显示,治疗组在激光刺激期间线粒体CCO 显著增加,刺激后氧合血红蛋白显著增加,脱氧血红蛋白减少,激光诱导的代谢和血液动力学效应与年龄呈负相关,治疗期间没有不良反应,提示TILS 增强年轻和年长健康成人的线粒体功能和脑血管脑氧合[38]。
总之,PBM可以缓解Aβ 诱导的广泛病理,包括线粒体功能障碍、氧化应激、神经炎症、神经元凋亡和Tau 磷酸化等。在动物模型中观察到PBM具有神经保护、神经调节、增强代谢途径、调节线粒体功能、调节细胞凋亡、增强抗氧化能力、抗炎作用、降低淀粉样蛋白毒性等作用。临床研究发现PBM 可以改善老年人的电生理活动和注意力、学习记忆等行为功能。动物和临床研究均表明PBM对大脑的代谢和血流动力学有很积极的影响。此外,目前没有记录PBM 治疗对健康老年人和脑损伤患者的大脑活动产生不利影响。因此,PBM 在治疗衰老引起的认知缺陷具有很好的前景。
2.2 光热疗法
在应用于AD 的众多治疗方法中,光热疗法(photothermal therapy,PTT)由于其时间和空间可控性而受到越来越多的青睐。应用的光热材料可以增强对Aβ 聚集的调控,从而对AD 产生治疗效果[39]。光热材料是通过PTT调节Aβ聚集的纳米材料,吸收光子的能量并将其转化为热量。研究表明长波近红外光(near infrared right,NIR)更适合用于治疗深层脑部的Aβ[40]。由于Aβ 的形成高度依赖于温度,局部温度的变化会大大影响Aβ的聚集,因此已经探索了各种光热材料用于AD的治疗,比如金纳米材料[41]。金纳米材料,如金纳米颗粒(Au nanoparticles,AuNPs)、金纳米 棒(Au nanorods,AuNRs)和金纳米层(Au nanospheres,AuNSs),是目前研究最广泛的用于PTT 的等离子体纳米材料[41]。利用AuNPs与短Aβ肽制备的Aβ-AuNPs 偶联物可以沉淀析出Aβ 聚集体,再通过高强度飞秒脉冲激光照射可以快速提高AuNPs 的温度,导致其表面周围形成蒸气纳米气泡(vapor nanobubbles,VNBs),并在很短的时间之内VNBs剧烈坍塌并引起高压冲击波,从而破坏Aβ 聚集体[42]。而与AuNPs 相比,聚乙二醇化的AuNRs(AuNRs-pegylated,AuNRs-PEG)不仅显示出较低的细胞毒性,而且表现出更强的表面离子共振效应[43]。在800 nm飞秒激光的照射下,AuNRs-PEG表面产生的瞬态机械力可破坏预先形成的Aβ 原纤维,导致Aβ 原纤维断裂成只具有较少β 折叠结构的小片段[44]。同时,带负电荷的脂质稳定的AuNRs 有两个作用:一方面可以通过阴离子脂质体以静电相互作用选择性地与阳离子Aβ序列结合,从而抑制Aβ 原纤维的形成;另一方面,在应用800 nm近红外光照射2 min后,可以通过吸收近红外光产生局部热点促进成熟Aβ 原纤维的热溶解,使其分解成更小的碎片[45]。此外,具有近红外光吸收特性的AuNSs已被用于调节纤维状Aβ的形成以及纤维状Aβ 沉积物的解离。在近外红光的照射下,钌复合物修饰的穿甲素(Pen)肽负载PEG稳定的AuNSs(Ru@Pen@PEG-AuNSs)不仅抑制了Aβ的聚集,而且有效地破坏了Aβ原纤维,从而阻止了Aβ 诱导的细胞凋亡,并恢复神经突生长和分支[46]。此外,等离子体光热特性的金属纳米材料(如银三角纳米片、Fe3O4纳米粒子)也已被应用于Aβ 原纤维的快速溶解。相关研究表明,在近红外光的照射下,银三角纳米片可以在1 h内降解Aβ原纤维[47]。通过将氮化碳(C3N4)纳米点锚定在Fe3O4@介孔二氧化硅纳米球上,并用苯并噻唑苯胺修饰,开发了一种具有螯合金属离子和靶向治疗能力的智能纳米系统,在近红外光的照射下可以诱导Aβ聚集和分解成熟的Aβ原纤维[48]。
综上所述,光热材料可以在激光的照射下通过局部温度的快速升高来解离Aβ原纤维或破坏Aβ聚集体,从而减轻Aβ 诱导的神经毒性,并改善认识障碍。因此,光诱导产生的局部热量用于靶向分解Aβ聚集体,是利用光热疗治疗AD的主要机制。
3 声光刺激
伽马(γ)波是人类大脑中最快的脑电波,由大量神经元发出同步电脉冲产生,形成共振频率为25~100 Hz,其中研究40 Hz 对大脑活动的影响最为广泛。有证据显示在海马体中经常出现γ 节律,γ波在人类物体表征、视觉特征绑定以及高级认知功能中发挥作用,提示γ波段同步参与各种认知功能的基本过程[49]。一项研究将轻度至中度AD患者随机分配到积极治疗组(n=14)和假手术组(n=8),积极治疗组接受了40 Hz视觉和听觉刺激,1 h/d,为期6个月,假手术组则暴露于高频(90 Hz以上)刺激,结果发现,40 Hz刺激疗法可以恢复皮质γ 振荡,并成功地改善轻度至中度AD 患者睡眠质量和日常生活活动能力[50]。
利用侵入性光遗传学手段将光纤植入5×FAD/PV-Cre 小鼠视觉皮层,再给予不同频率光刺激,1 h/d,持续7 d,结果发现,40 Hz光刺激可以使小胶质细胞由静息态转变为吞噬态,并降低了视觉皮层中53.22% Aβ1-40和44.62% Aβ1-42,而以8 Hz 或其他随机频率刺激均不能降低Aβ 水平,提示光刺激治疗效果与光刺激的频率有一定的关联[51]。40 Hz光闪烁刺激使小胶质细胞突起长度减少,胞体直径增加,免疫染色显示细胞体与Aβ 共定位的小胶质细胞数量比对照组增加近两倍,提示40 Hz光刺激诱导的小胶质细胞形态变化可增强其的吞噬活性[52]。非侵入性40 Hz 频率光闪烁刺激AD 小鼠,1 h/d,持续7 d,结果显示,40 Hz光闪烁刺激诱导γ 振荡,并减少淀粉样斑块和磷酸化的Tau 蛋白,增强神经保护因子释放,减少神经元损伤和小胶质细胞诱导的炎症反应;40 Hz 光闪烁刺激Tau 模型的P301S 小鼠(8 月龄)和CK-p25 小鼠(6~9 月龄),1 h/d,分别持续22 d 和42 d,发现改善突触功能、增强神经保护因子、减少神经元的DNA 损伤和减缓炎症反应,提示40 Hz视觉刺激可以改善神经退行性疾病症状[53]。线粒体ATP 敏感型钾离子通道和呼吸链活性损伤会加重AD症状。研究发现 40Hz 闪烁光刺激可改善线粒体ATP 敏感型钾离子通道结构和功能、线粒体呼吸链酶活性(复合物I和IV)、线粒体膜电位(ΔΨm)并减少线粒体活性氧(reactive oxygen species,ROS)的产生,提示光刺激影响线粒体钾离子通道和呼吸链[54]。40 Hz听觉刺激可诱40 Hz 听觉稳态反应(auditory steady-state response,ASSR)和γ 振荡,有助于改善认知功能和语言学习记忆能力[55]。研究使用5×FAD小鼠进行了1 h/d,为期7 d的40 Hz听觉刺激,发现40 Hz听觉刺激可以使小鼠听觉皮层和海马中的淀粉样蛋白(尤其是可溶性和不溶性Aβ1-42)显著减少,小胶质细胞数量和突起分枝显著增加,并改善5×FAD 小鼠的识别能力和空间记忆能力[56]。40 Hz 听觉刺激显著增加了APP/PS1 小鼠听觉皮层和海马CA1 区反应性星形胶质细胞的数量,提高血管直径,促进大脑听觉皮层、海马区的血液流动以及低密度脂蛋白受体相关蛋白1(lowdensity lipoprotein receptor-related protein 1,LRP1)介 导大脑脉管系统转胞吞作用,从而减少淀粉样蛋白负荷,提示40 Hz 听觉刺激促进淀粉样蛋白的清除[57]。此外,在Tau 病变、5×FAD 和APP/PS1 小鼠模型进行40 Hz 听觉刺激后发现高度磷酸化的Tau 形成的神经缠结显著减少,表明40 Hz 听觉刺激也能一定程度改善Tau蛋白沉积,并且这种有益效应并非限于某一种AD动物模型[58-59]。在临床试验中,对轻中度AD 患者进行40 Hz 光闪烁刺激,1 h/d,2 次/d(早、晚各一次),连续10 d,发现40 Hz 光疗没有降低AD 患者的皮质淀粉样蛋白负荷,提示可能短期(10 d)视觉刺激治疗效果不显著[60]。另一项研究对轻、中、重度AD 患者进行40 Hz听觉刺激干预,通过圣路易斯大学心理状态(SLUMS)测试、情绪评定量表和行为观察评估发现,40 Hz 听觉刺激治疗对轻至中度AD 患者精神症状改善效果最大,并随着治疗时间延长可使患者的认知能力增强[61]。
相关研究还探索了40 Hz视觉和听觉的双重组合刺激疗法。发现与单一视觉或听觉刺激相比,视觉和听觉组合刺激产生的治疗效果更好,引发更激烈的小胶质细胞反应、清除更多的淀粉样斑块以及更显著认知能力的恢复[57]。视听觉组合刺激使P301S 突变Tau 模型小鼠脑皮质层小胶质细胞数量显著增加,内侧前额叶皮层和新皮层斑块数目和体积均显著减少,脑萎缩减少,并改善大脑认知功能[56]。基于光和声音的伽玛感觉刺激疗法,Cognito Therapeutics公司推出了一款便携的头戴式Cognito 设备,AD 患者通过该设备接受40 Hz 视听觉双重刺激治疗,1 h/d,持续6个月,而安慰剂组的AD患者则接受虚假刺激,经过两组间的比较分析发现治疗组的AD 患者大脑白质(white matter)萎缩速度明显减少。鉴于白质连接大脑广阔区域,预防或减少大脑白质萎缩可能会减少AD 的进展。此外,阿尔茨海默病神经影像研究所(Alzheimer’s Disease Neuroimaging Institute,ADNI)数据库收集了200 名AD 患者和400 名被诊断为轻度认知障碍患者的定期脑部扫描影像,将接受Cognito 设备治疗的数据与ADNI 数据库的数据进行了比较分析,发现接受为期6个月Cognito设备治疗的AD患者白质体积增加(0.38±0.82)%,而ADNI 数据库同周期的AD 患者白质体积减少(2.45±0.40)%(P<0.004),提示为期6 个月伽玛感觉刺激疗法可以有效地减少白质萎缩[62]。在2022 年阿尔茨海默病协会国际会议(Alzheimer’s Association International Conference,AAIC)上,Cognito Therapeutics 公司首席科学官Mihaly Hajos 博士也指出,Cognito 设备是安全的、耐受性良好的,可很好地融入患者的日常生活,且长期每日伽玛感觉刺激可以保持认知功能、减少脑萎缩和改善睡眠质量[62]。视听觉组合刺激可将伽马频率夹带的有益效果延伸到前额叶皮层等大脑主要感觉区域之外,使前额叶皮层区斑块显著减少,进而产生更深层次、更广泛的作用,而仅听觉或视觉的单一刺激无法引发前额叶皮层区斑块的清除反应[56]。对42名轻度AD 患者进行40 Hz 声光刺激,1 h/d、连续3个月,发现40 Hz声光刺激增加了AD患者默认模式网络、中间视觉网络的连接性功能,改善昼夜节律和睡眠质量,提高人脸名称关联延迟回忆测试表现,减缓海马萎缩和心室扩张,提示40 Hz声光刺激可缓解AD 疾病发展[57]。另一项临床试验对10名轻度AD 患者进行了40 Hz 视听觉刺激,1 h/d,连续2个月,结果显示,刺激后肿瘤坏死因子样弱凋亡诱导因子(tumor necrosis factor-like weak inducer of apoptosis,TWEAK)、转化生长因子α(transforming growth factor-α,TGF-α)、巨噬细胞炎症蛋白1β(macrophage inflammatory protein 1 beta,MIP1β)和IL-5 显著下降,患者的默认模式网络功能连接也有所改善[63]。总之,40 Hz视听觉组合刺激通过诱发γ 振荡,改善AD 病理症状,并减缓记忆障碍。
综上所述,40 Hz诱发γ振荡改善AD病理症状主要是通过增加小胶质细胞吞噬活性,增强血管舒张和提高跨内皮细胞的胞吞作用,进而清除病理性蛋白,减缓AD病理症状,并改善记忆障碍。而且40 Hz视听觉组合刺激治疗效果优于单一视觉或听觉干预的效果。从AD 模型小鼠和AD 患者中获得的研究数据表明,接受40 Hz 视听觉刺激治疗后,表现出神经变性和脑萎缩减少、突触密度增加、昼夜节律正常化、认知功能改善,提示40 Hz视听觉刺激干预有望成为改善AD的新疗法。
4 脑电刺激
脑电刺激技术可以调节多种神经精神疾病的认知功能。相关研究表明,脑电刺激对AD具有可喜的治疗效果[64]。因此,脑电刺激技术正越来越多地被用于改善AD和相关痴呆症状的研究。脑电刺激可分为侵入性脑刺激(invasive brain stimulation,IBS)和非侵入性脑刺激(non-invasive brain stimulation,NIBS)。IBS 包括深部脑刺激(deep brain stimulation,DBS)和侵入性迷走神经刺激(invasive vagus nerve stimulation,iVNS),而NIBS包括重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)、经颅直流电刺激(transcranial direct current stimulation,tDCS)、经颅交流电刺激(transcranial alternating current stimulation,tACS)等,其中研究得最广泛的两种干预措施是rTMS和tDCS。
4.1 侵入性脑刺激
DBS 是将刺激电极直接植入大脑,再向周围脑组织施加电流的一种侵入性电刺激。利用DBS治疗AD 的常见脑部靶点包括穹窿[65]、内嗅皮层[66]、斜角带垂直部(vertical division of diagonal band,VDB)[67]等。在动物研究中发现,利用DBS 对Rett 综合征(Rett syndrome,RTT)小鼠的穹窿进行慢性刺激(频率130 Hz、60 μs 脉冲,1 h/d)后,增加神经元数量和提高神经发生,并减轻神经病理的负担,从而提高RTT小鼠在Morris水迷宫中的空间学习记忆能力和新物体识别中的辨别能力[68]。同时,相关临床研究显示,6名AD患者接受双侧穹窿慢性DBS刺激治疗(频率130 Hz、电压3.0~3.5 V),在一年的随访中发现患者内嗅区和海马区中记忆回路神经活动增强,提示DBS 治疗有利于提高记忆能力[69]。此外,目前未见对人类内嗅区进行DBS 慢性刺激的研究,但对啮齿类的AD 模型动物双侧内嗅区给予长期(持续25 d,7 h/d,5 d/周)DBS慢性刺激(频率130 Hz、电流50 μAmp、脉冲90 μs)后,发现啮齿类动物神经发生增加,且Aβ斑块负荷减少[70]。研究发现,嗅内皮层DBS(EC-DBS)治疗可以改善AD小鼠EC层II 至海马CA1 的突触连接的缺陷及诱导海马区的神经发生,进而改善认知功能[71]。EC-DBS治疗可减少早期(6 月龄)AD 小鼠背侧海马、前额叶皮层和杏仁核中的Aβ 斑块负荷,但对6 月龄后的AD 小鼠并没显著性的治疗效果,表明EC-DBS 可能仅对治疗早期AD 发挥作用[66]。斜角带垂直部DBS(VDB-DBS)治疗也已被证明可以挽救海马齿状回(dentate gyrus,DG)中胆碱能神经元突触密度的减少[67]。尽管普遍认为DBS 是安全且耐受性良好,但因侵入创伤而存在的无法预料的风险和可能发生神经或心理副作用,如对AD患者的丘脑前核进行双侧DBS 治疗癫痫时产生抑郁的副作用[72],因此应谨慎使用DBS,尤其是早期AD 患者不提倡使用。
iVNS 是将电极连接到大脑左侧迷走神经,并与植入左胸区域的脉冲发生器连接,通过脉冲发生器向迷走神经提供可编程的电刺激,从而调节大脑网络活动。研究发现,iVNS 通过海马穿刺通路CA3 区域上的蓝斑(locus coeruleus,LC)和β 肾上腺素受体发挥作用,以增强突触传递、神经可塑性和长时程增强(long-term potentiation,LTP),从而提高认知功能[73]。10名AD患者接受持续3个月的iVNS 治疗,其中7 名经过AD 评估量表认知分量表(Alzheimer’s disease assessment scale cognitive section,ADAS-Cog)评估有改善效果(中位改善3.0 分),9 名经过简易精神状态检查(mini-mental state examination,MMSE)评估有改善效果(中位改善1.5 分),提示iVNS 对认知具有改善作用[74]。基于这一发现,研究人员又招募17名AD患者进行了1年iVNS治疗,其中7名患者的ADAS-Cog 评分有所提高,12 名患者的MMSE 评分有所提高,12 名患者在临床医生访谈的变化印象(clinicians’ interview-based impression change,CIBIC)中有所改善[75],而且iVNS 刺激周期越长产生疗效越理想[75]。不同的iVNS刺激强度会产生差异的疗效。接受iVNS 的AD 大鼠在中等强度的刺激下表现出最大的记忆增强,并随着刺激强度增加表现出倒U形剂量反应曲线,在人类治疗中也出现类似的剂量反应关系[73]。
综上所述,作为脑电刺激的方法,DBS 和iVNS用于治疗AD,均可在一定程度上改善AD患者的认知障碍和记忆能力,但是二者作为侵入性治疗,在长期应用中都存在一定的风险和副作用,应谨慎选用。
4.2 非侵入性治疗
经颅磁刺激(transcranial magnetic stimulation,TMS)是一种非侵入性脑电刺激形式,通过位于头皮上的线圈传递短而强的电流脉冲,产生能穿透皮肤和颅骨的磁场,并在大脑皮层中产生电流,从而刺激或抑制线圈下方的一小块大脑区域。rTMS是以特定频率施加一系列强度相同的多个脉冲。在运动皮层中,rTMS 能够调节皮质兴奋性并诱导持久的神经可塑性变化[76]。rTMS 治疗可减少Aβ 肽的产生,提高神经元可塑性,并减少神经元的凋亡,从而有益于AD患者认知功能的改善[77]。轻中度AD患者参加一项rTMS治疗双盲随机对照试验,经过ADAS-Cog、MMSE、蒙特利尔认知评估(Montreal cognitive assessment,MoCA)和世界卫生组织-加利福尼亚洛杉矶大学听觉词语学习测试(World Health Organization-University of California-Los Angeles Auditory Verbal Learning Test,WHOUCLA AVLT)进行评估后发现,rTMS治疗对轻度AD患者认知、记忆和语言方面改善作用显著,而对中度AD患者在认知能力等方面的改善很小或不显著,提示rTMS对轻度AD患者疗效优于中度AD患者[78]。不同频率的rTMS 治疗效果不同。低频rTMS 抑制刺激区神经元的活动,而高频rTMS 则兴奋刺激区神经元的活动[79]。临床试验发现,20 Hz rTMS 比10 Hz 或1Hz rTMS 更好地改善AD患者的认知功能和日常生活自理能力,提示高频rTMS比低频rTMS产生更有效治疗效果[80]。rTMS对不同脑区的治疗效果不同。经过对94 名轻中度AD 患者进行rTMS 治疗后,发现刺激左侧前额叶背外侧皮层(dorsolateral prefrontal cortex,DLPFC)比右侧或双侧有更明显的认知改善效果[81]。另一项随机对照临床试验显示同时对大脑多个区域高频rTMS 治疗比单一区域更能改善AD患者的认知功能[82]。
经颅电刺激(transcranial electric stimulation,tES)是放置在头皮上的两个或多个电极之间传递微弱的刺激电流。tES最常见的形式是tDCS,即施加恒定电流(通常为1~2 mA)以产生电梯度,通过增加阳极附近神经元的静息膜电位(去极化)或降低阴极附近神经元的静息膜电位(超极化)来间接调节大脑皮层神经元的兴奋性[83]。已有研究表明,tDCS 通过改变皮层神经元的兴奋性,可调节大脑中的神经元可塑性,减轻神经病理症状,从而改善AD 患者的认知障碍[84]。tDCS 诱导的运动皮层兴奋性变化是由N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)和膜去极化介导产生[85]。正常人大脑运动皮层区经过阳极tDCS导致抑制性神经递质γ-氨基丁酸(gammaaminobutyric acid,GABA)浓度显著降低[86],而阴极tDCS 刺激导致谷氨酸显著降低,提示正负极的tDCS可调控不同神经递质释放[87]。健康老年人经过阳极tDCS 治疗后,显著降低GABA 水平和静息态大脑网络功能耦合,提示接受tDCS 抑制大脑功能效率[88]。此外,tDCS作用产生急性效应(刺激期间)和后效应(刺激后)依赖于不同的作用机制,其中急性效应依赖于钠通道和钾通道,而后效应依赖于NMDAR、GABA和钙通道[87]。BDNF是一种对大脑中神经元的可塑性起着重要作用的神经营养因子,有研究显示tDCS可增加AD患者BDNF水平[89]。阳极tDCS 刺激诱导BDNF 启动子I 的表观遗传修饰,如增加组蛋白3在赖氨酸9处的乙酰化(H3K9ac),从而增强BDNF 外显子I 和IX 的mRNA 及BDNF 蛋白质表达[90]。BDNF 启动子I 处的组蛋白乙酰化已被证明影响LTP和长期记忆[91]。此外,tDCS 与重复的低频突触激活(low frequency synaptic,LFS)结合会触发BDNF 前体(proBDNF)和蛋白酶的共同释放,蛋白酶可能会促进proBDNF裂解为成熟的BDNF,成熟的BDNF诱导的酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)激活,促进初级运动皮层LTP,从而通过增强突触可塑性,提高认知和记忆功能[92]。突触NMDAR 在海马CA1 区域的LTP 中起关键作用,有研究显示tDCS 诱导的LTP 还依赖于NMDAR激活[93]。
tACS 是以特定的频率在给定的刺激强度(即峰-峰幅度)下,将以正弦波在电极之间交替的电流传递到脑部区域,从而调节大脑皮层区域的活动,并将目标区域大量潜在神经元的放电活动引入到施加的外源性频率,通过施加的电流改变神经元的跨膜电位,从而提高神经夹带活性[94]。与tDCS通过调节神经元兴奋性从而发挥作用不同,tACS在认知或感觉-运动过程中直接与正在进行的神经元活动相互作用,进而引起大脑网络振荡的夹带同步,诱导突触可塑性,从而调节认知过程[95]。对AD 模型大鼠进行tACS 刺激,结果显示tACS 改善AD大鼠脑内Aβ诱导的记忆损伤和辨别能力下降,表明tACS 可以对抗Aβ 诱导的记忆障碍[96]。对5×FAD 小鼠进行了tACS 刺激,发现刺激导致兴奋性突触后电位显著增加[97]。tACS 会影响AD 小鼠模型突触传递的持久增强[97]。临床研究对轻中度AD患者进行靶向刺激双侧颞叶(尤其是内嗅皮质)的tACS 疗法,1 h/d、为期4 周,发现治疗后患者的磷酸化Tau蛋白和小胶质细胞活化显著降低,但脑内Aβ负荷无显著性改变,提示tACS疗法仅可以改善部分AD 病理[98]。另一项在内侧顶叶皮层和楔前叶区域上施加tACS 治疗,结果显示,治疗组的瑞氏听觉性语言学习测验(Rey auditory verbal learning test,RAVLT)总回忆、长时间延迟回忆分数和人脸名称关联得分均提高,且皮质内胆碱能神经传递的网络连接增强,提示tACS 显著改善AD患者记忆能力[99]。
综上所述,rTMS和tDCS都是通过调节大脑中神经元活动和兴奋性来减轻神经病理症状,从而达到治疗AD 的目的。tACS 不是改变神经元的兴奋性,而是通过夹带和共振效果将大量的神经元群体纳入局部振荡网络,改变区域执行的内部计算和更广泛的大脑网络活动,从而调节认知功能。虽然rTMS和tDCS都是对大脑连接和活动产生影响,但两种技术在作用机制上有所区别,即rTMS可以直接诱导动作电位,而tDCS 只能增加皮层神经元的静息膜电位;不过两种技术的局限性都是电流无法到达大脑深部区域,只能在大脑皮层中发挥作用。
5 温度干预
体温是已知的最古老的代谢读数,健康老化与核心体温变化有关。体温调节障碍常常出现在老年人,随着年龄的增长,平均体温逐渐降低,产生的热量越来越少,身体维持其核心温度的能力开始下降,即体温调节机制效率逐渐减弱。老年人体温调节能力的丧失可能部分归因于棕色脂肪组织(brown adipose tissue,BAT)的活性随着年龄的增长而逐渐降低[100]。有研究证据表明,老年人中逐渐发展的关键代谢障碍可能导致AD 发病[101]。体温调节障碍与AD发病率呈指数的增长,提示通过对体温干预调节可能改善AD。
热中性是指动物在环境温度的某一范围内,除了基础代谢产生的能量外,不需要通过生热作用产生额外的热量来维持其核心温度(如小鼠核心温度约为28°C;人体的核心温度大约在36.5~37.5℃,人直肠测量体温最接近此范围)。在热中性区,在不进行任何体力活动的情况下,哺乳动物通过新陈代谢产生足够的热量对抗体温调节失效造成的体温下降,从而维持预定的体温。通过维持热中性环境干预,可能改善AD小鼠或患者的认知体征和神经病理学。当将3×Tg-AD 小鼠暴露在28℃(小鼠的热中性区在26~34℃左右)的温暖环境中7 d 后,小鼠直肠的平均温度升高了0.95℃,通过执行对象识别任务试验和明暗箱实验(light-dark transtition test)评估发现热中性环境干预可恢复3×Tg-AD 小鼠的识别记忆功能[102]。为探索温度对Tau 磷酸化的作用,将26 周龄2 型糖尿病db/db 小鼠置于34~35°C的通风培养箱中1 h,db/db小鼠的直肠温度恢复到对照组温度,检测发现表位AT8、CP13、PHF1 和AT180 的Tau 磷酸化位点被完全消除[103]。老年人骨骼肌功能减退,通过热疗法使骨骼肌功能增强和线粒体能量代谢。一项临床研究将23 名志愿者进行脉冲短波透热疗法(800 脉冲/s,脉冲持续400 µs),2 h/d,持续10 d,使肌内温度升高了(4.2±0.29)°C,结果显示热处理可减轻人体骨骼肌的萎缩,并防止线粒体功能丧失[104]。AD 脑部血流量减少和血脑屏障功能障碍,通过被动加热可改善脑血流量。在一项研究中,18 名志愿者被分入热疗组(热水浸泡以保持直肠温度≥38.5°C,60 min/次,1 次/d,持续8周,n=9)和对照组(假手术,n=9),结果显示,热疗改善了皮肤微血管功能,改善血流介导的扩张、增加脉搏波速度、减少颈动脉内膜厚度,有利于维持脑血流和血脑屏障功能[105]。此外,根据体温测量,15~20 min 的桑拿浴足以将人体核心温度从原先的37°C 升高到大约 38~40°C[106]。一项针对2 000 多名健康男性的前瞻性研究表明,高频率的桑拿浴(4~7次/周)可以降低AD 以及其他痴呆的风险[107]。神经元树突标志物Drebrin 蛋白急剧减少是AD 和相关认知障碍主要病理特征之一,热中性环境引起的体温升高导致Drebrin 表达升高[102]。Drebrin 是一种与丝状-肌动蛋白结合的成束蛋白,对突触可塑性、树突棘形成发挥作用[108]。Drebrin 通过丝状-肌动蛋白与神经微管之间结合或解聚,调节记忆功能[109]。在突触可塑性中,DrebrinA通过调节肌动蛋白的骨架结构,从而影响树突棘的形态[110]。Drebrin与肌动蛋白构成的Drebrin-肌动蛋白复合物,促进树突棘形成,利于维持突触的正常功能[111]。Drebrin通过抑制星形胶质细胞的活化,从而有效抑制炎症因子和补体的分泌,使Drebrin 在抑制Aβ 生成或加速Aβ 降解的过程中发挥重要的作用。此外,在热中性环境下,核心体温的升高引起血脑屏障(blood brain barrier,BBB)有关的转运蛋白——LRP1 的大量增加,进而大幅度下调大脑皮质中不溶性Aβ42水平[102]。LRP1还介导BBB外腔侧的可溶性Aβ的内化降解[112],通过与磷脂酰肌醇结合网格蛋白组装蛋白(phosphatidylinositol-binding clathrin assembly,PICALM)、Rab5 和Rab11 小GTP 酶共同调节的跨BBB 的Aβ 胞吐作用,使Aβ 透过BBB的腔侧进入血液中,被BBB 相关周细胞(pericytes)清除[113]。
此外,核心体温降低会导致Tau 过度磷酸化[102]。BAT是哺乳动物的主要产热组织,通过刺激BAT 产热维持体温,可以纠正体温调节和代谢缺陷,进而阻断低温诱导的Tau 过度磷酸化[114]。老年C57BL6/129SvJ小鼠放置于4°C冷暴露,持续24 h,结果显示老年小鼠大脑皮质中的Tau 磷酸化明显增加(其可溶性Tau pThr181 和pThr231 显著升高)[101]。将3×Tg-AD 小鼠放置于4°C 冷暴露,持续24 h,结果发现增加小鼠大脑皮质Tau 磷酸化、可溶性Aβ 蛋白浓度和造成突触蛋白丢失[115]。老年(15 月龄)3×Tg-AD 小鼠进行4°C 冷暴露,4 h/d,5次/周,持续4周,发现反复短期冷暴露可以增强BAT 产热和改善葡萄糖耐量,还可以保护小鼠免受低温诱导的Tau过度磷酸化。反复短期冷暴露的小鼠BAT 中沉默调节蛋白3(silencing regulatory protein 3,SIRT3)增加。SIRT3 是一种在禁食或冷暴露条件下在BAT 线粒体中表达的蛋白质,短期反复冷暴露有效地刺激了BAT 产热[116]。AD小鼠进行4°C冷暴露,3 h/d、持续3 d,发现冷暴露可以对抗AD诱导的脂质代谢变化,提示短暂冷暴露干预对AD的潜在保护作用[117]。
温度干预对不同模型AD小鼠的作用效果总结于表1。热中性环境主要通过增加Drebrin含量,减少大脑皮质中的不溶性Aβ,而反复短期4°C 冷暴露诱导BAT 产热,改善体温调节和代谢缺陷,阻断低温诱导的Tau过度磷酸化,提示纠正体温调节缺陷对AD可能有一定的治疗作用。
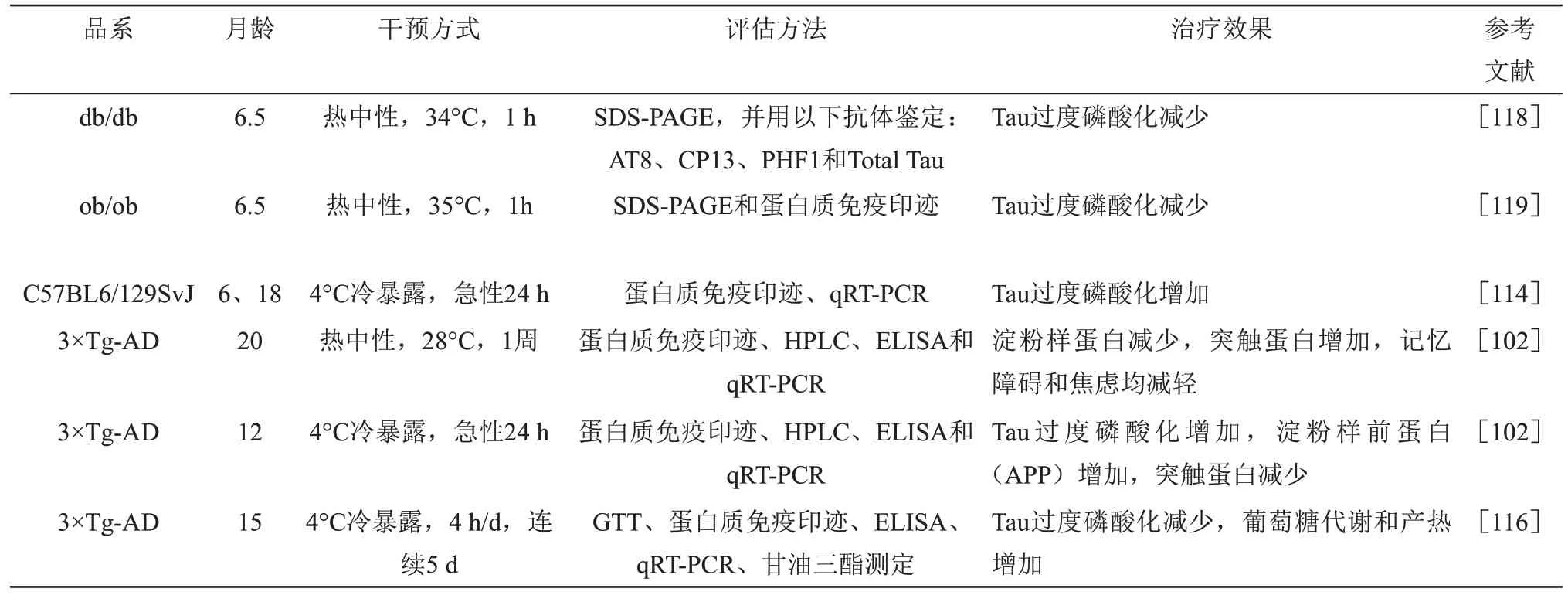
Table 1 Effects of temporary in mouse models of Alzheimer’s disease表1 温度对阿尔茨海默病模型小鼠干预的作用效果
6 展 望
虽然在药物治疗方面已经进行了大量的研究,但目前针对 AD 的药物治疗只能在一定程度上减轻临床症状,无法阻止或逆转病理进程。目前临床上AD治疗药物主要包括乙酰胆碱酯酶抑制剂和N-甲基-D-天冬氨酸受体拮抗剂等,这些药物对轻中度认知障碍患者有一定缓解效果,但不同个体的药物治疗效果也参差不齐。根据《2019 阿尔茨海默病患者家庭生存状况调研报告》显示,63.71%的患者因为疗效不明显而停药。此外,药物治疗可能带来腹泻、肌肉痉挛、乏力、恶心、呕吐和失眠等副作用,会大大降低患者用药的依从性。2018年4月首都医科大学发布的《阿尔兹海默症在中国以及世界范围内疾病负担的重新评估》显示,中国约有1 000 万AD 患者,平均每人治疗花费13 万元/年,这意味着巨大的经济负担可能会让许多患者主动放弃药物治疗[120]。因此相对安全、负担成本小、副作用少的物理干预可能会更加受到大部分患者的青睐。目前研究发现,嗅觉干预可以诱导并增强嗅觉神经元的兴奋性,光疗法可以促进脑血流量和能量代谢、降低炎症和氧化应激水平、抑制细胞凋亡等,声光刺激可以激活小胶质细胞吞噬活性、增强血管舒张和跨内皮细胞的胞吞作用,脑电刺激可以调节大脑中的神经元活动和兴奋性,温度干预可以改善体温调节和代谢缺陷等(图2),因此这些物理干预有望改善脑能量代谢、增强神经元可塑性、抗炎症和氧化作用等,进而预防和减缓AD 的发生,改善认知能力。国家卫健委发布的《阿尔茨海默病的诊疗规范(2020 年版)》指出及早治疗和延缓疾病特别是早期疾病的进展是AD治疗的重要原则[121]。而物理干预很可能是预防和治疗AD 早期阶段以及预防早期痴呆的有效方法。此外,单一因素物理干预作用治疗效果有限,如何使物理干预刺激效果最大化,如探索多个物理干预联合作用的效果,其疗效可能不止是单一物理干预简单叠加的效果,可能产生出协同的效应。同时,各个物理干预之间参数,刺激方式选择(同时叠加、依次叠加或间歇性叠加)等还需进行系统的研究论证。目前仍无一个公认且广泛的治疗AD体系,非药物治疗在临床上应用已发挥出其独具的优势,但仍需不断的进一步完善才能迎接已经来临的老龄化社会的挑战。

Fig.2 The mechanism of chemical and physical intervention in the treatment of Alzheimer’s disease图2 化学和物理干预治疗阿尔茨海默病的作用机制
