MiR-132-3p调控FZD4/Wnt/β-catenin通路抑制类风湿关节炎成纤维样滑膜细胞增殖和侵袭
2023-10-27梁舒崔玉荣吴洁张超郭占非高晓许振丹范文强
梁舒,崔玉荣,吴洁,张超,郭占非,高晓,许振丹,范文强
新乡市中心医院&新乡医学院第四临床学院风湿免疫科,河南 新乡 453000
类风湿关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病[1]。RA的诱导因子有病毒感染、激素失调以及基因表达失调[2]。RA 患者会出现增生性的滑膜衬里组织,能够导致患者致残以及死亡率增加,滑膜衬里组织包含大量成纤维细胞样滑膜细胞(fibroblast-like synoviocytes,FLSs)。FLSs 能够产生炎症细胞因子和分解代谢酶,主要通过和其他免疫相关因子作用促进关节炎症[2-3]。当FLSs激活后,其迁移和入侵能力会增加,这种特性有助于RA发展[4]。因此探究RA 中FLSs 表型的改变有助于发展RA 治疗方案。微小RNAs(microRNAs,miRNAs)是一类不具有蛋白编码能力的小RNAs,目前已经成为生物医学研究的一个重要领域[5]。此类小RNAs除了能够和长非编码RNAs 以及miRNAs 作用,也能够结合并破坏mRNAs转录[6]。研究指出一些miRNAs失调可能使个体易患RA,这些miRNAs 包括miR-126-3p、miR-339-5p 和let-7i-5p 等[7],另外有证据表明血清miRNA 水平可以预测RA 治疗的反应[6],表明miRNAs 具有治疗RA 的潜力。有文献已报道miR-132-3p 参与调控颞下颌关节骨关节病[8],并且具有预测甲氨蝶呤治疗RA反应的能力[9]。Tseng等[10]的预测也表明miR-132-3p在RA患者滑膜组织中的表达是失调的,但目前miR-132-3p调控RA 的机制尚不明确。 因此本研究围绕miR-132-3p 对RA-FLSs 表型影响以及相关机制展开研究,报道如下:
1 材料与方法
1.1 主要试剂和仪器 miRNA 提取试剂盒、无核酸酶超纯水、miRNA 逆转录试剂、cDNA 第一链合成逆转录试剂盒、高特异性染料法qPCR 预混液、TsingZol 总RNA 提取试剂、高纯度低电渗琼脂糖、聚丙烯酰胺电泳预制凝胶和蛋白Marker 购自北京擎科生物;蛋白电泳仪购自美国Invitrogen 公司;增强型ECL 化学发光检测试剂盒、脱脂奶粉、磷酸缓冲液、RIPA 裂解液、Βradford 蛋白定量试剂、pcDNA3.1 (+)载体和FZD4 过表达载体购自南京诺唯赞生物;蛋白成像系统购自美国UVP 公司;MTT 实验试剂购自广州赛云生物;酶标仪购自美国Thermo Fisher 公司;EdU 增值试剂盒、miR-132-3p 模拟物、基因定量分析所用引物、riboFECT™mRNA 转染试剂和miRNA 阴性对照(miR-NC)均由广州锐博生物提供;结晶紫、细胞凋亡检测试剂、FZD4、β-catenin、和c-Myc 抗体、减血清培养基、聚偏氟乙烯膜、二抗抗体和双荧光素酶检测试剂购自北京索莱宝生物;基底膜基质购自美国Corning公司;CyclinD1抗体购自武汉三鹰生物。
1.2 实验方法
1.2.1 滑膜组织收集 于2022年3月至2022年6月在新乡市中心医院或新乡医学院接受治疗的32 例RA患者和27例非RA患者分别提供了32份膜组织和27份正常滑膜组织(每例患者一份)。每例患者在手术前签了知情同意书。收集的滑膜组织储存在-80℃环境中,样品收集经医院伦理委员会批准。
1.2.2 RA-FLSs 分离与培养 依据已出版的细胞分离步骤[11]从收集的RA 滑膜组织和非RA 滑膜组织中分离RA-FLSs。首先去除滑膜组织中的脂肪和血管等组织,清洗后,将组织切为1 mm3左右放到装有适量DMEM完全培养基的培养瓶中,将培养瓶放到含有5%二氧化碳的温度为37℃的培养箱,在培养期间细胞需每隔3 d 传代一次;大概14 d 左右,RA-FLSs会从培养的组织中迁移出来并生长成细胞单层,此后培养单层的RA-FLSs,传代3~5 次的RA-FLSs 冻存在液氮中已备后续实验所用。
1.2.3 细胞处理与分组 分离的RA-FLSs 汇合度在90%左右时,用磷酸缓冲液清洗两次,进行传代培养,根据每个实验所需培养孔计算所需细胞量,待细胞汇合度达到30%~50%时进行细胞转染。用减血清培养基稀释riboFECTTMmRNA 转染试剂,将此混合液分别和miR-132-3p 模拟物、模拟物阴性对照、pcDNA3.1(+)载体以及FZD4 过表达载体在室温下孵育5 min 后并根据各个实验目的将这些寡聚核苷酸和载体单独或者一起加到培养板中,在培养箱培养48 h,收集细胞后进行功能实验。单独转染miR-132-3p 模拟物以及模拟物阴性对照的培养板记为miR-132-3p组和miR-NC组;联合转染miR-132-3p和pcDNA或者FZD4的记为miR-132-3p+pcDNA组以及miR-132-3p+FZD4组。
1.2.4 基因定量分析 RNA 提取操作严格按照miRNA提取试剂盒和TsingZol 总RNA 提取试剂说明书步骤。RNA 浓度和质量在微量核酸蛋白分析仪上检测,随后计算cDNA 反转录所需RNA 的体积,将相应体积的RNA和引物(表1)、miRNA逆转录试剂以及cDNA 合成试剂混合合成cDNA。高特异性染料法qPCR预混液用于基因定量分析。利用2-ΔΔCt法分析定量数据。

表1 定量分析所用引物Table 1 Primer sequences used in qPCR
1.2.5 细胞活力分析 接种在96孔板的RA-FLSs培养在正常条件下,待细胞密度达到30%~50%时按照以上方法进行细胞转染,在培养箱中继续培养48 h,每孔中加入MTT 试剂并孵育4 h,形成的甲攒结晶用二甲基亚砜溶解,最终用酶标仪分析样品。
1.2.6 细胞增殖实验 接种在6孔板的RA-FLSs在正常条件下培养,细胞融合度30%~50%时按照以上方法进行细胞转染,48 h后将细胞传代至96孔板(已加有标准浓度EdU 试剂)。细胞和EdU 试剂共孵育2 h后,在RA-FLSs 和Triton X-100、多聚甲醛以及DAPI共培养后,根据荧光显微镜下EdU阳性的细胞来确定细胞增殖情况。
1.2.7 细胞侵袭分析 用带有8 μm 孔室的12 孔板分析细胞侵袭,该12孔板的上室底部涂有基质。将RA-FLSs 接种到上室,并培养在无血清的DMEM 中,同时在培养板的下室添加含有15%胎牛血清的DMEM。24 h后用显微镜观察下室细胞数量。
1.2.8 双荧光素酶报告实验 利用在线数据库预测miR-132-3p 和FZD4 互补序列,FZD4 野生型质粒和突变载体(WT-FZD4 3'UTR和MUT-FZD4 3'UTR)依据是否将FZD4 3'UTR 和miR-132-3p 互补序列突变而构建。点直接突变试剂盒用于FZD4 3'UTR 和miR-132-3p 互补序列的突变。利用PCR 技术扩增包含所预测结合位点的FZD4 3'UTR 序列,将点突变后的FZD4 3'UTR 序列送生物公司合成,最终将PCR 扩增的序列和合成的序列引入pmirGLO 载体构建上述报告载体。细胞转染48 h后检测双荧光素酶活性。
1.2.9 蛋白表达分析 RIPA 裂解液制备蛋白样品,蛋白的浓度利用Βradford 蛋白定量试剂分析。将20 μg蛋白和蛋白Marker加入到聚丙烯酰胺电泳预制凝胶中,用蛋白电泳仪将不同分子量的蛋白分离开,随后蛋白转到聚偏氟乙烯膜上,用脱脂奶粉封闭后,将膜和FZD4、β-catenin、c-Myc 和CyclinD1抗体孵育,随后与二抗抗体孵育。最终用增强型ECL 化学发光检测试剂盒和蛋白成像系统显现蛋白条带。
1.3 统计学方法 应用GraphPad Prism 统计学软件分析数据。计量资料以均数±标准差()表示,组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 MiR-132-3p 在RA 患者和RA-FLSs 中的表达 如图1A 所示,与对照组滑膜组织比较,miR-132-3p 在RA 患者滑膜组织中低表达,差异有统计学意义(P<0.05)。而且结果展示miR-132-3p 在RA-FLSs 中的表达低于正常纤维样滑膜细胞中的表达,差异有统计学意义(P<0.05),见图1Β。
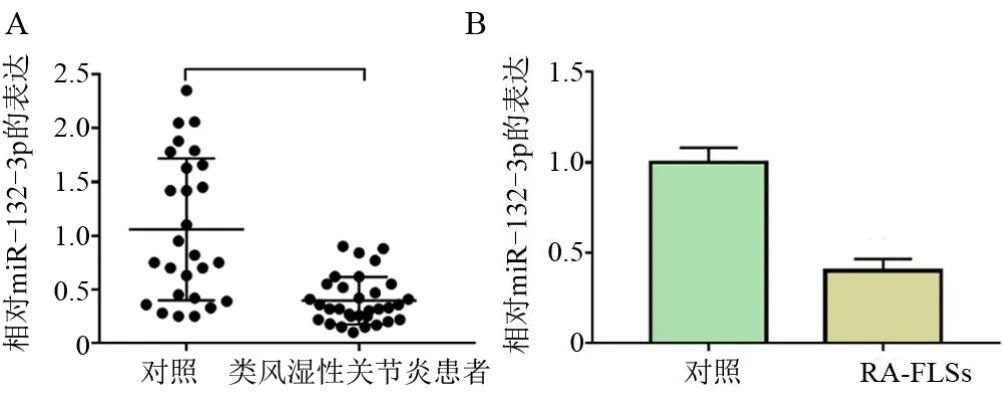
图1 miR-132-3p在滑膜组织和成纤维样滑膜细胞中的表达Figure 1 Expression analysis of miR-132-3p in synovial tissue and fibroblasts synovial cells
2.2 MiR-132-3p 抑制RA-FLSs 增殖和侵袭 本研究数据显示miR-132-3p在miR-132-3p模拟物转染的RA-FLSs中的表达比在miR-NC转染的RA-FLSs中高,差异具有统计学意义(P<0.05),见图2A,说明miR-132-3p模拟物能促进miR-132-3p的表达。随后发现miR-132-3p 模拟物转染后RA-FLSs 活力、EdU阳性细胞数以及侵袭细胞数减少,差异均有统计学意义(P<0.05),见图2Β~2D。

图2 MiR-132-3p抑制RA-FLSs增殖和侵袭Figure 2 MiR-132-3p inhibits the proliferation and invasion of RA-FLSs
2.3 MiR-132-3p 靶向结合FZD4 如图3A 所示,FZD4 3’UTR 含有miR-132-3p 结合位点(5'-ACUGUUU-3’)。根据此结合序列,本研究构建了FZD4 3’UTR 野生型和突变型报告质粒以鉴定miR-132-3p 和FZD4 的关系。 如图3Β 所示,WT-FZD4 3’UTR 组的荧光素酶活性在miR-132-3p转染后降低,差异有统计学意义(P<0.05),但是WT-FZD4 3’UTR 组的荧光素酶活性在miR-132-3p过表达后差异无统计学意义(P>0.05)。随后的结果揭示FZD4 在RA 患者滑膜组织中的mRNA 表达量要高于正常纤维样滑膜细胞中的表达,差异有统计学意义(P<0.05),见图3C,并且FZD4 在RA 患者滑膜组织的表达和miR-132-3p 的表达是负相关的,差异有统计学意义(P<0.05),见图3D。FZD4 在RA患者滑膜组织和RA-FLSs中的蛋白表达也高于对照组,差异有统计学意义(P<0.05),见图3E和图3F。
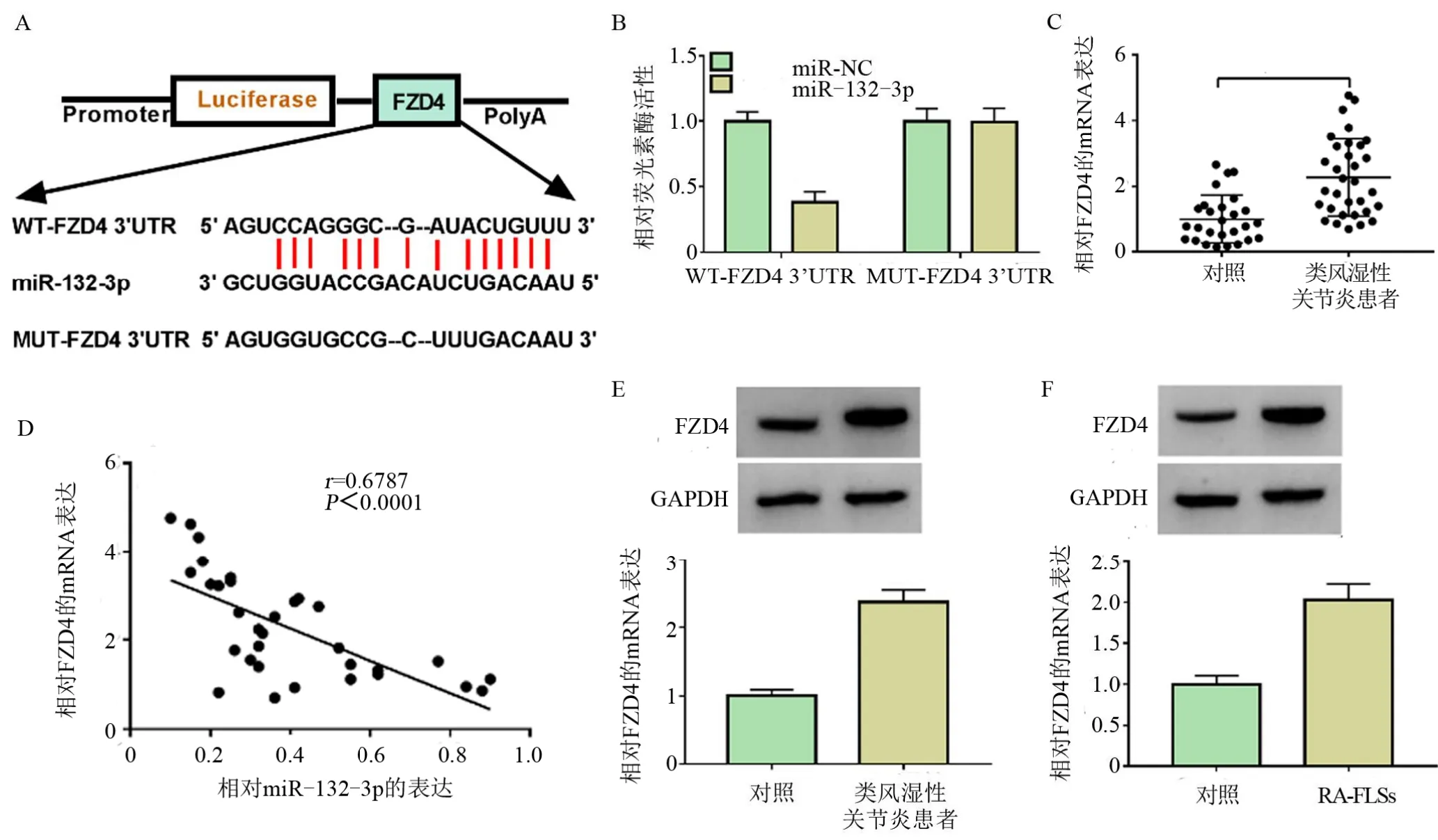
图3 MiR-132-3p 靶向结合FZD4Figure 3 Combination of miR-132-3p and FZD4
2.4 FZD4 挽救miR-132-3p 在RA-FLSs 中介导的影响 本研究发现FZD4的蛋白表达在miR-132-3p转染组低于miR-NC 转染组,差异有统计学意义(P<0.05),但是它在miR-132-3p和FZD4 共转染组的表达又高于miR-132-3p 和pcDNA 共转染组,差异均有统计学意义(P<0.05),见图4A。此外,数据显示转染miR-132-3p的RA-FLSs活力、EdU阳性细胞数和侵袭细胞数低于miR-NC转染组,差异均有统计学意义(P<0.05),但是这些指标在miR-132-3p和FZD4共转染组又高于miR-132-3p 和pcDNA 共转染组,差异均有统计学意义(P<0.05),见图4Β~4D。

图4 FZD4挽救miR-132-3p在RA-FLSs中介导的影响Figure 4 FZD4 rescue the effect miR-132-3p in RA-FLSs
2.5 MiR-132-3p 通过调控FZD4 表达抑制Wnt/β-catenin通路激活 转染miR-132-3p组的β-catenin、c-Myc 和CyclinD1 蛋白表达低于miR-NC 转染组,差异均有统计学意义(P<0.05),但是这些蛋白的表达在miR-132-3p 和FZD4 共转染组又高于miR-132-3p 和pcDNA 共转染组,差异均具有统计学意义(P<0.05),见图5。
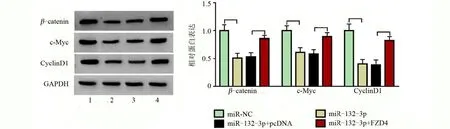
图5 MiR-132-3p和FZD4过表达在RA-FLSs中对β-catenin、c-Myc和CyclinD1蛋白表达的影响Figure 5 Effects of overexpression of miR-132-3p and FZD4 on β-catenin,c-Myc,and CyclinD1 protein expression in RA-FLSs
3 讨论
RA 患者FLSs 的过度生长是关节损伤的原因之一,FLSs 能够促进炎性因子和趋化因子产生,这种特性使得骨和软骨侵蚀加重,并能加重RA 疾病程度[12]。最近的研究指出一些miRNAs 在RA 患者中是异常表达的,并且有助于RA 发展[13-14]。Cheng 等[15]运用基因表达综合数据库说明了miR-132-3p 可能通过结合核富含丰富的转本1 参与RA 疾病进程;Zhang 等[16]研究数据显示miR-132-3p 可通过结合circsirt1 抑制RA-FLSs 凋亡以及加重炎症反应。本研究主要分析了miR-132-3p 对RA-FLSs增值和侵袭的影响。结果表明miR-132-3p 在RA 患者滑膜组织以及RA-FLSs中的表达降低,并且能够抑制RA-FLSs增值和侵袭。
随后的数据表明miR-132-3p 能够结合FZD4。FZD4是一种卷曲蛋白,研究指出这个蛋白能够通过circPTN/miR-145-5p/FZD4[17]、circ_0003972/miR-654-5p/FZD4[18]以及circ_0088036/miR-326/FZD4[19]等通路促进RA疾病进程。当前的工作说明了FZD4在RA患者以及RA-FLSs 中表达增加,并且参与miR-132-3p 介导的RA-FLSs增值和侵袭。Wnt蛋白家族能够调控增殖、器官发生和迁移,且证据表明Wnt/β-catenin通路有助于FLSs增值[20]。Wnt1属于Wnt蛋白家族成员,能够和FLSs 中的FZD4 蛋白作用,这种联系加重破骨细胞分化导致的骨侵蚀[21]。另外证据证实了Wnt1 诱导的基质降解酶的分泌和细胞因子释放涉及FZD4[22]。学者也说明Wnt1 和FZD4 的联合能促进滑膜细胞中β-连环蛋白转录因子的活化[23]。因此本研究又分析是否miR-132-3p 能够通过抑制FZD4 的表达来调控Wnt/β-catenin 通路,结果表明Wnt/β-catenin 通路相关蛋白β-catenin、c-Myc 和CyclinD1 蛋白表达在miR-132-3p过表达后被抑制,但是miR-132-3p和FZD4 的共转染释放了miR-132-3p 过表达对这些蛋白表达的影响,表明miR-132-3p 能够通过调控FZD4 来抑制Wnt/β-catenin通路的激活。
综上所述,miR-132-3p 通过抑制FZD4/Wnt/β-catenin 通路激活来抑制类风湿关节炎成纤维样滑膜细胞增殖和侵袭,说明miR-132-3p 可能限制RA发展,开发miR-132-3p相关药物制剂可能是治疗RA的一种新策略。但是当前的研究仅在细胞模型中说明miR-132-3p 对RA有抑制作用,随后的研究还应用鼠模型实验验证此结论。
