CD10、CA9、CD133表达与索拉非尼或舒尼替尼一线治疗转移性肾透明细胞癌患者预后的相关性
2023-10-25郑万祥刘克普侯广东袁建林
张 昊,郑万祥,刘克普,侯广东,袁建林
(空军军医大学西京医院泌尿外科,陕西西安 710032)
根据2020年全球癌症统计数据,肾癌的发病率在男性和女性恶性肿瘤中分别是第9位和第14位[1]。其中,肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)约占肾细胞癌的70%[2]。转移性肾细胞癌(metastatic renal cell carcinoma,mRCC)是一种对化疗耐药的恶性肿瘤,随着分子生物学的进展,近十几年来有多种靶向药物可用于治疗mRCC。索拉非尼和舒尼替尼主要用于靶向抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR),属于酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),能改善mRCC的预后,但不同患者之间的生存获益程度差异较大,此外,TKI会引起各种毒副作用,包括增加致命不良事件的风险[3]。因此,为了选择适合特定治疗方法的患者,有必要发现更多与TKI治疗转移性肾透明细胞癌(metastatic clear cell renal cell carcinoma,mccRCC)预后相关的生物标志物。
CD10在肾素-血管紧张素系统中催化生成血管紧张素1-7,后者与Mas受体结合可抑制血管生成和肿瘤进展[4];HORIE等[5]发现CA9外泌体在体外能促进血管生成;有学者发现表达CD133的内皮细胞可以促进肿瘤新生血管的形成[6]。鉴于3种标志物均参与调节肿瘤血管生成,本研究旨在分析CD10、CA9、CD133表达与TKI一线治疗mccRCC预后的相关性,从而帮助泌尿外科医生进行临床决策和促进个体化治疗。
1 资料与方法
1.1 临床资料回顾性分析2007年1月-2017年12月在西京医院泌尿外科接受索拉非尼或舒尼替尼一线治疗的93例mRCC患者的资料。纳入研究的患者需符合以下条件:①经病理证实为mccRCC;②接受舒尼替尼或索拉非尼作为一线的靶向治疗;③有可用的甲醛固定、石蜡包埋的肿瘤组织标本;④有详细的随访信息。如果患者既往患有其他恶性肿瘤、组织标本有超过80%坏死或出血区域以及随访信息缺失,则排除于本研究之外,本研究最终纳入80例患者。根据患者治疗方法不同分为索拉非尼组(53例)和舒尼替尼组(27例)。根据实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumors,RECIST)1.1版判断疾病进展(progressive disease,PD),将无进展生存期(progression free survival,PFS)定义为从靶向治疗的第1天到出现影像学PD、出现明确PD临床证据或死亡之间的时间;如果PD日期未知,把最后1次随访时间定义为PFS删失的时间。总生存期(overall survival,OS)定义为从靶向治疗的第1天到死亡之间的时间。
1.2 免疫组织化学染色及染色强度分析将ccRCC组织标本制备成5 μm石蜡切片,而后进行免疫组织化学(immunohistochemistry,IHC)染色,所有原发肿瘤组织标本均来自西京医院病理科。IHC过程如下:把石蜡包埋的载玻片在分级脱蜡液中脱蜡,接着进行抗原修复,而后用体积分数为3%的双氧水溶液阻断内源性过氧化物酶,用体积分数为3%的牛血清白蛋白(bovine albumin,BSA) 封闭切片后,将载玻片与一抗(抗CD10,1∶100,抗CA9,1∶600;抗CD133,1∶600)在4 ℃孵育过夜,然后在室温下孵育二抗(1∶200) 50 min,苏木精染色和脱水操作用于对细胞核进行反染色。通过全景切片扫描仪(Pannoramic MIDI,3DHISTECH,匈牙利) 采集IHC切片上的图像,并通过软件(Aipathwell,Servicebio Technology,中国) 进行分析,这款图像分析系统可自动识别组织测量区域,并评估阳性等级:阴性不着色,0分;弱阳性呈淡黄色,1分;中等阳性棕黄色,2分;强阳性呈棕褐色,3分。然后分析并计算阳性等级、测量区域中的组织区域面积、阳性面积等。对每个载玻片进行组织化学评分(H-score)以评估各标志物的染色强度,后基于各标志物H-score的中位数,将其区分为低表达或高表达,低于H-score中位数的为低表达,反之则高表达。H-score=∑(pi×i)=(弱阳性区域的百分比×1)+(中等阳性区域的百分比×2)+(强阳性区域的百分比×3)。pi代表阳性面积的百分比;i代表阳性等级(图1)。
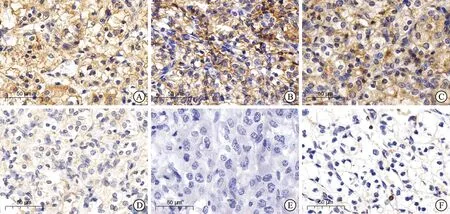
A、B:CD10高表达和低表达;C、D:CA9高表达和低表达;E、F:CD133高表达和低表达。
1.3 统计学分析分析IHC标志物表达与临床病理变量的相关性,两组间计量资料以中位数(P25,P75)表示,比较采用Mann-WhitneyU检验,计数资料以例(%)表示,比较采用χ2检验;用单因素和多因素Cox比例风险模型分析mccRCC的预后因素;在索拉非尼和舒尼替尼亚组内,采用Kaplan-Meier法进行标志物表达与PFS和OS的生存分析,低表达和高表达间生存率的比较采用Log Rank检验。所有统计分析均由SPSS 25.0统计软件进行,作图软件用Graphpad Prism 9.0,P<0.05为差异有统计学意义。
2 结 果
2.1 患者的基本特征本研究共回顾性纳入80例mccRCC患者,其中索拉非尼组53例,舒尼替尼组27例(表1)。截至2022年7月,37例(46.25%)患者出现PFS随访结局,中位PFS(median PFS,mPFS)为24.9(95%CI:16.5~33.2)个月;有55例(68.75%)患者死亡,中位OS(median OS,mOS)为44.2(95%CI:14.6~73.7)个月。患者基本特征在药物组间的均衡性检验显示,手术方式为肾部分切除术(partial nephrectomy,PN)和根治性肾切除术(radical nephrectomy,RN)在药物组间分布差异有统计学意义(χ2=12.914,P<0.001)。
2.2 患者几种标志物表达与临床病理变量的相关性分析CD10表达与Fuhrman分级相关(χ2=6.241,P=0.012),在CD10低表达组,Fuhrman 3~4级mccRCC占比更高;CA9表达与淋巴结转移(χ2=5.952,P=0.015)和转移器官个数(χ2=8.205,P=0.004)相关,在CA9低表达组,有淋巴结转移和转移器官个数≥2个的患者占比更高,没有发现CD133与临床病理变量的相关性(表2)。
2.3 mccRCC预后的影响因素分析将年龄、性别、Fuhrman分级、T分期、转移器官数、转移部位、手术方式、药物种类及各标志物的表达等因素分别与PFS进行Cox单因素分析,结果显示,Fuhrman分级、转移器官数以及淋巴结转移是PFS的影响因素(P<0.05),将P<0.05的因素纳入Cox多因素分析中,显示Fuhrman分级是PFS的独立影响因素(HR=2.457,95%CI:1.126~5.365,P=0.024);同样方法对各因素与OS进行Cox回归分析,单因素分析显示转移器官数、淋巴结转移及CA9表达是OS的影响因素(P<0.05),而其中转移器官数是OS的独立影响因素(HR=1.857,95%CI:1.048~3.290,P=0.034,表3)。
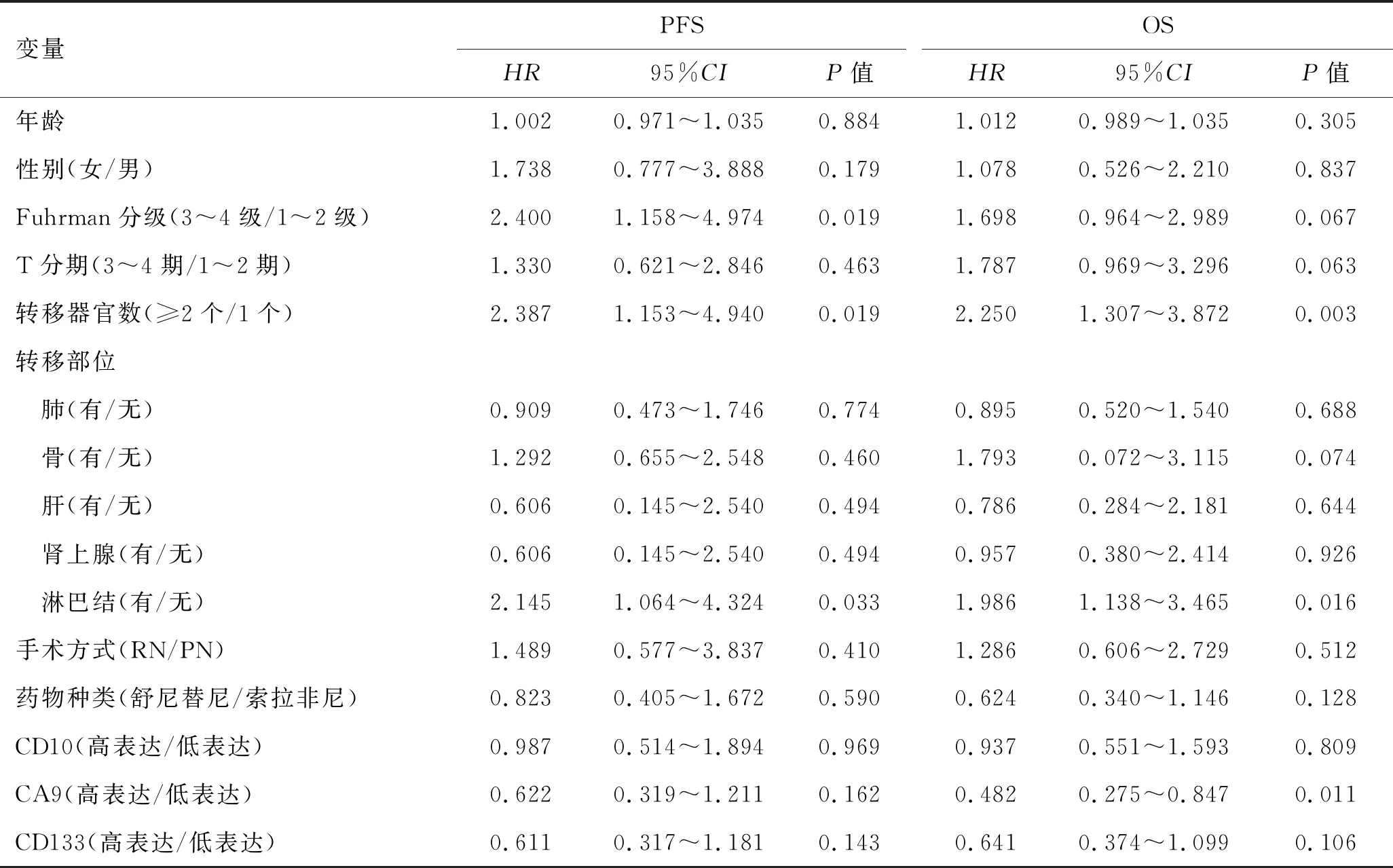
表3 mccRCC患者PFS和OS的单因素分析
2.4 CA9表达与治疗亚组患者PFS和OS的生存分析Kaplan-Meier生存分析和Log Rank检验显示,在索拉非尼组内,CA9低表达和高表达组患者的mOS分别是25.4、79.7个月,OS的生存曲线差异有统计学意义(Log RankP=0.006),而两组间PFS生存曲线差异无统计学意义。在舒尼替尼组内,CA9低表达和高表达组间PFS和OS生存曲线差异均无统计学意义(图2)。
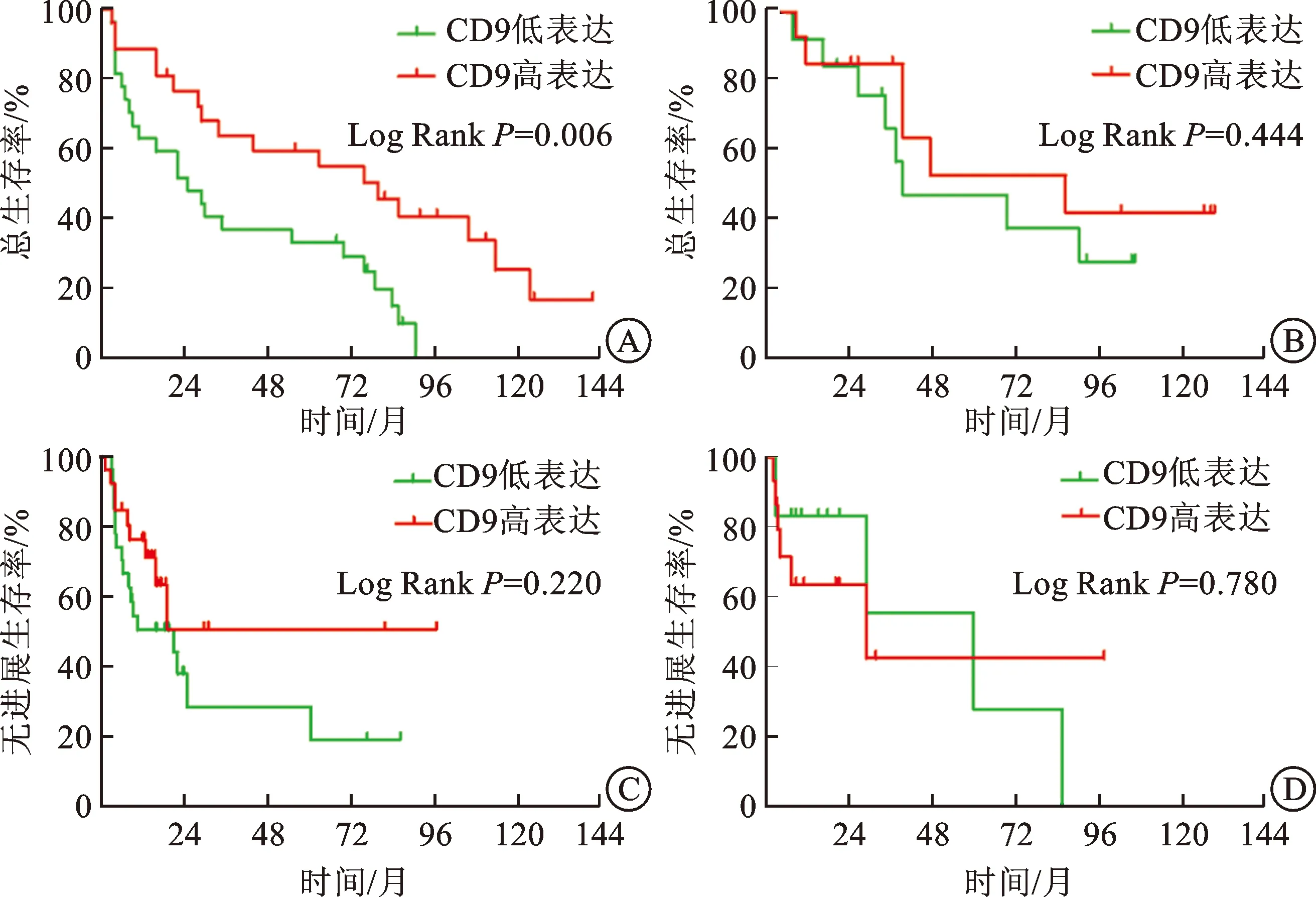
A、C:索拉非尼组CA9表达与OS(A)和PFS(B)的生存分析;B、D:舒尼替尼组CA9表达与OS(B)和PFS(D)的生存分析。
3 讨 论
2021年CSCO指南中指出舒尼替尼、索拉非尼是一线治疗转移性或不可切除性ccRCC的Ⅰ级推荐[7]。相较于索拉非尼或舒尼替尼的Ⅲ期临床试验结果[8-9],本研究中mccRCC患者的mPFS和mOS相对较长,原因可能来自两个方面。一方面是研究排除了失访的患者,而失访患者通常预后较差;另一方面是所纳入的患者都接受了PN或RN。既往回顾性研究显示,RCC患者在减瘤性肾切除术后接受靶向治疗较单纯靶向治疗具有显著OS获益[10]。
药物组间均衡性检验发现,索拉非尼组接受PN的患者仅3例(5.7%),明显低于舒尼替尼组。究其原因可能是索拉非尼组患者的发病时间早于舒尼替尼组。得益于医疗设备技术和循证医学的发展,接受PN的患者有逐年增多的趋势。一项研究回顾性分析了单中心在10年间接诊的1 498例RCC患者的资料,发现PN比例逐年提高,RN比例逐年降低[11]。有研究认为PN能有效地保存肾功能[12],降低心血管事件发生的风险[13],而接受RN或PN患者的肿瘤特异性生存率(cancer specific survival,CSS)并无明显差异[14]。
标志物表达与临床病理变量相关性分析发现,CD10低表达与Fuhrman高分级相关。与此发现一致的是,明少雄等[15]分析了1 084例ccRCC组织标本,发现CD10在细胞核高分化、中分化、低分化中的阳性表达率分别为81.1%、82.8%、50.0%,差异具有统计学意义(P=0.040)。这提示CD10低表达的mccRCC可能更容易发生疾病进展,有学者认为CD10表达缺失或减少可能会促进神经肽介导的细胞增殖和肿瘤进展[16]。CD10对ccRCC的预后作用尚存在争议。本研究未发现CD10表达与mccRCC患者PFS和OS的相关性。ERRARTE等[4]发现在ccRCC患者中,CD10阳性表达与更差的15年OS相关(P=0.007);另一研究发现在CD10阴性和阳性表达组之间,ccRCC患者的CSS生存曲线差异无统计学意义(P=0.361)[15]。
CA9低表达与淋巴结转移和转移器官数≥2相关,可能提示CA9低表达的ccRCC侵袭性更高。一项Meta分析研究发现,在RCC中CA9低表达与淋巴结转移和远处转移显著相关,并能预测较高的肿瘤分级[17]。ZHANG等[18]对730例接受手术治疗的ccRCC患者进行长期随访,中位随访时间为13.8年,发现CA9低表达与患者CSS降低相关(HR:1.62,P=0.001),但多因素分析没有发现显著相关性。本研究中,CA9低表达是mccRCC患者OS缩短的非独立预后因素。然而生存分析结果可能与CA9表达水平的界定标准有一定关系。CHAMIE等[19]对813例非转移性ccRCC患者的肿瘤组织进行CA9染色和H-socre评分,发现与CA9评分≤100分相比,CA9评分≥200分是PFS和OS独立且有利的预后因素。
CD133是五次跨膜糖蛋白prominin家族的成员,其表达在RCC中的预后作用存在争议。有Meta分析发现CD133高表达是RCC患者CSS独立且有利的预后因素(HR=0.4,95%CI:0.29~0.54)[20]。SAEEDNEJAD等[6]发现CD133的高胞质表达与ccRCC高分级、高分期、淋巴结转移显著相关,其膜性表达与肿瘤分级、分期不相关。而D’AlTERIO等[21]的一项研究评估了细胞质和细胞膜CD133的表达,发现CD133不是RCC患者无疾病生存期的预后因素(P=0.151)。本研究发现CD133不能作为mccRCC的预后因素,在进一步的研究中可分析胞膜或胞质表达其各自的预后作用。
治疗亚组内CA9表达与PFS和OS的生存分析表明,CA9高表达与索拉非尼组mccRCC患者较长的OS相关,而与PFS不相关。CHOUEIRI等[22]分析了TARGET研究中接受索拉非尼治疗的133例mccRCC患者的资料,CA9高表达与低表达患者的mPFS分别为5.5和5.4个月,差异没有统计学意义。在舒尼替尼治疗的ccRCC患者中,CA9的预后作用存在争议。本研究发现,CA9低表达与舒尼替尼组患者的OS和PFS均不相关。有学者前瞻性招募了67例接受舒尼替尼一线治疗的ccRCC患者,同样发现CA9表达不是PFS和OS的预后因素[23]。然而MA等[24]的研究发现,在52例接受舒尼替尼一线治疗的mccRCC中,CA9高表达组相较低表达组患者有较长的PFS和OS,差异有统计学意义。在本研究中,CA9低表达组患者从索拉非尼和舒尼替尼治疗中生存获益较少,因此对于肿瘤组织中CA9低表达的mccRCC患者,可以根据指南选择靶向免疫联合治疗或双免联合治疗以改善预后。
本研究存在一定局限性,首先,本研究为单中心的回顾性研究,存在一定偏倚,样本量相对较少,未来需要扩大样本量及前瞻性研究对本结论进行验证;其次,部分患者在疾病进展后换用不同的二线或三线药物治疗;第三,各研究所使用的抗体敏感性和规格各不相同,确定标志物阳性或阴性表达的标准也有所不同,可能会导致不同的结果。本研究仅纳入ccRCC患者,保证了数据的同质性,基于各标志物调节肿瘤血管生成的潜在机制,本研究可能是首个分析CD10、CD133与TKI治疗mccRCC预后相关性的研究,旨在协助临床医生精准决策。