谷氨酸棒状杆菌高丝氨酸脱氢酶单突变体酶学性质表征
2023-10-21江泽沅柳羽哲闵伟红
江泽沅,柳羽哲,高 欣,曾 琦,闵伟红*
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
蛋氨酸(Met)具有多种生理功能,在医药、饲料、食品等领域得到广泛应用[1]。在医药方面,Met具有保护肝脏、心肌、解毒、抗抑郁和降血压等生理活性,在临床治疗上应用广泛[2];在饲料方面,Met是禽畜类必需氨基酸之一,具有提供营养、提高动物免疫力和抗氧化力等功能[3];在食品方面,Met被用作食品调味剂和营养强化剂。目前,工业上主要通过化学法和蛋白水解法获得Met,微生物合成法由于过量积累的Met对微生物生长有害,未被大规模应用于工业化生产[4]。
天冬氨酸族氨基酸代谢途径是特异性生产M e t的氨基酸代谢途径,天冬氨酸是谷氨酸棒状杆菌(Corynebacterium glutamicum)中合成Met的前体物质,在天冬氨酸激酶催化下生成天冬氨酰-4-磷酸,经过天冬氨酸半醛脱氢酶催化合成天冬氨酸半醛[5]。高丝氨酸脱氢酶(homoserine dehydrogenase,HSD)参与天冬氨酸族氨基酸代谢途径的第3步反应,通过NADPH将L-天冬氨酸-β-半醛还原为L-高丝氨酸(L-homoserine,L-HSE),调控碳流向高丝氨酸生成的方向进行,最终控制Met的合成[6]。因此,减弱或解除天冬氨酸族氨基酸代谢途径中HSD的抑制作用能够达到通过微生物合成法高产Met的目的。
H S D 是一种氧化还原酶,在谷氨酸棒状杆菌中由hom基因编码,催化中心在生物中具有不同折叠方式,其晶体结构主要分为二聚体结构和四聚体结构。在嗜热栖热菌(Thermus thermophilus)[7]、酿酒酵母(Saccharomyces cerevisiae)[8]、极端嗜热古菌(Hyperthermophilic archaeal)[9]、超嗜热古菌(Sulfolobus tokodaii)[10]和金黄色葡萄球菌(Staphylococcus aureus)[11]中HSD为二聚体结构;在枯草芽孢杆菌(Bacillus subtilis)[12]、多核杆菌(Polynucleobacter)[13]和淋病奈瑟菌(Neisseria gonorrhoeae)[14]中HSD为四聚体结构。
Ogata等[15]通过结构分析,在超嗜热古菌中发现半胱氨酸(Cys)位于高丝氨酸结合位点内,并且Cys和烟酰胺环之间形成了共价键,进而抑制HSD活力。Kubota等[16]通过Sulfurisphaera tokodaii重组HSD被热处理后显著激活,得出热诱导活化是由于HSD催化区域的特定构象发生变化。此外,Li Ning等[17]在谷氨酸棒状杆菌中,通过强启动子增强L-HSD和L-高丝氨酸乙酰转移酶表达,进一步通过发酵使O-乙酰-L-高丝氨酸提高产量。然而,对HSD基因突变生产Met的研究较少。申术霞等[18]成功获得酶活力显著提高的双突变体L200F/D215K,为构建高产Met工程菌提供了参考依据。因此,本研究在实验室成功构建pET-28a-HSD基础上,对HSD进行基因突变,以获得高活力HSD,并进一步对高酶活力菌株进行酶学性质表征。旨在通过对HSD分子空间结构改造,为以后研究HSD催化机制和构建高产Met工程菌株提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
谷氨酸棒状杆菌ATCC13032、大肠杆菌BL21(DE3)和大肠杆菌DH5α均由本实验室保存;pET-28a-HSD质粒由实验室构建。
Taq聚合酶、定点突变试剂盒、核酸电泳Marker日本TaKaRa公司;非预染蛋白电泳Marker、基因组DNA抽提试剂盒、质粒抽提试剂盒、DNA胶回收试剂盒生工生物工程(上海)股份有限公司;高保真DNA聚合酶2×Phanta Max Master Mix Vazyme(中国)公司;异丙基硫代-β-D-半乳糖苷(isopropyl-β-Dthiogalactopyranoside,IPTG)、卡那霉素 长春市翊博生物科技公司;LB(Luria-Bertani)培养基参照文献[19]配制,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)试剂参照文献[20]配制。
1.2 仪器与设备
TGL-20000CR低温离心机 上海安亭科学仪器厂;空气浴振荡器 东联电子技术开发有限公司;铝质梯度聚合酶链式反应(polymerase chain reaction,PCR)仪德国Eppendorf AG公司;隔水式恒温培养箱 上海精宏实验设备有限公司;可见分光光度计 沙鹰科学仪器(上海)有限公司;蛋白印记转膜仪 美国Bio-Rad公司;SE260蛋白电泳仪 美国GE公司;UVP GelStudio Plus凝胶成像仪 德国耶拿公司。
1.3 方法
1.3.1 HSD突变体构建
以6dzs晶体结构为模板,利用同源建模方法获得了HSD的三维结构,使用软件Autodock4对催化底物L-HSE和NADP+进行分子对接,得到HSD与催化底物的复合结构。采用Discovery Studio软件[21]确定了突变的氨基酸位点,利用Primer 5.0软件设计突变位点引物,以pET-28a-HSD质粒为模板进行饱和定点突变。反应条件:94 ℃预变性5 min,94 ℃变性90 s,56 ℃退火1 min,72 ℃延伸10 min(扩增20 个循环);72 ℃延伸15 min。突变PCR完成后,使用1%琼脂糖凝胶对PCR产物进行电泳验证,保证质粒突变成功。随后,将质粒用DpnI酶在37 ℃金属浴中消化2 h,消化体系为缓冲液18 μL、突变PCR产物2 μL、DpnI酶0.3 μL[22]。
将大肠杆菌DH5α感受态细胞在冰上冰浴30 min,加入10 μL消化后PCR突变产物,充分混匀后冰浴15 min,在42 ℃金属浴热击90 s后再次冰浴10 min,加入900 μL LB液体培养基,放入37 ℃、190 r/min摇床中培养1~2 h。将复苏的菌液5 000 r/min离心5 min,弃掉上清液,将剩余100 μL菌液吹打混匀后,均匀地涂布于含卡那霉素的LB固体培养基中,在37 ℃培养箱中过夜培养[23]。挑取平板上单菌落进行扩大培养,经过菌液PCR验证后,将成功转化的菌液提取质粒进行测序。
1.3.2 突变体的表达和纯化
将大肠杆菌DH5α成功突变pET-28a-HSD质粒转化到表达菌株BL21中,挑取单菌落进行扩大培养,对菌液进行PCR验证,确保质粒成功转化至大肠杆菌BL21中。按2%接种量接种到100 mL含卡那霉素的LB发酵培养基中,放在37 ℃摇床中培养2 h,当菌液OD600nm值在0.6~0.8之间时加入100 μL诱导剂IPTG使其终浓度为1 mmol/L,放入摇床进行26 ℃、180 r/min诱导14~16 h。诱导后的菌液4 ℃、8 000 r/min离心10 min,弃掉上清液,用预冷磷酸盐缓冲溶液重悬菌体进行超声波破碎,4 ℃、8 000 r/min离心10 min,收集的上清液即为粗酶液。最后,将粗酶液进行镍柱纯化处理得到纯化液[24]。
1.3.3 HSD活力测定
将HSD的1 个酶活力单位定义为每10 min生成1 μmol NADPH所需要的酶量,其酶活力根据NADPH在340 nm波长处吸光度的变化进行测定。反应体系总体积为5 mL:100 mmol/L Tris-HCl(7.5)、10 mmol/L MgCl2、80 mmol/L KCl、1.2 mmol/L NADP+、20 mmol/LL-HSE、100 μL酶液[25-26]。将反应体系置于37 ℃水浴10 min后检测NADPH在340 nm波长处吸光度变化量。通过考马斯亮蓝法测定酶液中蛋白含量,每组实验做3 个平行[27]。
1.3.4 HSD最适pH值和最适反应温度测定
以L-HSE为底物,分别在不同pH值(6、6.5、7、7.5、8、8.5、9、9.5)和不同温度(25、30、35、40、45、50 ℃)条件下进行最适反应pH值和最适反应温度测定。将最高酶活力定义为100%,每组实验做3 个平行。
1.3.5 HSD热稳定性测定
将野生型(wild type,WT)和突变体分别置于最适温度下水浴保温,每隔1 h测定HSD活力,一共检测9 h,进而计算得出HSD活力半衰期。将0 h的酶活力定义为100%,每组实验做3 个平行。
1.3.6 金属离子、有机溶剂和底物抑制剂对HSD活力影响的测定
以L-HSE为底物,测定不同浓度(20、60、100、200 mmol/L)下K+、Mg2+和Ca2+对HSD活力影响;测定不同体积分数(1%、5%、10%、20%)甲醇、乙醇、乙腈和二甲基亚砜对HSD活力影响;测定不同浓度(1、5、10、20 mmol/L)的苏氨酸(Thr)、Met、Thr+Met对HSD活力影响。将不添加金属离子、有机溶剂以及酶抑制剂的酶活力定义为100%,每组实验做3 个平行。
1.3.7 酶动力学分析
在酶活力反应体系中,以不同浓度(1、5、10、20、30、40、50、70、90、100、200 mmol/L)L-HSE为底物,测定HSD活力,每组实验做3 个平行。根据Hill方程[25]V=Vmax[S]n/(K+[S]n)在GraphPad Prism软件中进行非线性拟合。
1.4 数据处理与分析
2 结果与分析
2.1 HSD突变位点选择
采用同源建模获得HSD三维结构,通过AutoDock对底物进行分子对接[26],成功构建HSD复合结构(图1)。通过Discovery Studio软件确定底物周围4 Å范围内氨基酸残基,由于保守位点影响底物结合,同时,根据突变原则不能选择CG含量过高位点,因此,选择Asp61和Gly25两个位点进行突变,筛选出酶活力较WT提高的突变体。
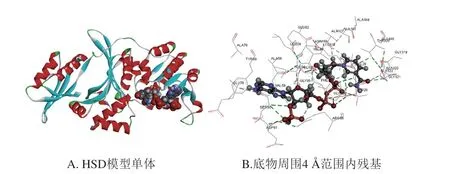
图1 突变位点选择Fig.1 Selection of mutation sites
2.2 HSD基因饱和定点突变
将全质粒扩增突变PCR产物用琼脂糖核酸电泳进行验证,pET-28a质粒大小约为5 369 bp,HSD基因大小约为1 335 bp,因此,突变PCR产物大小约为6 700 bp。如图2所示,在4 000~7 000 bp范围内靠近7 000 bp处出现一条明亮的条带,表明突变成功。将突变PCR产物转化至大肠杆菌BL21感受态中,经过测序验证突变成功,初筛获得酶活力提高的两个突变体A61L和G25G。测序结果表明,Asp61位点由Asp突变成赖氨酸(Lys),Gly25位点密码子由GGA突变成G。
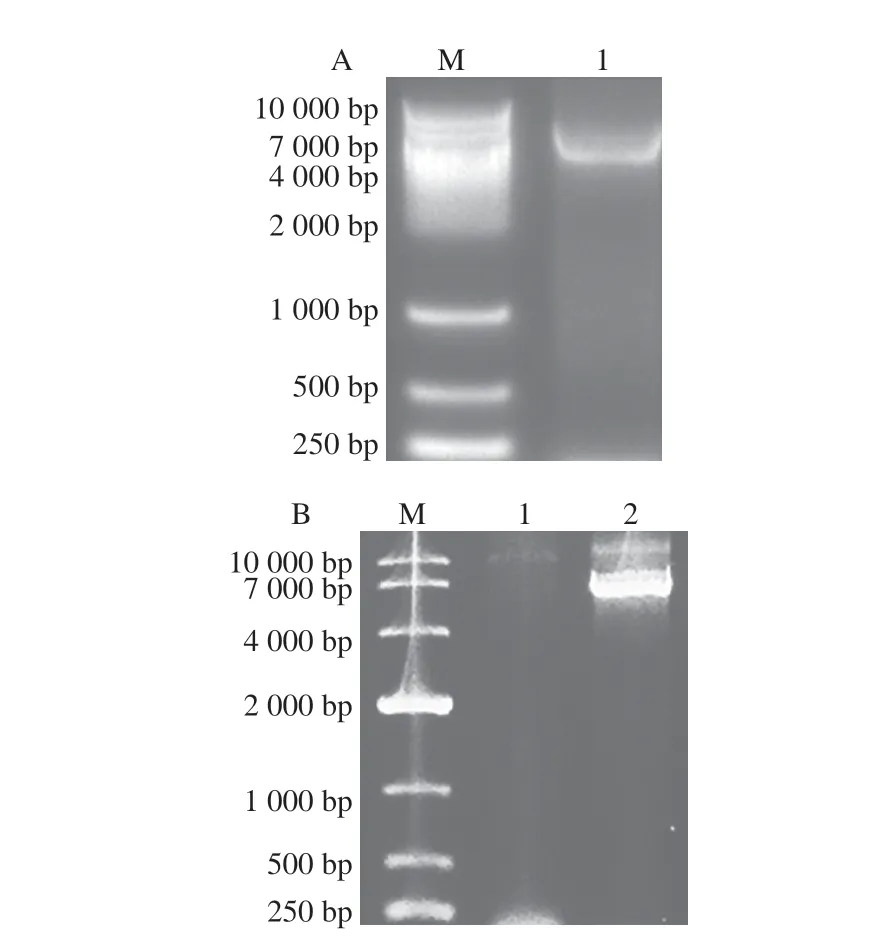
图2 Gly25(A)和Asp61(B)饱和定点突变PCR核酸电泳Fig.2 Electrophoresis of PCR amplified products from Gly25 (A) and Asp61 (B) with site-directed saturation mutation
2.3 HSD蛋白表达和纯化
将诱导表达的WT、A61L和G25G依次经过前处理和镍柱纯化得到HSD纯化液,SDS-PAGE结果(图3)显示,纯化液在46 kDa附近有明显单一条带,表明HSD蛋白表达成功;Western Blot验证结果表明,HSD纯化液含有HSD蛋白。
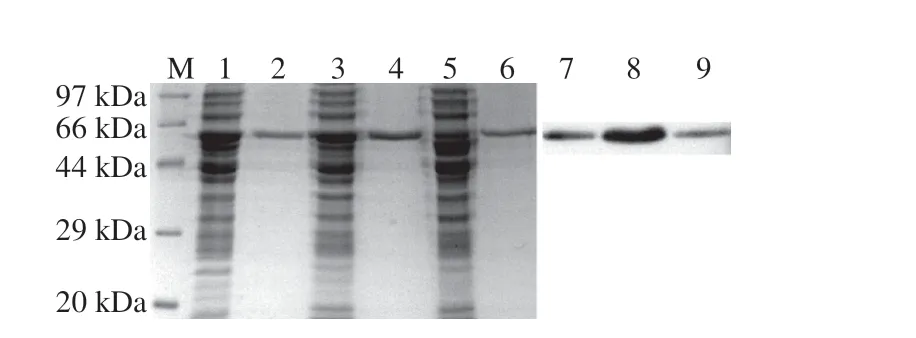
图3 SDS-PAGE及Western Blot验证结果Fig.3 SDS-PAGE and Western blot of purified HSD
2.4 HSD酶动力学分析
测定数据用软件GraphPad Prism 8进行非线性拟合,如图4所示。WT和突变体的酶动力学曲线符合Hill方程V=VmaxSn/(Kn+Sn),表明HSD为典型的别构酶。由表1可知,A61L和G25G突变体Vmax分别是WT的1.21 倍和1.35 倍。相比于WT,A61L和G25GKm值降低,表明突变体催化效率相较于WT提高,与底物亲和力增强。WT、A61L和G25G的n值均大于1,说明WT和突变体呈正协同性,并且A61L和G25G的n值相对于WT显著变小,说明别构效应减弱。

表1 WT和突变体的酶动力学参数Table 1 Enzyme kinetic parameters of WT and mutants
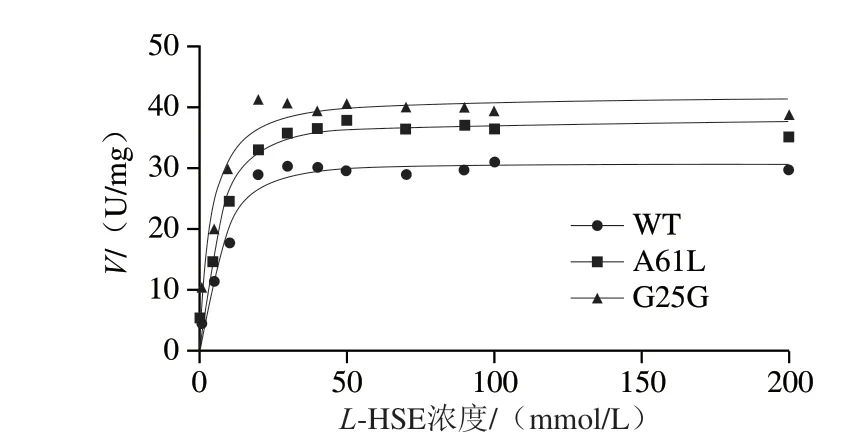
图4 WT和突变体的酶动力学曲线Fig.4 Enzyme kinetic curves of WT and mutants
2.5 HSD酶学性质
2.5.1 最适反应pH值和最适反应温度分析
由图5可知,与WT相比,突变体A61L和G25G最适温度没有显著变化。在高温环境下,A61L和G25G相对酶活力高于低温,且显著高于WT,表明突变体A61L和G25G更加耐高温。此外,与WT相比,突变体A61L最适pH值没有显著变化,为8.0,突变体G25G最适pH值提高至8.5。在碱性环境下,突变体A61L和G25G相对酶活力高于WT,表明突变体更适应碱性环境。

图5 温度(A)和pH值(B)对酶活力的影响Fig.5 Effect of temperature (A) and pH (B) on enzyme activity of WT and mutants
2.5.2 突变体热稳定性分析
由图6可知,WT和突变体在40 ℃最适温度下水浴保温,随着保温时间延长,WT和突变体相对酶活力持续下降,且下降趋势相似。与WT酶活力半衰期相比,突变体A61L酶活力半衰期增加至5.5 h,G25G酶活力半衰期减少至4.0 h。此外,突变体G25G在反应初期(0~2 h)和反应后期(7~9 h)相对酶活力均高于WT;然而,突变体A61L相对酶活力在整个反应时间内均高于WT。
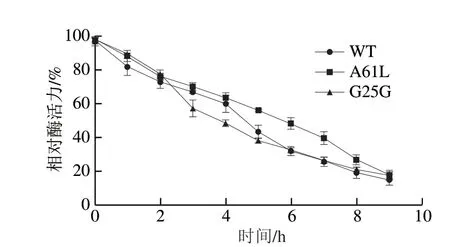
图6 WT和突变体的热稳定性Fig.6 Thermostability of WT and mutants
2.5.3 金属离子对WT和突变体酶活力的影响
由表2可知,终浓度为20~200 mmol/L的K+对WT、A61L和G25G有激活作用,随着浓度增大相对酶活力增高,在终浓度为100 mmol/L时WT、A61L和G25G相对酶活力达到最高,随后,增大浓度相对酶活力开始减弱;终浓度为20 mmol/L的Mg2+对WT、A61L和G25G有激活作用,并且在该浓度下WT和突变体相对酶活力最高,随着浓度增加相对酶活力降低;WT和A61L在Ca2+终浓度为20 mmol/L和60 mmol/L时被激活,G25G在Ca2+终浓度20、60 mmol/L和100 mmol/L时被激活,且随着浓度增大相对酶活力减弱。以上结果表明,低浓度的K+、Mg2+和Ca2+是WT和突变体的促进剂,且随着离子浓度增加抑制HSD活力。
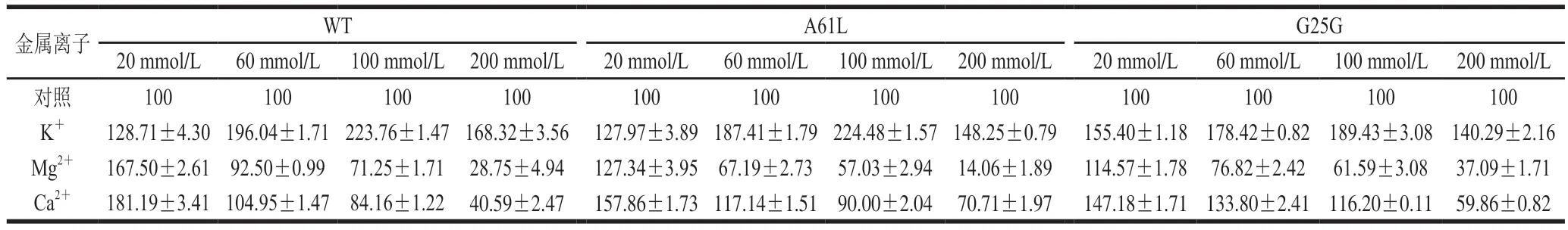
表2 金属离子对WT、A61L和G25G相对酶活力的影响Table 2 Effects of metal ions on relative enzyme activities of WT, A61L and G25G %
2.5.4 有机溶剂对WT和突变体酶活力的影响
由表3可知,不同体积分数有机溶剂对WT、A61L和G25G均有抑制作用,但5%乙醇对WT有激活作用,在该体积分数下WT相对酶活力达到最大,为115.11%;1%乙腈对A61L有激活作用,在该体积分数下A61L相对酶活力为107.65%;1%、5%、10%乙醇以及1%甲醇对G25G有激活作用,在5%乙醇时相对酶活力达到最大,为125.64%。随着有机溶剂体积分数增大,WT、A61L和G25G相对酶活力下降。

表3 有机溶剂对WT、A61L和G25G相对酶活力的影响Table 3 Effects of organic solvents on relative enzyme activities of WT, A61L and G25G %
2.5.5 底物抑制剂对WT和突变体酶活力的影响
由表4可知,WT受Thr反馈抑制和Met阻遏抑制。随着Thr和Met浓度增加,抑制作用显著加强,当Thr和Met抑制剂浓度增加至25 mmol/L时,对WT抑制率分别为83.67%和88.10%。当两种抑制剂组合浓度为25 mmol/L时,WT抑制率达到最高,为93.62%。在Thr、Met和Thr+Met抑制剂浓度为1~25 mmol/L时,突变体A61L和G25G抑制率均低于WT,结果表明,突变有效地降低了Thr反馈抑制和Met阻遏抑制,且在Thr+Met浓度为25 mmol/L下,突变体A61L和G25G抑制率达到最高。Thr对WT和突变体抑制作用弱于Met抑制剂,但Thr+Met抑制作用显著增强。
3 讨 论
由于生物遗传密码子存在简并现象,在某一碱基改变后,其原来的某种氨基酸位置译成同一种氨基酸,此现象称同义突变[28]。同义突变不会改变产生的蛋白质,但会对蛋白质水平产生显著影响[29-30]。同义突变主要是根据密码子偏好性进行最优密码子选择。密码子偏好性是翻译效率的重要决定因素,其通过调节RNA加工、蛋白质翻译和蛋白质折叠等多种过程加快翻译速率,进而提高酶的活性。郑志强[31]利用密码子偏好性对极端嗜热细菌嗜热栖热菌的漆酶编码基因进行密码子优化,得到了酶活力提高86 倍的漆酶;董聪等[32]通过对FAD依赖的葡萄糖脱氢酶进行密码子优化,成功构建高酶活力且稳定表达的重组菌株,表明利用密码子偏好性对酶编码基因进行密码子优化能够提高酶的活性。因此,本研究中突变体G25G在25位点密码子为GGC,WT在25位点密码子为GGA,根据大肠杆菌密码子偏好性分析,GGC密码子偏好性高于GGA密码子偏好性,表明GGC密码子对应的tRNA比GGA密码子对应的tRNA具有数量优势,促进翻译过程中tRNA聚集,进而加速翻译延伸过程,最终提高HSD活性。
HSD晶体结构空间变化和氢键改变均会导致酶活力升高或降低,WT 61位点为保守位点,A61L突变后,在位点侧链形成一个类似细长的棒状结构,解除电荷相互作用,空间位阻降低,更容易与底物相结合,促进酶-底物中间过渡态的形成和转化。相较于WT,突变体A61LKm值由7.011 mmol/L降低到6.276 mmol/L,这也表明与底物作用力增强,提高其酶活力和底物亲和力。
4 结 论
本研究对谷氨酸棒状杆菌HSD关键位点Gly25和Asp61进行饱和定点突变以达到增强底物亲和力和提高酶活力、得到优良单突变体的目的。通过互补引物进行全质粒扩增,获得2 个单突变体A61L和G25G。根据动力学分析,A61L和G25G突变体Vmax较WT分别提高到1.21 倍和1.35 倍,突变体与底物亲和力增强。酶学性质结果表明,突变体G25G最适pH值比WT提高,耐酸碱程度增加;2 个突变体最适温度与WT一致,但耐热性较WT提高;突变体A61L酶活力半衰期较WT延长,并表现出良好的稳定性;低浓度K+、Mg2+和Ca2+对突变体有激活作用;部分低体积分数乙醇、甲醇、乙腈和二甲基亚砜对突变体有抑制作用。本研究为优化谷氨酸棒状杆菌HSD代谢途径和促进天冬氨酸族氨基酸生物合成产业发展提供参考依据。
