1-辛烯-3-醇对禾谷镰刀菌的抑制活性及作用机理
2023-10-21钱沈安于伊楠孟佳佳张志岐黄晴雯赵志辉聂冬霞
钱沈安,胡 政,于伊楠,孟佳佳,张志岐,黄晴雯,赵志辉,聂冬霞,韩 铮,,,范 楷,*
(1.上海海洋大学食品学院,上海 201306;2.上海市农业科学院农产品质量标准与检测技术研究所,上海 201403;3.上海理工大学健康科学与工程学院,上海 200093)
禾谷镰刀菌(Fusarium graminearum)是镰刀菌属的重要真菌,可侵染小麦、大麦等禾谷类作物,引起赤霉病等严重的真菌病害[1]。禾谷镰刀菌不仅影响作物产量和质量,造成巨大的经济损失,其产生的脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)等真菌毒素,具有急性毒性(腹泻、呕吐、直肠出血等)和慢性毒性(厌食、体重减轻、发育不良等),严重威胁食品安全和人畜健康[2]。目前,我国常采用多菌灵、戊唑醇等化学杀菌剂来控制禾谷镰刀菌生长和DON产生,但这些人工合成杀菌剂的长期使用可能导致环境污染、菌株耐药性增强、引入新的食品安全风险等一系列问题。因此,寻求和开发高效、安全、环保的新型抑菌剂迫在眉睫。
近年来,天然植物成分因其具有抑制效率高、效果稳定、可降解、毒性低、不改变食品口味和营养价值等优势,已逐渐成为当前真菌毒素防控研究的新趋势[3]。1-辛烯-3-醇,又名蘑菇醇,是主要存在于植物和菌类中的一种脂肪族不饱和醇。1-辛烯-3-醇毒性低、对环境无污染,已被列入我国食品添加剂目录[4],在食品及香精中均有广泛使用。作为信号分子,1-辛烯-3-醇主要参与植物细胞防御反应,在植物-草食动物相互作用和植物-植物相互作用中发挥作用[5]。此外,研究表明1-辛烯-3-醇对多种细菌及真菌均表现一定的抑菌活性,如Xiong Chuan等[6]发现1-辛烯-3-醇对金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、表皮葡萄球菌(Staphylococcus epidermidis)、大肠埃希氏菌(Escherichia coli)和铜绿假单胞菌(Pseudomonas aeruginosa)等细菌均表现较强的抑菌活性,对革兰氏阳性菌和革兰氏阴性菌的最低抑菌浓度(minimum inhibitory concentration,MIC)分别为1 mg/mL和2 mg/mL;Berendsen等[7]研究表明1-辛烯-3-醇可以抑制菌生轮枝孢(Lecanicillium fungicola)的孢子萌发,而有效控制该真菌所引起的蘑菇干泡病;Yin Guohua[8]和Chitarra[9]等则分别证实1-辛烯-3-醇可以抑制产黄青霉(Penicillium chrysogenum)和酒青霉(Penicillium paneum)等青霉菌的孢子萌发和产孢。然而,目前对1-辛烯-3-醇的研究仅集中在抑制真菌生长上,而对真菌毒素产生情况的影响还不清楚,其抑菌机制也有待深入;此外,1-辛烯-3-醇对镰刀菌的抑制作用也尚鲜见报道。
本实验研究1-辛烯-3-醇对禾谷镰刀菌生长以及DON生物合成的抑制作用,在此基础上通过测定细胞膜完整性/通透性、细胞内容物释放量、麦角甾醇含量、氧化应激状态和关键基因表达量等探讨可能的作用机理,以期为将1-辛烯-3-醇开发为新型天然抑菌剂提供理论依据,为农产品和食品中禾谷镰刀菌和DON的污染防控提供新的思路。
1 材料与方法
1.1 材料与试剂
禾谷镰刀菌PH-1 美国典型菌种保藏中心。
1-辛烯-3-醇 上海国药集团化学试剂有限公司;DON标准品(纯度大于99%) 美国Romer公司;过氧化氢酶(catalase,CAT)、谷胱甘肽还原酶(glutathione reductase,GR)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒 北京索莱宝科技有限公司;葡萄糖、琼脂 上海源叶生物科技有限公司;乙腈、甲醇、乙酸铵(均为色谱纯) 美国Merck公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L;马铃薯葡萄糖肉汤(potato dextrose broth,PDB)液体培养基:马铃薯200 g/L,葡萄糖20 g/L;羧甲基纤维素钠(carboxymethyl cellulose,CMC)培养基:羧甲基纤维素15 g/L,NH4NO310 g/L,MgSO4·7H2O 0.5 g/L,KH2PO41 g/L,酵母提取物1 g/L;Trichothecene biosynthesis induction(TBI)产毒培养基:KCl 0.5 g/L,精氨酸0.871 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.01 g/L,蔗糖30 g/L,微量元素溶液(柠檬酸50 g/L,ZnSO4·6H2O 50 g/L,NaMoO4·2H2O 0.5 g/L,CuSO4·5H2O 2.5 g/L,MnSO40.5 g/L,H3BO30.5 g/L)200 μL/L。
1.2 仪器与设备
UPLC XEVO TQ-S超高效液相色谱(ultra-high performance liquid chromatography,UPLC)仪 美国Waters公司;TRIPLE QUADTM 5500三重四极杆质谱(mass spectrometry,MS)仪 美国AB SCIEX公司;HSC-24B氮吹仪 上海楚定分析仪器有限公司;Milli-Q超纯水仪 美国Millipore公司;AL104分析天平瑞士梅特勒-托利多仪器有限公司;SK8210LHC超声波清洗机 上海科导超声仪器有限公司;SX-500高压灭菌锅 日本TOMY公司;MGC-300H人工气候箱上海一恒科学仪器有限公司;GZX-CF101-2-BS电热恒温鼓风干燥箱 上海跃进医疗器械有限公司;Heraeus Multifuge X3高速离心机、Applied Biosystems 2720 Thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Thermo Fisher公司;LightCycler 96荧光定量PCR仪 瑞士Roche公司;Ni-E荧光显微镜日本尼康公司;UV-3300B紫外分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 禾谷镰刀菌孢子悬浮液、菌丝的制备
取活化后的镰刀菌菌丝,接种于CMC培养基,28 ℃、150 r/min培养5 d后,无菌纱布过滤,血球计数板计数,将分生孢子的浓度调为107个/mL左右,现用现制。
将1 mL孢子悬浮液接种至PDB培养基,28 ℃、180 r/min摇培48 h后,8 000 r/min、4 ℃离心5 min,弃上清液,无菌水洗涤3 次获得禾谷镰刀菌新鲜菌丝,备用。
1.3.2 1-辛烯-3-醇对禾谷镰刀菌生长和DON合成的影响
1.3.2.1 对菌落生长的抑制
分别采用接触法和熏蒸法考察1-辛烯-3-醇对禾谷镰刀菌菌落生长的影响。
接触法:量取适量1-辛烯-3-醇溶于含0.1%(V/V)Tween-20的超纯水,过滤除菌后加入PDA培养基,使得终含量为80、160、320、640、960、1 280、1 600 µL/L,以未经处理的样品为对照。在预先活化的禾谷镰刀菌菌落边缘取直径5 mm的菌饼,接种于含1-辛烯-3-醇的PDA培养基中心,28 ℃恒温培养7 d,十字交叉法测定菌落直径,每个处理重复3 次。
熏蒸法:将直径5 mm的禾谷镰刀菌菌饼置于PDA培养基平板中央,把3 片直径5 mm吸附有1-辛烯-3-醇的灭菌滤纸均匀放置于平皿边缘,使培养皿中1-辛烯-3-醇含量为20、40、60、80、100 µL/L(空气计,下同),以未经处理的样品为对照。培养皿用封口膜密封,放入自封袋,置于密封盒中,在28 ℃下培养7 d,十字交叉法测定菌落直径,每个处理重复3 次。1-辛烯-3-醇含量按下式计算:
1.3.2.2 对孢子萌发的影响
通过凹玻片法测定1-辛烯-3-醇对禾谷镰刀菌孢子萌发的影响。在培养皿中加入7 mL无菌水,向凹玻片的凹孔中加入50 μL的孢子悬浮液和50 μL的1%葡萄糖溶液,把3 片直径5 mm、吸附有1-辛烯-3-醇的灭菌滤纸均匀放置于玻片边缘,使培养皿中含量为0.1、1、5、20、40 µL/L,以未经处理的样品为对照,28 ℃培养8 h后,光学显微镜(×10)下观察孢子萌发情况,当孢子芽管长度超过孢子细端直径的一半时判定为已萌发,每个处理重复3 次。孢子萌发率的计算公式如下:
1.3.2.3 对DON生物合成的抑制作用
将1-辛烯-3-醇熏蒸处理后的PDA培养基于50 ℃烘箱干燥,粉碎混匀后,准确称取2 g样品于50 mL离心管,加入10 mL乙腈-水(84∶16,V/V),旋涡振荡1 min,浸泡5 min后,超声提取1 h,4 000 r/min离心10 min,取5 mL上清液,在40 ℃氮气吹干,1 mL的5 mmol/L乙酸铵溶液-甲醇(80∶20,V/V)溶解残渣,涡旋30 s后,适量稀释,过0.22 μm滤膜,UPLC-MS/MS测定,每个处理重复5 次。
将500 μL孢子悬浮液添加到50 mL TBI产毒培养基中,置于250 mL锥形瓶,将1-辛烯-3-醇均匀滴在滤纸并贴于锥形瓶内壁,使瓶中1-辛烯-3-醇含量为20、40、60、80、100 µL/L,以未经处理的样品为对照。锥形瓶用封口膜密封,放入自封袋,于25 ℃、180 r/min培养7 d后,取培养适量稀释,过0.22 μm滤膜,UPLC-MS/MS测定,每个处理重复5 次。
色谱条件:色谱柱:Agilent Poroshell 120 EC-C18色谱柱(100 mm×3.0 mm,2.7 mm);流动相:流动相A为5 mmol/L乙酸铵溶液,流动相B为甲醇;梯度洗脱程序:0~0.5 min,10% A、90% B;0.5~4 min,10%~90% A、90%~10% B;4~4.5 min,90% A、10% B;4.5~4.7 min,90%~10% A、10%~90% B;4.7~6 min,10% A、90% B;流速0.4 mL/min;进样量3 μL;柱温40 ℃。
质谱条件:采用电喷雾电离源(electron spray ionization,ESI)正离子模式;雾化气、辅助气均为高纯空气,碰撞气为高纯氮气;雾化气压力50 psi;辅助气压力50 psi;雾化温度500.0 ℃;喷雾电压5 500 V;喷雾电压气帘气压力35 psi;碰撞气压力8 psi;通过多反应监测模式对DON进行定量:母离子m/z297.3;定量子离子m/z203.0,碰撞能量38 eV;定性子离子m/z175.1,碰撞能量28 eV。
1.3.3 扫描电子显微镜(scanning electron microscope,SEM)观察超微结构
分别取20、60、100 µL/L 1-辛烯-3-醇熏蒸处理后的禾谷镰刀菌菌丝,2.5%戊二醛的磷酸缓冲液(0.1 mol/L,pH 7.2)室温避光固定2 h。梯度乙醇溶液脱水后,分别用乙醇和叔丁醇混合液和叔丁醇处理。菌丝-80 ℃预冻、干燥、喷金处理后,SEM观察。
1.3.4 麦角甾醇含量测定
分别取20、60、100 µL/L 1-辛烯-3-醇熏蒸处理后的禾谷镰刀菌菌丝,加入5 mL 25% KOH-乙醇溶液,涡旋2 min,85 ℃孵育4 h。加入2 mL无菌水和5 mL正庚烷,涡旋2 min。静置收集正庚烷层,用紫外分光光度计在230~300 nm波长处扫描,以未经处理的样品为对照。麦角甾醇含量计算公式如下:
1.3.5 碘化丙啶(propidium iodide,PI)染色
分别取20、60、100 µL/L 1-辛烯-3-醇熏蒸处理后的禾谷镰刀菌菌丝,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤,加入10 μg/mL PI染色,30 ℃黑暗环境下孵育20 min。PBS漂洗后,荧光显微镜(535 nm激发波长和615 nm发射波长)观察样品,每次随机观察3 个视野,以未处理组为对照,每个处理重复3 次。
1.3.6 蛋白质核酸泄漏
参照Jiao Wenxiao等[10]的方法检测蛋白质和核酸泄漏情况。取2 g禾谷镰刀菌菌丝悬浮于20 mL PBS中,将1-辛烯-3-醇均匀滴在滤纸,贴在50 mL离心管管口处,封口膜密封后放入自封袋,管中1-辛烯-3-醇含量为20、60、100 µL/L,以未经处理的样品为对照。28 ℃、180 r/min培养24 h,8 000 r/min、4 ℃离心10 min后,分别在260 nm和280 nm波长处检测上清液的吸光度,每个处理重复3 次。
1.3.7 氧化应激的测定
1.3.7.1 MDA含量的测定
按1.3.6节获得1-辛烯-3-醇熏蒸处理后的菌丝,PBS洗涤后在冰水浴中超声破碎(功率35%,超声6 s,间隔5 s,20 min)后,9 000 r/min、4 ℃离心5 min,取上清液。参照MDA含量检测试剂盒的处理方法,测定532 nm与600 nm波长处吸光度,计算MDA含量,每个处理重复3 次。
1.3.7.2 CAT和GR活性的测定
按1.3.6节获得1-辛烯-3-醇熏蒸处理后的菌丝,PBS洗涤后,称取0.1 g菌丝体,加入1 mL提取液,冰上研磨后,8 000 r/min、4 ℃离心10 min,取上清液。参照CAT活性检测试剂盒的处理方法,测定240 nm波长处吸光度,计算CAT活性;参照GR活性检测试剂盒的处理方法,测定340 nm波长处吸光度并利用10 s与190 s的差值计算GR活性。每个处理重复5 次。
1.3.8 基因表达分析
分别取20、40、60 µL/L 1-辛烯-3-醇熏蒸处理后的禾谷镰刀菌菌丝,分别按照TransZol Up、cDNA Synthesis SuperMix和PerfectStart Green qPCR SuperMix试剂盒(北京全式金生物技术有限公司)提取RNA,合成cDNA并检测相关基因表达情况,所用引物见表1。利用2-ΔΔCt方法计算各个基因在不同样品中的相对表达量。每个处理重复5 次。

表1 本实验考察基因及引物Table 1 Primers used in this study
1.4 数据分析
数据统计分析利用SPSS 19.0软件完成,差异显著性通过独立样本t检验和ANOVA方差分析获得,P<0.05,差异显著。绘图采用Origin 8软件完成。
2 结果与分析
2.1 1-辛烯-3-醇对禾谷镰刀菌生长的影响
2.1.1 对菌落生长的影响
分别通过接触法和熏蒸法评估1-辛烯-3-醇对禾谷镰刀菌菌落生长的影响。由图1可见,在28 ℃培养7 d后,对照组菌落长满平皿,形态完整,呈砖红色,表面覆盖白色绒毛状菌丝。接触法中,Tween对菌丝的生长基本无影响,而加入1-辛烯-3-醇后,随含量增加,菌株生长逐渐受到抑制,菌落逐渐变小,颜色渐转黄(图1A)。培养过程中,1-辛烯-3-醇处理组菌落的生长速度也明显慢于对照(图2A),培养7 d,80、320、960、1 600 μL/L条件下菌落抑制率分别为6.86%、13.95%、17.44%、27.67%。与直接接触相比,1-辛烯-3-醇熏蒸对禾谷镰刀菌菌落生长的抑制效果更为明显。20~40 μL/L 1-辛烯-3-醇作用下,镰刀菌菌丝逐渐稀疏,在60 μL/L时菌落呈现浅黄色,直径明显变小,200 μL/L以上禾谷镰刀菌生长完全被抑制(图1B)。培养7 d,20、60、100、200 μL/L条件下,菌落抑制率分别为13.60%、34.30%、60.70%和100%(图2B)。对比两种抑制方法所需1-辛烯-3-醇的用量,200 μL/L 1-辛烯-3-醇(每培养皿约15 μL)熏蒸可以完全抑制镰刀菌菌落的生长,而接触法中1 600 μL/L 1-辛烯-3-醇(每培养皿约32 μL)作用下抑制率仅为27.67%。因此,熏蒸处理抑菌效果更好、用量更低,可能是由于1-辛烯-3-醇自身挥发性较强,熏蒸更利于发挥其活性。因此,在后续实验均采用熏蒸法进行处理。
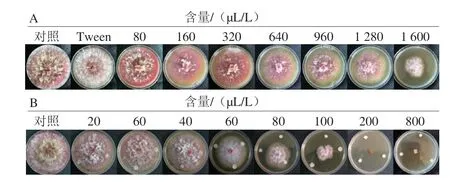
图1 1-辛烯-3-醇对禾谷镰刀菌菌落形态的影响Fig.1 Effect of 1-octen-3-ol on colony morphology of F. graminearum

图2 1-辛烯-3-醇对禾谷镰刀菌菌丝直径的影响Fig.2 Effect of 1-octen-3-ol on colony diameter of F. graminearum
2.1.2 对孢子萌发的影响
如图3所示,培养8 h后,对照组禾谷镰刀菌孢子萌发率为96.75%;1-辛烯-3-醇处理后,孢子萌发率不断降低,5 μL/L 1-辛烯-3-醇熏蒸下,孢子萌发抑制率为43.08%,而40 μL/L 1-辛烯-3-醇处理下,孢子萌发基本完全抑制。该结果与之前多个研究类似,如5 μL/L和10 μL/L的1-辛烯-3-醇处理下,黄曲霉(Aspergillus flavus)产孢抑制率分别为84.50%和99.75%[11];而74.00 μg/mL的1-辛烯-3-醇能使匍枝根霉(Rhizopus stolonifer)孢子萌发率从99.74%降低至66.51%,同时芽管平均长度减少为原来的24.77%[12];此外,1-辛烯-3-醇也被证实可明显降低酒青霉(Penicillium paneum)分生孢子的呼吸作用[9]。因此,1-辛烯-3-醇在较低含量时即可对真菌孢子的产生、萌发和呼吸造成显著抑制作用。

图3 1-辛烯-3-醇对禾谷镰刀菌孢子萌发的影响Fig.3 Effect of 1-octen-3-ol on spore germination of F. graminearum
2.2 对DON生物合成的影响
DON能够抑制蛋白质合成和核酸的复制,抑制线粒体功能,具有肠道毒性、细胞毒性、免疫毒性、遗传毒性等多种毒性[13],已被联合国粮农组织和世界卫生组织确定为最危险的食品污染物之一。不同含量1-辛烯-3-醇熏蒸处理后,禾谷镰刀菌产生DON毒素的结果见图4。PDA培养基中,与对照组相比,20、40、60、80、100 μL/L的1-辛烯-3-醇熏蒸作用下,DON合成量显著下降,分别为165.38、53.62、17.96、11.14 μg/kg和5.82 μg/kg,抑制率分别为29.00%、76.98%、92.29%、95.22%和97.50%;而TBI培养基上1-辛烯-3-醇的抑制效果更为明显,20 μL/L作用下DON产生降低了84.58%,40 μL/L及以上含量作用时DON合成几乎完全被抑制。之前研究表明,30 mg柠檬醛和丁香酚熏蒸处理能有效抑制20 g含水量21%的玉米碴中禾谷镰刀菌DON产量,抑制率分别为95.64%和98.33%,而玉米碴含水量为13%时,抑制率仅为67.42%和75.70%[14];94 μg/mL的98%环阿屯醇和97% 24-亚甲基环阿屯醇均对禾谷镰刀菌生物合成DON有明显抑制效果,抑制率分别为81.01%和74.68%[15]。对比可见,与其他天然产物相比,1-辛烯-3-醇抑制DON合成的用量更低,效果更为显著。目前,1-辛烯-3-醇已被作为食品添加剂广泛使用,其制备方式成熟,安全性更高,因此具有更好的开发和应用前景。

图4 1-辛烯-3-醇对DON合成的影响Fig.4 Effect of 1-octen-3-ol on DON production
2.3 对菌丝微观结构的影响
如图5A所示,对照组菌丝表面光滑,结构规则,饱满粗壮,具备正常的生理结构;而50 μL/L 1-辛烯-3-醇熏蒸后,菌丝表面逐渐粗糙,出现褶皱、干瘪,并伴随孔洞出现(图5B);当1-辛烯-3-醇增至100 μL/L,孔洞直径增大,菌丝变细,可能导致细胞膜膜通透性的增加和细胞内容物的泄漏(图5C)。与此类似,1-辛烯-3-醇处理枯草芽孢杆菌和表皮芽孢杆菌后,细胞形态受到严重破坏,外表面不规则褶皱且粗糙[6]。以上结果表明,1-辛烯-3-醇可对真菌菌丝的细胞结构造成不同程度的变化和损坏,从而影响细胞的正常生理功能,最终可能导致细胞死亡。

图5 不同含量1-辛烯-3-醇处理后禾谷镰刀菌菌丝微观形态的SEM照片Fig.5 SEM images of F. graminearum mycelia treated with 1-octen-3-ol at different concentrations
2.4 对细胞膜完整性的影响
PI是一种常见的细胞染色剂,正常情况下,PI不能穿过细胞膜,而当细胞膜受损而丧失选择性时,PI可进入细胞与DNA结合呈现红色荧光。本研究通过PI染色研究1-辛烯-3-醇熏蒸对禾谷镰刀菌细胞膜完整性的影响。由图6A可见,对照组菌丝基本检测不到荧光;50 μL/L 1-辛烯-3-醇熏蒸处理后,少数菌丝发出零星红色荧光,表明部分细胞膜被破坏,通透性增加(图6B);当含量增加至100 μL/L时,发出红色荧光的菌丝增多,信号明显增强,说明菌丝细胞膜被进一步破坏,细胞死亡的数量增加(图6C)。以上结果与SEM结果一致,表明较高浓度的1-辛烯-3-醇熏蒸可导致禾谷镰刀菌菌丝细胞膜被破坏,菌体死亡。

图6 不同含量1-辛烯-3-醇处理对禾谷镰刀菌细胞膜完整性的影响Fig.6 Effect of 1-octen-3-ol at different concentrations on the cell membrane integrity of F. graminearum
2.5 对细胞膜通透性的影响
分别通过检测上清液的OD280nm和OD260nm考察蛋白质和核酸的胞外泄漏情况。结果显示,1-辛烯-3-醇熏蒸处理后,镰刀菌胞内容物的释放量显著增加,且呈剂量依赖效应(图7);与对照相比,20、60、100 μL/L的1-辛烯-3-醇熏蒸作用下,其OD260nm分别增加至原来的1.61、2.06 倍和2.34 倍,OD280nm分别增加至原来的1.67、2.06 倍和2.39 倍。因此,1-辛烯-3-醇熏蒸可以显著影响禾谷镰刀菌细胞膜的通透性,导致蛋白质和核酸等细胞内容物泄漏。类似的,0.05 μL/mL丁香精油作用下黄曲霉菌(Aspergillus flavus)菌丝核酸和蛋白质的外渗量显著增加,胞外上清液的OD260nm和OD280nm分别为对照组的2.3 倍和2.7 倍[16]。此外,0.1 µg/mL丁香菌酯处理后稻瘟病菌(Magnaporthe oryzae)菌丝的相对电导率升高,细胞电解质外渗[17];披针叶红千层精油[18]和茉莉精油[19]可引起黄曲霉菌细胞Ca2+、K+、Mg2+等重要离子的大量泄漏,且呈剂量依赖关系。以上结果表明包括1-辛烯-3-醇在内的多种植物天然产物可以增加真菌细胞膜通透性,引起蛋白质、核酸和重要离子等细胞内容物泄漏,最终抑制真菌生长。

图7 1-辛烯-3-醇对蛋白质核酸泄漏的影响Fig.7 Effect of 1-octen-3-ol on leakage of intracellular proteins and nucleic acid
2.6 对麦角甾醇的影响
麦角甾醇是真菌细胞膜的主要甾醇部分,负责维持细胞的功能和完整性,麦角固醇的缺乏或减少会导致真菌细胞膜结构的丧失,导致细胞膜功能异常,进而造成细胞内容物泄漏甚至细胞死亡[20]。抗真菌药物常通过破坏麦角甾醇的生物合成途径,达到抑菌效果;植物天然成分导致真菌麦角甾醇含量的下降也在多项研究中证实[21-23]。本研究发现,与对照组相比,1-辛烯-3-醇熏蒸后麦角甾醇含量显著降低,20、60、100 μL/L处理组麦角甾醇含量分别下降49.01%、65.34%、84.89%,不同含量之间存在显著差异(P<0.05)(图8)。综合SEM、PI和泄漏实验,可认为1-辛烯-3-醇通过作用于禾谷镰刀菌细胞膜并影响麦角固醇合成的方式发挥抑菌作用。有研究表明真菌麦角甾醇含量的减少可能是由于其生物合成途径中羊毛甾醇-14-α-去甲基化酶活性降低[24-25],也可能是由于ERG11、ERG6和ERG4等合成关键基因表达的下调[26],而1-辛烯-3-醇干扰禾谷镰刀菌麦角甾醇合成的具体机制还有待进一步研究。

图8 1-辛烯-3-醇对麦角甾醇合成的影响Fig.8 Effect of 1-octen-3-ol on the synthesis of ergosterol
2.7 对氧化应激的影响
促进真菌细胞活性氧生成、诱导氧化应激、加重氧化损伤是许多天然植物成分发挥抑菌作用的重要机制之一[27-28]。本研究通过测定GR、CAT活性以及MDA含量考察1-辛烯-3-醇熏蒸对禾谷镰刀菌氧化应激的影响。由图9A所示,1-辛烯-3-醇熏蒸对GR活性有明显的抑制效果,效果随含量的增加而上升;20、60、100 μL/L处理组中,抑制率分别为49.37%、68.53%和83.36%。GR活性的降低可能会使细胞更易受到氢过氧化物和自由基的伤害,从而导致细胞死亡。不同于GR,CAT活性先升高后降低(图9B),20、60、100 μL/L处理组CAT活性分别升高到2.08、2.82 倍和1.98 倍。CAT是最主要的H2O2清除酶,低浓度1-辛烯-3-醇作用下,镰刀菌细胞通过CAT活性的升高抵御氧化损伤,而高含量1-辛烯-3-醇则可能打破细胞的氧化应激平衡并诱发损伤凋亡,使得CAT活性下降。MDA是评判脂质过氧化水平的关键指标,20 μL/L的1-辛烯-3-醇熏蒸作用下MDA含量变化不大,但在60 μL/L和100 μL/L的条件下,MDA含量显著上升(P<0.05),说明高含量1-辛烯-3-醇熏蒸下,禾谷镰刀菌细胞内活性氧积累并发生脂质过氧化反应。

图9 1-辛烯-3-醇对氧化应激状态的影响Fig.9 Effect of 1-octen-3-ol on antioxidant defense system
2.8 对DON生物合成关键基因的影响
除了菌株生长被抑制,禾谷镰刀菌DON产生的下降也有可能是其生物合成途径受到干扰,本研究通过实时PCR对DON合成关键基因簇(TRI基因簇)的表达情况进行分析。如图10A所示,20 μL/L 1-辛烯-3-醇作用下TRI5和TRI6的基因相对表达量无显著差异,其余TRI基因相对表达量有所下降,相应含量下DON产量降低29.00%(图4A);而在40 μL/L和60 μL/L处理组,除TRI6以外所有TRI基因(TRI4、TRI5、TRI8、TRI10、TRI12、TRI101)的相对表达量均显著下调,此时DON的合成几乎被完全抑制(图4)。TRI5、TRI4、TRI8和TRI101均编码直接参与DON生物合成的催化酶,TRI12编码毒素输出泵,负责将合成的DON毒素输出转运出菌体外[29];TRI6和TRI10则编码两种不同结构的转录因子,正向调控DON等单端孢霉烯族毒素生物合成的相关基因[30]。一般认为TRI6是DON生物合成的主要调控因子,而TRI10基因起次要作用,但本研究中发现1-辛烯-3-醇作用下,TRI6表达无显著变化,而TRI10的表达显著下调。目前,TRI10的具体功能还还尚不明了,有研究发现禾谷镰刀菌TRI10敲除后TRI6表达无变化,而其他TRI基因表达显著降低,DON合成被抑制[31]。因此,1-辛烯-3-醇主要是通过下调TRI10基因的表达,最终抑制禾谷镰刀菌中DON的生物合成。

图10 1-辛烯-3-醇对TRI基因表达量的影响Fig.10 Effect of 1-octen-3-ol on TRI gene expression
3 结 论
本研究通过体外抑菌实验发现,1-辛烯-3-醇熏蒸能有效抑制禾谷镰刀菌的菌丝生长和孢子萌发,其作用效果存在含量依赖性。SEM观察、PI染色和蛋白质核酸泄漏实验表明1-辛烯-3-醇熏蒸对能够损伤禾谷镰刀菌菌丝细胞结构伤,严重破坏了细胞膜完整性,增加了细胞膜透性,使细胞内容物外溢。此外,1-辛烯-3-醇熏蒸能够显著降低禾谷镰刀菌麦角甾醇的合成量,干扰氧化应激状态等,从而达到抑菌效果。最后,1-辛烯-3-醇还可通过调控TRI10基因的表达,显著抑制禾谷镰刀菌中DON的生物合成。以上结果表明,1-辛烯-3-醇能高效抑制禾谷镰刀菌的生长和产毒,未来有望将其开发为新型绿色抑菌剂,在农产品和食品DON污染防控中具有广阔的应用前景。
