提高解淀粉芽胞杆菌PHODG36 芽胞耐热性的技术研究
2023-10-19张晓云赵卫松曲远航苏振贺鹿秀云郭庆港李社增
张晓云, 丛 蓉, 赵卫松, 曲远航, 苏振贺,鹿秀云, 郭庆港, 李社增, 马 平
(河北省农林科学院 植物保护研究所,河北省农业有害生物综合防治创新中心,农业农村部华北北部作物有害生物综合治理重点实验室,河北 保定 071000)
芽胞是芽胞杆菌Bacillusspp.在生长发育后期形成的一种抗逆性很强的休眠体,可耐受多种不良环境条件,如热、干旱和紫外线等,常被用作有效成分研制微生物杀菌剂,其剂型有可湿性粉剂、水分散片剂、粉尘剂、干悬浮剂和微粉剂等,其中以可湿性粉剂居多[1-6]。干粉原药是研发上述微生物杀菌剂的核心原料,通常是由发酵浓缩液通过喷雾干燥而获得。喷雾干燥是将制备好的发酵浓缩液雾化成细微的雾滴,并进入干燥室内与高温空气接触,通过热空气交换,使水分气化,最终获得固态粉末的过程[7]。虽然芽胞抗逆性强,但喷雾干燥过程中的瞬时高温度气流会对芽胞造成多重胁迫,造成部分芽胞死亡,从而导致回收率降低。因此,喷雾干燥过程中,如何提高芽胞存活率,成为当前微生物杀菌剂研发过程中干粉原药高效生产亟需解决的问题,其中提高芽胞耐热性是解决该问题的关键所在。
芽胞耐热性的提高,可以通过菌株自身耐热性提高来完成,但微生物自然突变率极低,可采用人工手段诱导其发生突变。微生物诱变育种,是利用物理或化学方法诱导基因产生突变,并结合高效快速的筛选方法,获得性状优良的突变菌株的一种诱变方法,包括紫外诱变、超声波诱变、温度诱变和亚硝酸诱变等[8]。微生物生长需要一定的温度,改变温度必然会影响其体内的多种生物化学反应。吴明霞等[9]采用变温方式对兽疫链球菌进行诱变处理,获得了透明质酸产量提高48.0%的诱变菌株;李瑾[10]对炭样小单孢菌进行热诱变,筛选获得1 株抗生素产生能力提高98.5%的诱变菌株。但目前尚未见利用温度诱变选育芽胞耐热性提高菌株的研究报道。
抗热保护剂的筛选与应用,是提高芽胞耐热性的另一关键途径。保护剂能够减少喷雾干燥过程中的细胞损伤,从而提高存活率[11]。肖怀秋等[12]研究表明,海藻糖、蔗糖及脱脂奶粉对枯草芽胞杆菌Prob1822 菌株的保护效果较好,菌体存活率均高于80%以上;Agudelo 等[13]研究发现,蔗糖与海藻糖能提高保加利亚乳杆菌的菌体存活率;张凯[14]通过在枯草芽胞杆菌Bs-208 发酵浓缩液中添加热保护剂 (0.1% PEG4000 + 0.3%蔗糖 + 0.2%NaCl),能将该菌株芽胞存活率提高18.1%。
解淀粉芽胞杆菌PHODG36 是本实验室筛选获得的一株具有广谱抑菌作用的生防菌株[15],对多种土传病害防效较好。本研究以该菌株为研究对象,通过热处理诱变与变温诱变,获得该菌株芽胞耐热性提高的诱变菌株,进一步通过正交试验,研究了多种保护剂在湿热条件下的保护性能及其发挥最佳保护效果的用量与处理条件,旨在为该菌株干粉原药的喷雾干燥生产工艺优化提供技术支撑。
1 材料与方法
1.1 供试材料及仪器
1.1.1 培养基 LB 液体培养基:蛋白胨10g,酵母粉5g,氯化钠5g,水1000mL,pH7.0~7.5。LB 固体培养基:每1000mLLB 液体培养基中,加入15g 琼脂。发酵培养基:玉米粉30g,豆饼粉20g,NaH2PO44g,KH2PO40.3g,Na2CO31g,MgSO40.5g,CaCO32g,水1000mL,pH 7.0~7.5。低谷氨酸盐甘油(minimalsaltsglycerol glutamate,MSGG)培养基:3-(N-吗啡啉)丙磺酸10mmol/L,甘油0.5%,谷氨酸0.5%,K3PO45mmol/L,色氨酸50μg/mL,苯丙氨酸50μg/mL,硫胺素2μmol/L,MgCl22mmol/L,CaCl2700 μmol/L,FeCl350μmol/L,MnCl250μmol/L,ZnCl21μmol/L。马铃薯葡萄糖琼脂(potato dextrose agar,PDA) 培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,水1000 mL。
1.1.2病原菌 大丽轮枝菌Verticillium dahliae和立枯丝核菌Rhizoctonia solani,均由河北省农林科学院植物保护研究所分离并保存。
1.1.3仪器 DK-8D 恒温水浴锅(常州市亿能实验仪器厂);LC-MSB-HD 变温发酵装置:磁力搅拌器(上海力辰仪器科技有限公司)+具挡板三角摇瓶(1L,四川蜀玻(集团)有限责任公司);SZX16 体视显微镜(OlympusCorporation)。
1.2 试验方法
1.2.1 芽胞悬浮液的制备 挑取活化的供试菌株单菌落,接种于盛有100mLLB 液体培养基的三角瓶(容量300mL)中,于30℃、180r/min 条件下培养12h,得到种子液;吸取种子液,以2%的接种量接种于盛有100mL 发酵培养基的三角瓶(容量300mL)中,于30℃、180r/min 条件下培养48h,得到供试菌株发酵液;80℃水浴15min,去除其中残留的营养体[16],即为供试菌株的芽胞悬浮液。
2.2每周一设为消毒供应中心开放日,由护士长和带教老师负责接待和讲解,参观人员必须在指导下做好自我防护。
1.2.2 芽胞耐热性的检测 采用稀释平板涂布法[17]。首先,测定上述芽胞悬浮液中的芽胞含量作为初始芽胞含量;然后,量取适量芽胞悬浮液,置于灭菌离心管中,100℃水浴30min,测定其芽胞含量作为存活芽胞含量。按照公式(1)计算芽胞存活率。以芽胞存活率为指标评价其耐热性。
式中:Sr为芽胞存活率;Sc为存活芽胞含量,CFU/mL;Ic为初始芽胞含量,CFU/mL。
1.2.3 PHODG36 菌株芽胞耐热性提高菌株的筛选
1.2.3.1 PHODG36 菌株的热处理诱变 取5 mL PHODG36 菌株芽胞悬浮液于灭菌离心管中,100 ℃水浴60 min,取出,采用稀释平板涂布法[17]涂平板,在存活的芽胞中随机挑选10 株,转至LB液体培养基中,按1.2.1 节方法制备各菌株芽胞悬浮液,检测芽胞耐热性。以野生型菌株PHODG36为对照,筛选芽胞耐热性提高的诱变菌株。
1.2.3.2 PHODG36 菌株的变温发酵诱变 从1.2.3.1 节试验结果中,选取芽胞存活率较好的菌株作为出发菌株,进行变温发酵培养,发酵时间及其对应的培养温度如表1 所示,转速800 r/min,通气量0.6 L/min。发酵结束后采用稀释平板涂布法[17]涂平板,从每株出发菌株后代中随机挑选4 株,转至LB 液体培养基中,按1.2.1 节方法制备各诱变菌株芽胞悬浮液,检测芽胞耐热性。以野生型菌株PHODG36 为对照,筛选芽胞耐热性提高的诱变菌株。
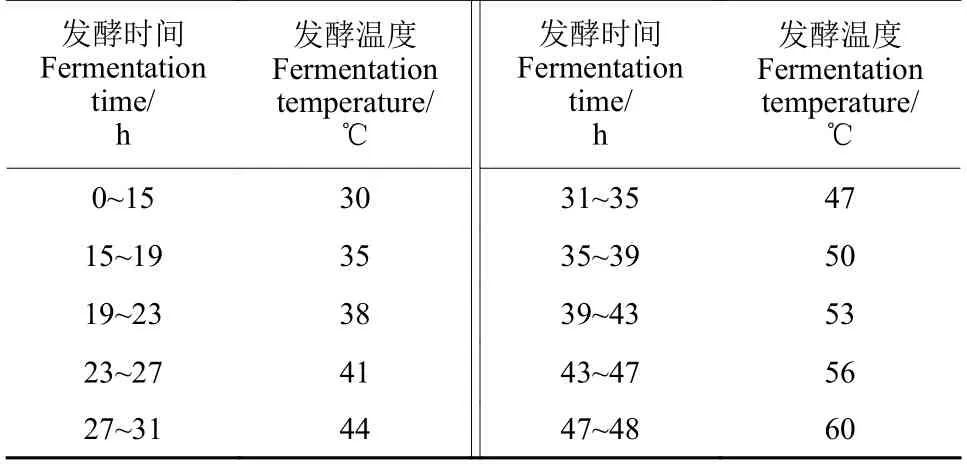
表1 发酵时间及相应培养温度Table 1 Fermentation time and corresponding culture temperature
1.2.4 不同恒温发酵培养中诱变菌株芽胞耐热性提高的效果 按照1.2.1 节方法制备野生型菌株PHODG36 及诱变菌株BBW-11 种子液,将种子液以2%的接种量接种于发酵培养基中,分别置于30℃与37℃下,180r/min 培养48h,制备2 菌株的芽胞悬浮液,检测其芽胞耐热性,对诱变菌株BBW-11 提高芽胞耐热性的效果进行确认。
1.2.6 野生型菌株与诱变菌株生物学特性的比较
将野生型菌株PHODG36 及诱变菌株BBW-11 分别接种于LB 液体培养基中,于30℃、180 r/min 条件下培养12~15h,离心收集菌体并用超纯水悬浮,调整至浓度相同(OD600=1.0),得到两菌株的菌体悬浮液,备用。
1.2.6.1 菌落形态比较 各取2 个供试菌株的菌悬液1 μL,接种到 LB 固体培养基平板上,30 ℃静置培养48 h,显微观察两菌株的菌落形态。每个菌株3 次重复[18]。
1.2.6.2 生物膜形成情况比较 采用结晶紫法[19]。分别取2 个供试菌株的菌悬液50 μL,加至装有2 mL MSGG 培养基的离心管中,用移液器吹吸混匀,转入24 孔细胞培养板中,37 ℃静置培养,分别于24 h 和48 h 观察两菌株生物膜的形成情况。观察完后,吸出培养孔中的MSGG 培养液,保留表层生物膜,用无菌水清洗2 次,自然风干2 h,用2 mL0.1%结晶紫 (W/V) 染液染色30 min,之后将结晶紫染液吸出,用无菌水清洗培养孔和生物膜2 次,然后加入2 mLV(乙醇) :V(丙酮) =4 : 1 混合液,溶解吸附在生物膜上的结晶紫,稀释适当倍数后测定OD570。每个菌株3 次重复。
1.2.6.3 生长动态比较 分别取两个供试菌株的菌悬液2 mL,接种于100 mL 发酵培养基中,于30 ℃、180 r/min 条件下培养48 h,每隔4 h 取样测定发酵液中的菌体浓度,并绘制生长曲线[18]。
1.2.6.4 抑菌作用比较 采用对峙培养法[20]比较野生型菌株PHODG36 及诱变菌株BBW-11 对大丽轮枝菌和立枯丝核菌的抑菌活性。在直径9 cm的PDA 平板中央,分别接种新培养的直径5 mm的大丽轮枝菌和立枯丝核菌菌盘;在距离菌盘2 cm处,用灭菌牙签接种新活化的野生型菌株PHODG36及诱变菌株BBW-11,以不接种两菌株的病原菌平板为对照,每个供试菌株3 次重复。25 ℃ 培养3~10 d,测量对照病原菌的菌落半径和两菌株处理后的菌落半径,按公式 (2) 计算抑菌率。
式中:Ir为抑菌率;Cr为对照菌落半径,mm;Tr为处理菌落半径, mm。
1.2.7 芽胞热保护剂种类、用量及处理条件的筛选 采用四因素五水平的正交试验,对芽胞热保护剂的种类、用量与处理条件进行筛选,正交试验设计见表2。按照1.2.1 节的方法制备诱变菌株BBW-11 芽胞悬浮液,在其中添加不同浓度的保护剂并混合均匀,然后在不同温度下水浴处理不同时间,检测不同处理的芽胞耐热性(以未处理的诱变菌株BBW-11 芽胞含量为初始芽胞含量),筛选提高诱变菌株BBW-11 芽胞耐热性的最适保护剂及其用量与处理条件组合。
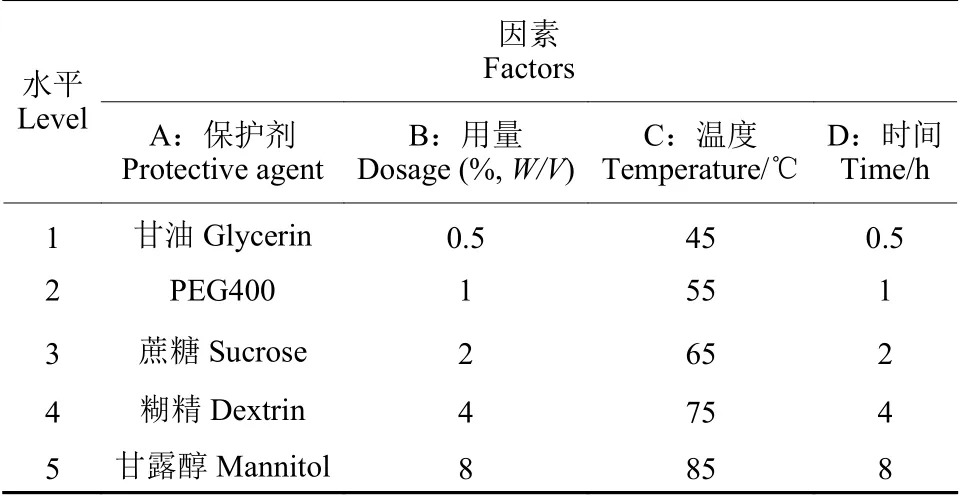
表2 正交试验设计因素及水平Table 2 The factors and levels of orthogonal experimental design
1.2.8 数据统计与分析 采用Excel 2010 和Origin 2019 进行数据整理与作图。利用IBM SPSS 19.0 软件,通过单因素方差分析 (利用Duncan 氏新复极差法进行多重比较) 与独立样本t检验,进行差异显著性分析。
2 结果与分析
2.1 PHODG36 菌株芽胞耐热性提高菌株的筛选
2.1.1 PHODG36 菌株的热处理诱变 结果(图1)表明:经100℃水浴处理30min 后,各诱变菌株与野生型PHODG36 菌株的芽胞存活率(1.2%)无显著性差异,因此选择芽胞存活率提高较多的B1、B2、B3、B8 与B9 这5 个诱变菌株(芽胞存活率分别提高7.5%、4.0%、4.9%、3.3%和9.8%)进行下一步的研究。
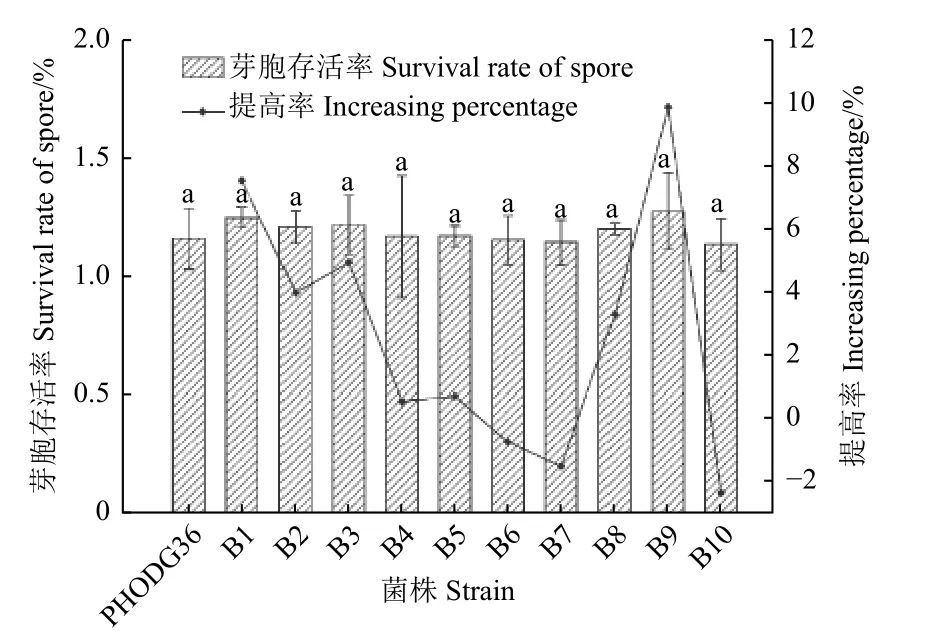
图1 100 ℃处理30 min 后解淀粉芽胞杆菌PHODG36菌株后代菌系的芽胞存活率Fig.1 The spore survival rate of the progeny isolates of B.amyloliquefaciens PHODG36 after heat-treating at 100 ℃ for 30 min
2.1.2 PHODG36 菌株的变温发酵诱变 将B1、B2、B3、B8 与B9 这5 个菌株进行变温发酵培养后,从每个菌株的后代菌株中随机挑选4 株制备芽胞悬浮液,检测芽胞耐热性。结果(图2)表明:诱变菌株BBW-11 的芽胞存活率最高,达到1.6%,与诱变菌株BBW-12(1.5%)无显著性差异;其次为诱变菌株BBW-14,芽胞存活率为1.4%;这3 株菌的芽胞存活率均显著高于野生型菌株PHODG36(1.1%)。其中,诱变菌株BBW-11的芽胞存活率比野生型菌株PHODG36 提高55.0%,因此,选择该诱变菌株继续进行下一步的研究。

图2 变温培养处理后解淀粉芽胞杆菌PHODG36 菌株后代菌系的芽胞存活率Fig.2 The spore survival rates of the progeny isolates of B.amyloliquefaciens PHODG36 after variable temperature culture
2.2 不同恒温发酵培养对诱变菌株BBW-11 芽胞耐热性提高的效果
结果 (图3) 表明:在30 和37℃培养温度下,同一个供试菌株的芽胞存活率无显著性差异;但在相同培养温度下,诱变菌株BBW-11 的芽胞存活率显著高于野生型菌株PHODG36,30 ℃和37 ℃时其芽胞存活率比野生型菌株PHODG36分别提高51.7%和52.3%。

图3 不同培养温度下野生型PHODG36 及其诱变菌株BBW-11 的芽胞存活率Fig.3 The spore survival rates of wild-type strain PHODG36 and the mutant isolate BBW-11 cultured at different temperatures
2.3 诱变菌株的遗传稳定性测定结果
结果 (图4) 表明:传代7 代后,野生型菌株PHODG36 和诱变菌株BBW-11 的芽胞存活率均有所下降 (下降率分别为17.1%和8.9%),但诱变菌株BBW-11 的芽胞存活率仍显著高于野生型菌株PHODG36,说明诱变菌株BBW-11 的芽胞耐热能力具有较好的遗传稳定性。
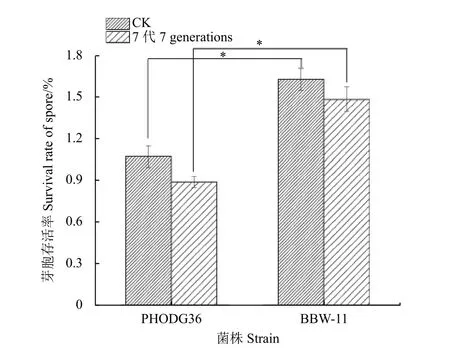
图4 野生型菌株PHODG36 与诱变菌株BBW-11 的遗传稳定性Fig.4 The genetic stability of wild-type strain PHODG36 and the mutant isolate BBW-11
2.4 野生型菌株PHODG36 与诱变菌株BBW-11的生物学特性比较
2.4.1 菌落形态比较 在LB 固体培养基平板上比较了野生型菌株PHODG36 和诱变菌株BBW-11 的菌落形态,结果(图5)表明:两个菌株在LB 固体培养基上均能形成表面褶皱的、具有立体结构的菌落形态,没有明显的区别。

图5 野生型菌株PHODG36 与诱变菌株BBW-11菌落形态比较Fig.5 Comparison of the colony morphologies between wild-type strain PHODG36 and mutant isolate BBW-11
2.4.2 生物膜形成能力比较 在MSGG 培养基中定性比较了野生型菌株PHODG36 和诱变菌株BBW-11 的生物膜形成能力。结果发现:培养24h后,两个菌株均已形成具有明显褶皱的生物膜;培养48h 后,两个菌株均在液体表面形成复杂的立体结构(图6A)。两个菌株表观上无明显差异。采用结晶紫染色法[19]定量测定了两个菌株的生物膜形成能力,结果表明,在培养24h 与48h 这两个时间点,两个菌株生物膜形成能力均无显著性差异(图6B)。
2.4.3 生长动态比较 在发酵培养基中比较了野生型菌株PHODG36 和诱变菌株BBW-11 的生长动态,结果 (图7) 表明:在所有取样阶段,两个菌株均生长旺盛,生长速率没有明显区别,8 h 后进入对数生长期,24 h 时菌体浓度达到最大值且无显著性差异。2.4.4 抑菌作用比较 采用平板对峙法[20]比较了野生型菌株PHODG36 和诱变菌株BBW-11 的抑菌作用。结果 (图8) 表明:两个菌株对立枯丝核菌的抑菌率分别为81.3%和80.9%,无显著性差异;对大丽轮枝菌的抑菌率分别为86.7%和87.5%,也无显著性差异。
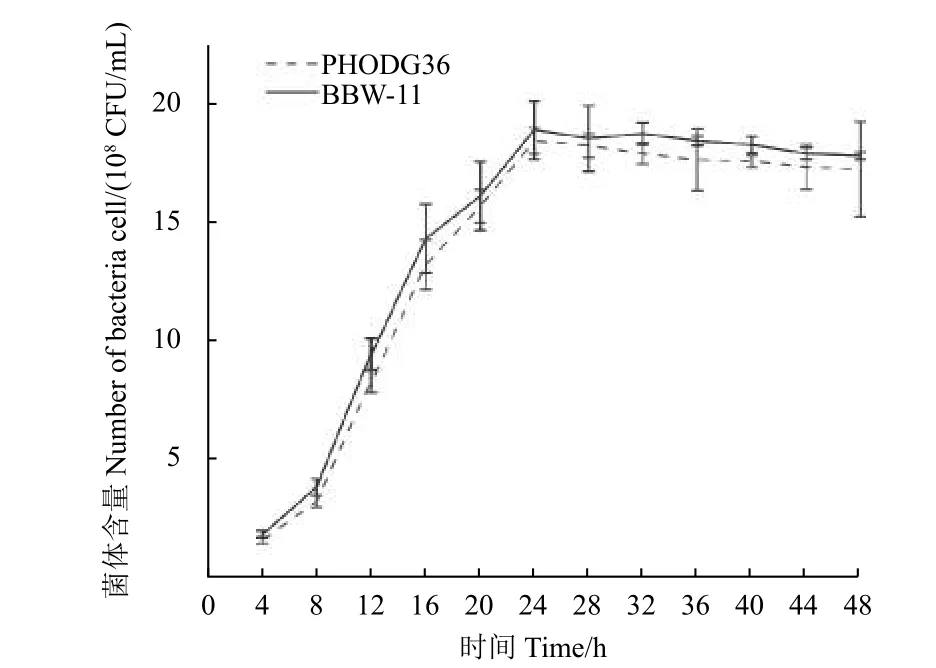
图7 野生型菌株PHODG36 与诱变菌株BBW-11 的生长动态曲线Fig.7 Comparison of the growth curves between wildtype strain PHODG36 and mutant isolate BBW-11

图8 野生型菌株PHODG36 与诱变菌株BBW-11 的抑菌作用比较Fig.8 Comparison of antifungal activities between wildtype strain PHODG36 and mutant isolate BBW-11
2.5 芽胞热保护剂种类、用量及处理条件的筛选
以BBW-11 菌株的芽胞存活率为指标,对保护剂的种类、用量、处理温度及时间进行了筛选。正交试验结果表明,各因素水平组合间芽胞存活率差异较大。直观分析结果表明,处理15(A3B5C2D4) 的芽胞存活率最高,达到4.8%;而正交试验结果分析表明,因素C 处理温度的delta 值最大,说明处理温度对芽胞存活率的影响最大,其次为因素A 保护剂,因素D 处理时间的影响最小 (表3),因此最佳组合应为A1B4C2D5。正交试验结果的方差分析 (表4) 表明,因素C 的P< 0.05,即处理温度对芽胞存活率的影响显著(P= 0.05);因素A 的P< 0.10,即保护剂对芽胞存活率存在一定的影响;因素B 与D 的P>0.10,即保护剂浓度与处理时间对芽胞存活率无显著性影响。因此,综合直观分析与方差分析的结果,再加上成本因素考虑,选择A3B1C2D1 为最佳组合。将A 3 B 5 C 2 D 4、A 1 B 4 C 2 D 5 和A3B1C2D1 这3 个组合进行芽胞耐热性的验证,结果表明,组合A3B5C2D4 的芽胞存活率最高,达到5.0%;组合A3B1C2D1 的芽胞存活率为4.9%,与组合A3B5C2D4 无显著性差异;组合A1B4C2D5 的芽胞存活率最低,为4.5%,与组合A3B1C2D1无显著性差异,但显著低于组合A3B5C2D4。综上,选择A3B1C2D1 为最优组合,即保护剂为蔗糖,浓度为0.5%,处理温度为55 ℃,热处理时间为0.5 h,此时的芽胞存活率比未处理的诱变菌株BBW-11 提高了2.3 倍,比野生型菌株PHODG36 提高了2.8 倍 (图9)。
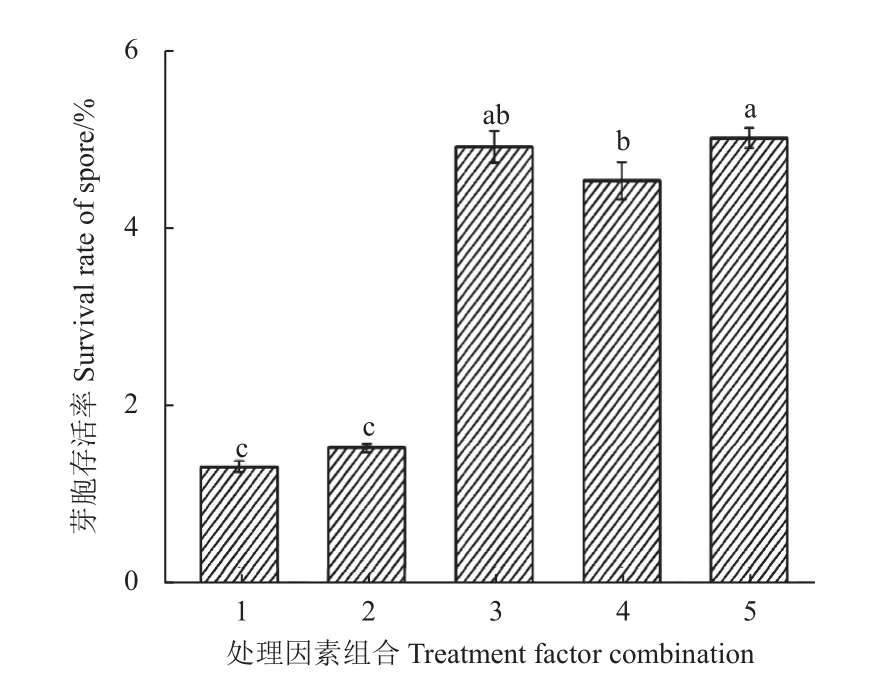
图9 不同处理因子组合对诱变菌株BBW-11芽胞存活率的影响Fig.9 The effects of different treatment factor combinations on the spore survival rate of mutant isolate BBW-11
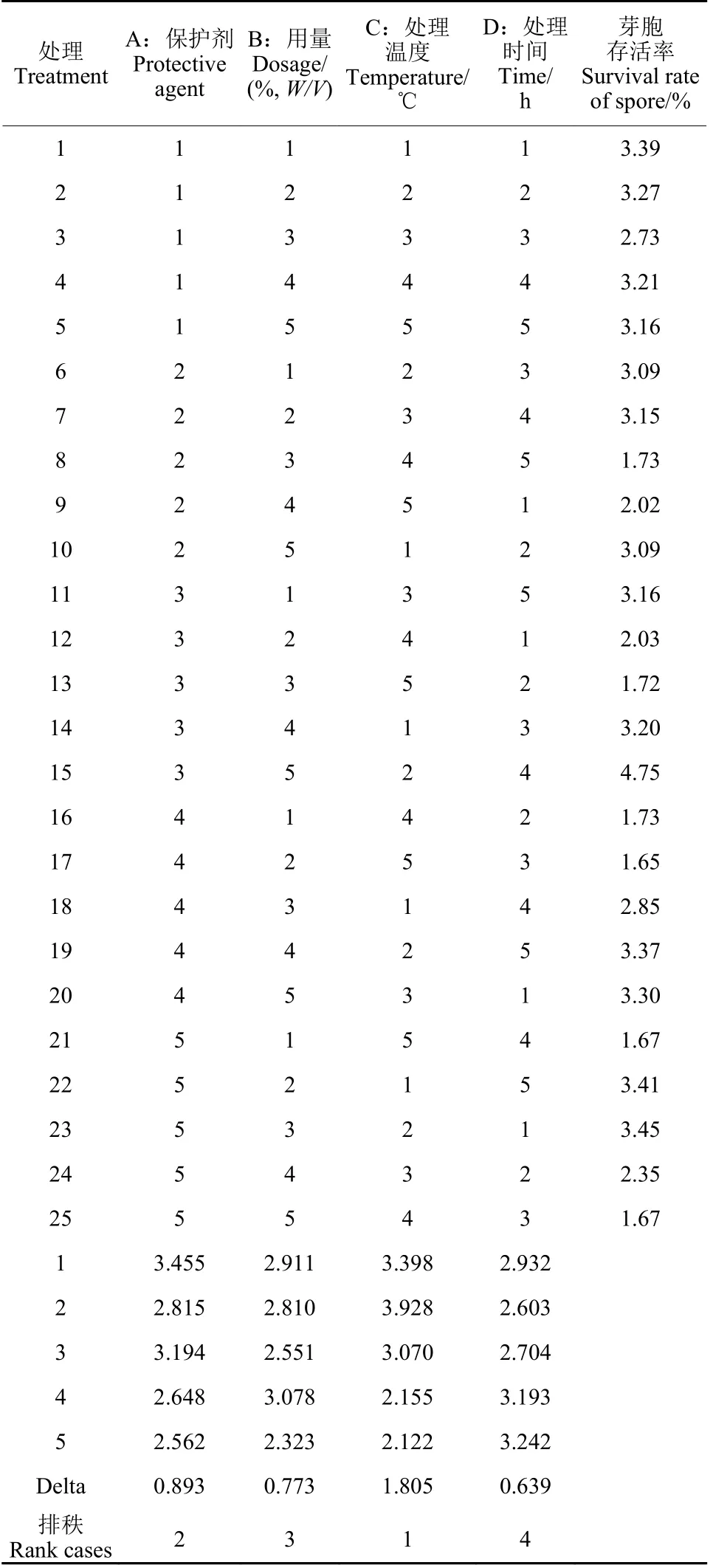
表3 正交试验设计结果Table 3 The results of different treatments in orthogonal experimental design
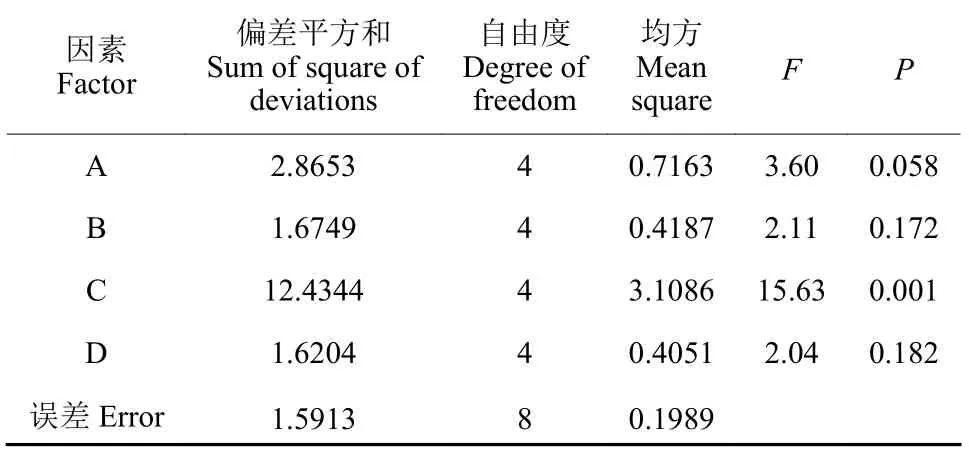
表4 正交试验结果方差分析表Table 4 Analysis of variance of orthogonal design results
3 结论与讨论
目前,芽胞杆菌微生物杀菌剂的粉剂工业化生产仍存在诸多问题,如成本高、货架期短等。其中,干粉原药生产成本高是导致制剂加工成本高的最重要的直接原因。干粉原药生产过程中,作为有效成分的芽胞,由液体悬浮状态经过喷雾干燥或沸腾干燥等干燥过程转化为干粉状态时死亡率过高[5,21],进而造成生产成本高。提高菌株自身的芽胞耐热性是提高芽胞存活率的重要途径。由于微生物自发突变的概率较低,诱变育种技术因具有突变率高、诱变手段简单等优点而广泛应用于高产抗生素或酶的微生物菌株诱变领域[10,22]。但目前尚未见到将温度诱变应用于选育芽胞耐热性提高菌株的研究报道。本研究通过热处理诱变和变温诱变,获得一株芽胞耐热性显著提高的诱变菌株BBW-11,其芽胞存活率相比野生型菌株PHODG36 提高了55.0%,且其在菌落形态、生物膜形成、生长动态和抑菌作用方面的生物学特性未发生明显改变;传代培养的结果表明,诱变菌株BBW-11 的芽胞耐热能力具有较好的遗传稳定性。表明变温诱变是选育芽胞耐热性提高菌株的一条有效途径。
热保护剂的使用是研制高活性微生物杀菌剂制剂的关键[23]。在喷雾干燥前加入载体/保护剂,可以通过形成含水量低的结晶性粉末,达到提高微生物回收率或酶活性的目的[24]。肖怀秋等[12]发现,添加脱脂奶粉 (5%)、海藻糖 (8%) 和蔗糖(5%) 后,枯草芽胞杆菌Prob1822 的菌体存活率均高于80%以上;赵越[25]研究报道,10%和25%的蔗糖均可显著提高嗜热脂肪芽胞杆菌ATCC7953的耐热性。本研究同样筛选出BBW-11 菌株的适宜保护剂为0.5%的蔗糖,经55 ℃热处理0.5 h,此时的芽胞存活率为4.9%,比未处理的诱变菌株BBW-11 提高了2.3 倍,比野生型菌株PHODG36提高了2.8 倍,表明通过保护剂和芽胞悬浮液热储存联合应用是提高芽胞耐热性一条高效措施。糖类通过化学结构中的羟基与细胞膜或蛋白质极性基团形成氢键或水化层,从而保护细胞膜或生物大分子结构的稳定性,达到保护菌体抗热的目的[26]。而本研究中蔗糖对提高芽胞耐热性的作用机制,还需要更深层的研究。还有研究表明,保护剂之间存在协同增效作用。如范娜等[27]选取海藻糖、明胶和甘油作为复合保护剂,对嗜酸乳杆菌和双歧杆菌混合菌体的抗热保护效果较好,菌体存活率可达16.6%,活菌数为1.7 × 108CFU/mL;张雯等[28]研究报道,以明胶、阿拉伯胶和海藻糖作为复合保护剂,枯草芽孢杆菌BS08 微生态制剂的活菌数最高可达6.0 × 1014CFU/g。而本研究仅针对单一保护剂进行了研究,保护剂复配是否具有协同作用还需要进一步研究。
