基于BDNF/TrkB/p-CREB信号通路探讨血府逐瘀胶囊促进神经再生防治卒中后抑郁的作用及机制
2023-10-19樊薛津金博文杨秋怡葛士宁王跃飞庄朋伟张艳军尹清晟张密霞
樊薛津,金博文,杨秋怡,葛士宁,宋 纹,张 营,王跃飞,庄朋伟,张艳军,尹清晟*,张密霞*
基于BDNF/TrkB/p-CREB信号通路探讨血府逐瘀胶囊促进神经再生防治卒中后抑郁的作用及机制
樊薛津1,金博文1,杨秋怡1,葛士宁1,宋 纹2,张 营2,王跃飞1,庄朋伟1,张艳军3, 4,尹清晟1*,张密霞1*
1. 天津中医药大学,天津 301617 2. 天津宏仁堂药业有限公司,天津 301617 3. 天津中医药大学第一附属医院,天津 300381 4. 国家中医针灸临床医学研究中心,天津 300381
探讨血府逐瘀胶囊对卒中后抑郁(post-stroke depression,PSD)大鼠抑郁症状的改善作用,并基于神经再生关键通路脑源性神经营养因子(brain derived neurotrophic factor,BDNF)/酪氨酸激酶受体B(tyrosine kinase receptor,TrkB)/ 磷酸化环腺苷酸应答元件结合蛋白(phosphorylated cAMP response element-binding protein,p-CREB)探讨其机制。采用短暂大脑中动脉梗塞(transient middle cerebral artery occlusion,tMCAO)复合慢性不可预知应激(chronic unpredictable mild stimulation,CUMS)方法复制PSD大鼠模型。大鼠随机分为假手术组、模型组及血府逐瘀低、高剂量(0.43、0.86 g/kg)组和氟西汀(1.8 mg/kg)组,每组18只。连续给予药物干预28 d,利用神经功能评分、糖水偏好实验、旷场实验、强迫游泳实验考察血府逐瘀胶囊对PSD大鼠神经功能损伤以及抑郁症状的改善作用;高效液相色谱-电化学检测法检测额叶皮质及海马神经递质多巴胺(dopamine,DA)和5-羟色胺(5-hydroxytryptamine,5-HT)含量;免疫荧光染色检测海马5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU)、双皮质素(doublecortin,DCX)和巢蛋白(neuroepithelial stem cell protein,Nestin)表达评价神经再生情况;Western blotting检测海马BDNF/TrkB/p-CREB蛋白表达。与假手术组比较,模型组大鼠神经功能评分显著提高(<0.001),糖水偏好率显著下降(<0.05),强迫游泳不动时间显著增长(<0.05);前额叶皮质、海马组织DA以及海马组织5-TH含量明显减少(<0.05);BrdU、DCX阳性细胞数量明显降低(<0.05、0.01),Nestin阳性细胞数量减少;海马BDNF、TrkB、p-CREB表达显著降低(<0.05、0.01)。与模型组比较,血府逐瘀胶囊组神经功能评分显著降低(<0.01),糖水偏好率明显升高(<0.05),强迫游泳的不动时间明显减少(<0.05、0.01);前额叶皮质和海马DA、5-TH含量均显著增加(<0.05、0.01);BrdU、Nestin、DCX阳性细胞数量明显增加(<0.05、0.01);海马BDNF表达有增加的趋势,TrkB、p-CREB表达均明显增加(<0.05)。血府逐瘀胶囊可通过BDNF/TrkB/p-CREB通路促进神经再生进而发挥治疗PSD作用。
血府逐瘀胶囊;卒中后抑郁;神经递质;神经再生;BDNF/TrkB/p-CREB信号通路
卒中后抑郁(post-stroke depression,PSD)是脑血管疾病发生后较常见的精神障碍类并发症。研究表明有近30%的患者会在卒中后5年内出现抑郁症症状[1],严重影响患者生活质量且给社会带来了沉重经济负担。目前基于单胺递质学说的抗抑郁药是PSD一线治疗药物,但长期服用会诱发较为严重的安全性问题[2]。中医认为PSD属“郁证”范畴,病机为素体不足、气滞血瘀,治法以活血化瘀、行气止痛为主。血府逐瘀缘起于王清任的《医林改错》,具有活血化瘀、行气止痛之功效。大量临床研究表明血府逐瘀胶囊具有缓解PSD患者临床抑郁症状、改善患者生活质量的作用[3-4],但具体机制仍需探索。
神经再生障碍是抑郁症的重要病理特征,促神经再生可减轻焦虑和抑郁样行为。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是一类重要的神经营养因子,在调控神经元增殖、分化、成熟及促神经元再生方面发挥重要作用,是目前抑郁症研究的核心因子[5]。BDNF表达受到包括环磷酸腺苷(cyclic adenosine monophosphate,cAMP)反应元件结合蛋白(cAMP response element binding protein,CREB)在内的多种信号调控,且其活性需与酪氨酸激酶受体B(tyrosine kinase receptor,TrkB)受体结合[6-7],BDNF/TrkB信号传导的激活导致CREB的磷酸化。因此,本研究重点基于BDNF/TrkB/p-CREB信号介导的神经再生考察血府逐瘀胶囊改善PSD作用机制,以期为血府逐瘀方临床应用提供实验依据。
1 材料
1.1 动物
SPF级雄性Wistar大鼠90只,体质量270~300 g,购自北京维通利华生物科技有限公司,许可证号SCXK(京)2016-0006。动物饲养室调节灯光12 h昼夜交替,温度(24±2)℃,相对湿度(35±5)%,自由进食饮水。动物实验经天津中医药大学实验动物伦理委员会批准(批准号TCM-LAEC2021271)。
1.2 药品与试剂
血府逐瘀胶囊(0.4 g/粒,批号BL03223)由天津宏仁堂药业有限公司提供;氟西汀(批号H20073985)购自山西仟源医药集团股份有限公司;多巴胺(dopamine,DA,批号D9520)、5-羟色胺(5-hydroxytryptamine,5-HT,批号SA5230)、尼氏染色试剂盒(甲基紫法,批号G1432)、DAPI(批号C0065)、抗荧光淬灭封片剂(批号S2110)、苏木素-伊红(HE)染色试剂盒(批号G1120)、驴血清(批号SL050)均购自北京Solarbio公司;巢蛋白(neuroepithelial stem cell protein,Nestin)抗体(批号bs-8203R)、双皮质素(doublecortin,DCX)抗体(批号bs-20797R)购自北京博奥森生物技术有限公司;5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU)抗体(批号AB6326)、Alexa Fluor 488标记驴抗小鼠二抗(批号ab150105)、Alexa Fluor 647标记驴抗兔二抗(批号ab150075)购自英国Abcam公司;β-actin抗体(批号AP0060)购自Bioworld公司;BDNF抗体(批号PB9075)、TrkB抗体(批号PB0475)均购自武汉博士德生物有限公司;p-CREB抗体(批号AP0019)购自武汉爱博泰克生物科技有限公司;羊抗兔二抗(批号A0208)购自上海碧云天生物技术有限公司。
1.3 仪器
R500型通用型小动物麻醉机(深圳市瑞沃德生命科技有限公司);Agilent 1260 Infinity II型高效液相色谱仪(美国Agilent公司);DM750型倒置荧光显微镜(德国Leica公司);Spark酶标仪(瑞士Tecan公司)。
2 方法
2.1 PSD模型的复制
采用短暂大脑中动脉梗塞(transient middle cerebral artery occlusion,tMCAO)联合慢性不可预见温和应激法(chronic unpredictable mild stimulation,CUMS)进行造模[8-13]。大鼠经异氟烷麻醉后,分离颈部肌肉,暴露血管,分离右侧颈总动脉、颈内动脉和颈外动脉。从右侧颈内动脉插入线栓向前推进至大脑中动脉,插入线栓60 min后,缓慢拔除线栓,恢复供血。假手术组仅做颈外动脉结扎处理。术后第8天应激开始,28 d内随机接受7种不同的应激方式:①24 h内大鼠禁食;②24 h内大鼠禁水;③昼夜颠倒;④潮湿垫料;⑤水平摇晃;⑥45°斜笼24 h;⑦4 ℃冰水游泳。每日1种,每1种出现4次且每种刺激不重复出现[14]。
2.2 动物分组和给药
将大鼠随机分为假手术组、模型组及血府逐瘀低、高剂量(0.43、0.86 g/kg,分别相当于1、2倍临床等效剂量)组和氟西汀(1.8 mg/kg)组,每组18只。术后第8天开始应激并ig药物,假手术组和模型组ig等体积蒸馏水,1次/d,连续28 d。术后经神经功能缺损评分进行重新分组,最后选取每组15只进行后续的实验验证。在tMCAO复合CUMS造模以及药物治疗过程中,共有9只大鼠死亡。
2.3 神经功能评分
于大鼠应激第28天,采用Longa神经功能评分[15]评定大鼠神经功能缺损。
2.4 行为学检测
于大鼠开始应激后第29天,进行糖水偏好实验、旷场实验、强迫游泳实验。
2.4.1 糖水偏好实验 各组大鼠在应激后第29天进行糖水偏好实验[16],并计算糖水偏好率。
糖水偏好率=糖水消耗量/(纯水消耗量+糖水消耗量)
2.4.2 旷场实验 旷场实验采用开口的观察盒(100 cm×100 cm×40 cm)并用与大鼠毛色相反的颜色覆盖满内壁,将底部分为25等份的方块。把大鼠置于观察盒底的中央部分(50 cm×50 cm)适应1 min,然后开始测试,用摄像机记录5 min内总距离和直立次数[17]。
2.4.3 强迫游泳实验 强迫游泳实验通过圆柱形透明Pyrex游泳筒完成,筒高40 cm,筒底部直径20 cm,水深30 cm,水温23~25 ℃,记录6 min内大鼠静止不动行为的时间评价大鼠的绝望行为[16,18]。
2.5 HPLC检测大鼠前额叶皮质及海马DA和5-HT含量
2.5.1 样品制备 将各组大鼠麻醉,心脏灌流后,迅速断头取脑,放置在冰盒上,迅速剥离出脑组织,剥离出前额叶皮层、海马。组织称定质量后,以10 μL/mg比例加入0.1 mol/L高氯酸溶液,4 ℃、14 000 r/min离心20 min,取上清液,置于冰上备用。
2.5.2 对照品溶液的制备 精密称取10 mg DA和10 mg 5-HT,分别添加高氯酸定容至10 mL,过0.22 μm微孔滤膜,取滤液备用。
2.5.3 色谱条件 Waters 反相C18色谱柱(150 mm×4.5 mm,5 μm);流动相为10%乙腈-90%缓冲盐溶液(含醋酸钠0.041 mol/L、柠檬酸0.025 mol/L、辛烷磺酸钠0.92 mmol/L、EDTA-2Na 0.001 2 mmol/L);柱温35 ℃;体积流量1 mL/min;进样体积10 μL。
2.5.4 DA和5-HT含量测定 采用标准曲线回归方程及相关系数进行含量计算。
2.6 血府逐瘀胶囊对PSD模型大鼠神经再生的影响
2.6.1 免疫荧光检测新生神经元数量 行为学实验结束后,各组大鼠麻醉后心脏灌流,迅速剥离大脑,4%多聚甲醛室温固定24 h。将标本转入10倍体积的30%蔗糖溶液,4 ℃脱水至组织沉底,OCT包埋,冷冻至OCT完全凝固,使用冷冻切片机切片。取冰冻切片室温放置30 min,柠檬酸盐缓冲液热修复10 min,0.25% Triton X-100通透10 min,10%驴血清孵育30 min,分别滴加一抗BrdU(1∶200)、Nestin(1∶200)、DCX(1∶200),4 ℃孵育过夜,37 ℃复温后,滴加荧光二抗(1∶1000),避光孵育2 h,DAPI孵育5 min,滴加抗荧光淬灭封片剂,盖玻片封片,显微镜下观察,采集图像进行分析。
2.6.2 Western blotting检测海马BDNF、TrkB和p-CREB蛋白表达 取海马组织30 mg,按20∶1的比例加入含有蛋白酶抑制剂的裂解液600 μL,振荡研磨,冰上裂解30 min后,4 ℃、14 000 r/min离心10 min,取上清,BCA法测定样品蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,5%脱脂牛奶封闭2 h,分别加入兔源β-actin(1∶500)、BDNF(1∶1000)、TrkB(1∶1000)以及p-CREB(1∶1000)抗体,4 ℃孵育过夜,加入羊抗兔二抗(1∶1000)室温孵育2 h,TBST洗膜5次,5 min/次。加入ECL化学发光显影液显影后,Image J软件进行结果分析。
2.7 统计学分析
3 结果
3.1 血府逐瘀胶囊对PSD模型大鼠神经功能的影响
如图1所示,在应激28 d后,与假手术组比较,模型组大鼠神经功能评分显著升高(<0.001),提示造模后大鼠存在神经功能损伤;与模型组比较,各给药组大鼠神经功能评分均显著降低(<0.01),表明血府逐瘀胶囊具有改善PSD大鼠神经功能损伤的作用。
3.2 血府逐瘀胶囊对PSD模型大鼠抑郁样症状的影响
为考察血府逐瘀胶囊对PSD大鼠抑郁样症状的改善作用,采用糖水偏好、强迫游泳实验、旷场实验来考察PSD模型大鼠的抑郁状态,糖水偏好率越高,游泳不动时间越短、直立次数越多、总距离越远,则说明大鼠抑郁症状改善。如图2所示,与假手术组比较,模型组大鼠糖水偏好率显著下降(<0.05),游泳不动时间显著增长(<0.05),活动总距离和直立次数有减少趋势,表明动物出现明显抑郁样症状,PSD造模成功;与模型组比较,各给药组大鼠糖水偏好率明显升高(<0.05),游泳不动时间均明显减少(<0.05、0.01),旷场运动总距离均有增加的趋势,但无统计学差异。血府逐瘀胶囊低剂量组大鼠直立次数显著增加(<0.05),血府逐瘀胶囊高剂量组和氟西汀组大鼠直立次数有增加的趋势,但无统计学差异。结果表明血府逐瘀胶囊具有改善PSD大鼠抑郁样症状的作用。

与假手术组比较:*P<0.05 **P<0.01 ***P<0.001;与模型组比较:#P<0.05 ##P<0.01,下图同
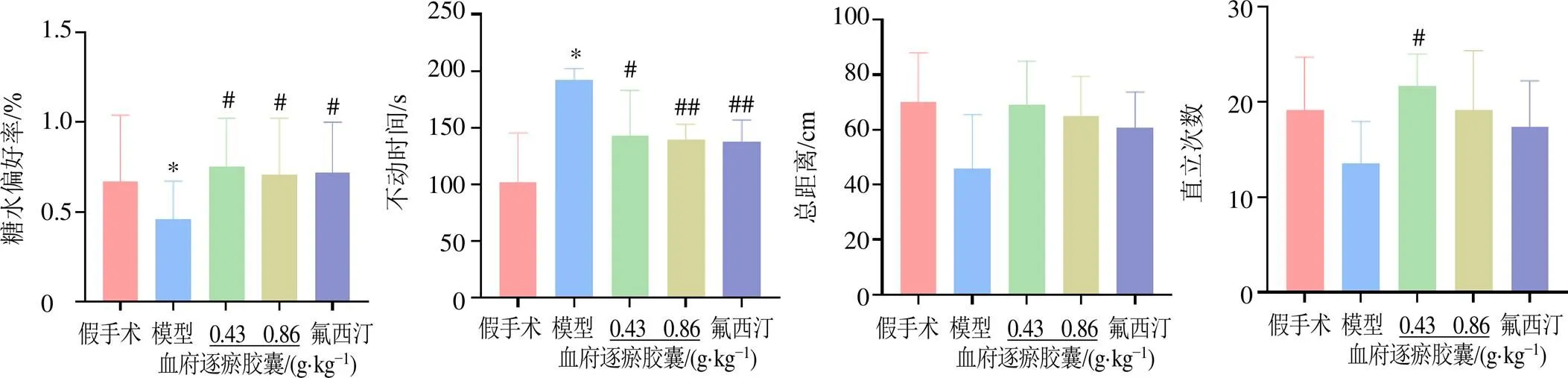
图2 血府逐瘀胶囊对PSD模型大鼠行为学的影响(, n = 15)
3.3 血府逐瘀胶囊对PSD模型大鼠前额叶皮质及海马神经递质含量的影响
脑内单胺类神经递质水平(如DA、5-HT)降低是抑郁症主要病理特征,因此考察了血府逐瘀胶囊对PSD大鼠脑内神经递质的影响。如图3所示,与假手术组比较,模型组大鼠前额叶皮质DA含量和海马DA、5-TH含量均明显降低(<0.05),前额叶皮质5-HT有降低趋势;与模型组比较,血府逐瘀胶囊低剂量组和氟西汀组前额叶皮质DA、5-HT含量均显著增加(<0.05、0.01),血府逐瘀胶囊高剂量组和氟西汀组海马DA含量均显著增加(<0.05),血府逐瘀胶囊低剂量组海马5-HT含量显著增加(<0.05),表明血府逐瘀胶囊具有增加PSD大鼠脑内神经递质含量的作用。
3.4 血府逐瘀胶囊对PSD模型大鼠神经再生的影响
神经再生障碍是抑郁症的重要病理特征,促神经再生可减轻焦虑和抑郁样行为。因此考察了血府逐瘀胶囊对PSD模型大鼠神经再生的影响。如图4所示,与假手术组比较,模型组大鼠海马中DCX、BrdU的阳性细胞数量显著降低(<0.05、0.01),Nestin的阳性细胞数量有减少趋势;与模型组比较,血府逐瘀胶囊低剂量组BrdU、Nestin、DCX阳性细胞数量显著增加(<0.05、0.01),氟西汀组DCX阳性细胞数量显著增加(<0.05),Nestin和BrdU有所增加。结果表明血府逐瘀胶囊能够促进PSD大鼠的海马新生神经元数量增加。

图3 血府逐瘀胶囊对PSD模型大鼠前额叶皮质(A) 及海马(B) 中DA和5-HT含量的影响(, n = 10)
3.5 血府逐瘀胶囊对PSD模型大鼠海马BDNF、TrkB和p-CREB蛋白表达的影响
BDNF的表达受到多种信号通路的调节,BDNF与TrkB受体结合后激活相关信号通路,使CREB磷酸化,从而调节BDNF的表达。如图5所示,与假手术组比较,模型组大鼠海马组织BDNF、TrkB和p-CREB蛋白表达水平均显著降低(<0.05、0.01);与模型组比较,血府逐瘀胶囊低剂量组TrkB、p-CREB蛋白表达水平均显著升高(<0.05),BDNF表达有增加趋势;氟西汀组p-CREB蛋白表达水平显著升高(<0.05),BDNF、TrkB表达有增加趋势。结果表明血府逐瘀胶囊可通过BDNF/ TrkB/p-CREB通路对PSD大鼠起到治疗作用。

图5 血府逐瘀胶囊对PSD模型大鼠海马组织BDNF、TrkB和p-CREB蛋白表达的影响(, n = 3)
4 讨论
PSD是一种高发的卒中相关情绪障碍,症状包括情绪低落、快感缺乏、精力丧失、注意力下降、精神迟钝、失眠或嗜睡和内疚等。这些情绪障碍对患者卒中后的预后产生负面影响,患者日常活动依赖性增加、认知较差、社交活动延迟、康复效率降低,降低患者生活质量,增加死亡率[19-21]。但抑郁症状在卒中幸存者中较为普遍,这与社会关系、健康程度和受教育程度具有一定相关性[22-23]。PSD对于中医来说可称之为“中风”和“郁症”的合病。血府逐瘀汤方中君药红花善活血、散瘀以止痛,桃仁善破血、行滞而润燥,红花和桃仁相互配合,增强活血化瘀的力量。川芎善行气活血、祛风止痛;赤芍善清热凉血、散瘀止痛、活血化瘀止痛以助君药;牛膝长于祛瘀通脉,引瘀血下行,3药共为臣药。生地黄凉血清热,以除瘀热;枳壳理气宽中疏胸中气滞;当归养血活血润燥,祛瘀生新不伤正;桔梗宣散肺气,以利宽中理气,并载药上行,与枳壳配伍,升降相辅,开胸行气;柴胡疏肝解郁、升举清阳,共为佐药。甘草调和诸药又缓急止痛,其为使药。本方活血行气、祛瘀生新,既解血的瘀滞,又解气的郁结,可作为通治一切血瘀气滞的基础方[24-26],是活血理气的代表方药。血府逐瘀胶囊是经过现代制剂及加工工艺制成的中成药,制剂工艺和药效物质相对明确。
本课题组前期研究也发现血府逐瘀胶囊可以通过改善肠屏障功能而间接发挥脑保护防治PSD的药效作用[27],然而其脑内相关效应机制尚不清楚。本研究首先通过神经功能评分、行为学、神经递质水平等确认了血府逐瘀胶囊防治PSD的药效作用,发现血府逐瘀胶囊明显改善了PSD大鼠的神经功能损伤,提高了PSD大鼠糖水偏好率,提升了其自主活动能力,明显缩短了PSD大鼠的不动时间。“单胺假说”是抑郁症的一个重要假说,它表明DA、5-HT和去甲肾上腺素在抑郁症中起着关键作用[28]。本研究结果表明,PSD大鼠前额叶皮质以及海马中DA和5-HT含量均降低,经过血府逐瘀胶囊治疗后明显地恢复,证明在血府逐瘀胶囊干预后可以增加PSD大鼠中神经递质的含量。
BrdU在神经科学研究中经常被用作新分裂细胞的标志,被认为是鉴定神经再生的“金标准”方法[29]。Nestin是神经上皮干细胞蛋白,Nestin表达细胞经常出现在神经再生区域,并且在神经干细胞的自我更新和存活中具有重要作用[30-31]。DCX是迁移和分化神经元中包含的微管相关蛋白之一,在发育和成熟中枢神经系统的神经元前体中特异性表达,神经元前体细胞的迁移与DCX的表达有关,并且DCX在分化的神经元中表达,表明DCX在神经元可塑性、轴突生长或合成中都起到重要作用。因此,DCX经常被用作新生成神经元而非神经胶质细胞的标志[32-33]。为探究血府逐瘀胶囊在神经再生机制方向的治疗作用,采用免疫荧光检测BrdU、DCX和Nestin的表达,发现相较于PSD大鼠,血府逐瘀胶囊低剂量组以上蛋白表达均有增加,说明血府逐瘀胶囊干预后可增加PSD大鼠海马新生神经元数量,为血府逐瘀胶囊治疗PSD的神经再生机制探究奠定了基础。
BDNF通过影响细胞分化、神经元发育、生长和存活、神经发生、突触发生和突触可塑性,在神经系统发育中起关键作用[34]。研究报道,BDNF水平降低与脑卒中后抑郁样行为增加之间存在很强的相关性,脑卒中人类患者血清BDNF水平降低,因此,BDNF的表达变化在PSD的发生发展中可能起关键作用[35]。从树突释放的成熟BDNF可与特异性受体TrkB结合并激活TrkB受体,在神经元生长、成熟(分化)和维持中起到重要作用[36-37]。CREB是胚胎皮质神经元中BDNF诱导基因表达的重要调节因子,参与调节神经元生长发育、突触可塑性和长期记忆形成,CREB磷酸化激活可抑制细胞凋亡并促进损伤后的细胞分化和修复[38]。CREB在BDNF/TrkB信号传导被激活后被磷酸化,上调BDNF的表达[39]。这是一种目前广泛认可与抑郁和抗抑郁样反应有关的转录因子。BDNF/CREB信号被认为是细胞存活、突触结构等许多神经元生物学过程中的关键信号[40]。本研究通过Western blotting检测海马BDNF、TrkB、p-CREB蛋白的表达,给予血府逐瘀胶囊干预后发现,海马中BDNF、TrkB、p-CREB蛋白的表达相较于模型组大鼠明显升高,表明血府逐瘀胶囊可通过BDNF/TrkB/p-CREB通路发挥对PSD的治疗作用。
综上,本研究证实了血府逐瘀胶囊对PSD的潜在治疗作用。并且发现其可通过BDNF/TrkB/p-CREB通路促进神经再生,进而发挥防治PSD的作用。本研究对血府逐瘀胶囊的现代研究和临床合理用药具有一定参考价值,并为进一步深入探究血府逐瘀胶囊防治PSD的作用机制提供线索。
利益冲突 所有作者均声明不存在利益冲突
[1] Hackett M L, Pickles K. Part I: Frequency of depression after stroke: An updated systematic review and meta-analysis of observational studies [J]., 2014, 9(8): 1017-1025.
[2] Das J, Rajanikant G K. Post stroke depression: The sequelae of cerebral stroke [J]., 2018, 90: 104-114.
[3] 杨华. 血府逐瘀汤加味方对脑卒中后抑郁患者神经评分及睡眠质量的影响 [J]. 现代中西医结合杂志, 2020, 29(28): 3159-3162.
[4] 李岩峰. 血府逐瘀汤联合黛力新治疗缺血性脑卒中后伴抑郁的疗效观察 [J]. 内蒙古中医药, 2020, 39(4): 81-82.
[5] Björkholm C, Monteggia L M. BDNF—A key transducer of antidepressant effects [J]., 2016, 102: 72-79.
[6] Ruan J, Liu L, Shan X,. Anti-depressant effects of oil fromvia PKA-CREB-BDNF signaling [J]., 2019, 39(4): BSR20190141.
[7] Wang C Y, Guo J Y, Guo R J. Effect of XingPiJieYu Decoction on spatial learning and memory and cAMP-PKA-CREB-BDNF pathway in rat model of depression through chronic unpredictable stress [J]., 2017, 17(1): 73.
[8] 罗琳. 从MAPK/ERK信号通路探讨补阳还五汤对卒中后抑郁大鼠海马神经再生的影响 [D]. 长沙: 湖南中医药大学, 2015.
[9] 蔡华. 畅郁逍遥散对脑卒中后抑郁 (PSD) 小鼠作用机理的实验研究 [D]. 武汉: 湖北中医药大学, 2010.
[10] 展淑琴, 高亚亚, 张凌峰, 等. 大鼠大脑中动脉永久性缺血和缺血再灌注模型的比较 [J]. 陕西医学杂志, 2013, 42(6): 643-646.
[11] Sicard K M, Fisher M. Animal models of focal brain ischemia [J]., 2009, 1: 7.
[12] Fluri F, Schuhmann M K, Kleinschnitz C. Animal models of ischemic stroke and their application in clinical research [J]., 2015, 9: 3445-3454.
[13] Chiang T, Messing R O, Chou W H. Mouse model of middle cerebral artery occlusion [J]., 2011(48): 2761.
[14] Qiao H, Li M X, Xu C,. Dendritic spines in depression: What we learned from animal models [J]., 2016, 2016: 8056370.
[15] Mei Z G, Huang Y G, Feng Z T,. Electroacupuncture ameliorates cerebral ischemia/reperfusion injury by suppressing autophagy via the SIRT1-FOXO1 signaling pathway [J]., 2020, 12(13): 13187-13205.
[16] Bogdanova O V, Kanekar S, D'Anci K E,. Factors influencing behavior in the forced swim test [J]., 2013, 118: 227-239.
[17] Katz R J, Roth K A, Carroll B J. Acute and chronic stress effects on open field activity in the rat: Implications for a model of depression [J]., 1981, 5(2): 247-251.
[18] Porsolt R D, Bertin A, Jalfre M. Behavioral despair in mice: A primary screening test for antidepressants [J]., 1977, 229(2): 327-336.
[19] Kim J S. Post-stroke mood and emotional disturbances: Pharmacological therapy based on mechanisms [J]., 2016, 18(3): 244-255.
[20] Babkair L A. Risk factors for poststroke depression: An integrative review [J]., 2017, 49(2): 73-84.
[21] Villa R F, Ferrari F, Moretti A. Post-stroke depression: Mechanisms and pharmacological treatment [J]., 2018, 184: 131-144.
[22] Dong L M, Sánchez B N, Skolarus L E,. Ethnic differences in prevalence of post-stroke depression [J]., 2018, 11(2): e004222.
[23] Santos E B, Rodrigues R A P, Pontes-Neto O M. Prevalence and predictors of post stroke depression among elderly stroke survivors [J]., 2016, 74(8): 621-625.
[24] 孟瑶, 赵丹阳, 隋月皎. 血府逐瘀胶囊治疗冠心病疗效的Meta分析[J]. 药物评价研究, 2021, 44(9): 1990-1997.
[25] 杨丽丽. 血府逐瘀汤治疗头痛临床体会 [J]. 光明中医, 2022, 37(4): 693-695.
[26] 王璐瑶, 张亚平, 穆琦瑄, 等. 基于超分子传感技术研究血府逐瘀汤对三甲胺结肠吸收的影响[J]. 中草药, 2022, 53(6): 1783-1789.
[27] 郑舒, 金博文, 李东娜, 等. 基于肠屏障功能探讨血府逐瘀胶囊防治卒中后抑郁作用研究 [J]. 中南药学, 2022, 20(12): 2823-2830.
[28] Gu S M, He Z M, Xu Q Y,. The relationship between 5-hydroxytryptamine and its metabolite changes with post-stroke depression [J]., 2022, 13: 871754.
[29] Cooperrider J, Chan H H, Gale J T,. BrdU-induced hyperlocomotion in the stroked rat [J]., 2019, 703: 96-98.
[30] Park D, Xiang A P, Mao F F,. Nestin is required for the proper self-renewal of neural stem cells [J]., 2010, 28(12): 2162-2171.
[31] Bernal A, Arranz L. Nestin-expressing progenitor cells: Function, identity and therapeutic implications [J]., 2018, 75(12): 2177-2195.
[32] Hwang I K, Yoo K Y, Li H,. Differences in doublecortin immunoreactivity and protein levels in the hippocampal dentate gyrus between adult and aged dogs [J]., 2007, 32(9): 1604-1609.
[33] Hwang I K, Yoon Y S, Choi J H,. Doublecortin- immunoreactive neuronal precursors in the dentate gyrus of spontaneously hypertensive rats at various age stages: Comparison with Sprague-Dawley rats [J]., 2008, 70(4): 373-377.
[34] Palasz E, Wysocka A, Gasiorowska A,. BDNF as a promising therapeutic agent in Parkinson’s disease [J]., 2020, 21(3): 1170.
[35] Shan D, Zheng Y D, Froud K. Brain-derived neurotrophic factor as a clinical biomarker in predicting the development of post-stroke depression: A review of evidence [J]., 2021, 13(6): e15662.
[36] Zhang E, Liao P. Brain-derived neurotrophic factor and post-stroke depression [J]., 2020, 98(3): 537-548.
[37] Chen F, Zhou C C, Yang Y,. GM1 ameliorates lead-induced cognitive deficits and brain damage through activating the SIRT1/CREB/BDNF pathway in the developing male rat hippocampus [J]., 2019, 190(2): 425-436.
[38] Li Y Z, Wu Z Y, Zhu B Q,. The BDNF-TrkB-CREB signalling pathway is involved in bisphenol S-induced neurotoxicity in male mice by regulating methylation [J]., 2022, 10(8): 413.
[39] Liu S, Li X H, Gao J M,. Icariside II, a phosphodiesterase-5 inhibitor, attenuates beta-amyloid- induced cognitive deficits via BDNF/TrkB/CREB signaling [J]., 2018, 49(3): 985.
[40] Xue W, Wang W, Gong T,. PKA-CREB-BDNF signaling regulated long lasting antidepressant activities of Yueju but not ketamine [J]., 2016, 6: 26331.
Effect and mechanism of Xuefu Zhuyu Capsule on promoting nerve regeneration and preventing post-stroke depression based on BDNF/TrkB/p-CREB signaling pathway
FAN Xue-jin1, JIN Bo-wen1, YANG Qiu-yi1, GE Shi-ning1, SONG Wen2, ZHANG Ying2, WANG Yue-fei1, ZHUANG Peng-wei1, ZHANG Yan-jun3, 4, YIN Qing-sheng1, ZHANG Mi-xia1
1. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2. Tinjin Hong Ren Tang Pharmaceutical Co., Ltd., Tianjin 301617, China 3. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China 4. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China
To explore the improvement effect of Xuefu Zhuyu Capsule (血府逐瘀胶囊) on depression symptoms in post-stroke depression (PSD) rats, and explore its mechanism based on the key pathway of neural regeneration [brain derived neurotrophic factor (BDNF)/tyrosine kinase receptor B (TrkB)/phosphorylated cAMP response element binding protein (p-CREB)].The rats model of PSD was established by transient middle cerebral artery occlusion (tMCAO) and chronic unpredictable mild stimulation (CUMS). Rats were randomly divided into sham group, model group, Xuefu Zhuyu Capsule low-and high-dose (0.43, 0.86 g/kg) groups and fluoxetine (1.8 mg/kg) group, with 18 rats in each group. Continuous medication intervention was given for 28 d, and the improvement effect of Xuefu Zhuyu Capsule on neurological function damage and depressive symptoms in PSD rats was investigated by neurological function scores, sugar preference experiments, open field experiments and forced swimming experiments; High performance liquid chromatography-electrochemical detection method was used to detect the contents of neurotransmitters dopamine (DA) and 5-hydroxytryptamine (5-HT) in frontal cortex and hippocampus; Immunofluorescence staining was used to detect the expressions of 5-bromo-2-deoxyuridine (BrdU), doublecortin (DCX) and neuroepithelial stem cell protein (Nestin) in hippocampus to evaluate nerve regeneration; Western blotting was used to detect the expressions of BDNF/TrkB/p-CREB protein.Compared with sham group, neurological deficit score of rats in model group was significantly increased (< 0.001), the sugar water preference rate was significantly decreased (< 0.05), and duration of forced swimming immobility was significantly increased (< 0.05). The levels of DA in prefrontal cortex and hippocampus and 5-TH in hippocampus were significantly reduced (< 0.05). The number of BrdU and DCX positive cells were significantly decreased (< 0.05, 0.01), while the number of Nestin positive cells was decreased. The expressions of BDNF, TrkB and p-CREB in hippocampus were significantly reduced (< 0.05, 0.01). Compared with model group, neurological deficit score in Xuefu Zhuyu Capsule group was significantly reduced (< 0.01), the sugar water preference rate was significantly increased (< 0.05), and the immobility time of forced swimming was significantly reduced (< 0.05, 0.01). The levels of DA and 5-HT in prefrontal cortex and hippocampus were significantly increased (< 0.05, 0.01). The number of BrdU, Nestin and DCX positive cells were significantly increased (< 0.05, 0.01). The expression of BDNF in hippocampus showed an increasing trend, and the expressions of TrkB and p-CREB were significantly increased (< 0.05).Xuefu Zhuyu Capsule can promote nerve regeneration through BDNF/TrkB/p-CREB pathway and thus exert therapeutic effects on PSD.
Xuefu Zhuyu Capsule; post-stroke depression; neurotransmitter; neuronal regeneration; BDNF/TrkB/p-CREB signaling pathway
R285.5
A
0253 - 2670(2023)20 - 6704 - 08
10.7501/j.issn.0253-2670.2023.20.014
2023-06-19
国家自然科学基金资助项目(81873192)
樊薛津(2000—),女,汉族,硕士研究生,从事中药药理学研究。E-mail: 13302001628@163.com
通信作者:张密霞(1976—),女,汉族,高级实验师,博士,主要从事中药药理学研究。Email: mimimixia@sina.com
尹清晟(1994—),男,汉族,助理研究员,博士,主要从事中药药理学研究。Email: carrysable@163.com
[责任编辑 李亚楠]
