环状RNA circ-FOXM1降低克唑替尼对肺癌细胞抑制效果的作用机制研究
2023-10-18夏延贞霍寅萍王龙珍商雄跃
夏延贞, 霍寅萍, 王龙珍, 商雄跃
肺癌是全球最常见的癌症类型和癌症死亡原因[1-2],世界卫生组织估计全球的肺癌死亡率仍将继续升高[3]。目前,手术切除配合放化疗是肺癌主要的治疗方法,但患者预后仍不理想[4]。克唑替尼是一种多靶点蛋白激酶抑制剂,其可作用于间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、c-ros原癌基因1受体酪氨酸激酶(c-ros oncogene 1 receptor tyrosine kinase,ROS1)、肝细胞生长因子受体(hepatocyte growth factor receptor,c-Met)等位点,对肺癌具有显著的临床疗效[5],但患者容易产生获得性耐药,限制了克唑替尼的应用[6]。寻求增强克唑替尼抑癌效果的方法有利于肺癌的治疗。环状RNA(circular ribonucleic acid,circRNA)是一种具有共价闭合环状结构的非编码RNA,参与包括癌症在内的多种病理过程,对肺癌的发生、发展以及化疗耐药起着重要的调控作用[7-8]。有研究表明circ-FOXM1可促进肺癌的增殖、迁移和侵袭[9]。克唑替尼可通过抑制磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路而抑制肺癌细胞侵袭[10]。本研究旨在探讨过表达和沉默circ-FOXM1是否可改变克唑替尼对肺癌细胞的抑制效果,以及PI3K/AKT信号通路在其中的作用机制,为克唑替尼耐药肺癌的治疗提供参考。
1 材料与方法
1.1细胞、主要试剂与仪器 人正常肺上皮细胞株BEAS-2B、肺癌细胞株H2228均购自美国ATCC细胞库。DMEM培养基、胎牛血清购自美国Gibico公司。克唑替尼购自美国Sigma-Aldrich公司。四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、RIPA裂解液均购自上海碧云天生物技术有限公司。circ-FOXM1过表达质粒(pcDNA3.1-circ-FOXM1)及阴性对照质粒(pcDNA3.1)、circ-FOXM1小干扰RNA(si-circ-FOXM1)及乱序无意义阴性对照(si-NC)、circ-FOXM1、GAPDH引物均购自上海吉康生物科技有限公司。LipofectamineTM2000、Trizol试剂和RNA反转录试剂盒购自美国Invitrogen公司。Annexin V/PI凋亡检测试剂盒购自美国BD公司。鼠抗人单克隆抗体磷酸化的磷脂酰肌醇3激酶(phosphorylated phosphatidylinositol 3 kinase,p-PI3K)、PI3K、磷酸化的蛋白激酶B(phosphorylated protein kinase B,p-AKT)、AKT均购自美国Santa Cruz公司。Epoch全波长酶标仪购自美国Bio-Tek公司。CytomicsTMFC 500流式细胞仪购自美国贝克曼库尔特公司。Transwell小室,规格:24孔,孔径8 μm,购自美国康宁公司。CX-43光学显微镜购自日本奥林巴斯公司。
1.2细胞培养及克唑替尼耐药肺癌细胞的构建 H2228细胞培养于含10%胎牛血清的DMEM培养基,培养箱条件设置为37 ℃、5% CO2。构建克唑替尼耐药肺癌细胞时,在培养基内添加终浓度为5 nmol/L的克唑替尼,当H2228细胞稳定生长时将克唑替尼的浓度加倍,重复此步骤,历时8个月。MTT实验检测克唑替尼对H2228细胞的半抑制浓度(half maximal inhibitory concentration,IC50)的变化,计算H2228细胞的耐药指数(resistance index,RI)。IC50指对细胞增殖的抑制效果达到细胞正常增殖水平50%时的药物浓度。RI=耐药细胞IC50/亲本细胞IC50。RI的分级:<5为低度耐药;5~15为中度耐药;>15为高度耐药。本研究构建的克唑替尼耐药肺癌细胞达到中度耐药,记为H2228/CR细胞。
1.3细胞分组及干预处理 将H2228细胞随机分为过表达组和过表达对照组。将H2228/CR细胞随机分为沉默组和沉默对照组。参照LipofectamineTM2000试剂盒说明书分别将circ-FOXM1过表达质粒、阴性对照质粒、circ-FOXM1小干扰RNA、乱序无意义阴性对照转染进过表达组、过表达对照组、沉默组、沉默对照组细胞。采用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)法检测转染效果。转染成功后过表达对照组和过表达组细胞用187.56 nmol/L的克唑替尼处理。另将克唑替尼换为等量DMSO处理过表达对照组和过表达组细胞作为对照。沉默对照组和沉默组细胞用400 nmol/L的克唑替尼处理。另将克唑替尼换为等量DMSO处理沉默对照组和沉默组细胞作为对照。在细胞培养箱(37 ℃、5% CO2)中培养24 h后收集各组细胞,检测相关指标。
1.4qRT-PCR法检测circ-FOXM1表达 用Trizol法提取细胞总RNA,应用反转录试剂盒将其反转录为cDNA,并以cDNA为模板进行qRT-PCR。引物序列见表1。实验条件:95 ℃ 5 min,95 ℃ 10 s,58 ℃ 30 s,72 ℃ 30 s,总共40个循环。以GAPDH为内参,通过2-△△Ct法计算circ-FOXM1的相对表达量。重复6次独立实验。
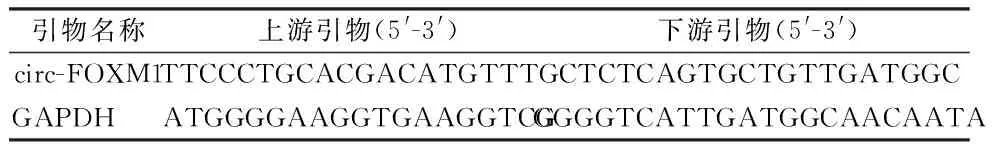
表1 circ-FOXM1和GAPDH的引物序列
1.5MTT法检测细胞存活率 将细胞分别以5×103cells/孔接种至96孔板,每组设置6个复孔。应用不同浓度(0、50、100、200、400、800、1 600 nmol/L)的克唑替尼处理,细胞培养箱中继续培养24 h后加入10 μl MTT试剂,孵育4 h,弃上清,加入150 μl DMSO重悬后用酶标仪检测490 nm处的吸光度值(OD值)。计算细胞存活率与克唑替尼的IC50。细胞存活率=[(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)]×100%。
1.6流式细胞术检测细胞凋亡率 按Annexin V/PI凋亡检测试剂盒说明书进行细胞凋亡检测。收集培养24 h后的各组细胞。4 ℃、1 000 r/min离心10 min,弃上清。加入1×Binding Buffer重悬细胞,调整细胞密度至1×106cells/ml。取100 μl细胞悬液,加入5 μl Annexin V-FITC、5 μl PI,混匀后室温避光孵育15 min。加入400 μl 1×Binding Buffer,1 h内上机检测凋亡率。重复6次独立实验。
1.7Transwell法检测细胞迁移水平 在Transwell小室上室加入无胎牛血清的DMEM培养基,下室加入含10%胎牛血清的DMEM培养基。将各组细胞培养于上室。培养24 h后除去小室上表面未穿过室膜的细胞,予无水甲醇固定,1%结晶紫染色,显微镜观察细胞迁移情况,随机选取5个视野进行计数并拍照。重复6次独立实验。
1.8Western blot法检测细胞p-PI3K、PI3K、p-AKT、AKT蛋白表达水平 收集培养24 h后的各组细胞,应用RIPA裂解液提取总蛋白,SDS-PAGE电泳分离蛋白,转膜、封闭处理后加入p-PI3K、PI3K、p-AKT、AKT蛋白的一抗稀释液(1∶1 000),4 ℃孵育过夜,加入HRP标记的二抗稀释液(1∶5 000),室温孵育2 h,磷酸缓冲盐溶液洗膜,加入ECL试剂,暗室曝光显影。以GAPDH为内参,应用Quantity One软件分析目标蛋白的相对表达量。重复6次独立实验。
2 结果
2.1克唑替尼耐药肺癌细胞H2228/CR的构建结果 MTT实验结果显示,随着克唑替尼浓度的增加,H2228和H2228/CR细胞的存活率逐渐降低,克唑替尼对H2228细胞和H2228/CR细胞的IC50分别为(195.24±16.89)nmol/L、(1546.83±125.73)nmol/L,克唑替尼对H2228/CR细胞的IC50显著高于H2228细胞(t=26.097,P<0.001)。RI=7.90±0.63,符合耐药株的要求。见图1。
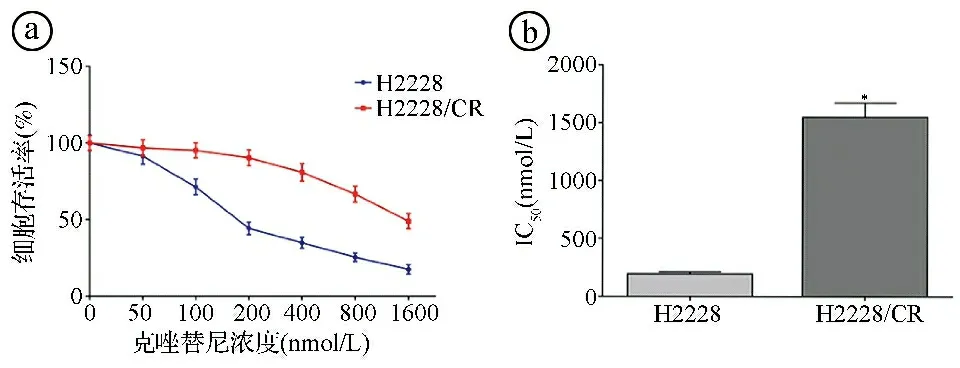
ⓐMTT法检测不同浓度克唑替尼对H2228和H2228/CR细胞存活率的影响;ⓑ克唑替尼对H2228和H2228/CR细胞的IC50比较;*P<0.05图1 克唑替尼耐药肺癌细胞H2228/CR构建结果图
2.2circ-FOXM1在BEAS-2B、H2228和H2228/CR细胞中的表达水平比较 qRT-PCR实验结果显示,H2228/CR细胞circ-FOXM1表达水平显著高于BEAS-2B细胞和H2228细胞(P<0.05)。H2228细胞circ-FOXM1表达水平显著高于BEAS-2B细胞(P<0.05)。circ-FOXM1表达水平在三种细胞间比较差异有统计学意义(F=183.232,P<0.001)。见图2。
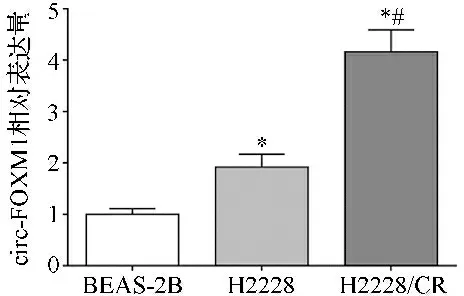
与BEAS-2B比较,*P<0.05;与H2228细胞比较,#P<0.05图2 circ-FOXM1在BEAS-2B、H2228和H2228/CR细胞中的表达水平比较图
2.3过表达和沉默circ-FOXM1的细胞模型的构建结果 qRT-PCR实验结果显示,过表达组H2228细胞circ-FOXM1表达水平显著高于过表达对照组(t=12.253,P<0.001),沉默组H2228/CR细胞circ-FOXM1表达水平显著低于沉默对照组(t=14.858,P<0.001)。结果提示过表达和沉默circ-FOXM1的细胞模型构建成功。见图3。
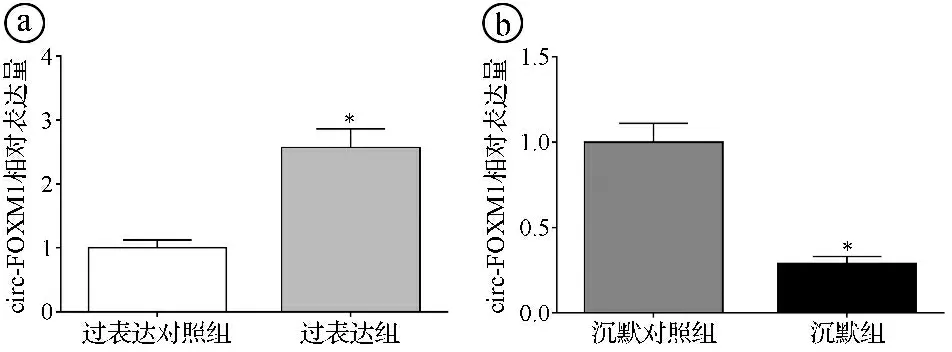
图3 过表达和沉默circ-FOXM1的细胞模型的circ-FOXM1检测结果图(*P<0.05)
2.4circ-FOXM1过表达降低克唑替尼对H2228细胞的抑制效果 MTT实验结果显示,随着克唑替尼浓度的增加,过表达对照组和过表达组H2228细胞存活率逐渐降低,克唑替尼对过表达组的IC50显著高于过表达对照组(t=22.442,P<0.001)。选择过表达对照组H2228细胞的IC50(187.56 nmol/L)用于后续实验。以克唑替尼对过表达对照组和过表达组H2228细胞进行干预处理,结果显示过表达组的凋亡率显著低于过表达对照组(t=11.865,P<0.001),过表达组的细胞迁移数显著高于过表达对照组(t=-6.922,P<0.001)。见图4。
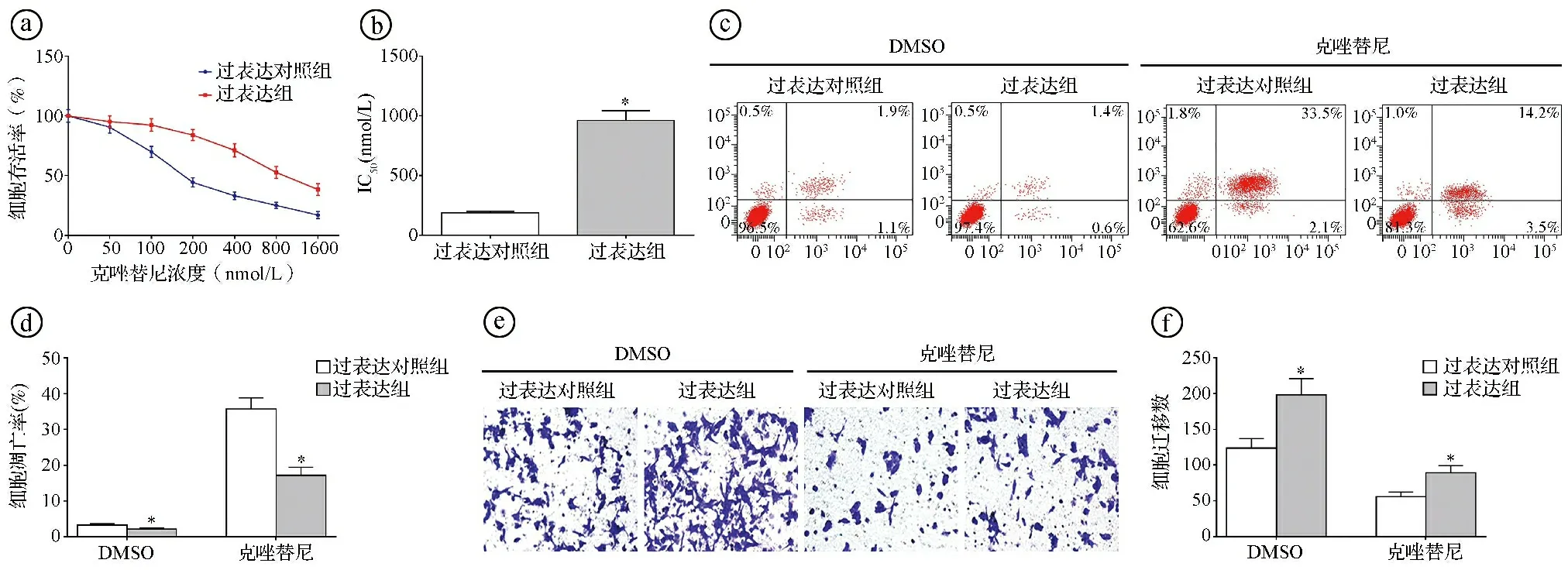
ⓐ不同浓度克唑替尼干预处理后,过表达组及过表达对照组H2228细胞的存活率比较;ⓑ克唑替尼对过表达对照组和过表达组H2228细胞的IC50比较;ⓒⓓ流式细胞术检测187.56 nmol/L克唑替尼干预处理后,过表达对照组和过表达组的细胞凋亡率比较;ⓔⓕTranswell实验检测187.56 nmol/L克唑替尼干预处理后,过表达对照组和过表达组的细胞迁移数比较;*P<0.05图4 circ-FOXM1过表达降低克唑替尼对H2228细胞的抑制效果图
2.5circ-FOXM1过表达对克唑替尼干预的H2228细胞的PI3K/AKT信号通路影响结果 Western blot实验结果显示,经克唑替尼干预处理后,过表达组p-PI3K/PI3K比值、p-AKT/AKT比值均显著高于过表达对照组(t=7.813,P<0.001;t=6.834,P<0.001)。见图5。
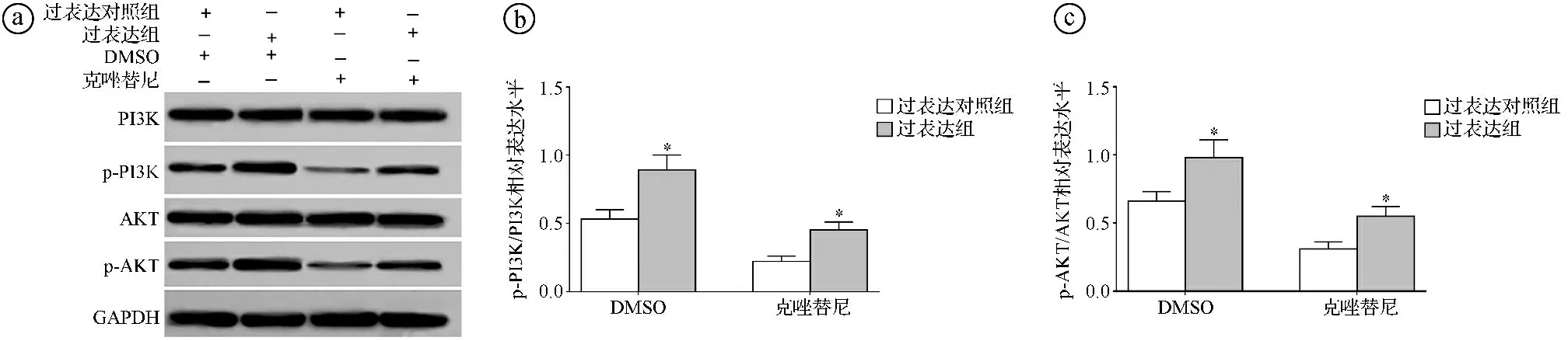
ⓐWestern blot实验结果图;ⓑ两组p-PI3K/PI3K比值比较;ⓒ两组p-AKT/AKT比值比较;*P<0.05图5 circ-FOXM1过表达对克唑替尼干预的H2228细胞的PI3K/AKT信号通路影响结果图
2.6沉默circ-FOXM1增强克唑替尼对H2228/CR细胞的抑制效果 MTT实验显示,随着克唑替尼浓度增加,沉默对照组和沉默组H2228/CR细胞存活率逐渐降低,克唑替尼对沉默组的IC50显著低于沉默对照组(t=20.088,P<0.001)。选择对沉默对照组H2228/CR细胞抑制率较低的克唑替尼浓度(400 nmol/L)用于后续实验。经克唑替尼干预处理后,沉默组的细胞凋亡率显著高于沉默对照组(t=12.353,P<0.001),沉默组的细胞迁移数显著低于沉默对照组(t=7.543,P<0.001)。见图6。
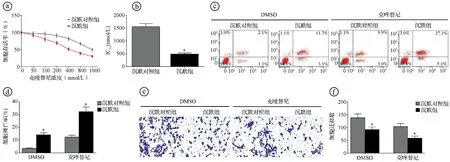
ⓐ不同浓度克唑替尼干预处理后,沉默对照组和沉默组H2228/CR细胞存活率比较;ⓑ克唑替尼对沉默对照组和沉默组H2228/CR细胞的IC50比较;ⓒⓓ流式细胞术检测400 nmol/L克唑替尼干预处理后,沉默对照组和沉默组细胞凋亡率比较;ⓔⓕTranswell实验检测400 nmol/L克唑替尼干预处理后,沉默对照组和沉默组的细胞迁移数比较;*P<0.05图6 抑制circ-FOXM1表达增强克唑替尼对H2228/CR细胞的抑制效果图
2.7抑制circ-FOXM1表达对克唑替尼干预的H2228/CR细胞的PI3K/AKT信号通路影响结果 Western blot实验结果显示,经克唑替尼干预处理后,沉默组的p-PI3K/PI3K比值、p-AKT/AKT比值均显著低于沉默对照组(t=12.247,P<0.001;t=8.542,P<0.001)。见图7。
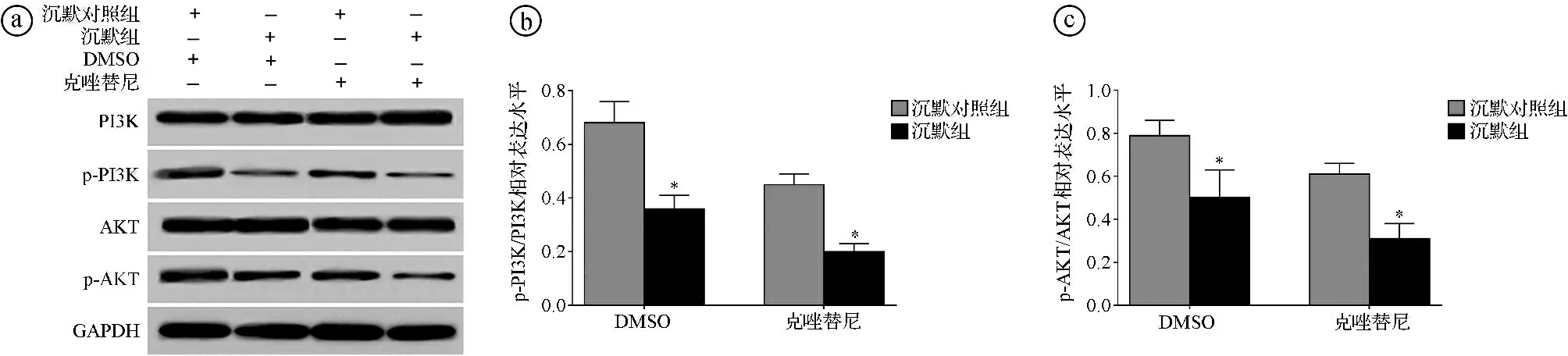
ⓐWestern blot实验结果图;ⓑ两组p-PI3K/PI3K比值比较;ⓒ两组p-AKT/AKT比值比较;*P<0.05图7 抑制circ-FOXM1表达对克唑替尼干预的H2228/CR细胞的PI3K/AKT信号通路影响结果图
3 讨论
3.1克唑替尼是常用的肺癌靶向治疗药物,但由于肺癌容易产生耐药性,导致克唑替尼的抑癌效果降低[11]。本研究发现,用浓度递增的克唑替尼长期处理肺癌细胞后,克唑替尼对肺癌细胞的IC50显著增加,这与相关文献结果一致[12],表明长期使用克唑替尼可使对克唑替尼敏感肺癌细胞H2228转变对克唑替尼耐药的肺癌细胞H2228/CR。探究肺癌对克唑替尼耐药的机制对改善肺癌患者的治疗效果具有重要意义。
3.2circRNA是目前医学研究的热点之一,其可通过调控基因、信号通路、微小RNA参与包括癌症在内的各种病理进程[13]。circRNA也参与癌细胞化疗耐药的调控,癌细胞耐药性的转变与circRNA表达水平的改变密切相关[14]。circ-FOXM1是一种新发现的与癌症有关的circRNA,其定位于chr12:2966846-2983691位点,源自FOXM1基因[15]。circ-FOXM1在肺癌中高表达,可通过调控多种信号通路促进肺癌进展,抑制circ-FOXM1表达则可抑制肺癌细胞的生长。抑制circ-FOXM1表达可通过靶向miR-149-5p调控自噬相关基因5(autophagy-related gene 5,Atg5)表达,从而抑制肺癌细胞增殖、迁移、自噬并诱导细胞凋亡[16]。抑制circ-FOXM1表达可通过调控miR-132-3p/跨膜蛋白14A(transmembrane protein 14A,TMEM14A)轴抑制非小细胞肺癌细胞增殖、迁移、侵袭并诱导细胞凋亡[17]。circ-FOXM1也可能与癌细胞对某些化疗药物耐药性的改变有关。circ-FOXM1可作为miR-1324的分子海绵上调甲基CpG结合蛋白2(methyl-CpG-binding protein 2,MeCP2)表达,促进肝癌细胞对索拉非尼的耐药[18]。本研究发现,circ-FOXM1在肺癌细胞H2228中的表达水平显著高于人正常肺上皮细胞BEAS-2B,且在克唑替尼耐药肺癌细胞H2228/CR中的表达水平显著高于克唑替尼敏感肺癌细胞H2228,提示circ-FOXM1可能与肺癌的克唑替尼耐药有关。
3.3为验证circ-FOXM1表达水平对肺癌细胞克唑替尼耐药性的影响,本研究以克唑替尼敏感肺癌细胞H2228和克唑替尼耐药肺癌细胞H2228/CR为实验对象。结果显示,circ-FOXM1过表达后,克唑替尼对H2228细胞的IC50显著增加,并显著降低克唑替尼干预后H2228细胞的凋亡率,增加细胞迁移数。表明circ-FOXM1过表达可降低克唑替尼对H2228细胞的抑制效果,circ-FOXM1表达水平上升可能是肺癌细胞对克唑替尼由敏感向耐药转变的一个原因。另外,本研究结果还发现,沉默circ-FOXM1后,克唑替尼对H2228/CR细胞的IC50显著降低,沉默circ-FOXM1可显著增加克唑替尼作用下H2228/CR细胞的凋亡率并降低细胞迁移数。表明沉默circ-FOXM1可增加克唑替尼对H2228/CR细胞的抑制效果,circ-FOXM1可能成为提高克唑替尼的抑癌效果的一个靶点。
3.4PI3K/AKT是一条与磷脂酰肌醇有关的信号通路,参与对肿瘤的发生、转移、凋亡、糖酵解等方面的调控,在许多癌症中发挥致癌作用,针对PI3K/AKT信号通路的抑制剂是抗癌药物研究的热点[19]。PI3K/AKT信号通路可通过调控多种耐药基因的表达影响化疗耐药[20]。有研究表明,克唑替尼通过抑制PI3K/AKT信号通路调控相关蛋白表达抑制肺癌细胞增殖、迁移并诱导细胞凋亡[10,21]。本研究结果显示,克唑替尼可降低肺癌细胞H2228和H2228/CR细胞中p-PI3K/PI3K比值、p-AKT/AKT比值,表明克唑替尼可抑制肺癌细胞PI3K/AKT信号通路,这与相关研究结果一致。许多circRNA对癌症进程的调控及对化疗耐药的调控也都涉及PI3K/AKT信号通路。circRNA circ_103809通过激活PI3K/AKT信号通路加速乳腺癌的细胞周期进程并抑制细胞凋亡[22]。circRNA circ_PTN通过miR-542-3p/PIK3R3途径激活PI3K/AKT信号通路,促进胶质母细胞瘤的顺铂耐药[23]。本研究发现,circ-FOXM1过表达可上调克唑替尼干预后H2228细胞的PI3K/AKT信号通路,沉默circ-FOXM1则可下调克唑替尼干预后H2228/CR细胞的PI3K/AKT信号通路,由此推测circ-FOXM1可能通过调控PI3K/AKT信号通路影响克唑替尼对肺癌细胞的抑制效果。
综上所述,circ-FOXM1可降低克唑替尼对肺癌细胞的抑制效果,其机制可能与circ-FOXM1激活PI3K/AKT信号通路有关,但本研究仅进行了细胞实验,相关机制还有待进一步完善。由于化疗耐药的产生是多种基因、信号通路、circRNA等同时进行调控的复杂过程,且一个circRNA可同时调控多种基因、微小RNA、蛋白质、信号通路;反之,circRNA亦可受各种分子的调控,故今后的研究将深入下游机制,并进行动物实验,为减轻克唑替尼耐药提供参考。
