重组大肠杆菌全细胞催化合成NMN
2023-10-17曾伟主石选平黄忠实张天萌张伟平周景文
曾伟主, 石选平, 黄忠实, 张天萌, 张伟平, 周景文*
(1. 江南大学未来食品科学中心,江苏 无锡 214122;2. 江南大学生物工程学院,江苏 无锡 214122;3. 华熙生物科技股份有限公司,山东 济南 250101)
β-烟酰胺单核苷酸(NMN)是人体内一种重要的核苷酸化合物[1]。在细胞内,NMN 主要通过转化生成烟酰胺腺嘌呤二核苷酸 (nicotinamide adenine dinucleotide,NAD+)来发挥其重要的生理功能,包括激活NAD+依赖组蛋白脱乙酰酶(sirtuins)活性、影响细胞存活以及维持细胞氧化还原状态等[2-3]。NAD+在生物新陈代谢、抗衰老,以及治疗帕金森病、阿尔茨海默病、抑郁症、糖尿病和其他衰老相关疾病等方面具有重要作用[4]。 由于其分子大和具有电荷,NAD+很难直接进入细胞,通常需要通过补充其前体来提高NAD+在细胞内的含量, 从而起到抗衰老等作用。 研究表明,口服NMN 能够在体内迅速转化成NAD+,因此被认为是NAD+很好的替代品[5-6]。 近年来,NMN 在医学上的功能受到广泛研究。NMN 在一些天然来源的食物中含量丰富,包括毛豆、西兰花、鳄梨、蘑菇、生牛肉和虾等,同时,NMN 具有较高的食品安全性,未显示出任何明显毒性和副作用[7-8]。随着生活水平的提高和人口老龄化问题的加重,人们对抗衰老类药物的追求愈发强烈,NMN 的市场需求量不断增加[9]。
目前,NMN 的合成方法主要包括化学合成法和生物合成法。 已知的最新化学合成法主要包括两种:一种是以四乙酰核糖和烟酰酸乙酯为原料进行合成,另一种是以氯磷酸二苯酯作为磷酸化试剂进行合成[10]。但由于存在生产效率和产品纯度较低、分离难度大以及生产成本高等问题,化学合成法合成NMN 仍受到一定限制[11]。 因此,过程简单、对环境友好的生物合成法凸显优势。 大肠杆菌(Escherichia coli)作为常用的模式菌株,其生长迅速、基因操作简单,已被广泛应用于合成多种高价值化合物[12-13]。生物合成法合成NMN 也主要将宿主聚焦于大肠杆菌中。Marinescu 等在大肠杆菌中表达来源杜克雷嗜血杆菌(Haemophilus ducreyi)的烟酰胺磷酸核糖基转移酶 (HdNadV), 以烟酰胺为底物合成了15.42 mg/L 的NMN[14]。 Black 等通过过量表达来源于土拉弗朗西斯菌 (Francisella tularensis) 的NMN 合酶(FtNadE) 以及敲除pncC 和nadR 两个基因,将NMN 的产量提高至501 mg/L[15]。 Shoji 等通过筛选高效的烟酰胺磷酸核糖基转移酶(NAMPT)以及两个转运蛋白(NiaP 和PnuC),并构建大肠杆菌全细胞催化体系,以NAM 和葡萄糖为底物合成了6.79 g/L的NMN,转化率为86%[16]。
作者所在研究团队在前期研究过程中,通过在大肠杆菌E. coli BL21(DE3)中敲除与NMN 分解和调控相关的基因nadR、pncC、ushA 和purR,并对比不同来源的 NAMPT, 确定来源于 Vibrio bacteriophage 的效果最佳, 再引入蕈状芽孢杆菌(Bacillus mycoides)的转运蛋白BMpnuC,优化表达各模块基因后, 构建了一株能以NAM 和葡萄糖为底物高产NMN 的工程菌株E.coli BL21(DE3)-NF017,NMN 生成量为16.2 g/L[17]。相比于微生物发酵法,全细胞催化法能够显著降低中间代谢产物的积累,从而利于产物的后期分离提取。 近年来,全细胞催化法被广泛应用于生产一些高价值目标产物。 基于此,作者利用全细胞催化法进行NMN 的合成。 在摇瓶水平上考察了菌株发酵过程所用培养基类型、诱导温度和异丙基-β-D-硫代吡喃半乳糖苷(IPTG)浓度,以及全细胞催化过程的反应体系初始pH、反应温度和底物NAM 与葡萄糖添加比例(质量浓度比)对催化合成NMN 的影响。 在5 L 发酵罐水平上进一步探究了催化过程中溶氧水平和底物NAM 流加方式对合成NMN 的影响。 最终,应用恒定速度流加NAM 的补料方式, 强化了全细胞催化合成NMN,为实现NMN 的工业化生产奠定了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株大肠杆菌Escherichia coli BL21(DE3)-NF017 为作者所在实验室在前期的研究工作中构建,用于合成NMN[17]。
1.1.2 主要试剂 蛋白胨、酵母提取物:Oxoid 公司产品;卡那霉素(Km)、链霉素(Sm)、IPTG:上海生工生物工程有限公司产品; 葡萄糖、 甘油、K2HPO4、KH2PO4、NaCl 等: 上海国药集团产品; 烟酰胺(NAM)、β-烟酰胺单核苷酸(NMN):上海麦克林生化科技有限公司产品。
1.1.3 主要仪器 摇床:上海知楚仪器有限公司产品;5 L 发酵罐:迪必尔生物工程(上海)有限公司产品; 高效液相色谱仪: 美国Agilent 公司产品;BioPhotometer D30 分光光度计、 离心机: 德国Eppendorf 公司产品; 葡萄糖-乳酸生物传感器分析仪:深圳市西尔曼科技有限公司产品。
1.1.4 培养基
1)LB 培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0,固体培养基添加20.0 g/L 的琼脂粉;121 ℃灭菌15 min。
2)TB 培养基(g/L):蛋白胨12.0,酵母提取物24.0,甘油5.0,K2HPO412.5,KH2PO42.3;121 ℃灭菌15 min。
3)摇瓶发酵合成培养基(g/L):葡萄糖20.0,酵母提取物 10.0,KH2PO46.0,K2HPO4·3H2O 1.4,MgSO4·7H2O 1.0, 硫酸铵6.0, 一水合柠檬酸1.1;121 ℃灭菌15 min。
4)5 L 发酵罐发酵合成培养基 (g/L): 葡萄糖10.0, 酵母提取物10.0,KH2PO46.0,K2HPO4·3H2O 1.4, MgSO4·7H2O 1.0, 硫酸铵6.0, 一水合柠檬酸1.1;121 ℃灭菌15 min。
5)补料培养基(g/L):葡萄糖600.0,酵母提取物10.0,MgSO4·7H2O 9.0;121 ℃灭菌15 min。
1.2 实验方法
1.2.1 菌株培养方法
1)种子培养 将保存在-80 ℃冰箱中的菌株取出,在具有卡那霉素和链霉素抗性的固体平板上划线,37 ℃恒温培养箱中培养12 h, 挑取平板上的单菌落转接至装有25 mL 种子培养基(LB 培养基)的250 mL 摇瓶中,37 ℃、200 r/min 培养12 h。
2)摇瓶发酵培养 将活化后的种子液以2%的接种体积分数接种至装有25 mL 发酵培养基的250 mL 摇瓶中,在37 ℃、200 r/min 条件下培养,当OD600nm为0.8~1.0 时, 加入终浓度为0.2 mmol/L 的IPTG 进行诱导,37 ℃、200 r/min 继续培养至16 h。
3)5 L 发酵罐培养 将活化后的种子液以10%的接种体积分数接种至装有120 mL 种子培养基的2 L 摇瓶中,37 ℃、200 r/min 培养12 h。 将二级种子液以4%的接种体积分数接入5 L 发酵罐中, 装液量为3.5 L,初始转速为300 r/min,通气量为1.0 L/(L·min),通过与转速关联控制发酵过程溶氧(DO)水平在30%, 补加体积分数50%的氨水控制过程pH 为7.0,37 ℃下培养至OD600nm为10 ~12 时,加入终浓度为0.2 mmol/L 的IPTG 进行诱导,诱导后补加补料培养基,控制发酵液中葡萄糖质量浓度在2.0 g/L 左右,37 ℃继续培养至18 h。
1.2.2 全细胞催化合成NMN
1)摇瓶水平 将摇瓶上诱导培养后的发酵液在4 ℃、3 500 r/min 条件下离心30 min 收集菌体,重悬于全细胞催化体系中,催化反应体系组成(g/L):Na2HPO46.8、 K2HPO43.0、NH4Cl 1.0、NaCl 0.5、烟酰胺1.0、葡萄糖4.0,最终菌体OD600nm为10。
2)5 L 发酵罐水平 将发酵罐上诱导培养后的发酵液在4 ℃、3 500 r/min 条件下离心30 min 收集菌体,重悬于全细胞催化体系中。 分批催化反应体系组成(g/L):Na2HPO46.8、K2HPO43.0、NH4Cl 1.0、NaCl 0.5、烟酰胺10.0、葡萄糖40.0,最终菌体OD600nm为40; 补料催化反应体系组成(g/L):Na2HPO46.8、K2HPO43.0、NH4Cl 1.0、NaCl 0.5、烟酰胺1.0、葡萄糖4.0,最终菌体OD600nm为40。 全细胞催化过程初始转速为300 r/min, 通气量为0.8 L/(L·min),根据不同策略控制反应过程中溶氧水平以及底物烟酰胺的补加方式。
1.2.3 检测方法
1)菌体浓度检测 用超纯水稀释发酵液至合适倍数, 使用分光光度计在600 nm 波长下测定OD 值。
2)葡萄糖质量浓度检测 利用葡萄糖-乳酸生物传感器分析仪测定发酵液和全细胞催化体系中葡萄糖的质量浓度。
3)NAM、NMN 质量浓度检测 采用高效液相色谱法 (HPLC) 检测全细胞催化反应液中NAM、NMN 的质量浓度。 色谱柱:Hypersil ODS-2 C18色谱柱(4.6 mm×250 mm);检测器:紫外检测器;检测条件:流动相20 mmol/L 乙酸铵和乙腈(体积比95∶5),流量1.0 mL/min,柱温30 ℃,检测波长259 nm。
2 结果与分析
2.1 不同发酵培养基的对比
以菌株E.coli BL21(DE3)-NF017 为出发菌株,充分活化后, 分别在TB 培养基和合成培养基中发酵培养16 h。离心收集菌体,重悬至合成NMN 的全细胞催化体系中,最终OD600nm为10,分别取4 h 和6 h 的反应体系样品检测NMN 的生成量,结果如图1 所示。 由图1(a)可知,诱导培养后,菌株在TB 培养基中的OD600nm为12.45, 在合成培养基中的OD600nm为8.65, 菌株在TB 培养基中的生长情况明显优于其在合成培养基中的生长情况。 然而,将相同OD600nm的湿菌体用于全细胞催化合成NMN,发现利用合成培养基培养得到的菌体更有利于NMN的合成,反应6 h 后,利用合成培养基发酵得到的菌体能够催化合成0.75 g/L 的NMN, 而利用TB 培养基发酵得到的菌体仅能够合成0.39 g/L 的NMN(见图1(b))。 对比合成培养基和TB 培养基的组成,合成培养基成分更加多样,其中的MgSO4·7H2O、一水合柠檬酸等成分可能更有利于NMN 合成过程中相关基因的表达。 另外,对比TB 培养基,合成培养基大大减少了有机氮源的使用, 从而更有利于降低NMN 实际生产中的成本。 因此,选取合成培养基作为后续菌株培养用发酵培养基。
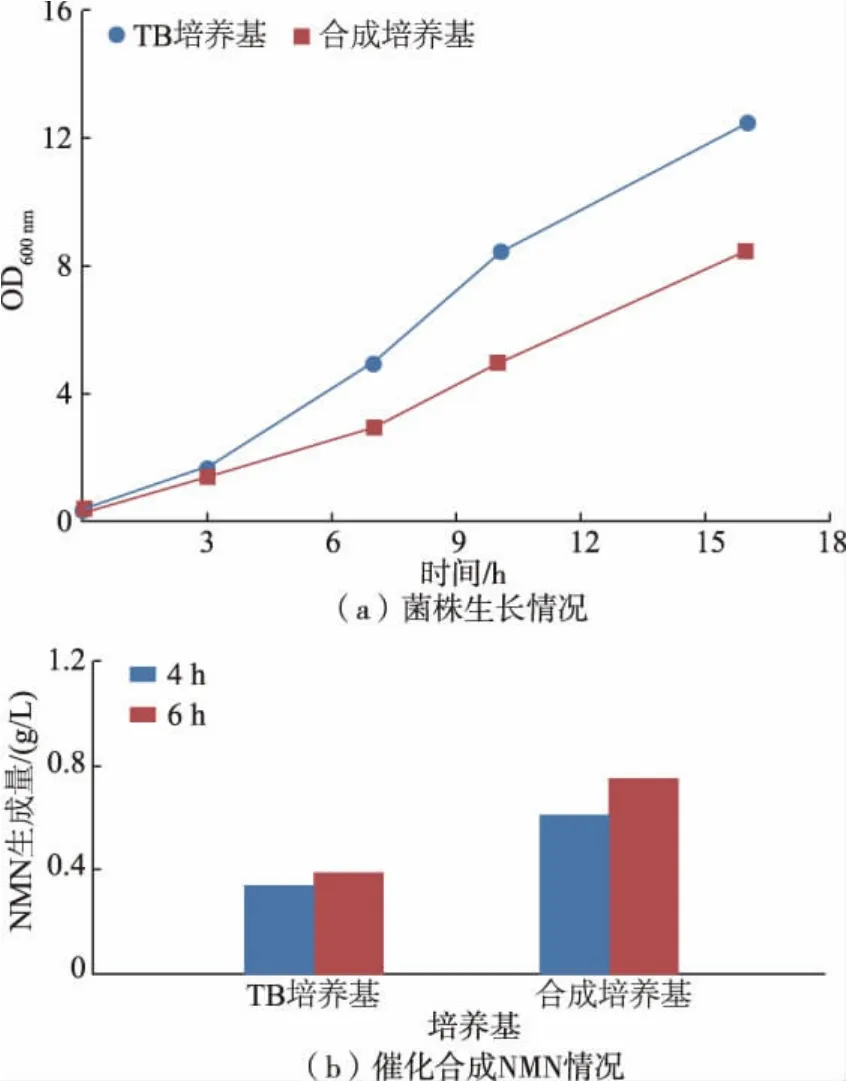
图1 不同发酵培养基对菌株生长及催化生成NMN 的影响Fig. 1 Effects of different fermentation media on cell growth and catalytic synthesis of NMN
2.2 诱导温度及IPTG 浓度对催化合成NMN 的影响
诱导温度和IPTG 浓度是影响外源蛋白质表达的重要因素[18-19]。 考察了菌株培养过程中不同诱导温度和诱导剂IPTG 浓度对合成NMN 的影响,研究发现当诱导温度为25 ℃时,菌体量较低,另外,在实际的工业生产中, 控制25 ℃的发酵温度通常需要制冷,从而会导致生产成本增加。 因此,选择30 ℃和37 ℃两个诱导温度, 并结合不同的诱导剂IPTG 添加浓度(0.2、0.5、1.0 mmol/L)进行研究。分别取反应2、4、6 h 的反应体系样品, 检测NMN 的生成量(质量浓度),结果如图2 所示。 在催化反应6 h内,随着催化时间的延长,NMN 的生成量不断增加。在相同的反应时间内,37 ℃诱导得到的菌体催化合成的NMN 生成量明显高于30 ℃诱导得到的菌体催化合成的NMN 生成量。 另外, 在同一诱导温度下,NMN 的生成量随诱导剂IPTG 浓度的增加反而呈下降趋势, 这可能由高浓度IPTG 对菌体有一定毒性所导致。 当诱导温度为37 ℃、IPTG 浓度为0.2 mmol/L 时,NMN 的生成量最高, 反应6 h 后其生成量为1.15 g/L。 综上,选择诱导温度37 ℃、IPTG浓度0.2 mmol/L 用于制备全细胞催化合成NMN 所用湿菌体。

图2 不同诱导温度和IPTG 浓度对催化合成NMN 的影响Fig. 2 Effects of different induction temperature and IPTG concentration on catalytic synthesis of NMN
2.3 摇瓶水平全细胞催化条件的优化
2.3.1 反应体系不同初始pH 对催化合成NMN 的影响 研究表明,pH 能影响酶的构象以及底物和产物等的解离, 从而影响催化反应的进行和平衡,因此,应用大肠杆菌全细胞催化法生成特定目标产物通常需要在一定的pH 范围内进行[20-21]。本研究中考察了全细胞催化体系中不同初始pH(6.0、6.5、7.0、7.5、8.0)对催化合成NMN 的影响,分别取催化反应2、4、6 h 的反应体系样品, 检测NMN 的生成量(质量浓度),结果如图3 所示。 在相同的反应时间内,NMN 的生成量随初始pH 的变化呈钟形;当初始pH 在6.0~7.0 时,NMN 生成量呈现上升趋势;而当在初始pH 在7.0~8.0 时,NMN 生成量呈现下降趋势。 当初始pH 为7.0 时,催化合成NMN 的效果最好,反应6 h 后NMN 的生成量达1.21 g/L。

图3 不同初始pH 对催化合成NMN 的影响Fig. 3 Effect of different initial pH on catalytic synthesis of NMN
2.3.2 反应体系不同温度对催化合成NMN 的影响在优化了全细胞催化体系的初始pH 后, 又考察了全细胞催化过程中不同反应温度对NMN 合成的影响。 通常来说,反应温度对全细胞催化的效率和速率具有较大影响,不同温度下胞内酶的活性不同[21]。本研究中分别比较了在25、30、37 ℃下全细胞催化合成NMN 的情况,结果如图4 所示。 发现在反应温度为37 ℃的条件下,菌体催化合成NMN 明显受到抑制,反应6 h 时仅积累了0.24 g/L 的NMN,显著低于反应温度为25 ℃(1.37 g/L)和30 ℃(1.46 g/L)时的生成量;另外,当催化时间延长至12 h,不同反应温度下NMN 的生成量均有所降低, 表明反应生成的NMN 有所降解。 研究发现,细胞内的NMN 能够被少量降解生成NAD+用于菌体生长, 从而降低细胞内NMN 的积累[16-17]。 综上,全细胞催化过程中控制30 ℃的反应温度更有利于NMN 的合成。

图4 不同反应温度下NMN 的合成情况Fig. 4 Synthesis of NMN at different reaction temperatures
2.3.3 底物添加比例对催化合成NMN 的影响 在催化底物NAM 合成NMN 过程中,磷酸核糖焦磷酸(PRPP) 是另一重要的直接底物,PRPP 通常由葡萄糖经磷酸戊糖途径生成[22]。 另外,在大肠杆菌中,葡萄糖又能够被糖酵解等代谢途径消耗,从而降低葡萄糖经磷酸戊糖途径代谢生成PRPP 的效率。 为了增加大肠杆菌全细胞催化NAM 合成NMN 的生成量, 本研究中考察了全细胞催化体系中底物NAM和葡萄糖的不同添加比例(ρNAM∶ρGlu=1∶2~1∶5)对NMN合成的影响,即分别在全细胞催化体系中加入1.0 g/L 的底物NAM 以及对应不同质量浓度的底物葡萄糖(2.0、3.0、4.0、5.0 g/L),结果如图5 所示。 总的来说, 全细胞催化过程中NMN 的生成量大致随葡萄糖添加量的增多而增加; 当催化反应10 h 时,ρNAM∶ρGlu=1∶4 时效果最好,NMN 的最高生成量达1.84 g/L,略高于在ρNAM∶ρGlu=1∶5 时的生成量(1.81 g/L)。考虑到添加葡萄糖的成本问题,后续研究选取ρNAM∶ρGlu=1∶4。 另外,与前期研究结果相似,延长催化反应时间至18 h, 在底物NAM 和葡萄糖的不同添加比例下,NMN 的生成量均有所下降。

图5 不同底物添加比例对催化合成NMN 的影响Fig. 5 Effect of different substrate addition ratios on catalytic synthesis of NMN
2.4 5 L 发酵罐水平放大
2.4.1 全细胞催化过程中不同溶氧水平对合成NMN 的影响 基于在摇瓶水平上优化得到菌株的最适生长条件和全细胞催化生成NMN 的条件,为了进一步提高NMN 的生成量, 在5 L 发酵罐上进行放大。 首先,为了提高在发酵罐上培养的菌体量,采用补料分批发酵培养模式, 经IPTG 诱导后OD600nm达到41.6(见图6(a))。 离心收集得到湿菌体,加入分批催化反应体系中(NAM 10.0 g/L、葡萄糖40.0 g/L、最终菌体OD600nm为40.0),考察全细胞催化过程中控制溶氧水平对合成NMN 的影响。 研究发现, 全细胞催化过程中控制一定水平的溶氧更有利于NMN 的合成, 当反应20 h 后不控制溶氧水平的NMN 生成量为4.80 g/L(见图6(b));当溶氧水平控制在30%时, 反应20 h 后NMN 的生成量为5.92 g/L(见图6(c));当溶氧水平控制在40%时,反应20 h 后NMN 的生成量为6.86 g/L (见图6(d)),控制溶氧水平的结果明显高于不控制溶氧水平。 然而,催化反应体系中仍有较多的底物NAM 剩余,控制溶氧水平在40%时反应20 h 后NAM 剩余量 (质量浓度)为6.22 g/L,总反应过程NAM 的摩尔转化率为66.28%。

图6 催化过程控制溶氧水平对合成NMN 的影响Fig. 6 Effects of controlling dissolved oxygen levels during catalytic process on NMN synthesis
2.4.2 全细胞催化过程中底物烟酰胺不同流加方式对合成NMN 的影响 在分批催化反应过程中,考虑到底物NAM 有较多的剩余,10.0 g/L 的初始底物质量浓度可能对催化过程具有一定抑制作用。 基于此, 通过降低底物NAM 的初始添加量, 考察NAM 的不同流加方式(梯度流速流加、恒定速度流加和多节点流加)对合成NMN 的影响,过程中为减少葡萄糖效应,全细胞催化过程中实时监测葡萄糖质量浓度,并通过补料方式维持反应体系中葡萄糖质量浓度在4.0 g/L 左右。 研究发现,当催化过程以恒定速度流加方式(0~20 h 以0.450 g/(L·h)的流速流加) 补加底物NAM 的效果最好, 反应24 h 后NMN 生成量为12.24 g/L,反应体系中仍有4.78 g/L的NAM 剩余,底物NAM 摩尔转化率为85.65%(见图7(a));以梯度流速流加方式(0~5 h 以0.900 g/(L·h)的流速补加,>5~10 h 以0.450 g/(L·h)的流速补加,>10~20 h 以0.225 g/(L·h) 的流速补加)补加底物NAM 的反应过程,反应24 h 后NMN 生成量为10.59 g/L, 体系中剩余5.42 g/L 的NAM, 底物NAM 摩尔转化率为84.45%(见图7(b))。 结果表明,通过补料方式能够显著提高全细胞催化反应合成NMN 的生成量,相比分批催化反应过程,以恒定速度流加方式补加底物NAM 的反应过程,NMN 的生成量提高了78.43%,底物NAM 的摩尔转化率提高了29.22%。

图7 催化过程中底物烟酰胺流加方式对合成NMN 的影响Fig. 7 Effects of different adding modes of nicotinamide during catalytic process on NMN synthesis
3 结 语
随着对NMN 在抗衰老和治疗神经退行性疾病等方面生物学功能的深入研究,近年来应用生物合成法高效合成NMN 已成为研究热点[23]。研究人员通过代谢工程改造策略, 在大肠杆菌中构建了NMN的合成途径,通过发酵过程优化和全细胞催化等策略,提高了NMN 的合成效率[11,24]。 作者在前期研究构建的一株能够高效合成NMN 的大肠杆菌菌株的基础上,在摇瓶水平上对菌株培养条件和全细胞催化条件进行了优化, 并在5 L 发酵罐上对催化过程底物NAM 的补料方式进行了优化,NMN 的生成量提高至12.24 g/L, 底物NAM 的摩尔转化率为85.65%。 与前期已报道的NMN 全细胞催化合成NMN 相比(6.79 g/L)[16],本研究中得到的NMN 生成量有明显提高,底物NAM 的摩尔转化率也接近,但催化时间有所延长。 另外,与作者所在研究团队前期建立的在发酵过程中流加底物NAM 的生产工艺相比[17],本研究中建立的全细胞催化工艺仍需进一步优化。 为提高NMN 生成量以满足工业化生产需求,后期需要进一步对菌株培养的发酵条件、全细胞催化过程以及放大工艺等进行系统优化。
