基于复合诱变选育高抑菌活性植物乳杆菌
2023-10-17卢艳波杨小雁马忠玛刘颖颖鲍青青
毛 银, 卢艳波, 杨小雁, 马忠玛, 刘颖颖, 鲍青青, 邓 禹*
(1. 江南大学粮食发酵与食品生物制造国家工程研究中心, 江苏 无锡 214122; 2. 山东渤海实业集团有限公司山东省油脂油料精深加工技术重点实验室,山东 滨州 256500)
在食品制造和储藏过程中,致病菌的污染影响了食品的质量安全,对人类健康造成了严重的危害[1-2]。尽管传统的添加化学防腐剂来延长食品保质期的方法已取得了相当大的进展,但随着人们对“清洁标签”食品需求的不断增加,寻找安全、绿色、高效的防腐物质来取代化学衍生物质具有重要意义[3]。
现代生物技术的不断发展为解决上述问题提供了理论支撑。 研究表明,乳酸菌在培养过程中会产生大量抑菌代谢物,如有机酸、脂肪酸、乙偶姻、过氧化氢、蛋白质类化合物、苯乳酸、细菌素和过氧化氢等[4-5]。 这些物质在不同的体系中可以单独或协同发挥抑菌作用[6-7],且不影响食品感官特性和人体健康[8-9]。 因此,使用无毒、无副作用的高抑菌活性乳酸菌及其代谢产物作为天然防腐剂可用于控制食品腐败及致病菌的生长,为食品添加剂安全问题提供了良好的解决方案[10-11],极具应用前景。
通过微生物诱变育种的手段来获得高抑菌活性的乳酸菌,是提升菌株抑菌性能的有效方式[12]。物理诱变虽然具有安全性高、 变异范围广等优势,但也存在诱变设备要求较复杂、诱变专一性较差等缺点。 化学诱变虽然具有诱变效果强的优点,但操作时存在安全性差的问题。 由于物理、化学诱变存在各自的局限性,同时长期的单一处理容易造成生长周期延长、代谢减缓等菌种退化问题,所以常采用多种诱变剂复合处理的方式进行诱变育种[13]。 复合诱变可以扩大突变的位点,使诱变方式起到协同作用,更易获得性能优良的菌株[14]。
随着高通量测序技术和生物信息学的快速发展, 具有高抑菌活性菌株的抑菌机理逐步得到阐明。 基因组重测序手段可以挖掘全基因组范围内的基因和结构差异,从而获得与抑菌性能相关的变异基因[15]。 作者所在团队前期从自然发酵的酸菜中筛选到一株抑菌性能较好的植物乳杆菌DY6,并对其抑菌活性物质进行了初步研究,但其抑菌机理尚不清楚[16]。因此,作者首先通过常压室温等离子体和亚硝基胍对植物乳杆菌DY6 进行复合诱变,筛选获得了高抑菌活性的菌株。 随后通过基因组重测序技术系统分析了植物乳杆菌DY6 和其诱变菌株的遗传差异,对抑菌性能相关的变异基因进行初步挖掘与分析,为植物乳杆菌在饲料和食品防腐领域的应用提供了有益借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 植物乳杆菌DY6:作者所在实验室保藏;大肠杆菌(ATCC25922):中国普通微生物菌种保藏中心提供。
1.1.2 培养基 MRS 培养基(g/L):胰蛋白胨10.0,牛肉膏8.0,酵母粉4.0,葡萄糖20.0,K2HPO42.0,柠檬酸三铵 2.0,CH3COONa 5.0,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,吐温80 1 mL;pH 6.3~6.5,115 ℃灭菌30 min。
LB 液体培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0;pH 自然,115 ℃灭菌30 min。
所有固体培养基中琼脂粉质量浓度为2 g/dL,半固体培养基中琼脂粉质量浓度为1 g/dL。
抑菌活性测定所用培养基为双层LB 培养基,即上层为半固体培养基加指示菌,下层为固体培养基。
1.1.3 仪器与试剂 UV-1800 分光光度计:上海翱艺仪器有限公司产品;电热恒温培养箱:上海善志仪器设备有限公司产品;多功能酶标仪:美国Bio-Tek 有限公司产品;Artp-iis ARTP 诱变系统:无锡源清天木生物科技有限公司产品;游标卡尺(0~150 mm):桂林广陆数字测控股份有限公司产品。
葡萄糖、胰蛋白胨、牛肉膏、CH3COONa、吐温80、NaCl、亚硝基胍、丙酮等:国药化学试剂有限公司产品。
1.2 高抑菌活性诱变菌株的选育
1.2.1 抑菌活性的测定 以大肠杆菌作为指示菌,采用牛津杯法测定植物乳杆菌抑菌活性[16]。 首先将大肠杆菌接种至LB 液体培养基中,37 ℃、250 r/min培养12 h,制备菌液。 然后将待测菌株接种至MRS培养基中,37 ℃、250 r/min 培养24 h,制备发酵液,随后12 000 r/min 离心10 min 制备发酵上清液,用于抑菌活性测定。
通过双层LB 培养基测定菌株的抑菌活性,控制上层半固体培养基中大肠杆菌的菌体浓度为1×108CFU/mL。 在此基础上等距离摆放牛津杯(4~5个)后放置在水平台面上凝固。 然后在牛津杯中加入待测的发酵上清液200 μL,37 ℃培养15 h 后测量上清液对指示菌产生的抑菌圈直径,每次测定做3 组平行。
1.2.2 常压室温等离子体(ARTP)诱变 菌悬液的制备: 将植物乳杆菌在37 ℃、250 r/min 培养12 h,12 000 r/min 离心10 min 收集菌体并用生理盐水清洗3 次,最后稀释成1×107CFU/mL 的菌悬液。
ARTP 诱变:取10 μL 菌悬液涂在金属载片上,将其放入ARTP 诱变系统操作室,控制功率100 W,气流量为10 L/min,照射距离为2 mm。诱变结束后,将载片移至装有生理盐水的离心管内,迅速振荡样品。 将诱变后的菌悬液涂布于MRS 平板上,待长出单菌落后测定平板菌落数,以未处理的菌悬液作为对照,计算致死率[17],每组实验3 个平行:
式中:F 为致死率,%;Nc为对照平板菌落数;Nm为诱变平板菌落数。
1.2.3 亚硝基胍(NTG)诱变 NTG 母液的配备:取0.02 g NTG 加入1 mL 丙酮配制成质量浓度为20 g/L的NTG 母液, 再用磷酸缓冲液稀释至NTG 质量浓度为2 g/L。
NTG 诱变: 在1 mL 的植物乳杆菌菌悬液中加入适量的NTG 溶液和磷酸缓冲液, 控制NTG 的终质量浓度分别为0.25、0.50、0.75、1.00 mg/mL, 混合均匀后放置在37 ℃、250 r/min 的摇床中振荡处理30 min,6 000 r/min 离心10 min 收集菌体并用磷酸缓冲液清洗3 次。 将诱变后的菌悬液涂布于MRS平板上,待长出单菌落后测定平板菌落数,以未处理的菌悬液作为对照,计算出NTG 的致死率,每组实验测定3 组平行。
1.2.4 复合诱变 将ARTP 诱变后抑菌圈直径有明显提高的突变菌株作为出发菌株,对其进行NTG 诱变,筛选抑菌活性较出发菌株有显著提高的突变菌株。
1.2.5 诱变菌株的初筛 参考Gerez 等的方法[18]并稍加修改, 通过96 孔板法测定植物乳杆菌对大肠杆菌的抑制效果。 将诱变后的菌株接种于200 μL MRS 培养基中,37 ℃、250 r/min 培养12~16 h。随后转接至96 孔板中, 接种体积分数为2%,37 ℃、250 r/min 培养24 h。 通过96 孔板法测定植物乳杆菌诱变菌株对大肠杆菌的抑制效果。 将50 μL 大肠杆菌菌悬液(1×108CFU/mL)和150 μL 植物乳杆菌诱变菌株的发酵上清液添加到96 孔板中,37 ℃、250 r/min 培养24 h 后用酶标仪测定OD600nm值,以接种大肠杆菌菌悬液于MRS 培养基的孔板作为对照组,计算诱变菌株的抑菌率:
式中:I 为抑菌率,%;As为实验组在600 nm 处的吸光度;Ac为对照组在600 nm 处的吸光度。
1.2.6 诱变菌株的复筛及遗传稳定性测试 以初筛后抑菌率较高的菌株作为筛选对象,将其接种于MRS 培养基中,37 ℃、250 r/min 培养24 h 制备发酵液。 采用牛津杯法测定菌株的抑菌活性,以抑菌圈直径为筛选高抑菌活性诱变菌株的唯一标准进行复筛。 选取ARTP 诱变以及复合诱变复筛后抑菌活性较高的菌株,对其连续传代,用牛津杯法测定每一代菌株的抑菌活性,评估诱变菌株的遗传稳定性。
1.3 基因组重测序
植物乳杆菌DY6 和诱变菌株在37 ℃、250 r/min培养12 h 后提取基因组DNA 用于全基因组测序,测序工作由上海生工生物工程有限公司完成。 首先选择质检合格的基因组DNA 制备用于IlluminaTM二代测序平台的DNA 文库。 测序完成后将初始数据进行质量评估后过滤得到高质量的数据,与参考基因组植物乳杆菌WCFS1 (NC_004567.2) 进行比对。 使用GATK 的HaplotypeCaller 分析样品和参考基因组之间的基因型差异, 并通过DELLY、CNVnator 软件对样品的SV、CNV 进行检测。根据参考基因组的注释信息,利用SnpEff 软件对突变进行注释。
2 结果与分析
2.1 常压室温等离子体诱变菌株的筛选
2.1.1 ARTP 最佳诱变时间 通过ARTP 对植物乳杆菌DY6 的菌悬液进行诱变处理,将经过不同照射时间(0、10、20、30、40 s)的菌悬液分别涂布于MRS平板上,待长出单菌落后进行菌落计数,计算致死率。结果如图1 所示,ARTP 诱变对植物乳杆菌DY6的致死率随着诱变时间的增加而不断升高,表明该菌株对ARTP 诱变非常敏感。 当处理时间为20 s时, 菌株致死率达到91.3%; 当处理时间达到40 s时,平板上无菌株生长。 由于菌株的致死率大于90.0%时,突变菌株中能有较高的正向突变且回复突变的概率较小[19],故选择ARTP 诱变的时间为20 s。

图1 ARTP 诱变致死率Fig. 1 Fatality rate curve of ARTP mutation system
2.1.2 ARTP 诱变菌株的初筛 将植物乳杆菌DY6的菌悬液在ARTP 诱变系统中处理20 s 后涂布于MRS 平板上,37 ℃培养48 h 挑取单菌落接种于96孔板。 依据1.2.5 中的方法筛选抑菌性能较强的菌株, 由于具有抑菌效果的植物乳杆菌上清液的添加,孔板中大肠杆菌的生长受到了抑制,因此实验组孔板的OD600nm会低于对照组。据此,通过公式(2)计算各菌株的抑菌率,筛选抑菌率大于野生型菌株(DY6)的诱变菌株,将其编号为A1~A62(见图2)。在所有正突变菌株中,菌株A4、A28、A55 的抑菌率有显著提高,分别为61.48%、59.48%、60.02%。
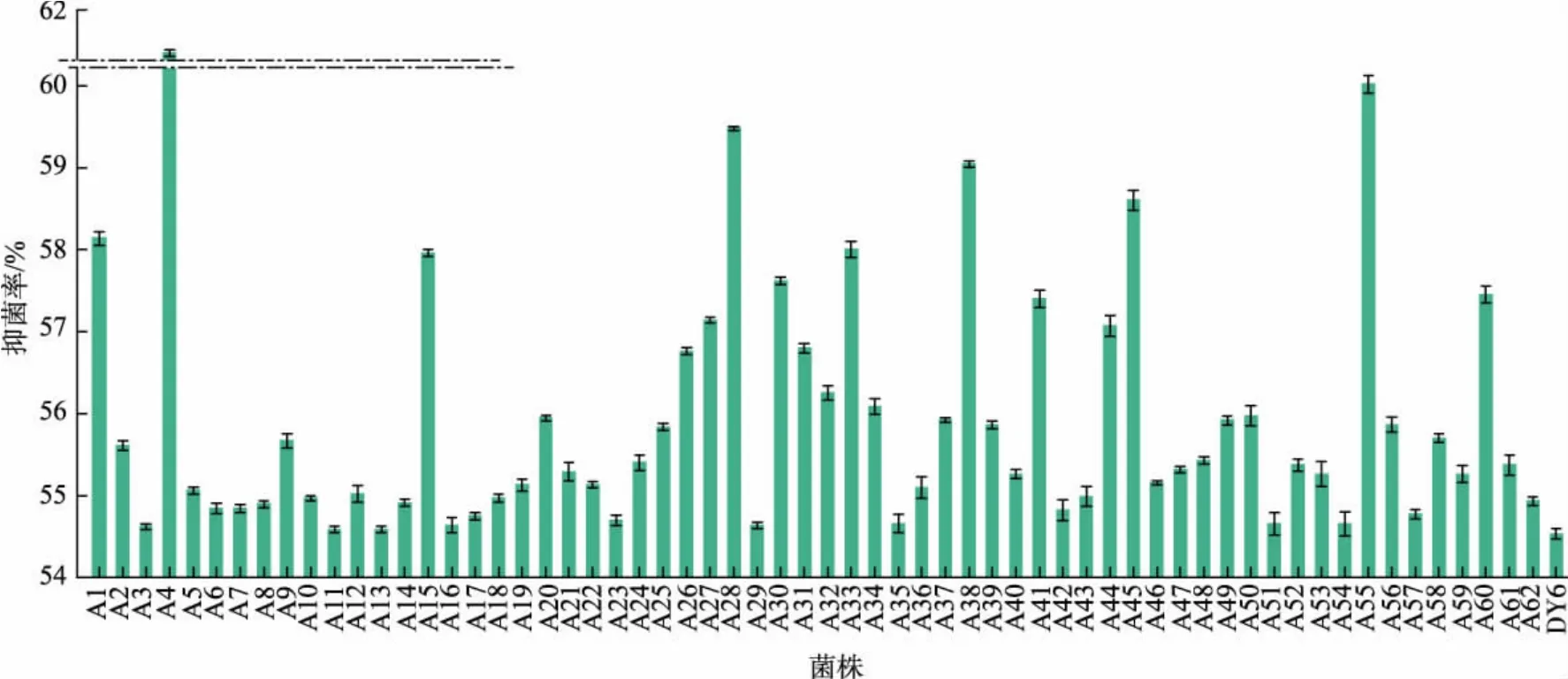
图2 ARTP 诱变菌株的初筛Fig. 2 Preliminary screening of ARTP mutant strains
2.1.3 高抑菌活性ARTP 诱变菌株的复筛 选取抑菌性能优良的A4、A28、A38、A45、A55 共5 株诱变菌株, 通过牛津杯法测定其抑菌活性进行菌株复筛。结果如图3 所示,5 株诱变菌株的抑菌活性均高于野生型菌株(DY6)。 其中菌株A4 和A55 的抑菌圈直径较大, 抑菌活性相对于野生型植物乳杆菌DY6 分别提高了16.38%和14.47%。因此,后续研究中选择菌株A4 作为复合诱变菌株。

图3 ARTP 诱变菌株的复筛Fig. 3 Rescreening of ARTP mutant strains
2.2 复合诱变菌株的选育
2.2.1 NTG 诱变剂量优化 与ARTP 诱变一致,在进行NTG 复合诱变前, 首先需要确定NTG 的最佳处理剂量。 依照1.2.3 中的方法,向待诱变菌株菌悬液中加入不同体积的NTG 母液,控制其终质量浓度分别为0.25、0.50、0.75、1.00 mg/mL, 以未添加NTG的菌悬液作为对照,反应后涂布于MRS 平板上,计算NTG 对植物乳杆菌的致死率。 结果如图4 所示,随着菌悬液中NTG 质量浓度的增加,致死率也逐渐上升。 当使用0.50 mg/mL NTG 处理植物乳杆菌时,菌株的致死率达到90.0%以上。 由于过高的NTG 质量浓度会导致菌体的活力下降, 而质量浓度太低时则会导致突变菌株不稳定, 故选取0.50 mg/mL 为NTG 的最佳诱变质量浓度, 以利于正突变菌株的产生。
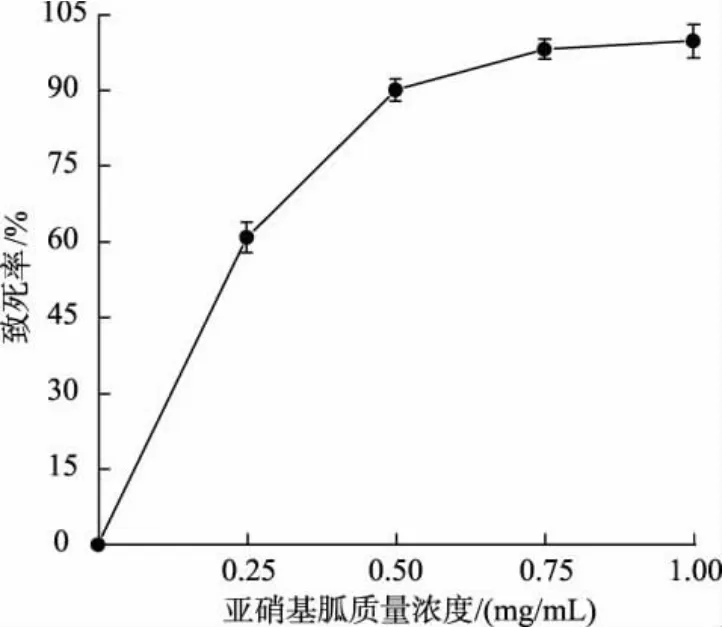
图4 NTG 质量浓度对菌株致死率的影响Fig. 4 Effect of mass concentration of NTG on mortality rate of strain
2.2.2 ARTP 和NTG 复合诱变菌株的初筛 选取ARTP 诱变后抑菌性能最佳的植物乳杆菌A4 作为出发菌株制备菌悬液,添加终质量浓度为0.50 mg/mL 的NTG 进行诱变, 以不添加NTG 的菌悬液作为对照,诱变后涂布于MRS 平板上。 待长出单菌落后测定各菌株的抑菌率,筛选抑菌性能较高的菌株。 复合诱变后正突变菌株的数量有所增加,抑菌性能也有了进一步提升。 将所有正突变菌株分别编号为AN-1~AN-72(见图5),其中菌株AN-55、AN-58、AN-68 的抑菌率较高,分别为63.09%、74.45%、66.55%。

图5 复合诱变初筛结果Fig. 5 Preliminary screening results of mutants by compound mutagenesis
2.2.3 高抑菌活性复合诱变菌株的复筛 选取抑菌性能优良的AN-7、AN-34、AN-55、AN-58、AN-68 共5 株诱变菌株, 通过摇瓶发酵制备上清液,测定抑菌活性进行菌株复筛。 结果如图6 所示,菌株AN-55、AN-58 和AN-68 的抑菌圈直径较大, 抑菌活性相对于野生型植物乳杆菌DY6 分别提高了19.83%、21.91%和18.40%。

图6 复合诱变复筛结果Fig. 6 Re-screening of mutants by compound mutagenesis
2.2.4 诱变菌株的遗传稳定性实验 由于诱变菌株在很多情况下会出现不稳定的情况,所以需要采用多次传代的方式来排除遗传性能不稳定的菌株。首先选取ARTP 诱变筛选得到的抑菌活性较高的菌株A4、A55 和复合诱变筛选得到的抑菌活性较高的菌株AN-55、AN-58、AN-68 进行连续传代,测试每次传代后各菌株的抑菌活性,共传代8 次。 结果如图7 所示,在每次传代中,复合诱变菌株的抑菌活性(抑菌圈直径)普遍高于ARTP 单一诱变菌株,表明复合诱变更有利于获得性能优良的菌株。 在所有诱变菌株中, 菌株AN-55 和AN-58 的抑菌性能较为稳定,经8 次传代后抑菌活性相较于野生型菌株提高了20.51%、18.84%。

图7 突变菌株遗传性稳定结果Fig. 7 Genetic stability of mutant strains
2.3 植物乳杆菌全基因组重测序分析
2.3.1 突变基因功能注释 结合上述研究,选择复合诱变后抑菌性能最稳定的菌株AN-55 和出发菌株植物乳杆菌DY6 进行全基因组重测序。以植物乳杆菌WCFS1(NC_004567.2)的基因组作为参考基因组, 将菌株AN-55 和DY6 的重测序结果与其进行比对,结果如表1 所示,诱变后的菌株AN-55 定位到参考基因组的比例相较于出发菌株有所增加。 与出发菌株植物乳杆菌DY6 相比, 菌株AN-55 中发生突变的位点有70 个, 其中单核苷酸多态性位点(SNP) 44 个,插入缺失位点(InDel)26 个;注释到的突变基因有27 个, 所有基因的突变类型包括错义突变、移码突变、框内插入或缺失。 在GO 数据库功能注释中(见图8),共有50 个基因被注释到不同的功能层面,包括生物过程层面、分子功能层面、细胞组分层面以及其他层面。 生物过程层面中,这些注释的基因主要参与了代谢途径及细胞过程等;在分子功能层面中, 注释的基因则主要参与转运等过程;细胞组分层面中,在细胞膜组分中被注释的基因较多。

表1 基因组重测序数据统计Table 1 Genetic resequencing data statistics

图8 GO 数据库功能注释Fig. 8 GO database function annotation
2.3.2 突变基因分析 研究发现植物乳杆菌的抑菌能力主要来源于其代谢产物[20]。 在诱变菌株AN-55 注释的所有突变基因中,推测与抑菌性能相关的基因及其突变位点列于表2。 其中,plnK 是一种细菌素的编码基因,这种细菌素对于近源的细菌有较好的抑制作用。PlnK 属于Ⅱb 类细菌素,这类细菌素通过2 个多肽相互作用发挥抑菌功能。 研究表明细菌素PlnK 和PlnJ 两个多肽链混合时可以破坏细胞膜的功能,使得抑菌效果明显增强[21]。 菌株AN-55中plnK 发生位点突变,从其抑菌效果来看,推测这一突变可能是正向的,有利于增强菌株的抑菌能力。

表2 抑菌性相关基因突变位点变化Table 2 Changes of antibacterial related gene mutation sites
糖基转移酶(GT1 家族,基因cps4G)是一个尿苷二磷酸(UDP)糖基依赖的转移酶超家族,主要以UDP-己糖或其衍生物为糖基供体,通过糖基化反应形成种类繁多的糖基化衍生物,其中的部分衍生物具有抑菌性能[22-23]。 糖基转移酶也是糖苷类抗生素合成途径中的关键酶,可以催化合成具有较好抑菌性能和广泛抑菌谱的糖苷类抗生素。 Ostash 等研究明确了莫诺霉素合成途径的GT1 催化关键环节,将首个糖基连接到法尼基焦磷酸上[24]。另外,熊永刚通过过表达引导糖基转移酶将植物乳杆菌的胞外多糖产量提升了30.15%,并发现该多糖对扩展青霉等致病菌的生长具有明显的抑制作用[25]。 在转录组学中,过表达糖基转移酶基因影响了糖酵解和糖异生途径中葡萄糖-6-磷酸的合成, 进而提高了胞外多糖的产量。由此推测诱变菌株AN-55 的cps4G 可能存在正向突变,促使菌株产生具有抑菌性能的糖基化衍生物及其他物质,进而影响其抑菌性能。
菌株AN-55 中注释到磷酸转移酶(PTS)系统中的甘露糖特异性EIID 组分(pts9D)、低聚糖特异性EIIBCA 组分(pts1BCA)和甘露糖特异性EIIAB组分(pts9AB)中存在较多的突变位点。 在植物乳杆菌中,PTS 系统可以将多种糖类转运至细胞内,使得菌株可以高效利用不同碳源,进而产生大量代谢产物[26]。 根据菌株AN-55 的抑菌性能推测pts9D、pts1BCA、pts9AB 可能存在正向突变,使其具有较强的甘露糖和低聚糖的转运能力,从而提高碳源利用率,增强有机酸等代谢产物的合成,进而达到高效抑菌的目的。此外,丝氨酸/苏氨酸蛋白激酶(pkn1)、XRE 家族转录调控因子(lp_1483)、核黄素合成酶(ribB) 等的编码基因可能发生正向或负向突变,影响菌株的生长代谢,从而间接影响了菌株的抑菌性能。
3 结 语
近年来,食品安全问题逐渐受到重视,越来越多的国内外学者致力于开发绿色、高效的天然抗菌物质。 乳酸菌因其天然的抑菌特性受到了广泛关注,是新型绿色食品添加剂和天然防腐剂等产品研发领域中的重点研究对象。 本研究中以抑菌性能优良的植物乳杆菌DY6 为出发菌株, 通过ARTP 和NTG 复合诱变提升菌株的抑菌性能,根据抑菌率和抑菌活性对诱变菌株进行筛选,得到了到抑菌活性较强的菌株AN-55、AN-58 和AN-68, 遗传稳定性实验表明诱变菌株AN-55 的抑菌性能较为稳定,抑菌活性提高了20.51%。经全基因组重测序研究发现菌株AN-55 中plnK、cps4G、pts9D 等基因的突变可能是影响其抑菌性能的重要基因,为后续植物乳杆菌抑菌机理的研究及其在抗生素替代物中的应用奠定了基础。
