淫羊藿苷对激素抵抗型肾病综合征大鼠足细胞PODXL/Ezrin蛋白及Caspase-3、Bax、Bcl-2表达的影响
2023-10-17王晓辉戴恩来段淑文刘灿丁照然
王晓辉,戴恩来,段淑文,刘灿,丁照然
甘肃中医药大学,甘肃 兰州 730000
激素抵抗型肾病综合征(steroid resistant nephrotic syndrome,SRNS)是一种临床表现为对标准类固醇治疗缺乏反应的疾病[1],其特点是类固醇抵抗性、临床变异性和遗传异质性[2]。目前未见经过验证的生物标志物能预测SRNS或定义调节SRNS的途径[3]。SRNS治疗困难,易发展为终末期肾病,生存率低,迫切需要逆转类固醇耐药性及减少长期使用高剂量类固醇药物的措施[4]。SRNS发病机制伴随肾小球上皮细胞(足细胞)凋亡[5-6],因此,抑制足细胞凋亡是SRNS一种潜在的治疗策略。淫羊藿苷(icariin,ICA)在神经退行性疾病、心血管疾病、抗骨质疏松、抗炎、抗氧化应激、抗抑郁和抗肿瘤等方面有多种药理作用[7-9],对肾脏疾病具有保护作用,在提高糖皮质激素疗效方面有一定优势[10],但其机制有待进一步探索。在前期研究基础上,本研究进一步观察ICA对足细胞相关蛋白及凋亡的影响,探讨其减轻足细胞损伤的作用机制。
1 实验材料
1.1 动物
雄性SPF级SD大鼠60只,体质量(180±20)g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号SCXK(京)2019-0010。饲养于甘肃中医药大学动物实验中心,温度22 ℃,湿度30%~50%,辐照灭菌SPF级大鼠饲料及饮用水喂养。本研究经甘肃中医药大学实验动物管理(伦理)委员会审批(2021-181)。
1.2 药物
ICA,陕西博林生物技术有限公司,批号BL20211102001。泼尼松片,山东鲁抗医药集团赛特有限责任公司,批号211007。盐酸阿霉素(ADR),北京索莱宝科技有限公司,批号HY-15142。
1.3 主要试剂与仪器
Caspase-3抗体(批号GTX110543)、Bax抗体(批号GTX635715)、Bcl-2抗体(批号GTX100064)、Ezrin抗体(批号GTX111709),美国Gene Tex公司;PODXL抗体(批号bs-1345R),北京博奥森生物技术有限公司;β-actin(批号GB12001)、HRP标记山羊抗兔二抗(批号GB23303),武汉赛维尔生物科技有限公司;TUNEL试剂盒(批号G1501),武汉赛维尔公司;CCB法尿蛋白检测试剂盒(货号C035-2-1),南京建成生物工程研究所。7600-1101SE型全自动血液生化分析仪(日立诊断产品有限公司),ECLIPSE C1、E100正置荧光显微镜(日本尼康),DS-U3成像系统(日本尼康),BT-2电泳仪(武汉赛维尔公司),TSY-B摇床(武汉赛维尔公司)。
2 实验方法
2.1 造模、分组及给药
60只SD大鼠随机分为空白组12只,其余48只分别于实验第1、8日注射ADR 4、3.5 mg/kg建立SRNS大鼠模型[11]。造模14 d后将大鼠随机分为模型组、激素组、ICA组和联合组,每组12只。激素组予0.63 mg/mL泼尼松溶液(生理盐水配制)6.3 mg/kg灌胃,ICA组予5 mg/mL ICA溶液(生理盐水配制)50 mg/kg灌胃,联合组同时予泼尼松和ICA溶液灌胃,空白组及模型组予生理盐水,灌胃体积1 mL/100 g,连续6周。实验期间每周称量大鼠体质量。
2.2 标本采集
第2次注射ADR后开始检测尿蛋白,提前1 d用代谢笼收集大鼠24 h尿液,每周1次。干预结束后,以2%戊巴比妥50 mg/kg腹腔注射麻醉大鼠,心尖取血,室温静置1 h,4 ℃、3 000 r/min离心10 min,取上清液分装,用于检测生化指标。切除大鼠左侧肾脏,生理盐水清洗,剥离肾包膜,用于肾组织病理检测,右侧肾组织用于蛋白检测。
2.3 肾功能指标测量
CCB法试剂盒测定24 h尿蛋白(24 h-UTP)含量;采用全自动血液生化分析仪检测血清白蛋白(ALB)、血尿素氮(BUN)、血肌酐(SCr)含量。
2.4 肾组织病理学检测
将肾脏切成厚度0.5 cm组织,装入EP管中,加入4%组织细胞固定液,常温固定48 h,经洗涤固定、脱水、透明、浸蜡、包埋、切片后,行Masson染色,光学显微镜下观察肾组织病理形态。
2.5 Western blot检测
称取适量肾组织剪碎,加入组织蛋白裂解液,匀浆,4 ℃、10 080×g离心10 min,收集上清液,紫外分光光度计测定蛋白浓度。样品上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜至聚偏二氟乙烯膜,脱脂奶粉封闭2 h,加入Caspase-3、Bax、Bcl-2、PODXL、β-actin一抗(1∶1 000)和Ezrin一抗(1∶5 000),4 ℃孵育过夜,PBST洗膜,室温孵育二抗2~3 h。DAB显色,电化学发光显色液曝光,用Image J软件对图像进行灰度分析。
2.6 TUNEL染色检测细胞凋亡
石蜡切片脱蜡至水,蛋白酶K修复,破膜,缓冲液常温孵育10 min,加入TUNEL反应液,37 ℃加湿室中孵育2 h,PBS缓冲液清洗,滴加DAPI染液,室温避光孵育10 min,脱水、封片后,荧光显微镜下观察肾组织凋亡情况,计算TUNEL阳性表达荧光强度。
3 统计学方法
4 结果
4.1 淫羊藿苷对模型大鼠体质量的影响
模型组死亡2只,最终各组按10只进行统计。与空白组比较,模型组大鼠体质量增长缓慢,造模14 d及给药6周后体质量明显下降(P<0.05,P<0.01);与模型组比较,激素组大鼠体质量无明显差异(P>0.05),ICA组和联合组大鼠体质量明显增加(P<0.05,P<0.01)。见表1。
表1 各组大鼠不同时点体质量比较(,g)

表1 各组大鼠不同时点体质量比较(,g)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
给药6周组别只数造模14 d 360.20±6.49 254.60±8.20**256.80±3.16 260.20±2.30#308.70±6.88##空白组模型组激素组ICA组联合组10 10 10 10 10 253.20±6.39 204.00±5.46*204.00±6.90 201.80±4.08 199.90±4.86
4.2 淫羊藿苷对模型大鼠24 h尿蛋白含量的影响
与空白组比较,模型组大鼠造模14 d及给药6周后24 h-UTP含量明显升高,差异有统计学意义(P<0.01);给药6周后,与模型组比较,ICA组和联合组大鼠24 h-UTP含量明显降低,差异有统计学意义(P<0.05,P<0.01)。见表2。
表2 各组大鼠不同时点24 h-UTP含量比较(,mg)
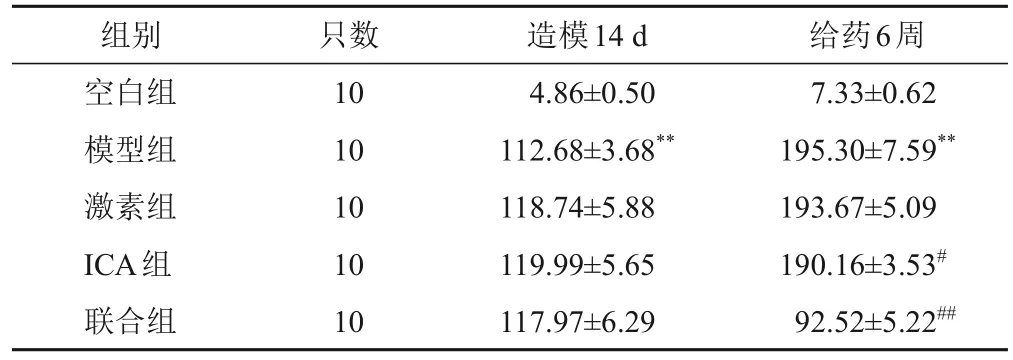
表2 各组大鼠不同时点24 h-UTP含量比较(,mg)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
7.33±0.62 195.30±7.59**193.67±5.09 190.16±3.53#92.52±5.22##空白组模型组激素组ICA组联合组10 10 10 10 10 4.86±0.50 112.68±3.68**118.74±5.88 119.99±5.65 117.97±6.29
4.3 淫羊藿苷对模型大鼠生化指标的影响
与空白组比较,模型组大鼠血清ALB含量减少,SCr、BUN含量增加,差异有统计学意义(P<0.05);与模型组比较,联合组大鼠血清ALB含量增加,SCr、BUN含量减少,差异有统计学意义(P<0.01)。见表3。
表3 各组大鼠血清ALB、SCr、BUN含量比较()
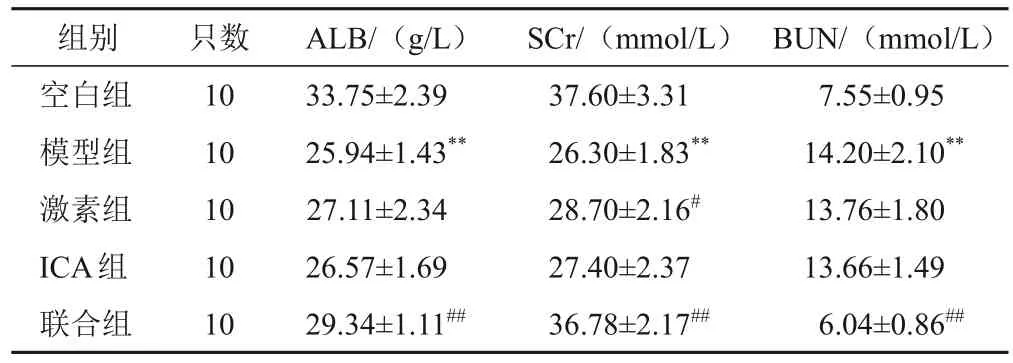
表3 各组大鼠血清ALB、SCr、BUN含量比较()
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01
组别空白组模型组激素组ICA组联合组BUN/(mmol/L)7.55±0.95 14.20±2.10**13.76±1.80 13.66±1.49 6.04±0.86##只数10 10 10 10 10 ALB/(g/L)33.75±2.39 25.94±1.43**27.11±2.34 26.57±1.69 29.34±1.11##SCr/(mmol/L)37.60±3.31 26.30±1.83**28.70±2.16#27.40±2.37 36.78±2.17##
4.4 淫羊藿苷对模型大鼠足细胞形态的影响
空白组大鼠肾小球基底膜完整,系膜基质分布均匀;模型组大鼠肾小球基底膜明显增厚,沉积物增多,足细胞肿胀、变性、增生,散在分布于肾小囊内;与模型组比较,各治疗组大鼠肾小球基底膜及足细胞病理结构均有不同程度改善,肾小球基底膜沉积物减少,足细胞增生及变性减轻,联合组改善更佳。见图1。

图1 各组大鼠肾组织形态(Masson染色,×400)
4.5 淫羊藿苷对模型大鼠肾组织蛋白表达的影响
与空白组比较,模型组大鼠肾组织PODXL、Ezrin、Bcl-2蛋白表达明显降低,Caspase-3、Bax蛋白表达升高,差异有统计学意义(P<0.05,P<0.01);与模型组比较,ICA组大鼠肾组织PODXL、Ezrin、Bcl-2蛋白表达明显升高,联合组大鼠肾组织PODXL、Ezrin、Bcl-2蛋白表达明显升高,Caspase-3、Bax蛋白表达明显降低,差异有统计学意义(P<0.05,P<0.01)。见图2、表4。
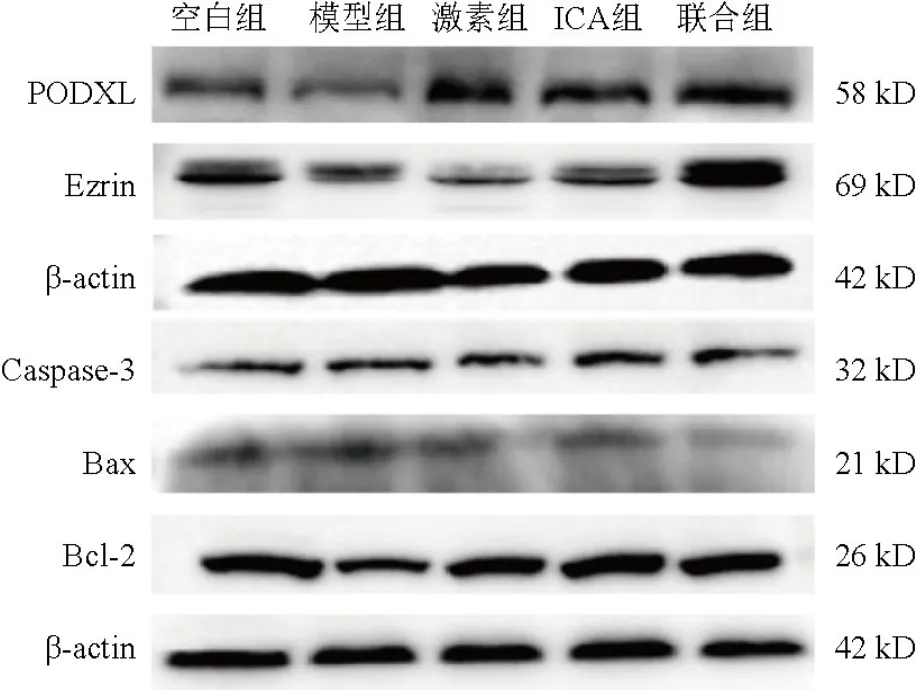
图2 各组大鼠肾组织PODXL、Ezrin、Caspase-3、Bax、Bcl-2蛋白免疫印迹
表4 各组大鼠肾组织PODXL、Ezrin、Caspase-3、Bax、Bcl-2蛋白表达比较()
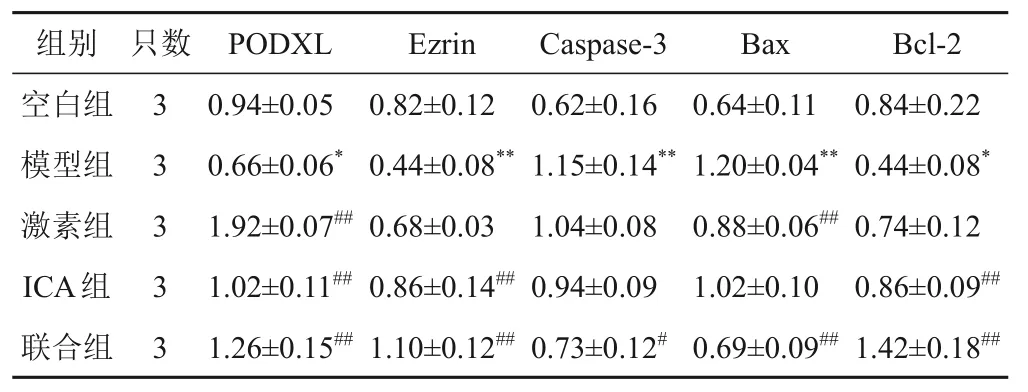
表4 各组大鼠肾组织PODXL、Ezrin、Caspase-3、Bax、Bcl-2蛋白表达比较()
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别空白组模型组激素组ICA组联合组Bcl-2 0.84±0.22 0.44±0.08*0.74±0.12 0.86±0.09##1.42±0.18##只数3 3 3 3 3 PODXL 0.94±0.05 0.66±0.06*1.92±0.07##1.02±0.11##1.26±0.15##Ezrin 0.82±0.12 0.44±0.08**0.68±0.03 0.86±0.14##1.10±0.12##Caspase-3 0.62±0.16 1.15±0.14**1.04±0.08 0.94±0.09 0.73±0.12#Bax 0.64±0.11 1.20±0.04**0.88±0.06##1.02±0.10 0.69±0.09##
4.6 淫羊藿苷对模型大鼠肾组织细胞凋亡的影响
与空白组比较,模型组大鼠肾组织细胞凋亡增加(P<0.01);与模型组比较,ICA组和联合组大鼠肾组织细胞凋亡减少(P<0.05,P<0.01)。见表5、图3。
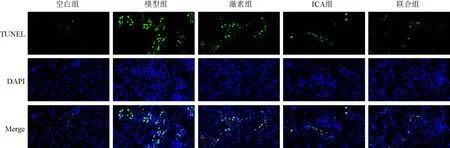
图3 各组大鼠肾组织细胞凋亡阳性表达(TUNEL染色,×400)
表5 各组大鼠肾组织细胞凋亡比较()
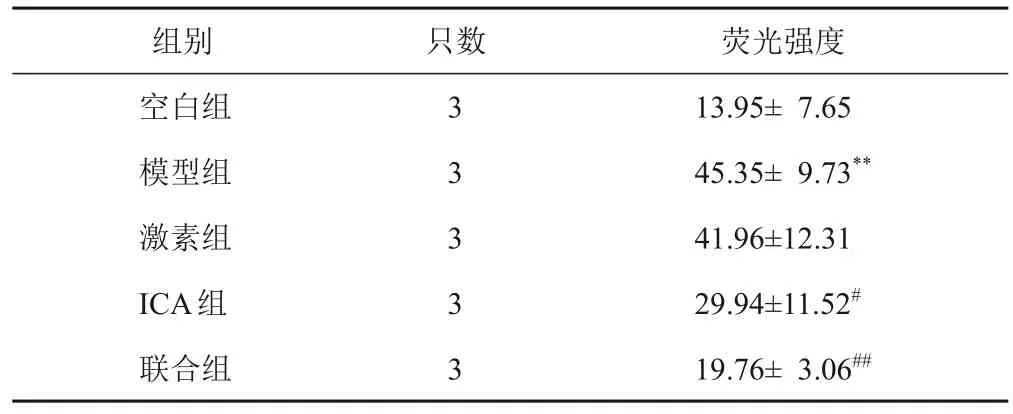
表5 各组大鼠肾组织细胞凋亡比较()
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
只数组别空白组模型组激素组ICA组联合组3 3 3 3 3荧光强度13.95± 7.65 45.35± 9.73**41.96±12.31 29.94±11.52#19.76± 3.06##
5 讨论
SRNS是严重的进行性肾脏疾病病因之一[12],绝大多数SRNS患者会发展为慢性肾病和终末期肾病[13]。SRNS病因仍不清楚,也无标准化治疗方法,诊断和治疗SRNS成为巨大的挑战[14-15]。肾小球滤过屏障由内皮细胞、肾小球基底膜和足细胞组成,其功能障碍在肾病中普遍发生。有多种调节肾小球滤过屏障功能的蛋白与SRNS相关,包括足细胞狭缝隔膜蛋白、足细胞肌动蛋白、线粒体蛋白、黏附和肾小球基底膜蛋白、转录因子等[16]。
PODXL是CD34家族表面糖基化的唾液酸激酶,表达于足细胞和血管内皮细胞表面[17]。成熟的足细胞需要PODXL维持足突结构,其能将足突和狭缝膈膜蛋白定位到正确的膜结构域并维持超滤所需结构的完整性[18]。PODXL可用于识别各种肾小球疾病中的足细胞损伤[19],是足细胞损伤的特定标志物之一,其表达异常将导致足细胞完整性丧失、肾小球组织破坏[20]和肾脏疾病的发展[21]。Ezrin属ERM家族成员,为细胞膜和肌动蛋白细胞骨架之间的连接蛋白,主要通过调节黏附分子和信号转导参与细胞间、细胞与基质间相互作用。Ezrin特异性表达于成熟及发育中的肾小球上皮细胞(GEC),是GEC标志物[22]。Ezrin可与肌动蛋白细胞骨架连接,还可通过Na+/H+-交换调节因子2(NHERF2)与PODXL连接[23],形成Ezrin-NHERF2-PODXL复合物,该复合物位于足细胞足突顶端,可与肌动蛋白细胞骨架相互作用,这种相互作用在嘌呤霉素氨基核苷、硫酸鱼精蛋白或唾液酸酶处理的大鼠GEC中被破坏,表现出显著的足突消失与肾病综合征[23],表明其在维持上皮结构中的重要性[24]。本研究结果显示,与空白组比较,模型组大鼠肾组织PODXL、Ezrin蛋白表达降低,提示足细胞损伤。经ICA联合激素治疗后,模型大鼠肾组织PODXL、Ezrin蛋白表达升高,提示ICA可通过抑制PODXL、Ezrin表达改善肾损伤。
足细胞是肾小球滤过膜的重要组成部分,参与多种肾病的发生发展[25]。足细胞损伤导致蛋白尿和肾病综合征,进一步诱导足细胞凋亡[26]。因此,减轻足细胞凋亡对治疗蛋白尿和进行性肾小球疾病至关重要[27]。Caspase家族是诱导细胞凋亡的关键酶,Caspase-3激活后可直接降解细胞内的结构蛋白和功能蛋白,引起细胞凋亡[28]。Bcl-2和Bax通过形成同源或异源二聚体调节细胞凋亡。当受到凋亡信号刺激时,Bax被激活并在线粒体上形成同源二聚体,使线粒体膜通透性增加,引起凋亡因子释放,最终诱导细胞死亡。凋亡发生伴有细胞色素C从线粒体释放,继而伴有Caspase激活和凋亡级联反应,Bcl-2通过与Bax形成异源二聚体阻止细胞色素C释放到细胞质,从而抑制细胞凋亡,发挥抗凋亡作用[29]。本研究结果显示,模型组大鼠肾组织Caspase-3、Bax蛋白表达升高,Bcl-2蛋白表达降低,表明肾损伤时凋亡途径被激活。经ICA联合激素治疗后,模型大鼠Caspase-3、Bax蛋白表达降低,Bcl-2蛋白表达升高。说明ICA能通过抑制足细胞损伤及凋亡改善肾损伤。
综上所述,ICA可通过上调PODXL、Ezrin、Bcl-2蛋白表达,下调Caspase-3、Bax蛋白表达,抑制足细胞凋亡、恢复细胞结构及完整性,从而减轻SRNS大鼠足细胞损伤。本研究结果初步阐明ICA保护SRNS肾功能,减轻肾损伤的机制。
