山竹多酚的生物学功能及其在畜禽生产中的应用
2023-10-16胡睿智贺建华伍树松
吕 敬 胡睿智 贺建华 伍树松*
(1.湖南农业大学动物科学技术学院,长沙 410128;2.湖南省畜禽安全生产协同创新中心,长沙 410128)
山竹(GarciniamangostanaL.)为藤黄科、藤黄属,是金丝桃科常绿乔木山竹的果实,原产于马来西亚,目前在我国东南沿海省份均有种植,2022年我国进口山竹果20.88万t[1]。山竹可食用部分仅占整果的29%~45%,果皮占整果的52%~68%[2-3]。山竹果皮中除了含有部分粗纤维、果胶和色素等,还含有种类丰富的植物多酚类物质。经检测发现,山竹果皮中的多酚含量为21.36 mg/g(干重),远高于果肉中的多酚含量[0.388 mg/g(干重)][4],但山竹果皮通常作为废弃物处理,这造成了资源的浪费。前期研究表明,山竹多酚具有抗氧化、消炎、抑菌和调节肠道健康等多种生物学活性[5-6],在动物饲料中具有很好的应用前景。为深入研究和挖掘山竹多酚在畜禽绿色健康养殖中的应用,本文就山竹多酚的主要组成成分、提取方法、生物学功能、作用机制以及其在畜禽生产中的应用等进行综述。
1 山竹多酚的主要组成成分和提取方法
1.1 山竹多酚的主要组成成分
山竹多酚是广泛存在于山竹中的一类具有多元酚结构的次生代谢产物[2],且大多位于山竹果皮部位。山竹多酚包含的化合物种类繁多,迄今为止,从山竹果皮中分离鉴定的多酚类化合物超过100种[5],其中黄酮类化合物——氧杂蒽酮类化合物是其发挥生物活性的主要物质;此外,还有一些非黄酮类化合物,包括原花青素、苯甲酮类化合物、甾体类化合物、花色苷和一些种类的有机酸等[6-7]。
1.1.1 黄酮类化合物
山竹多酚中含量丰富的黄酮类化合物为氧杂蒽酮类化合物,也称为双苯吡酮类化合物[8],其具有母核为线性排列的二苯并γ-吡喃酮环结构,并具有8个可以取代的位置(图1)。氧杂蒽酮类化合物的生物学功能与母核结构及母核上连接的取代基和取代基的位置有较大关系。目前,从山竹中分离出的氧杂蒽酮类化合物有107种[9-17],在这类成分中,α、β和γ-倒捻子素(山竹黄酮)是主要成分(图1),含量最丰富,也是最早从山竹皮中提取并被鉴定的成分[14],其中α-倒捻子素的含量约占山竹黄酮总含量的69%[15],故对它的药理活性研究也最多。此外,山竹多酚中也含有不同取代基的黄酮成分,如表儿茶素、芦丁和槲皮素等[18];还含有部分双黄酮化合物,主要为穗花杉双黄酮和它的一些衍生物[16-17,19],但总体含量少,并不是发挥各种生理功能的主要物质。
1.1.2 非黄酮类化合物
山竹多酚中还含有原花青素、苯甲酮类、酚酸类、甾体类、萜类和花色苷等非黄酮类化合物。在山竹果皮中,除氧杂蒽酮类化合物外,含量最高的多酚类化合物为原花青素[20],而原花青素化合物是由黄烷-3-醇通过黄烷键聚合而成[21]。Zhang等[20]对山竹果皮中的原花青素含量进行测定,发现分别包括47.7%单聚、24.1%二聚和26.0%三聚原花青素。苯甲酮类化合物大多是由2个苯环通过羰基相连,并有多个异戊烯基取代的化合物。已从山竹中提取到了Cambogin和藤黄酮K等苯甲酮类化合物[19]。山竹多酚中的酚酸类化合物主要包括苯甲酸衍生物、原儿茶酸和香草酸等[22]。此外,从山竹中也分离出了β-谷甾醇和β-豆甾醇等甾体类化合物[9-10]。
1.2 山竹多酚的提取方法
从山竹果皮中提取多酚类化合物主要有:有机溶剂提取法、微波提取法、超声波提取法、酶提取法和超临界流体萃取法等方法(表1)[23-27]。其中,有机溶剂提取法操作简单,但其提取速度较慢,提取率和化合物纯度均较低[23];超临界流体萃取法能保持样品活性成分和热不稳定成分结构完整,但需严格控制样品的含水量,操作复杂[27];超声波提取法、酶提取法和微波提取法可以对细胞壁进行破坏,加速多酚化合物的释放、扩散和溶解,提高提取效率,减少样品和溶剂损耗[24-26]。山竹多酚中含量最多的成分为α-倒捻子素,其在水中的溶解度很低,制剂时通常需要大量的增溶剂,这限制了其应用[28]。目前,普遍通过形成复合物、纳米颗粒和利用助溶剂等方法增加其溶解度[28-29]。Suharyani等[29]将α-倒捻子素与γ-环糊精形成复合物,其溶解度提高了31.74倍。
2 山竹多酚的生物学功能
山竹多酚在不同动物模型中发挥的生物学功能见表2[30-50],总体来看,山竹多酚的作用表现在以下几个方面。

表2 山竹多酚在不同动物模型中发挥的生物学功能
2.1 抗氧化
畜禽在生产过程中遭受外部不良因素的影响,会造成机体氧化还原动态平衡被破坏,产生过量的自由基,这些基团主要以活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)的形式存在[51]。自由基积累过多会导致机体内大分子物质遭到攻击,进而造成动物组织和细胞产生氧化损伤,引起氧化应激[52]。诸多研究结果表明,山竹多酚的抗氧化活性可分为直接和间接2种途径,直接抗氧化途径为清除无机自由基和脂质自由基,间接抗氧化途径主要为调节机体抗氧化酶系统。
2.1.1 清除自由基
山竹多酚化合物具有丰富的酚羟结构,这使其可以作为特殊的氢或电子供体,快速地将氢原子转移给过氧化物,并产生较稳定的半醌结构,进而终止自由基链式反应,达到清除自由基的作用[53]。谭琳等[4]研究表明,多酚浓度为100 μg/mL时,对二苯代苦味酰基自由基(DPPH·)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(ABTS+·)的清除率分别为(86.75±1.72)%和(90.52±1.20)%;浓度为200 μg/mL时;对羟自由基(·OH)的清除率为(95.66±1.74)%。研究表明,山竹多酚发挥抗氧化活性的主要化合物为α-和γ-倒捻子素,Das等[54]测定其半抑制浓度(IC50,在DPPH·清除率为50%时的浓度)分别为7.4和5.3 μg/mL,其中α-倒捻子素的抗氧化活性高于维生素C(5.4 μg/mL)。此外,α-和γ-倒捻子素对自由基的清除作用也表现出浓度依赖性[47,55]。
2.1.2 抑制脂质过氧化反应
机体内过量的ROS也会与生物膜相关的多不饱和脂肪酸及核酸等大分子物质发生脂质过氧化反应,产生大量脂质过氧化物(lipid peroxide,LPO)[56]。丙二醛(malondialdehyde,MDA)是脂质过氧化的产物之一,高含量的MDA表明体内ROS和不饱和脂质之间的反应水平较高[57]。研究发现,将山竹多酚应用于高糖脂模型动物的治疗试验中,结果均表现出机体中ROS和MDA含量的降低,表明山竹多酚可以有效地清除脂质过氧化物,从而发挥抗氧化作用[30-35,38-40,47,58]。Eisvand等[59]将α-倒捻子素应用于阿霉素诱导的大鼠心脏损伤治疗,结果发现心脏MDA含量显著降低,且与维生素E给药组无显著差异。
2.1.3 调节抗氧化酶系统
应用动物模型研究和临床试验表明(表2),使用山竹提取物或分离的多酚化合物能够提高机体抗氧化酶活性,如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等[30-35,58]。核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是调控这些抗氧化酶的重要转录因子,其转录活性受到胞质阻抑蛋白Kelch样环氧氯丙烷关联蛋白1(Kelch-like ECH-associated protein 1,Keap1)的调控。动物机体发生氧化应激时,Keap1与Nrf2解偶联,抑制Nrf2泛素化,促使其进入细胞核,并与核内抗氧化反应元件(antioxidant response element,ARE)序列结合,增强抗氧化基因转录。山竹多酚可通过上调Nrf2和ARE表达,提高机体抗氧化酶活性,减少氧化应激对细胞的损害。Tsai等[30]将山竹果皮提取物饲喂脂肪肝模型大鼠,肝脏谷胱甘肽(glutathione,GSH)含量及GSH-Px、SOD和CAT活性均升高。Wahjuni等[31]使用山竹果皮乙醇提取物(150 mg/kg)饲喂高血糖大鼠,结果发现血浆SOD活性提高了65.71%。Fang等[60]研究发现,α-倒捻子素能介导Nrf2信号通路,提高还原型烟酰胺腺嘌呤二核苷酸苯醌氧化还原酶1[NAD(P)H quinone oxidoreductase 1,NQO1]和亚铁血红素加氧酶-1(heme oxygenas-1,HO-1)的表达,缓解视网膜细胞氧化损伤情况。α-倒捻子素也可以通过抑制酸性鞘磷脂酶(acid sphingomyelinase,ASMase)-神经酰胺(ceramide)途径和上调内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)-一氧化氮(NO)信号通路,改善糖尿病小鼠的血管内皮细胞损伤情况[61]。Chuang等[62]发现,α-倒捻子素可通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)-过氧化物酶增殖活化受体γ辅助激活因子-1α(peroxisome proliferator-activated receptor gamma coactivator-1α,PGC-1α)途径,调节沉默交配型信息调节因子2同源蛋白3(silent mating-type information regulation 2 homolog 3,SIRT3)的表达,提高SOD、SOD2、CAT活性及GSH含量,减少细胞内ROS和细胞外过氧化氢(H2O2)的产生,缓解氧化应激造成的视网膜色素上皮细胞的凋亡。
2.2 缓解炎症
山竹多酚的抗氧化作用与抗炎作用相关,ROS的过度积累会导致组织和细胞产生氧化损伤,进而引发机体炎症反应[63]。山竹多酚因其较强的抗氧化作用,能通过清除过量的过氧化物,中断ROS-炎症循环,发挥抗炎作用。通过不同小鼠炎症模型的研究发现(表2),山竹多酚主要是通过下调核因子-κB(nuclear factor-kappa B,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来发挥抗炎作用。大量炎症因子受NF-κB调控,如血管内皮生长因子(vascular endothelial growth factor,VEGF);促炎细胞因子:白细胞介素(interleukin,IL)-1、IL-1β、IL-6、IL-10、IL-12和肿瘤坏死因子-α(tumor necrosis factor,TNF-α);趋化因子:IL-8和巨噬细胞炎症蛋白-1α(macrophage inflammatory protein-1α,MIP-1α);细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)等。山竹果皮中提取的α-和γ-倒捻子素能降低脂多糖(lipopolysaccharide,LPS)诱导的RAW264.7细胞损伤模型TNF-α含量,抑制诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的mRNA表达水平,缓解炎症损伤[40]。MAPK可通过激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2/5、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)1/2/3和p38 MAPK,调节机体对环境的应激和炎症反应,同时MAPK又与NF-κB等其他途径相互作用产生炎症反应。α-和γ-倒捻子素均能通过抑制NF-κB和MAPK信号通路传导,来阻断ERK、JNK和p38磷酸化,同时降低TNF-α、IL-1β含量,进而阻断TNF-α触发ICAM-1表达[50,64]。Yan等[36]研究发现,α-倒捻子素通过Akt-哺乳动物雷帕霉素靶蛋白(mTOR)信号通路,下调Bcl2/腺病毒E1B相互作用蛋白3(Bcl2/adenovirus E1B interacting protein 3,BNIP3)和自噬微管相关蛋白轻链3(autophagy-related microtubule-associated protein light chain 3,LC3)的表达,抑制细胞凋亡,改善对乙酰氨基酚引起的小鼠急性肝脏损伤。花生四烯酸信号通路也被认为是多酚化合物抗炎的重要机制之一,α-倒捻子素和槲皮素能抑制花生四烯酸代谢相关的酶,如环氧合酶(cyclooxygenase,COX)和脂氧合酶(lipoxygenase,LOX)等,减少花生四烯酸、前列腺素、白三烯和一氧化氮的产生,发挥抗炎作用[63,65]。氧杂蒽酮类化合物也可以通过激活Nrf2信号通路,调节肌醇1,4,5-三磷酸受体(inositol 1,4,5-trisphosphate receptor,IP3R),提高细胞内钙离子(Ca2+)的浓度,并通过MAPK与NF-κB通路,降低IL-1β、TNF-α等炎症因子含量,改善铅诱导的肾损伤[44]。山竹多酚除了通过调节炎症因子缓解炎症损伤外,还可以提高免疫细胞水平,增强机体免疫力。秦艳萍等[42]研究发现,100 mg/(kg·d)的α-倒捻子素能够提高小鼠的胸腺和脾脏指数、半数溶血值、脾淋巴细胞增殖率和自然杀伤(natural killer,NK)细胞活性,改善免疫抑制小鼠的生理功能。
综上所述,山竹多酚主要是通过两方面发挥抗炎作用的:一方面,依靠较强的抗氧化能力清除过量的过氧化物,抑制其引发炎症反应;另一方面,通过调节机体中炎症相关因子的水平,改善炎症损伤。此外,山竹多酚还能通过促进免疫细胞(如B淋巴细胞、T淋巴细胞及NK细胞等)的活性,增强机体免疫力。山竹多酚的抗氧化和抗炎机制见图2[30-50,52-59,63-69]。
2.3 抑菌
根据临床和实验室标准研究所的指南[66],收集了85种典型的黄酮类化合物进行抗菌试验,其中表现出强抑菌能力的黄酮类化合物大多有1个或多个异戊二烯基团。细菌内膜的生理功能完整性对于细菌的生长和存活至关重要,异戊二烯基的存在可以显著增加化合物的亲脂性和降低苯环的疏水性,帮助化合物进入细菌细胞膜的磷脂双分子层,进而破坏细胞膜快速杀死细菌。因此,主链本身的异戊二烯化结构以及主链上连接有多个异戊二烯基团是黄酮类化合物发挥抗菌活性的先决条件[67]。山竹中含量较高的几种多酚化合物均具有异戊二烯结构,从而表达出较强的抑菌能力。Sakagami等[68]研究发现,α-倒捻子素对万古霉素抗性肠球菌(vancomycin resistantEnterococci,VRE)和甲氧西林抗性金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)具有抑制活性,最低抑菌浓度(MIC)分别为6.25和6.25~12.50 μg/mL。Larsuprom等[69]也测定了α-倒捻子素对甲氧西林抗性伪中间球菌(methicillin-resistantStaphylococcuspseudintermedius,MRSP)的MIC为0.47 μg/mL。Tatiya-Aphiradee等[37]将山竹果皮乙醇提取物作用于MRSA感染的小鼠浅表皮,伤口于给药的第10天完全愈合,MRSA菌落数量也从给药第1天开始逐步减少,且测定山竹果皮乙醇提取物的MIC为14.0 μg/mL。
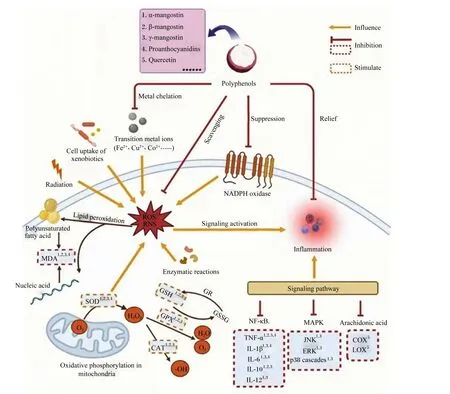
α-mangostin:α-倒捻子素;β-mangostin:β-倒捻子素;γ-mangostin:γ-倒捻子素;Proanthocyanidins:原花青素;Quercetin:槲皮素;Polyphenols:多酚;Metal chelation:金属螯合;Scavenging:清除;Suppression:抑制;Relief:缓解;Radiation:辐射;Cell uptake of xenobiotics:细胞对外源性物质的摄取;Transition metal ions:过渡金属离子;Polyunsaturated fatty acid:多不饱和脂肪酸;Lipid peroxidation:脂质过氧化;ROS:活性氧 reactive oxygen species;RNS:活性氮 reactive nitrogen species;NADPH oxidase:还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶;MDA:丙二醛 malondialdehyde;Nucleic acid:核酸;Enzymatic reactions:酶反应;SOD:超氧化物歧化酶 superoxide dismutase;GSH:谷胱甘肽 glutathione;GSH-Px:谷胱甘肽过氧化物酶 glutathione peroxidase;CAT:过氧化氢酶 catalase;GR:谷胱甘肽还原酶 glutathione reductase;GSSG:氧化型谷胱甘肽 oxidized glutathione;Oxidative phosphorylation in mitochondria:线粒体中的氧化磷酸化;Inflammation:炎症;Signaling activation:信号激活;NF-κB:核因子-κB nuclear factor-κB;MAPK:丝裂原活化蛋白激酶 mitogen-activated protein kinase;Arachidonic acid:花生四烯酸;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;IL:白细胞介素 interleukin;JNK:c-Jun氨基末端激酶 c-Jun N-terminal kinase;ERK:细胞外信号调节激酶 extracellular signal-regulated kinase;p38 cascades:p38瀑布;COX:环氧合酶 cyclooxygenase;LOX:脂氧合酶 lipoxygenase;Influence:影响;Inhibition:抑制;Stimulate:促进。
2.4 调节糖和脂代谢
肥胖、非酒精型脂肪肝和Ⅱ型糖尿病等代谢疾病主要是因机体糖和脂代谢紊乱造成的,同时会导致畜禽免疫力、饲料转化率和畜产品质量下降。山竹多酚可以通过抑制α-淀粉酶、α-葡萄糖苷酶和钠依赖性葡萄糖转运蛋白1(sodium-dependent glucose transporter 1,SGLT1)的活性,进而抑制肠道对葡萄糖的吸收,刺激胰岛素分泌[70]。这是由于氧杂蒽酮类化合物与α-淀粉酶和α-葡萄糖苷酶的变构位点结合,导致其构象改变,进而抑制它们的活性[71]。Husen等[32-33]和Karim等[34-35]将山竹果皮提取物饲喂Ⅱ型糖尿病小鼠,其肾脏MDA含量以及血液葡萄糖和胆固醇含量均下降,肾脏SOD活性和血浆胰岛素含量升高。Chen等[47]研究发现,γ-倒捻子素通过调节腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)-过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)途径,提高胰岛素水平,从而改善小鼠糖尿病。此外,山竹多酚的抗氧化和抗炎能力也可以通过减少机体ROS和炎症因子产生,改善肥胖引起的损伤。利用山竹果皮饲喂高脂诱导的前列腺增生小鼠,其前列腺组织MDA、IL-6、TNF-α和血液总胆固醇含量下降,附睾脂肪和肾周脂肪明显减少[39]。
3 山竹多酚在畜禽生产中的应用
3.1 在猪生产中的应用
在现代养殖过程中,仔猪断奶时期的饮食和环境的转变会引起胃肠道微生物群失衡,导致肠道炎症和细菌感染,其中主要是大肠杆菌感染[72]。断奶阶段是猪生产过程中的重要阶段,腹泻会导致仔猪死亡,造成严重经济损失。研究表明,将山竹醇(garcinol)以200、400和600 mg/kg剂量添加到断奶仔猪饲粮中,通过对肠道菌群的分析发现,其能抑制肠道中多数有害细菌,特别是大肠杆菌的生长,促进有益细菌如乳杆菌的生长,并提高空肠绒毛高度/隐窝深度值和闭锁小带蛋白-1(zonula occludens-1,ZO-1)、闭合蛋白(occludin)和封闭蛋白-1(claudin-1)的基因表达,降低腹泻率、肠道通透性和炎症因子(IL-6、IL-10、IL-1β和TNF-α)水平,进而提高断奶仔猪抗氧化能力和生长性能[73]。育肥猪饲粮中添加600 mg/kg的山竹醇能显著降低猪的背膘厚度,提高背最长肌中肌红蛋白含量,并通过提高GSH-Px、CAT活性及总抗氧化能力(T-AOC),降低乳酸脱氢酶(lactic dehydrogenase,LDH)、磷酸甘油酸酯激酶1(phosphoglycerate kinase 1,PGK1)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和6-磷酸果糖-2-激酶(PFK)/果糖-2,6-二磷酸酶3(PFKFB3)活性,抑制宰后糖酵解过程,减少乳酸沉积,改善屠宰性能和肉品质[74]。在80日龄“杜×长×大”三元杂交公猪的饲粮中添加400 mg/kg的山竹醇,可以提高肌肉的抗氧化能力,增加背最长肌中Ⅰ型肌纤维的比例[75]。在三元杂交去势公猪饲粮中添加山竹醇,可以通过抑制组蛋白乙酰转移酶P300/CBP结合因子(P300/CBP associated factor,PCAF)降低糖酵解酶PFKFB3、PFK1、GAPDH和PGK1的活性,抑制宰后肌肉糖酵解过程和乳酸的产生,改善猪的屠宰性能[76]。在母猪妊娠晚期(怀孕第90天)和哺乳期饲喂山竹醇,母体抗氧化状况、乳蛋白含量、脐带血酸碱平衡和仔猪的初生重均得到了提高[77]。从化学结构和吸收光谱的数据来看,从印度藤黄果皮中提取到的山竹醇(一种苯甲酮类化合物)与其同分异构的大叶藤黄醇(xanthochymol)有潜在关联[78]。上述研究表明,山竹多酚具有缓解猪生产中的氧化应激,提高妊娠母猪的乳汁品质和生产性能及改善断奶仔猪的腹泻等作用。此外,山竹多酚还可以通过调节糖和脂代谢改善育肥猪和去势公猪的脂肪沉积情况,提高肉品质。虽然山竹多酚已被广泛应用于不同小鼠疾病模型试验中,但其主要成分α-倒捻子素并未被应用于猪各个生产阶段的研究中。随着近年来提取工艺的进步,应对其饲喂剂量和作用机制等方面进行更深入的探究。
3.2 在家禽生产中的应用
山竹多酚可以作为一种天然的饲料添加剂替代抗生素应用到肉鸡饲粮中。Herawati等[79]研究发现,在肉鸡饲粮中添加2%山竹果皮提取物,与添加抗生素(黏菌素,0.3 g/kg)相比,在不增加肉鸡抗药性的情况下,能有效地改善肉鸡的整体生长性能。另有研究表明,山竹多酚能显著提高鸭的生长性能,Kusmayadi等[80]在雄鸭饲粮中添加山竹果皮粉(0.5%、1.0%、1.5%和2.0%),显著提高了平均日增重,降低了死亡率,改善了鸭的生长性能、脂质分布和腹部脂肪沉积。山竹多酚有很强的抑菌效果,将其应用于冷鲜鸡肉中,还可以抑制细菌的腐败作用,延缓保鲜时间[81]。由此可见,山竹多酚能在不产生耐药性的情况下提高肉鸡生长性能,改善鸭的脂肪沉积,但相关作用机制还有待进一步研究。此外,山竹多酚的抑菌作用使其在抑制冷鲜肉腐败、延长保鲜时间上有显著效果。
3.3 在反刍动物生产中的应用
Foiklang等[82]将山竹果皮粉作为饲料添加剂应用于阉牛精饲料中,其瘤胃消化率得到了显著提升,并且调节了瘤胃的微生物群,显著加快了微生物蛋白质的合成。在奶牛饲粮中添加16%粗蛋白质精料和300 g/(头·d)山竹果皮粉,提高了瘤胃消化功能,改变了微生物种群数量,增强了奶牛生产性能,进而提高了泌乳产量[83]。以上研究均表明了山竹多酚可以通过调节瘤胃微生物群的组成和丰度来改变反刍动物的生产性能。同时,也有研究表明,山竹多酚通过其强效的抗氧化作用改善反刍动物的血液生化指标,如血浆总蛋白和白蛋白含量,并通过提高血浆中SOD、CAT和GSH-Px活性来调节反刍动物机体抗氧化能力[84]。这表明可以将山竹多酚用于反刍动物的饲粮中,以提高反刍动物的抗氧化能力和生长性能。此外,山竹多酚已被证明有很强的抗炎作用,但并未在反刍动物生产领域发现相关功能的研究,可以对这方面进行进一步的探究,为山竹多酚在反刍动物生产领域中的应用提供更多依据。
4 小结与展望
山竹多酚应用于畜禽生产中具有改善仔猪肠道健康、育肥猪肌肉品质、妊娠母猪繁殖性能、肉鸡屠宰性能以及反刍动物瘤胃发酵效率等作用。虽然许多研究已经证明了山竹多酚的生物学活性,但相关作用机制的研究还不深入。未来有关山竹多酚在畜禽生产中的研究可以从以下几个方面开展:1)山竹多酚化合物种类繁多,有针对性分析不同成分的生物学功能,并探究其在畜禽生产中的应用;2)明确山竹多酚在畜禽不同生长阶段的最佳饲喂剂量和作用效果;3)探究山竹多酚与其他营养物质的协同效应和在畜禽机体中的代谢过程;4)揭示山竹多酚调节畜禽肠道微生物组成与改善生产性能之间的关系和作用机制。
