氯喹对人宫颈癌细胞系HeLa增殖、凋亡及自噬的影响
2023-10-11徐丹丹刘训涛舒丽莎
高 朋,徐丹丹,张 斌,刘训涛,舒丽莎
1.河北北方学院 研究生院,河北 张家口 075000;河北北方学院附属第一医院 2.中心实验室;3.检验科;4.妇科,河北 张家口 075000
根据GLOBOCAN 2020,宫颈癌是继乳腺癌、结直肠癌和肺癌之后的全球女性第四常见癌,全世界估计有604 000例新的宫颈癌病例和342 000例死亡病例[1]。宫颈癌早期、局部晚期和转移性疾病的 5 年总生存率 (OS) 分别约为 92%、65% 和 17%。晚期或者复发的宫颈癌不能接受手术或者放疗预后差,中位无进展生存期约2~5个月,总生存期约5~16个月[2]。
氯喹(chloroquine,CQ)最初主要用于预防和治疗疟疾,现在则是一种众所周知的自噬抑制剂。此外,CQ还被认为是一种潜在的抗癌剂,具有减少癌细胞侵袭、转移及克隆形成的能力[3]。有研究认为,CQ的抗肿瘤作用主要归因于自噬抑制[4],这是通过溶酶体来降解细胞内大分子和细胞器从而在细胞中起到抑癌机制的作用。然而,据报道,CQ 抑制自噬的能力并不是其发挥抗肿瘤作用的唯一机制。证据表明,单独使用 CQ 也可有效抑制肺癌、肝癌及胰腺癌细胞的增殖[5-6]。然而,CQ单一疗法对人宫颈癌细胞系HeLa的抗肿瘤作用的机制尚未得到明确研究。本研究拟以宫颈癌细胞系HeLa细胞为材料,探讨CQ对宫颈癌细胞增殖、凋亡及自噬的影响,以期为临床有效治疗宫颈癌提供一定参考。
1 材料与方法
1.1 材料
1.1.1 细胞: 人宫颈癌细胞系HeLa(武汉普诺赛科技有限公司)。
1.1.2 试剂及试剂盒: 氯喹(Toronto Research Chemicals公司);DMEM培养基、胰蛋白酶和胎牛血清(上海逍鹏生物科技有限公司);细胞自噬染色试剂盒(MDC法)、Hoechst33342染色液、细胞增殖及毒性检测试剂盒(CCK-8)(河北瑞帕特科技有限公司);活性氧检测试剂盒(ROS Assay Kit-Highly Sensitive DCFH-DA)(日本同仁化学科技有限公司)。Annexin V-eFluor450/7-AAD凋亡检测试剂盒(赛默飞世尔科技有限公司)。兔抗人B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)单抗体、兔抗人Bcl-2相关X蛋白(Bcl-2-associated X,Bax)抗体、兔抗人磷酸化磷脂酰肌醇-3激酶(phospho-phosphatidylinositol 3-kinase,p-PI3K)单抗、兔抗人p-AKT单抗和兔抗人p-MDM2单抗(武汉三鹰有限公司);兔抗人微管相关蛋白1轻链3 (LC3)单抗、兔抗人Sequestosome-1(SQSTM1/p62)单抗和兔抗人Beclin 1单抗(日本博尔迈有限公司);兔抗人磷酸化辣根过氧化酶标记的羊抗兔和羊抗小鼠IgG抗体(二抗)(北京博奥森有限公司)。
1.2 方法
1.2.1 细胞的分组及处理:细胞在37 ℃、5% CO2培养箱中常规培养。选取处于对数期的细胞分为对照组和CQ组(浓度分别为25,50,75,100,150 μmol/L),每组设 4 复孔。
1.2.2 CCK-8法检测细胞增殖活性:不同浓度CQ干预后的细胞继续培养24、48 h。吸弃培养液,每孔加 100 μL 稀释的 CCK-8溶液(无血清DMEM∶CCK-8原液=9∶1),于37 ℃、5% CO2条件下继续培养1 h后取出,用酶标仪在450 nm波长下测定各孔吸光度(Absorbence,A)值,取平均值。细胞存活率(%)=(实验组A值-空白对照组A值)/(细胞对照组A值-空白对照组A值)×100%。每组设6个复孔,实验重复3次。选择IC20、IC50氯喹浓度进行后续实验。
1.2.3 平板克隆实验检测细胞克隆形成率:取对数增殖期细胞胰酶消化计数后,以每孔1×103个的细胞的密度接种于12孔板,每3 d更换1次培养基,当集落细胞数大于50个时终止培养;4%多聚甲醛固定15 min,并在室温下用结晶紫染色10 min,清洗干燥后拍照计数。并用Image J定量分析集落细胞数>50 个的集落数。每组设3个复孔,实验重复3次。
1.2.4 MDC染色法检测自噬活性:消化后的细胞接种到6孔板,细胞贴壁后加入适量MDC染色液,37 ℃避光孵育30 min。吸净MDC染色液,使用Assay Buffer洗涤3次后再加入1 mL Assay Buffer。在荧光显微镜下用紫外光激发,观察绿色荧光。实验重复3次。
1.2.5 活性氧检测试剂盒检测细胞内ROS:消化后的细胞接种到6孔板,细胞贴壁后加入适量DCFH-DA,按说明书操作。在荧光显微镜下用紫外光激发,观察绿色荧光。实验重复3次。
1.2.6 Hoechst33342染色检测细胞核:消化后的细胞接种到6孔板,细胞贴壁后加入适量hoechst33342染色液,避光孵育20 min;PBS洗涤1次;在荧光显微镜下用紫外光激发,观察蓝色荧光。实验重复3次。
1.2.7 Annexin V-eFluor450/7-AAD双染法检测细胞凋亡率:消化后的细胞接种到6孔板,细胞贴壁48 h后弃上清,向100 μL细胞悬液中加入5 μL annexin Ⅴ试剂;室温避光孵育15 min;加入结合缓冲液洗涤,离心弃上清;在200 μL缓冲液中重悬细胞并加入5 μL的7-AAD,室温孵育15 min后将其加载到流式细胞仪,分别通过450和670 nm的带通滤光片测定eFluor450和 7-AAD荧光,在405 nm波长下激发以检测细胞凋亡。实验重复3次。
1.2.8 蛋白印迹法检测自噬蛋白、凋亡蛋白、PI3K/AKT/MDM2通路蛋白的表达:从细胞中提取蛋白后采用BCA试剂盒测蛋白质浓度。将蛋白质变性后,通过配胶、上样、电泳、转膜、封闭、抗体孵育和显影等步骤,检测自噬蛋白(p62,Beclin1,LC3)、凋亡蛋白(Bax,Bcl-2,PARP)、p-PI3K、p-AKT、p-MDM2蛋白表达情况。用Image J分析条带吸光度值。目的蛋白的相对表达量 =目的蛋白条带吸光度值/内参蛋白(GAPDH)吸光度值。实验重复3次。
1.3 统计学分析

2 结果
2.1 CQ抑制HeLa细胞增殖能力
与对照组相比,CQ呈时间及剂量依赖性抑制HeLa细胞的增殖(P<0.01)(图1)。药物在48 h的IC20和IC50分别为25 μmol/L和75 μmol/L,因此,在后续的实验中选择该浓度的CQ进行实验。

*P<0.01,**P<0.001 compared with control group.图1 细胞存活情况比较Fig 1 Comparison of cell survival in each group
2.2 CQ抑制HeLa平板集落形成能力
与对照组相比,实验组细胞集落形成逐渐减少(P<0.01)(图2)。
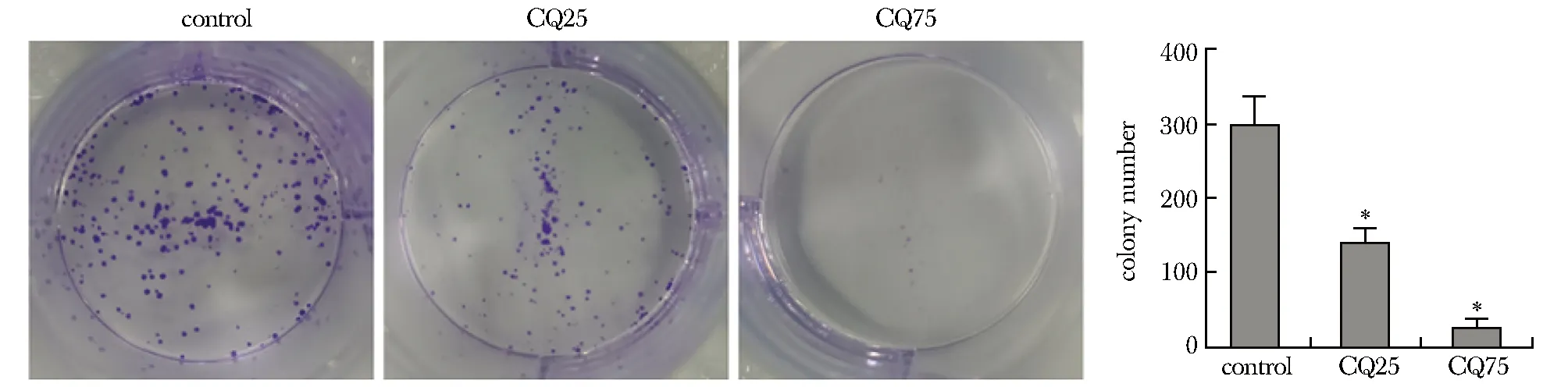
*P<0.01 compared with control group.图2 CQ抑制细胞集落形成Fig 2 CQ inhibits cell colony formation
2.3 CQ抑制HeLa细胞自噬活性
与对照组相比,实验组自噬囊泡显著增加(P<0.01)(图3)。

*P<0.01 compared with control group;arrow indicates autophagic vacuole.图3 各组细胞的MDC染色Fig3 The MDC staining of the cells in each group
2.4 CQ诱导细胞内ROS的产生
细胞经DCFH-DA染色后,ROS阳性呈绿色荧光。细胞核经hoechst33342染色后均呈蓝色荧光。与对照组相比,实验组蓝色荧光未见明显变化,绿色荧光显著增强(P<0.001)(图4)。

*P<0.001 compared with control group.图4 CQ诱导细胞ROS形成Fig 4 CQ induced ROS formation in cells
2.5 CQ诱导HeLa细胞凋亡
与对照组相比,实验组凋亡率显著升高(P<0.01)(图5)。
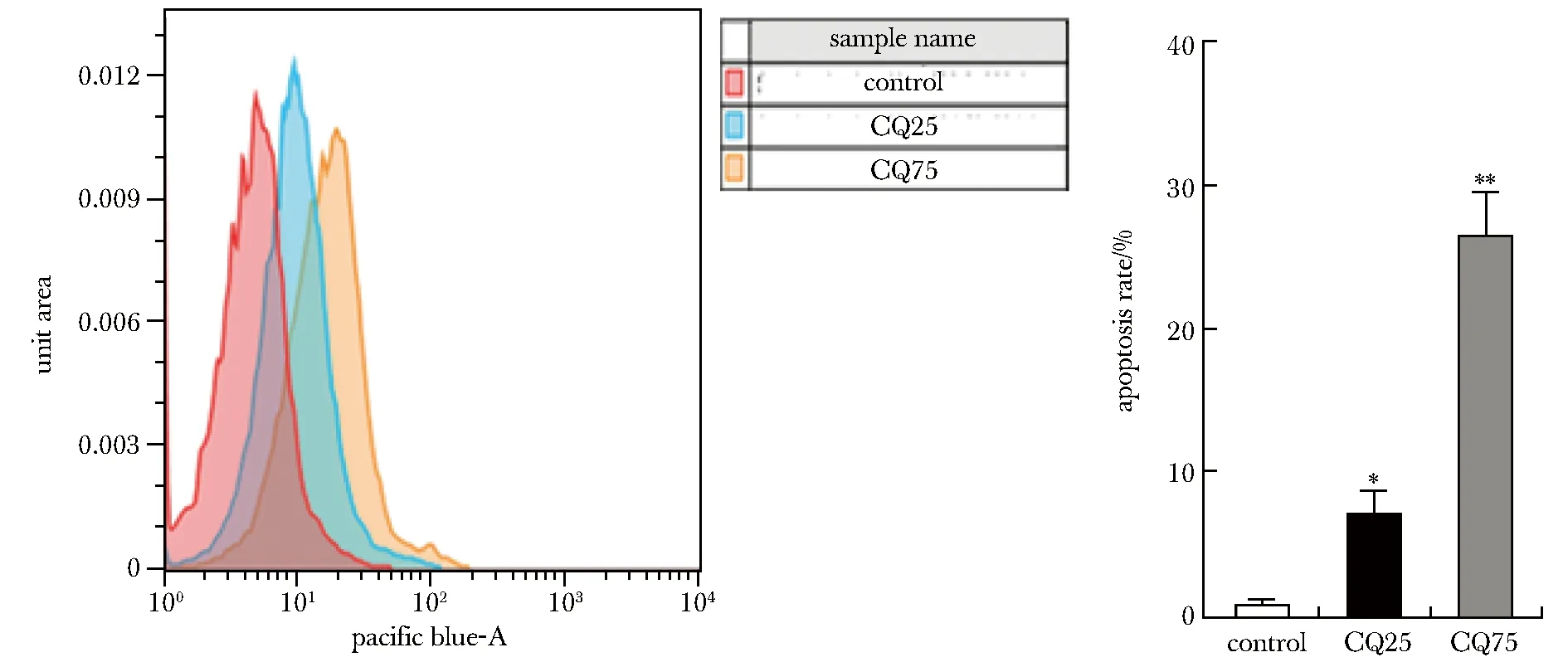
*P<0.01,**P<0.001 compared with control group.图5 CQ诱导细胞凋亡Fig 5 CQ induced apoptosis in cells
2.6 CQ对Bax、Bcl-2、PARP、LC3、p62、Beclin1及p-PI3K/AKT/MDM2通路蛋白的影响
与对照组相比,实验组LC3、p62、Bax及剪切的PARP蛋白相对表达水平升高,Beclin1、Bcl-2、p-PI3K、p-AKT和p-MDM2蛋白表达水平均降低(P<0.05)(图6)。

A,C,E.expression of LC3,p62,Beclin1,p-MDM2,p-PI3K,p-AKT,Bax,Bcl-2 and cleaved-PARP protein detected by Western blot; B,D,F.sataistical analysis of Western blot results; *P<0.05,**P<0.01 compared with control group.图6 CQ对LC3、p62、Beclin1、Bax、Bcl-2、PARP及PI3K/AKT/MDM2通路蛋白的影响Fig 6 Effect of CQ on the LC3, p62, Beclin1, Bax, Bcl-2, PARP, and the PI3K/AKT/MDM2 pathway proteins
3 讨论
应用抗癌药物的主要策略包括抑制细胞增殖或诱导细胞凋亡。本实验结果表明,CQ以剂量依赖性方式显著抑制癌细胞的增殖。目前的结果与CQ可抑制肺癌、肝癌及胰腺癌细胞增殖的结果相一致。众所周知,ROS参与细胞死亡,其是增殖、分化和凋亡过程中重要的信号分子[7]。事实上,几种抗癌剂被证明可以通过促进ROS的产生诱导细胞凋亡[8-10]。因此,实验研究了ROS在CQ诱导细胞死亡中的作用。CQ增加了DCFH的荧光强度,提示了细胞内ROS的增加,这一实验结果与之前的报告相一致,可能也是导致细胞凋亡的关键诱因之一[11]。
自噬是溶酶体降解体内衰老、损伤细胞器维持细胞内稳态的过程[12]。LC3 Ⅰ转化为LC3 Ⅱ被广泛认为是自噬的标志物。p62作为自噬的底物,随着自噬活性的减弱而增多[13]。Beclin-1主要作用是募集ATG,而ATG是自噬体形成的关键因素。Beclin1降低表明自噬活性受到抑制。本实验结果表明CQ剂量依赖性增加p62、LC3 Ⅱ/LC3 Ⅰ的表达,降低Beclin1的表达,说明CQ抑制HeLa细胞自噬。细胞凋亡在癌的发生发展中发挥着重要的作用。本研究分析了CQ处理后Bax和Bcl-2的表达。结果表明,Bax表达增加,Bcl-2表达降低,Bax/Bcl-2比值增加。而Bax 的过度激活与 Bcl-2表达的降低协同作用可以增加线粒体膜通透性,从而释放促凋亡分子,激活半胱天冬酶3、6和7,导致细胞凋亡。PARP被执行型的caspase剪切,成为凋亡的标志物。因此,这就不难理解,在本研究中观察到切割的PARP表达增加的结果。PI3K/AKT信号通路参与细胞增殖、侵袭、转移和凋亡,其通常在各种肿瘤中被激活[14]。有研究表明,磷酸化AKT可以进一步激活下游蛋白,从而抑制细胞凋亡,例如MDM2[15]。此实验结果表明CQ可显著降低磷酸化PI3K/AKT/MDM2蛋白的表达,阻断了PI3K/AKT/MDM2通路,这可能是CQ抑制细胞增殖,促进其凋亡的重要原因。但本实验还存在一些不足:1)没有进行抑制实验验证CQ的抗癌作用依赖于PI3K/AKT/MDM2信号通路;2)缺乏动物实验验证;3)只使用了一种细胞系。
